Professional Documents
Culture Documents
Cambios de Estado y Equilibrio de Fasesb
Uploaded by
Joaquin Chila FCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cambios de Estado y Equilibrio de Fasesb
Uploaded by
Joaquin Chila FCopyright:
Available Formats
FISICOQUIMICA
CAMBIOS DE ESTADO Y
EQUILIBRIO DE FASES
CONDICION DE EQUILIBRIO
Anticipamos que para un sistema en equilibrio, el
potencial qumico de cada constituyente debe ser el
mismo en cualquier lugar del sistema , existan una o
mas fases.
para un sistema de un solo componente deducimos:
dP V dT S G + =
dP V dT S + =
n
G
=
P
T
S
|
.
|
\
|
c
c
=
T
P
d
V
|
.
|
\
|
c
=
;
;
Las derivadas de estas dos ltimas ecuaciones son
las pendientes de las curvas contra T y contra
P, respectivamente
La explicacin de la diferencia entre las pendientes de
las curvas slido (S), lquido (L) y vapor (G) en la
figura 1 radica en que: segn la Tercera Ley, la
entropia de una sustancia es siempre positiva;
entonces la relacin es siempre negativa,
en consecuencia la grfica Vs T, tiene curvas con
pendientes negativas, y como adems:
Sgas > S liquido > Sslido
( en consecuencia S gas > S liquido > S slido) se
explica la diferencia entre las pendientes
P
T
|
.
|
\
|
c
c
ESTABILIDAD DE LAS FASES EN UNA SUSTANCIA
PURA
Ahora discutiremos el equilibrio entre una o mas fases
(liq-vapor, sol-liq, sol-vapor, etc), de uno o ms
constituyentes.
En estos sistemas la masa permanece constante en
su conjunto, no importando los cambios que ocurra en
su interior, en consecuencia, se pueden tratar como
sistemas cerrados.
Por simplicidad consideremos un sistema formado por
dos fases Liq-vapor, de un sustancia en equilibrio a
temperatura y presin constantes.
Supongamos que se transfiere una pequea cantidad
de una fase a la otra, hasta llegar al equilibrio, en esta
condicin tendremos: AGtotal = 0
Si G
A
es la energa libre molar de la sustancia en un
fase (liq) y G
B
en la otra fase (gas), el paso de un mol
de lquido al estado vapor ira acompaado por un
incremento de G
B
y una disminucin de G
A
.
AG
total
= G
B
- G
A
= 0 G
B
= G
A
A B
=
" Siempre que dos fases de una sustancia estn en
equilibrio a temperatura y presin dadas, la energa
libre molar ( ) es la misma en cualquier punto de
cada fase
"La fase mas estable es la que tiene el potencial
qumico ( ) mas bajo".
Los diagramas indicados en las figuras 1 y 2, de este
captulo, muestran la secuencia familiar de fases que
se observa al calentar un slido a presin constante
ECUACIN DE CLAPEYRON
Como la energa libre molar de una sustancia es la
misma en cada fase de un sistema de un solo
componente en equilibrio , se deduce que si varan
infinitesimalmente la temperatura y presin,
permaneciendo el sistema en equilibrio bajo las
nuevas condiciones, el cambio de energa libre
deber ser el mismo en cada fase es decir:
Como:
A B
dG dG =
SdT VdP dG =
dT S dP V dT S dP V
B B A A
=
Como el trmino AS es el incremento de la entropa
para la transferencia de una cantidad especificada,
por ejem, un mol de sustancia de la fase A a la fase B,
por tanto es igual a AH/T, donde AH es el calor
latente molar del cambio de fase , que tiene lugar a la
temperatura T.
A B
A B
V V
S S
dT
dP
=
V
S
dT
dP
A
A
=
V T
H
dT
dP
A
A
=
EQUILIBRIO ENTRE DOS FORMAS CRISTALINAS
(ALOTROPIA)
La relacin nos indica la variacin de la temperatura
de cambio de fase ( T
cf
) con la presin externa
EQUILIBRIO SLIDO-LQUIDO (FUSIN)
EQUILIBRIO LQUIDO-VAPOR (VAPORIZACIN)
t
H
V V T
dP
dT
A
=
) (
| o
f
s l f
H
V V T
dP
dT
A
=
) (
vap
l g eb
H
V V T
dP
dT
A
=
) (
ECUACIN DE CLAUSIUS-CLAPEYRON
Cuando la temperatura no esta muy prxima al punto
crtico, el volumen del lquido (V
l
) ser muy pequeo
en comparacin con la del vapor (V
g
) a la misma
temperatura y presin, en consecuencia:
si el vapor tiene comportamiento ideal:
g
vap
TV
H
dT
dP
A
=
2
RT
H P
P
RT
T
H
dT
dP
vap vap
A
=
A
=
dT
RT
H
P
dP
vap
2
A
=
dT
RT
H
P d
vap
2
ln
A
=
Si AHvap no depende de la temperatura:
Si AHvap es funcin de la temperatura y recordando
que:
dado que:
|
|
.
|
\
|
A
=
1 2 1
2
1 1
ln
T T R
H
P
P
vap
ctte
T
H
P
vap
+
A
= ln
.....
3 2
+ + + + A = A CT BT AT H H
o
.......
2
+ + + = T T C
p
| o
|
.
|
\
| A
+
A
+
A
+
A
=
2
1
2
2
ln ln T
R
C
T
R
B
T
R
A
RT
H
P
P
o
igual que en el punto 4.10.-, se puede escribir:
I T
R
C
T
R
B
T
R
A
RT
H
P
o
+
A
+
A
+
A
+
A
=
2
2
ln ln
I T B
T
A
P + + = log log
'
'
........ " " log
2 "
"
+ + + + = T D T C B
T
A
P
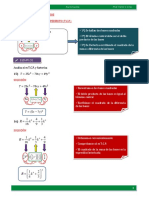
REGLA DE LAS FASES
Nmero de fases ( F)
Fase es la parte de un sistema que en su totalidad es
homogneo (uniforme) considerado, tanto fsica como
qumicamente.
Nmero de componentes ( C )
Por definicin, nmero de componentes es el menor
nmero de especies qumicas diferentes e
independientes, necesarios para describir la
composicin de c/u de la diferentes fases del sistema
Grados de libertad ( u ) o varianza ( V )
Es el menor nmero de variables intensivas que
es necesario determinar para fijar los valores de
todas las dems variables intensivas.
Deduccion de la Regla de las Fases
Supongamos que C componentes se distribuyen
en F fases y que cada componente esta en
equilibrio en las distintas fases.
F1 F2 F3 .................. .. FF
C1 C1 C1 .............................................. C1
C2 C2 C2 .............................................. C2
C3 C3 C3 .............................................. C3
CC CC CC .............................................. CC
A = total de variables intensivas que se requieren para
describir por separado cada fase.
B = Numero de variables, cuyos valores estn
determinados por las relaciones de equilibrio entre las
fases.
Anlisis de A:
En cada fase se necesita C-1 valores de
concentracin para definir cuantitativamente la
composicin de cada fase, recordar:
A = F(C 1 ) + 2
donde: F ( C 1 ), son variables de concentracin
el numeral 2, corresponde a la presin y temperatura
Anlisis de B:
El nmero de estas variables (de concentracin) fijadas
por condiciones de equilibrio son:
Si el componente 1 ( C1 ) se distribuye en las fases F1 y
F2, en el equilibrio tendremos:
=1
i
X
As, si la concentracin C1 en la fase F1 esta
determinada, esta relacin fija la concentracin en la
fase 2 ( F2 ).
Entonces tendremos:
| |
| |
1
2
1
1
F
F
C
C
K =
) 1 ( = F C B
) 1 ( 2 ) 1 ( + = = = u F C C F B A V
2 + = F C V
DIAGRAMA DE FASES
La representacin de este diagrama, muestra de
inmediato las propiedades de la sustancia;
punto de fusin, de ebullicin, puntos de
transicin, solubilidad, punto triple, etc.
Cada punto representa un estado del sistema
dado que establece valores de presin y
temperatura.
S = estado slido
L = estado lquido
V = estado vapor
DIAGRAMA DE FASES DE UNA SOLA SUSTANCIA
SOLUCIONES
Es una mezcla homognea de especies
qumicas dispersas en escala molecular
Las soluciones pueden ser binarias, ternarias, ..
etc, dentro de estas, las clases de soluciones
pueden ser:
Soluciones gaseosas: mezcla de gases o
vapores
Soluciones lquidas: slidos, lquidos o gases
disueltos en un lquido.
Soluciones slidas: gases o slidos en slidos
(todas las aleaciones
SOLUCIN IDEAL (LEY DE RAOULT)
A semejanza de los gases, las soluciones tienen,
tambin, comportamiento ideal; ahora consideremos
un solvente voltil y un soluto no voltil, y
examinemos el equilibrio entre la solucin y el vapor
Cuando se tiene el solvente puro, la presin de vapor
de la solucin ser (P
o
)
Cuando se introduce el soluto no voltil, la presin de
vapor de la solucin ( P ) ser menor a la del lquido
puro ( P
o
)
Graf 1
Adems se comprob, experimentalmente, que
conforme se aade soluto la presin de vapor (
Pvapor) de la solucin disminuye en forma lineal: (*)
GRAF 2
en consecuencia la ecuacin ( * ) se podr escribir:
en general:
Xm b P + =
o o o
P X P X P P ) 1 (
2 2
= + =
o
P X P
1
=
o
XP P =
expresiones conocidas como la Ley de RAOULT,
que dice La presin de vapor del solvente puro
sobre la solucin es igual a la presin de vapor del
solvente puro multiplicado por la fraccin molar del
solvente en la solucin.
La disminucin de la presin de vapor ser:
y cuando las soluciones tiene varios constituyentes:
o o o o
P X XP P P P ) 1 ( = =
o o
P X P P P
2
= A =
o
i i i
P X P =
Soluciones Binarias
Analicemos el caso en el cual los dos componentes
son voltiles:
En este caso, la composicin estar descrita de
acuerdo a:
(composicin del lquido)
(composicin del vapor)
no olvidemos que se analiza una solucin en
equilibrio con el vapor, por tanto:
por Raoult se tendr: y
1
2 1
= + X X
1
2 1
= +Y Y
o
P X P
1 1 1
=
o
P X P
2 2 2
=
o
P X P
1 1 2
) 1 ( =
si la presin total sobre el sistema es:
( ** )
por tanto P es funcin lineal de X1
2 1
P P P + =
o o
P X P X P P P
2 1 1 1 2 1
) 1 ( + = + =
1 2 1 2
) ( X P P P P
o o o
+ =
En la anterior ecuacin ( ** ), es evidente que la
adicin de un soluto puede aumentar o disminuir la
presin de vapor, dependiendo del que sea ms
voltil.
La ecuacin ( ** ) relaciona la presin total sobre la
mezcla, con la fraccin molar del componente 1 en el
lquido. Pero tambin la presin ( P ) puede
expresarse en funcin de la fraccin molar de
cualquiera de los dos constituyentes en el vapor ( Y1
o Y2).
Recordemos que:
X
1
= fraccin del componente 1 en el lquido
X
2
= fraccin del componente 2 en el lquido
Y
1
= fraccin del componente 1 en el vapor
Y
1
= fraccin del componente 2 en el vapor
En el vapor (Ley de Dalton) :
P Y P
1 1
=
1 2 1 2
) ( X P P P P
o o o
+ =
1 2 1 2
1
1
) ( X P P P
Y
P
o o o
+ =
1 2 1 2
1
1
) ( X P P P
P
Y
o o o
+
=
1 2 1 2
1 1
1
) ( X P P P
P X
Y
o o o
o
+
=
1 1 2 1
2 1
1
) ( Y P P P
P Y
X
o o o
o
+
=
reemplazando en la ecuacin (**):
1 1 2 1
2 1
2 1 2
) (
) (
Y P P P
P Y
P P P P
o o o
o
o o o
+
+ =
1 1 2 1
2 1 2 1 1 1 2 2 1 2
) (
) ( ) (
Y P P P
P Y P P Y P P P P P
P
o o o
o o o o o o o o
+
+ +
=
1 1 2 1
1 2 2 1 2 1 1 2 1 1 2 2 1 2
) ( Y P P P
Y P P Y P P Y P P Y P P P P
P
o o o
o o o o o o o o o o
+
+ +
=
1 1 2 1
1 2
) ( Y P P P
P P
P
o o o
o o
+
=
Diagrama presin Vs composicin
En el lquido tendremos:
si:
si:
que, a temperatura constante, se representa en
la grafica siguiente
1 2 1 2
) ( X P P P P
o o o
+ =
o
P P X
2 1
0 = =
o
P P X
1 1
1 = =
En el vapor:
Si:
Si :
La anterior ecuacin se asemeja a la relacin
matemtica:
En consecuencia X no puede describir estados,
del sistema, completamente gaseosos y por su
parte Y tampoco puede describir un estado
completamente lquido.
1 1 2 1
1 2
) ( Y P P P
P P
P
o o o
o o
+
=
o
P P Y
2 1
0 = =
o
P P Y
1 1
1 = =
o o
P
Y
P
Y
P
2
2
1
1
1
+ =
Superponiendo ambas grficas tendremos:
En esta ltima grfica tendremos que:
1 (rojo) es la llamada curva lquida o curva del punto
de la burbuja
2 (verde) es la curva de vapor curva del rocio
En 1 aparece la primera seal de vapor
En 2 aparece la primera seal de lquido
En el sector L + V coexisten lquido y vapor en
diferentes cantidades, segn sea la presin total.
DIAGRAMA TEMPERATURA vs COMPOSICION
Sin embargo, son mas importantes los diagramas
realizados a presin constante, por esto es usual y
mas til fijar la presin ( aunque no siempre a una
atmsfera) y determinar la temperatura a la cual el
lquido y el vapor estan en equilibrio. De esta forma se
construyen los diagramas de puntos de ebullicin
contra la concentracin (T vs X).
Se determin que y son funciones de la
temperatura a presin constante (se refiere a la
presin total. Las ecuaciones, en cuestin, son las
relaciones entre la temperatura de equilibrio (la de
ebullicin), y X
1
(composicin del lquido) y Y
1
(composicin del vapor)
o
P
1
o
P
1
o
P
2
Diagrama Temperatura Vs Fraccin Molar
graf 4
REGLA DE LA PALANCA
En la siguiente figura, esta regla demostrar,
para una composicin X y una Temperatura T
que la composicin de la fase lquida siempre
ser x1 y la de la fase gaseosa Y1 y que solo
cambiaran las cantidades de ambas fases
cuando X vari (siempre y cuando se encuentre
en la zona bifsica).
El balance de masa de las fases nos asegura que:
El balance de la sustancia 1 en todo el sistema y
en ambas fases es:
V L M + =
2 1
m m M + =
V Y L x M X
1 1 1
+ =
Regla de la Palanca
Graf 6
( ) ( )V X Y L x X
V Y L x V X L X
V Y L x V L X
1 1 1 1
1 1 1 1
1 1 1
) (
=
+ = +
+ = +
1 1
1 1
X Y
x X
L
V
=
REGLA DE LA PALANCA
En esta ltima relacin, el punto X se constituye en
el punto de apoyo de la palanca, el nmero de
moles lquido esta representada por la longitud
Y
1
X
1
y el nmero de moles de vapor por la longitud
( segmento) x
1
X
1
; la primera desde F hasta v y la
segunda desde F hasta l .
Entonces, como la deduccin de la regla de la
palanca depende de solo un balance de masa,
es entonces, vlida para calcular las cantidades
relativas de las dos fases presentes en
cualquier regin bifsica del sistema , de un
sistema multicomponente.
Cuando el diagrama se traza en trminos de
fracciones de masa y no en funcin de
fracciones molares, la regla de la palanca se
cumple y establece masas relativas de las dos
fases en vez de los nmeros de moles relativos.
Cambios de estado por reduccin isotrmica
de la presin graf7
Cambios de estado por reduccin isobrica
de la temperatura
DESTILACION FRACCIONADA
En el caso de mezclas de lquidos con diferentes temperaturas
de ebullicin, los primeros vapores que se forman durante el
calentamiento son muy ricos en los componentes mas voltiles,
de manera que la primera parte del destilado contiene grandes
cantidades de los lquidos mas voltiles y va quedando en el
recipiente la mezcla de los componentes menos voltiles, si
este proceso se repite varias veces bajo determinadas
condiciones, las mezclas de lquidos pueden separarse en sus
componentes individuales o en mezclas mas simples de
componentes con diferente grado de volatilidad y se denomina
destilacin fraccionada.
La destilacin fraccionada se usa mucho en la industria y en
especial para la separacin de los petroleos naturales en sus
derivados bsicos (gasolina, querosene etc).
COLUMNA DE FRACCIONAMIENTO
TORRE DE REFINACION
DESTILACION FRACCIONADA
AZEOTROPOS
En una mezcla no ideal las interacciones entre
los lquidos A B puede aumentar o disminuir
la presin de vapor de la mezcla. A cierta
composicin total, la separacin de los lquidos
por destilacin se impide, ya que en esa
condicin tanto la mezcla lquida y su vapor
tienen la misma composicin (AZEOTROPOS),
y la mezcla destila como si fuera un lquido puro.
(Ej: HNO3 + H2O, desviacin positiva; Etanol +
H2O, desviacin negativa).
DESVIACION POSITIVA
DESVIACION NEGATIVA
TRES COMPONENTES
En este tipo de sistemas se tienen 4 variables
independientes: presin, temperatura y dos
concentraciones.
Por sus propiedades geomtricas, un tringulo
equiltero es cmodo para representar
concentraciones (a T y P constantes).
PROPIEDADES DEL TRIANGULO DE
CONCENTRACIONES
1) Si los lados del tringulo expresan las
concentraciones de A, B y C ( en fracciones
molares o en porcentaje en peso), entonces la
concentracin de A, B y C de un
punto P cualquiera en el interior del tringulo
viene dada por:
AB= xB ( o porcentaje de B);
BC = xC ( o porcentaje de C);
CA = xA ( o porcentaje de A);
Si el punto P est expresado en coordenadas
dadas en porcentaje en peso, no tiene
porqu coincidir con el punto P equivalente,
expresado en coordenadas dadas en en
fracciones molares.
2) Una transversal cualquiera, por ejemplo CQ
en la figura, es el lugar geomtrico de
los puntos que cumplen la condicin xA/ xB=
constante, o bien %A/ %B= constante, en el
caso que el tringulo est expresado en
porcentaje en peso.
3)Una paralela a cualquier lado del tringulo, por
ejemplo MN / AB en la figura, debe satisfacer la
relacin que la suma de las concentraciones de
los componentes ubicados en el lado paralelo
es constante. As, para MN se tiene:
xA +xB = 1 xC = constante,
o bien (%A +%B)=100-%C = constante
4) Si se elige, por ejemplo el punto P
ubicado en el interior del tringulo AQC de
la figura, las concentraciones de l
pueden quedar expresadas en trminos
de A,Q y C, pero es imposible expresarlas
en trminos de Q, B y C porque el
tringulo QBC ni siquiera contiene al
punto P.
A
B
C
L
1
L
3
L
2
A 84% 10
B 5% 86
C 11% 4
A 69 11
B 10 81
C 21 8
A 52 13
B 19 72
C 29 15
A
B
C
COMPOSICIN:
PORCENTAJES
EN PESO
A 84% 10
B 5% 86
C 11% 4
A 69 11
B 10 81
C 21 8
A 52 13
B 19 72
C 29 15
PROBLEMA: Se mezclan 7,5 kg de A con 4,5 kg de B y 3 kg de C. Calcule la
masa de las fases formadas y su respectiva composicin. Calcule la masa
mnima de C que se debe agregar para formar una sola fase
SOLUCIN:
Clculo de la composicin total:
Masa total = (7,5 + 4,5 + 3)kg = 15 kg
Porcentaje total de A:
Porcentaje total de B:
Porcentaje total de C: 100 50 30 = 20%
% 50 100
15
5 , 7
% = =
kg
kg
A
% 30 100
15
5 , 4
% = =
kg
kg
B
A
B
C
COMPOSICIN:
PORCENTAJES
EN PESO
P
1 2 3 4 5 6
A
B
C
COMPOSICIN:
PORCENTAJES
EN PESO
P
A
B
C
COMPOSICIN:
PORCENTAJES
EN PESO
R
Q
T
Midiendo las distancias QP = 2,7 cm y PR = 1,0 cm
Aplicando la regla de la palanca: m
Q
x2,7 = m
R
x1,0
Tambin m
Q
+ m
R
= 15 kg
Resolviendo:
m
Q
= 4,1 kg y m
R
= 10,9 kg
Composicin de la fase Q A: 12%; B: 78%; C: 10%
Composicin de la fase R A: 64%; B: 12%; C: 24%
Para conseguir una sola fase, seguimos la trayectoria de la lnea verde hasta
el vrtice C, de donde al intersecar con la curva de equilibrio, el contenido en
C es 31%, entonces:
De donde m
C
= 2,39 kg
100
15
3
31
C
C
m
m
+
+
=
You might also like
- Ley #300 Ley Marco de La Madre Tierra y Desarrollo Integral para Vivir BienDocument64 pagesLey #300 Ley Marco de La Madre Tierra y Desarrollo Integral para Vivir BienarmamontesNo ratings yet
- DS - 3856 Modificaciones Rpca PDFDocument69 pagesDS - 3856 Modificaciones Rpca PDFMiriam100% (1)
- Normativa de Gestion Ambiental. MMAYADocument208 pagesNormativa de Gestion Ambiental. MMAYAJoaquin Chila FNo ratings yet
- Decreto Supremo 0902Document4 pagesDecreto Supremo 0902PriscilaNo ratings yet
- DS1641Document7 pagesDS1641rigarigo3000No ratings yet
- 14 Anexo2 - K2AP11Y14-E1Document16 pages14 Anexo2 - K2AP11Y14-E1Joaquin Chila FNo ratings yet
- 11 DS 25158 Orga SERNAPDocument11 pages11 DS 25158 Orga SERNAPJoaquin Chila FNo ratings yet
- 202 Guía de Educación Ambiental en La Gestión Integral de Residuos Sólidos PDFDocument133 pages202 Guía de Educación Ambiental en La Gestión Integral de Residuos Sólidos PDFTony Larson86% (7)
- 15 Anexo3 - K2AP11Y14-E1Document5 pages15 Anexo3 - K2AP11Y14-E1Joaquin Chila FNo ratings yet
- Ley 755 Gestion Integral ResiduosDocument30 pagesLey 755 Gestion Integral ResiduosJoaquin Chila FNo ratings yet
- 13 Anexo1 - K2AP11Y14-E1Document2 pages13 Anexo1 - K2AP11Y14-E1Joaquin Chila FNo ratings yet
- 16 Anexos4 - K2AP11Y14-E1Document5 pages16 Anexos4 - K2AP11Y14-E1Joaquin Chila FNo ratings yet
- 12 Inf - K2AP11Y14-E1 PDFDocument168 pages12 Inf - K2AP11Y14-E1 PDFJoaquin Chila F100% (1)
- Cementos MolinsDocument5 pagesCementos MolinsRose AdelineNo ratings yet
- Memoria 2014Document150 pagesMemoria 2014Wilson SentenoNo ratings yet
- CEMCOLSA EIA Planta Cementera San Luis 20101215 PDFDocument570 pagesCEMCOLSA EIA Planta Cementera San Luis 20101215 PDFJoaquin Chila FNo ratings yet
- Precios Medio Ambiente-BoliviaDocument4 pagesPrecios Medio Ambiente-BoliviaJoaquin Chila FNo ratings yet
- 4 - BOLIVIA Del Carpio FANCESA PDFDocument53 pages4 - BOLIVIA Del Carpio FANCESA PDFAdams Rodrigo Colque RamosNo ratings yet
- Factorización Parte 2Document11 pagesFactorización Parte 2Joaquin Chila FNo ratings yet
- 3.2. Factorizacion P2 PDFDocument4 pages3.2. Factorizacion P2 PDFJoaquin Chila FNo ratings yet
- 4169 2705 1 PBDocument6 pages4169 2705 1 PBGustavo AlejandroNo ratings yet
- 3.2. Factorizacion P2 PDFDocument4 pages3.2. Factorizacion P2 PDFJoaquin Chila FNo ratings yet
- Lopez Rodriguez Angeles PDFDocument674 pagesLopez Rodriguez Angeles PDFファルファン ラウルNo ratings yet
- Linea Recta IDocument10 pagesLinea Recta IJoaquin Chila FNo ratings yet
- Factorizacion TeoriaDocument6 pagesFactorizacion TeoriaJoaquin Chila FNo ratings yet
- 3.2. Factorizacion P2 PDFDocument4 pages3.2. Factorizacion P2 PDFJoaquin Chila FNo ratings yet
- Factorización - 1era ParteDocument9 pagesFactorización - 1era ParteJoaquin Chila FNo ratings yet
- Cómo Seleccionar Un Instrumento para Evaluar Aprendizajes Estudiantiles - PDF 7Document45 pagesCómo Seleccionar Un Instrumento para Evaluar Aprendizajes Estudiantiles - PDF 7Nathaly SandovalNo ratings yet
- Silogismo Sofisma o Falasia ParalogismoDocument9 pagesSilogismo Sofisma o Falasia Paralogismopilars2No ratings yet
- Educación secundaria comunitaria productiva: Ciencia, tecnología y producciónDocument50 pagesEducación secundaria comunitaria productiva: Ciencia, tecnología y producciónangles_mpaNo ratings yet