Professional Documents
Culture Documents
Teoría Del Enlace de Valencia
Uploaded by
Erik Ortiz BlancoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Teoría Del Enlace de Valencia
Uploaded by
Erik Ortiz BlancoCopyright:
Available Formats
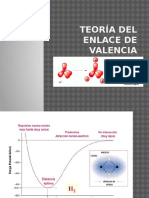
Teora del enlace de valencia Hasta la fecha se utilizan dos teoras mecanico-cuanticas para describir la formacin del enlace
covalente y la estructura electrnica de las molculas. La teora de enlace de valencia (EV) supone que los electrones en una molcula ocupan orbitales atmicos de los tomos individuales. Esto permite tener en mente el esquema de los tomos individuales participando en la formacin del enlace. La teora de enlace de valencia proporciona una visin mas clara sobre la formacin de enlaces qumicos que la teora de Lewis. Establece que una molcula estable se forma a partir de la reaccin entre los tomos cuando la energa potencial del sistema ha disminuido al mnimo De acuerdo con la teora sobre enlace valencia, se forma un enlace entre dos tomos cuando se satisfacen las condiciones siguientes:
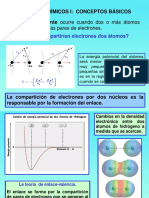
Un orbital de en un tomo viene a ocupar una porcin de la misma regin del espacio que ocupa un orbital del otro tomo. Se dice que los dos orbtales se traslapan. Esto se explica ya que a medida que el orbital de un tomo se traslapa con el otro, los electrones en orbtales comienzan a moverse alrededor de ambos tomos. Debido a que los electrones a ambos ncleos a la vez, jalan juntos a los tomos. La fuerza del enlace depende de la cantidad de traslape; mientras mayor sea la sobreposicin mayor ser la fuerza de la unin.
El nmero total de electrones en ambos orbtales no es mayor a dos. Lo dos orbtales no pueden contener ms de dos electrones, porque en una regin dada del espacio solo pueden estar dos electrones (esto ocurre siempre y cuando si los espines de los electrones son opuestos).
A medida que el orbital de un tomo se traslapa con el orbital de otro, los electrones en los orbtales empiezan a moverse alrededor de ambos tomos. Debido a que los electrones son atrados a ambos ncleos a la vez, jalan juntos a los tomos. La fuerza del enlace depende de la cantidad de traslape; mientras mayor sea la sobreposicin mayor ser la fuerza de la unin. Los dos orbtales no pueden contener mas de dos electrones, porque en una regin dada del espacio solo pueden estar dos electrones (y eso solamente si los espines de los electrones son opuestos).
Un aspecto importante de la teora del enlace de valencia es la condicin de mximo traslape que conduce a la formacin de los enlaces posibles ms fuertes. Esta teora se usa para explicar la formacin de enlaces covalentes en muchas molculas.
Por ejemplo en el caso de la molcula F2, el enlace F-F est formado por el traslape de orbitales p de dos tomos de flor diferentes, cada uno conteniendo un electrn desapareado. Dado que la naturaleza de los orbitales es diferente en las molculas de H2 y F2, la fuerza de enlace y la longitud de enlace diferirn en ambas molculas.
En una molcula de HF, el enlace covalente est formado por el traslape del orbital 1s del H y 2p del F, cada uno conteniendo un electrn desapareado. La comparticin mutua de los electrones entre H y F resulta en la formacin de un enlace covalente entre ambos. Teora de orbital molecular La Teora de Orbital Molecular (TOM) considera que en una molcula covalente, al estar tan cerca los ncleos de los tomos que conforman la molcula, la ecuacin de ondas acta de forma distinta y los orbitales normales (s, p, d, f) de los tomos se combinan para formar orbitales moleculares. Estos orbitales moleculares se pueden explicar como un solapamiento de los orbitales comunes de cada uno de los tomos. As, se tiene que los orbitales solapados generan una zona de mayor estabilidad, pero al mismo tiempo deben generar una de menor estabilidad que los orbitales originales. Por ejemplo, en el caso de los orbitales s, el solapamiento es como se indica en la figura 1:
FIGURA 1: SOLAPAMIENTO DE LOS ORBITALES s
Entonces, el orbital es el llamado orbital enlazante, porque causa cohesin entre los tomos, mientras que el orbital molecular es el orbital anti-enlazante, ya que causa una separacin de los ncleos (Ay B).
Por otro lado, para los orbitales p, el solapamiento es distinto dependiendo de la direccin espacial de los orbitales solapados, tenindose orbitales que solapan verticalmente y otros horizontalmente.
La teora de los orbitales moleculares aplicada a la molcula de hidrgeno es relativamente sencilla por estar implicados solamente dos orbitales atmicos s y nicamente dos electrones. Pero en las molculas poliatmicas con ms de dos ncleos y varios orbitales atmicos, el tratamiento es mucho ms complicado, pues, para llegar a conocer con exactitud la situacin ms estable del conjunto de los tomos de la molcula, habra que considerar orbitales moleculares que comprendieran a ms de dos ncleos o, incluso, a la molcula entera. Para obviar el estudio de una situacin tan compleja, sobre todo desde el punto de vista matemtico, se utilizan y admiten ciertas simplificaciones como la consideracin de que, en general, los orbitales moleculares se localizan esencialmente entre dos nicos ncleos y que su forma y orientacin mantienen cierta similitud con la forma y orientacin de los correspondientes orbitales atmicos. Esta aproximacin coincide con las ideas clsicas de considerar cada enlace como la fuerza de unin entre dos tomos, despreciando la influencia que el resto de la molcula pueda ejercer sobre el mismo. Con estas simplificaciones
se pueden interpretar la mayora de las molculas, aunque no todas, y aproximarse a la interpretacin que del enlace covalente da la teora del enlace de valencia. Orbitales moleculares s El orbital molecular enlazante descrito para la molcula de hidrgeno, que tiene forma elipsoidal (simtrico respecto al eje de unin de los dos ncleos), recibe el nombre de orbital molecular s (sigma) y el enlace covalente resultante, enlace s. Anlogamente el orbital molecular antienlazante correspondiente recibe el nombre de orbital s* (sigma estrella o sigma asterisco). Por solapamiento o interaccin de dos orbitales atmicos de tipo s se forman siempre orbitales moleculares de tipo s. Pero tambin a partir de orbitales p se pueden formar orbitales y enlaces s. As, por ejemplo, cuando un orbital p interacciona con un orbital s se llega a sendos orbitales moleculares s, uno enlazante:
y otro antienlazante con una zona nodal entre los ncleos de los dos tomos:
Como en el caso de la combinacin de dos orbitales s, en el orbital enlazante formado a partir de un orbital s y otro p, debido a la sensible disminucin que experimenta el lbulo no implicado en el solapamiento del orbital p, la mayor densidad electrnica se encuentra entre los dos ncleos y el orbital molecular resultante tiene prcticamente simetra elipsoidal respecto al eje que une los dos ncleos. Se trata pues de un orbital molecular s similar al de la molcula de hidrgeno. Tambin la interaccin frontal de dos orbitales p da origen a dos orbitales moleculares de tipo s, uno enlazante y otro antienlazante:
Como en los casos anteriores, en el orbital enlazante, al disminuir considerablemente los lbulos posteriores y poseer simetra elipsoidal, la mxima probabilidad de encontrar los electrones est entre los dos ncleos. Orbitales moleculares p Pero a partir de dos orbitales atmicos p puede originarse otro tipo de orbitales moleculares. En efecto, el solapamiento o interaccin entre los dos orbitales atmicos p puede tener lugar lateralmente para dar lugar a dos orbitales moleculares del tipo p (pi), uno enlazante, de menor energa que los atmicos de partida, y otro antienlazante, de mayor energa y con un nodo:
Esto es, los dos orbitales atmicos p puede orientarse de tal manera que sus lbulos del mismo signo queden al mismo lado de su plano nodal reforzndose mutuamente (situacin enlazante) o en lados opuestos (situacin antienlazante).
Como los orbitales atmicos de partida, los orbitales moleculares de tipo p tambin poseen zonas de distinto signo separadas por un plano nodal. El orbital molecular p enlazante est formado por dos lbulos de distinto signo en los que la probabilidad de encontrar a los electrones es mxima, separados por un plano nodal que pasa por los dos ncleos. Es decir, en el orbital enlazante, los dos ncleos de los tomos que aportan los orbitales p quedan unidos por dos zonas o nubes p, una superior y otra inferior de distinto signo. En el orbital antienlazante, las zonas nodales son dos, la del plano que pasa por los dos ncleos y la de un plano perpendicular al primero que hace que las zonas superior e inferior queden divididas a su vez en dos partes de distinto signo:
You might also like
- Combinación Lineal de Orbitales Atómicos, o Método CLOA, Que Considera Que El OrbitalDocument5 pagesCombinación Lineal de Orbitales Atómicos, o Método CLOA, Que Considera Que El Orbitallitul888No ratings yet
- Teoria de Orbitales AtomicosDocument7 pagesTeoria de Orbitales AtomicosDark HikaruNo ratings yet
- 1.1.3. - Modelo de Orbitales MolecularesDocument5 pages1.1.3. - Modelo de Orbitales MolecularesALANNo ratings yet
- Teoria Orbital MolecularDocument7 pagesTeoria Orbital MolecularMarco Antonio Cutimbo PacoNo ratings yet
- Teoria de Enlace de ValenciaDocument13 pagesTeoria de Enlace de ValenciaAdii VilHerNo ratings yet
- Punto 1 de ContenidoDocument6 pagesPunto 1 de ContenidoArmando ArmendarizNo ratings yet
- Enlace metálico: modelo de mar de electronesDocument9 pagesEnlace metálico: modelo de mar de electronesJovanna Michelle Hernandez HernandezNo ratings yet
- Teoria Orbital MolecularDocument9 pagesTeoria Orbital MolecularEstefi AcedoNo ratings yet
- TeoriasDocument14 pagesTeoriasAbby LopzCalderónNo ratings yet
- Inorganica 1Document3 pagesInorganica 1Julio CesarNo ratings yet
- Teoria de Enlace de ValenciaDocument4 pagesTeoria de Enlace de ValenciaRicardo AlmarzaNo ratings yet
- TEORÍA DE ORBITALES MOLECULARESDocument10 pagesTEORÍA DE ORBITALES MOLECULARESANDREWNo ratings yet
- Hibridación Orbital y Teoría de Orbitales MolecularesDocument4 pagesHibridación Orbital y Teoría de Orbitales MolecularesazulcathalinagNo ratings yet
- Trabajo QuímicaDocument2 pagesTrabajo Químicamirago 364No ratings yet
- Enlace e HibridaciónDocument19 pagesEnlace e HibridaciónAlonso Pino100% (4)
- Elance y Valencia y CovalenteDocument6 pagesElance y Valencia y CovalenteAriel CQNo ratings yet
- Investigación 2 de QuímicaDocument13 pagesInvestigación 2 de QuímicaJuanCaAPNo ratings yet
- Enlaces Sigma y Enlaces PiDocument2 pagesEnlaces Sigma y Enlaces PiIsrael Cortes100% (3)
- Orbitales Atómicos y Configuración Electrónica PDFDocument10 pagesOrbitales Atómicos y Configuración Electrónica PDFedisonNo ratings yet
- Quimica Organica CDocument26 pagesQuimica Organica CRolleros unidosNo ratings yet
- Quimica Organica ADocument23 pagesQuimica Organica ARolleros unidosNo ratings yet
- Compendio de Química Orgánica PDFDocument70 pagesCompendio de Química Orgánica PDFSelene JiménezNo ratings yet
- Conocimientos Previos para Química OrgánicaDocument6 pagesConocimientos Previos para Química OrgánicaAvril Bolondi MedinaNo ratings yet
- Fundamentos de Quimica Unidad 3Document30 pagesFundamentos de Quimica Unidad 3Diego David Iturria DawnNo ratings yet
- Teoría Del Enlace de Valencia XDDocument12 pagesTeoría Del Enlace de Valencia XDEmanuelNo ratings yet
- Q - Org - Compendio PDFDocument70 pagesQ - Org - Compendio PDFAngelNo ratings yet
- Teorías para Explicar El Enlace CovalenteDocument22 pagesTeorías para Explicar El Enlace CovalenteJuan RamírezNo ratings yet
- "Modelo de Enlace Valencia" Equipo - 5 Grupo1256Document19 pages"Modelo de Enlace Valencia" Equipo - 5 Grupo1256Lisbeth JimenezNo ratings yet
- La Teoría Del Orbital MolecularDocument8 pagesLa Teoría Del Orbital MolecularJoel AzaelNo ratings yet
- La Materia y Sus TransformacionesDocument6 pagesLa Materia y Sus TransformacionesEsteban ÑacataNo ratings yet
- SEMANA 3 TOM 2Document11 pagesSEMANA 3 TOM 2Torres Atencio AlonsoNo ratings yet
- Consulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.Document10 pagesConsulta N°2 Quimica General 1. Angamarca Angulo Brayan Alexander.BryanAngamarcaNo ratings yet
- Tipos de Orbitales MolecularesDocument3 pagesTipos de Orbitales MolecularesRubenNo ratings yet
- Estructura de LewisDocument14 pagesEstructura de LewisEdwin Roberto Molina RamirezNo ratings yet
- Notas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaDocument7 pagesNotas de Teoria de Las Repulsiones Entre Los Pares de Electrones de La Capa de ValenciaEgcrisostomoNo ratings yet
- EnlacesQuímicosDocument12 pagesEnlacesQuímicosFranz CaliNo ratings yet
- Orbitales moléculares y TOMDocument4 pagesOrbitales moléculares y TOMRocio Diaz TrujanoNo ratings yet
- UiouikjkjklDocument10 pagesUiouikjkjklRaymi CampoNo ratings yet
- Teoría de Orbitales MolecularesDocument2 pagesTeoría de Orbitales MolecularesFrey MeloNo ratings yet
- Generalidades Del Enlace Químico...Document3 pagesGeneralidades Del Enlace Químico...Juliana GonzálezNo ratings yet
- Práctica No 1 Enlaces HíbridosDocument9 pagesPráctica No 1 Enlaces HíbridosZury Carrion100% (1)
- Teoria Del Enlace de ValenciaDocument2 pagesTeoria Del Enlace de ValenciaMarina AquinoNo ratings yet
- Generalidades de La Química OrgánicaDocument14 pagesGeneralidades de La Química OrgánicaFranco BorgatelloNo ratings yet
- Estructuras de Lewis y propiedades de los enlaces químicosDocument20 pagesEstructuras de Lewis y propiedades de los enlaces químicosChristian Dominguez VillafanaNo ratings yet
- Estructura molecular orgánicaDocument27 pagesEstructura molecular orgánicaMarcela CastañedaNo ratings yet
- Enlacequimico 1 BachDocument22 pagesEnlacequimico 1 Bachpeterpam25No ratings yet
- Enlace Químico TeoríaDocument15 pagesEnlace Químico TeoríaDara AguilaNo ratings yet
- Teoria de BandasDocument5 pagesTeoria de BandasRamon Flores LechugaNo ratings yet
- Enlace MetálicoDocument9 pagesEnlace MetálicoKathiam JaretNo ratings yet
- ENLACEDocument0 pagesENLACESalvador CortésNo ratings yet
- Química orgánica: hibridación, orbitales enlazantes y tipos de enlaceDocument3 pagesQuímica orgánica: hibridación, orbitales enlazantes y tipos de enlaceMichelle ValdezNo ratings yet
- Cuestionario 1 CONTESTADODocument3 pagesCuestionario 1 CONTESTADOCarmenPalaciosNo ratings yet
- Orbitales Atómicos y MolecularesDocument7 pagesOrbitales Atómicos y Molecularesashley0balcazarNo ratings yet
- Hibridación de Orbitales AtómicosDocument30 pagesHibridación de Orbitales AtómicosMonica BortNo ratings yet
- Geometria Electronica QuimicaDocument10 pagesGeometria Electronica QuimicaBryanAngamarcaNo ratings yet
- Trabajo de QuimicaDocument14 pagesTrabajo de QuimicaObbalonaire Vanessa Cruz BNo ratings yet
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseFrom EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseRating: 4.5 out of 5 stars4.5/5 (7)
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaFrom EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaRating: 5 out of 5 stars5/5 (1)
- Resumen de Reacciones PericíclicasDocument5 pagesResumen de Reacciones PericíclicasErik Ortiz BlancoNo ratings yet
- Resumen Grupos ProtectoresDocument7 pagesResumen Grupos ProtectoresErik Ortiz BlancoNo ratings yet
- Modificaciones Genéticas para El Incremento de La ProducciónDocument13 pagesModificaciones Genéticas para El Incremento de La ProducciónErik Ortiz BlancoNo ratings yet
- Perfil cardiaco: biomarcadores y tratamientosDocument3 pagesPerfil cardiaco: biomarcadores y tratamientosErik Ortiz BlancoNo ratings yet
- Proyecto GenéticaDocument7 pagesProyecto GenéticaErik Ortiz BlancoNo ratings yet
- Objetivos de La FarmacogenómicaDocument7 pagesObjetivos de La FarmacogenómicaErik Ortiz BlancoNo ratings yet
- Estudios de Toxicidad Crónica y SubcrónicaDocument5 pagesEstudios de Toxicidad Crónica y SubcrónicaErik Ortiz BlancoNo ratings yet
- Cuestionario de La Practica de LipidosDocument5 pagesCuestionario de La Practica de LipidosErik Ortiz BlancoNo ratings yet
- Bioquímica Metabólica - Práctica 3Document2 pagesBioquímica Metabólica - Práctica 3Erik Ortiz BlancoNo ratings yet
- Bioquímica Metabólica - Práctica 3Document2 pagesBioquímica Metabólica - Práctica 3Erik Ortiz BlancoNo ratings yet
- Equilibrio electrolítico: principales electrolitos y métodos de mediciónDocument7 pagesEquilibrio electrolítico: principales electrolitos y métodos de mediciónErik Ortiz Blanco100% (1)
- ÉbolaDocument13 pagesÉbolaErik Ortiz BlancoNo ratings yet
- Farmacología - Práctica N - 3 CorregidaDocument13 pagesFarmacología - Práctica N - 3 CorregidaErik Ortiz BlancoNo ratings yet
- Cuestionario de GenéticaDocument2 pagesCuestionario de GenéticaErik Ortiz BlancoNo ratings yet
- Bioquímica Metabólica - Práctica 3Document2 pagesBioquímica Metabólica - Práctica 3Erik Ortiz BlancoNo ratings yet
- Laboratorio de Química Orgánica III Practica 1Document3 pagesLaboratorio de Química Orgánica III Practica 1Erik Ortiz BlancoNo ratings yet
- Elementos de La Familia IADocument6 pagesElementos de La Familia IAErik Ortiz BlancoNo ratings yet
- Elementos de La Familia IADocument6 pagesElementos de La Familia IAErik Ortiz BlancoNo ratings yet
- CARBOHIDRATOSDocument26 pagesCARBOHIDRATOSErik Ortiz BlancoNo ratings yet
- Calidad TotalDocument4 pagesCalidad TotalErik Ortiz BlancoNo ratings yet
- Salud y Enfermedad. Inf. ErikDocument6 pagesSalud y Enfermedad. Inf. ErikErik Ortiz BlancoNo ratings yet
- Soluciones CristaloidesDocument3 pagesSoluciones CristaloidesErik Ortiz BlancoNo ratings yet
- Soluciones CristaloidesDocument3 pagesSoluciones CristaloidesErik Ortiz BlancoNo ratings yet
- Dirección General de Educación Tecnológica Agropecuaria y Ciencias del MarDocument88 pagesDirección General de Educación Tecnológica Agropecuaria y Ciencias del MarAmérica Dayanee García CruzNo ratings yet
- Valencia y enlace químico: propiedades de sustanciasDocument4 pagesValencia y enlace químico: propiedades de sustanciasDavinia ValdiviaNo ratings yet
- 3o 2T ALUMNO QUIMICA CUADERNILLODocument44 pages3o 2T ALUMNO QUIMICA CUADERNILLOSo Og87% (15)
- Solución Guia Enlace QuímicoDocument4 pagesSolución Guia Enlace QuímicoSamuel AgudeloNo ratings yet
- Números de OxidaciónDocument6 pagesNúmeros de OxidaciónLuis GarciaNo ratings yet
- U1 - Tema 2 - Los Compuestos QuimicosDocument39 pagesU1 - Tema 2 - Los Compuestos QuimicosAlejandro Estrella GutiérrezNo ratings yet
- Desarrollo Taller de QuimicaDocument3 pagesDesarrollo Taller de QuimicaDianitta MaciasNo ratings yet
- Actividades de Repaso U.D 1.Document4 pagesActividades de Repaso U.D 1.quifinmaNo ratings yet
- Guia N°1 (II°C) Estructura de LewisDocument3 pagesGuia N°1 (II°C) Estructura de LewisJacky KarNo ratings yet
- Nomenclatura de Los ElementosDocument124 pagesNomenclatura de Los ElementosJavier ZarateNo ratings yet
- Tema-2 20 21Document42 pagesTema-2 20 21Pilar de la CruzNo ratings yet
- Biologia 08Document192 pagesBiologia 08Susana EcheverriNo ratings yet
- REPASO EXAMEN FQA 2do 1raDocument1 pageREPASO EXAMEN FQA 2do 1raRomina Ruiz DíazNo ratings yet
- Balanceo Redox por Ión-ElectrónDocument14 pagesBalanceo Redox por Ión-ElectrónIrvin JosueNo ratings yet
- Sistema Periódico y propiedades periódicas ejercicios resueltosDocument8 pagesSistema Periódico y propiedades periódicas ejercicios resueltosOxana ShtefanNo ratings yet
- Libro Q 2Document294 pagesLibro Q 2biologiaumar0% (2)
- La Tabla Periódica WordDocument7 pagesLa Tabla Periódica Wordluana ayalaNo ratings yet
- Configuración electrónica: distribución de electrones en átomosDocument30 pagesConfiguración electrónica: distribución de electrones en átomosJorge MéndezNo ratings yet
- Formación de enlaces químicosDocument6 pagesFormación de enlaces químicosMax Wells100% (3)
- Formulación InorgánicaDocument15 pagesFormulación Inorgánica96qjxnsywrNo ratings yet
- Funciones QuimicasDocument29 pagesFunciones QuimicasMitchell CalixtoNo ratings yet
- Enlace Quimico Completo PDFDocument38 pagesEnlace Quimico Completo PDFkatherineNo ratings yet
- Formulacion-Quimica-2eso - TEORÍADocument7 pagesFormulacion-Quimica-2eso - TEORÍAInmaculada Velicias CartónNo ratings yet
- Teoría de Repulsión de Pares Electrónicos en La Capa de ValenciaDocument5 pagesTeoría de Repulsión de Pares Electrónicos en La Capa de ValenciaemkersytNo ratings yet
- ENLACE QUIMICO-2b para PDFDocument106 pagesENLACE QUIMICO-2b para PDFDairo TorresNo ratings yet
- Organización experiencia y conceptos átomo e ionDocument14 pagesOrganización experiencia y conceptos átomo e ionMiguel SanchezNo ratings yet
- Enlaces Químicos Cierre Del Módulo.Document17 pagesEnlaces Químicos Cierre Del Módulo.DANIELA SOLIS MARROQUINNo ratings yet
- Teoría de la Formación por Etapas (TFEAMDocument7 pagesTeoría de la Formación por Etapas (TFEAMJerico Dante100% (1)
- Números de OxidaciónDocument3 pagesNúmeros de OxidaciónAndres VargasNo ratings yet