Professional Documents
Culture Documents
Gases
Uploaded by
gori-rCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Gases
Uploaded by
gori-rCopyright:
Available Formats
1
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
U N I D A D
6
Gases
1.Variables de estado 2.Leyes de los gases ideales
3. Mezcla de gases 4 Gas recogido sobre agua
INTRODUCCIN
Los estados clsicos de la materia son el slido, el lquido y el gaseoso. Una
sustancia presenta un estado especfico dependiendo de los valores de
presin y temperatura.
El estado gaseoso se caracteriza porque no tiene forma ni volumen definido
y ocupa todo el volumen del recipiente que lo contiene.
Las leyes que regulan el comportamiento de los gases dependen de las
relaciones entre las variables de estado:
Moles (n), temperatura absoluta (T), presin (P) y volumen del gas (V).
Volumen del gas:(V)
Es el volumen disponible por el gas para su movimiento y corresponde al
volumen del recipiente que lo contiene menos el volumen ocupado por sus
molculas, este ltimo es despreciable si el gas es "ideal".
Para un gas ideal:
V V del recipiente
Para un gas real: V = V del recipiente - V de las molculas del gas
Presin: (P)
Las molculas del estado gaseoso poseen alta velocidad y al chocar contra
las paredes del recipiente que lo contiene originan unas fuerzas de choque y
como:
Conceptualmente, presin es fuerza que acta en la unidad de rea, entonces P =
Fuerza
rea
se origina la presin que ejerce el gas. La presin que ejerce un gas (causa)
se puede medir mediante un manmetro, as:
2
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
La presin del gas (causa) ocasiona el desnivel (h) y el valor de esta altura
(efecto) es una presin hidrosttica (Ph) que se puede calcular
conceptualmente as:
Como presin, P =
fuerza
rea
La Fuerza est dada por el peso del lquido ( W ) de la columna hidrosttica
de altura h (esto tambin se conoce como cabeza hidrosttica), y el
rea es el rea transversal, segn lo anterior:
Ph =
W
rea
Pero W = m x g, donde:
W = Peso del lquido.
m = Masa del lquido.
g = Aceleracin de la gravedad, sustituyendo W queda:
Ph =
m x g
rea
Pero, m = V x d, donde:
V = Volumen del lquido.
d = Densidad del lquido, sustituyendo m , queda:
Ph =
V
x d x g
rea
Pero V = rea x h, sustituyendo V , queda
h
GAS
3
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Ph =
rea
x h x d x g
rea
El rea se "cancela" y esto ocasiona la paradoja hidrosttica: la presin
hidrosttica (Ph) de un lquido slo depende de su diferencia de alturas y es
independiente del volumen de la masa del lquido, y queda:
Ph = h
x
d
x
g
Nota:
Para una presin dada, las variables del lquido h y d, vemos que son
inversamente proporcionales y si cambiamos de dicho lquido por el lquido
de referencia que es el mercurio (Hg), tambin se cumple que:
Ph = hHg
x
dHg
x
g
Como Ph del lquido = Ph del Hg, entonces:
h
x
d = hHg
x
dHg
Nota, la dHg = 13.6 g / mL
Comentario:
La Ph en fsica se calcula y su resultado se expresa en unidades de Fuerza
sobre unidades de rea, como:
Ph[=]
dina
,
Newton
,
Kg fuerza
,
poundal
,
lb fuerza
cm
2
cm
2
cm
2
inch
2
inch
2
Y algunas veces con "nombre propio" como Pa (Pascal), bares, Psi.
La Ph en qumica no se calcula, SE REPORTA con la altura medida en cm
para el lquido manomtrico de referencia que es el mercurio, esto es:
Ph [=] cm Hg
Lo anterior se lee presin hidrosttica medida en centmetros de mercurio,
Ph [=] mm Hg (tambin conocido como Torr)
Lo anterior se lee presin hidrosttica medida en milmetros de mercurio, o Torricelli.
Si el lquido manomtrico experimental no es mercurio, se traslada (o se
corrige) dicha altura a la equivalente de mercurio (Hg) de referencia usando
la relacin inversa de densidades, la altura obtenida de mercurio es mucho
menor, ya que el mercurio es el lquido que posee mayor valor de densidad,
as:
Sea h la medida experimental de la altura del lquido, dicha altura
corresponde a:
4
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
hHg = h x
d si h est en cm, obtenemos cm Hg.
13.6 si h est en mm, obtenemos mm Hg, o Torr (Torricelli).
Cuando se mide la presin de la atmsfera al nivel del mar, de acuerdo al
experimento propuesto en 1643 por Evangelista Torricelli, matemtico y
fsico italiano (1608 1647), la altura de la Ph medida con mercurio es de 76
cm, de aqu se afirma que:
1 atm = 76 cm Hg
1 atm = 760 mm Hg (obvio, ya que 1 cm = 10 mm)
1 atm = 760 Torr (en honor a Torricelli)
Curiosidades:
Psi: notacin muy conocida en textos tcnicos y es la abreviatura de "Pounds
per Square Inch" y corresponde a la presin medida en:
Libras
, o
libras
1 atm = 14.7 Psi
Pulgada
2
Inch
2
Pascal (Pa) es el nombre asignado a la presin medida en:
Newton
1 atm = 101325 Pa
Metro
2
Bar es el nombre asignado a la presin medida en:
dina
cm
2
Variacin de la presin atmosfrica con la altura.
Blas Pascal (basado en la experiencia de Torricelli), supuso que si la altura
de la columna de mercurio en el barmetro se deba a la presin atmosfrica,
dicha longitud deba disminuir con la altura y, por resultados experimentales,
concluy que por cada 10,5 metros de altura el mercurio debe descender
1mm, esto es vlido para pequeas diferencias de altura, ya que la presin
atmosfrica no disminuye uniformemente, porque a mayor altura, menor es la
densidad del aire.
Temperatura:
Para medir la temperatura hay dos tipos de escala: temperatura absoluta
(requerida como variable de estado en gases) y temperatura relativa.
La escala absoluta No acepta valores negativos y La escala relativa acepta
valores positivos y negativos.
Ambas se miden en sistema decimal en sistema ingls (escala usada en
textos tcnicos), as:
5
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
ESCALA DECIMAL INGLS
Absoluta Kelvin (K) Rankine (R)
Relativa Centgrado (C) Fahrenheit (F)
Segn el sistema internacional de unidades, los grados Kelvin no se deben
representar como K, la representacin sugerida es solo K, pero al discutir
las leyes de los gases ideales aparecen constantes de proporcionalidad, que
tambin se representan como K, para obviar homnimos, vamos a usar K.
La relacin entre estas escalas es lineal, por lo tanto hacen falta dos puntos
de referencia para establecerla, estos puntos de referencia son: las
temperaturas normales (a 1atm) de ebullicin y de fusin del agua, as:
Temperatura de Ebullicin 100C 373K 212F 672R
Temperatura Fusin 0C 273K 32F 492R
Si queremos relacionar C y F basta con usar el plano cartesiano con los
ejes C vs F y ubicar los puntos: de fusin y ebullicin, as:
C
100
B(212,100)
D (F,C)
o
(32,0)A
E C
32 212 F
Originamos dos tringulos semejantes (ACB y AED) y por geometra, por trigonometra o con
la ecuacin de la lnea recta de geometra analtica, (es lo mismo), tenemos:
con: AC = 212 - 32 = 180
AE = F 32
CB = 100 0 = 100
ED = C 0 = C
Podemos afirmar que:
En el tringulo AED:
Tan =
ED
=
C
AE F - 32
6
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
En el tringulo ACB:
Tan =
CB
=
100
=
5
AC 180 9
Igualando a Tan :
C
=
5
o mejor, 1.8 C = F 32, (Por qu?)
F - 32 9
Con un procedimiento similar llega a: K = C + 273
Leyes de los gases IDEALES
Estas fueron propuestas por los investigadores Robert Boyle (qumico
irlands, 1627 - 1691, quien enunci antes que Matiotte su ley, en 1661 y
defini por primera vez el elemento qumico); Jacques Charles (fsico
francs, 1746 1823) y Amadeo Avogadro (qumico italiano, 1776 1856).
Manipulando una variable independiente (causa) y observando como cambia
la variable dependiente (efecto); lo anterior se conoce como las leyes de
Boyle, Charles y Avogadro.
La variable dependiente, tiene que ser fcil de comparar y de ellas la ms
verstil es el volumen.
V: Volumen del gas dependiente
Las variables de estado son:
T: Temperatura absoluta (K, R)
n: Moles independientes
P: Presin
Para identificar fcilmente las variables correlacionadas en cada una de las
leyes, basta con ordenar alfabticamente las variables independientes (n,
P, T) y a los investigadores que generaron dichas leyes (Avogadro, Boyle,
Charles).
Orden alfabtico Restriccin
n Avogadro P y T constantes
V P Boyle n y T constantes
Variable
dependiente T Charles n y p constantes
Anlisis de la correlacin entre la variable independiente y la variable
dependiente en las tres leyes de los gases ideales:
7
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Para "VER" como la variable independiente (causa) altera el volumen
(variable dependiente o efecto), usaremos un Pistn (si no conoce un pistn
imagnese una jeringa).
Ley de Avogadro:
"Vemos" que si agregamos moles (aumenta n), el mbolo (parte mvil del
pistn) se desplaza hacia arriba (el volumen aumenta), es decir: el Volumen
(V) y las moles (n) son directamente proporcionales.
V
= Ka, Ka = f (T,P) . Esto significa que:
n
Ka es la constante de Avogadro. Su
valor es relativo para cada
experimento ya que depende de los
valores de T y P (constantes) a los
cuales se toman los valores variables
de, V y n. es decir Ka es una
constante relativa.
Ley de Boyle:
"Vemos" que si aumentamos la presin (causa), el mbolo se desplaza
hacia abajo, el volumen disminuye y por lo tanto V y P son inversamente
proporcionales, es decir:
V
x
P= Ka, Kb = f (n,T) . Esto significa que:
Kb es la constante de Boyle, su
valor es relativo para cada
experimento ya que depende de
los valores constante de n y T a
los cuales se toman los valores de V
y P, Kb es una constante relativa
Ley de Charles:
n , T
P(+)
V(-)
T.P
V(+)
n(+)
8
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Si aumentamos la temperatura, el mbolo asciende, es decir, aumenta el
volumen y estas variables (V y T) son directamente proporcionales.
V
= Kc, Kc = f (P,n) . Esto significa que:
T
Kc es la constante de Charles para la
proporcionalidad directa entre volumen
y temperatura absoluta, el valor de Kc
es relativo a los valores de n y P que
permanecen constantes en la variacin
de V y T, o sea que Kc es una
constante relativa
Ley Combinada De Boyle - Charles
V
x P
= Kbc, Kbc = f (n) . Esto significa que:
T
Kbc Constante de Boyle-Charles su
valor es relativo a las moles a las
cuales se les determina la relacin
inversa V-P y directa V-T. Kbc tambin
es una constante relativa.
Para un Experimento i
Vi x Pi
= Kbc i Kbc I = f (ni)
Ti
Para un Experimento o
Vo x Po
= Kbc o Kbc o = f (no)
To
Si no = ni Kbc o = Kbc i, es decir: Vi x Pi
=
Vo x Po
Ti To
Haciendo "producto de medios igual a producto de extremos queda:
Vi x Pi x To = Vo x Po x Ti ; esto para recordar se lee: vipito igual a vopoti
o ms elegante Vi = Vo x
Po Ti
, donde:
Pi To
P, V, T
directa
Inversa
n
P,n
V(+)
T(+)
9
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Po
es la "correccin" inversa del volumen Vo, ocasionada por el cambio de presin, y
Pi
Ti
es la "correccin" directa del volumen Vo, ocasionada por el cambio de temperatura.
To
Ley Combinada De Avogadro - Boyle - Charles (ABC)
V
x P
= Kabc,
n
x
T
Kabc es la constante de Avogadro,
Boyle y Charles no depende de
ninguna de las variables de estado,
slo puede tener un valor y por
esto se llama: "LA CONSTANTE
UNIVERSAL DE LOS GASES
IDEALES" R
El valor de R se calcula con "un dato experimental confiable".
Cambiando Kabc por R , queda: V
x P
= R
n
x
T
Definicin:
Condiciones normales (CN) de un gas ideal, (mejor TPE) Temperatura y
Presin Estndar, son unos valores estndar de temperatura y presin y son:
T = 273 K , y P = 1 atm
Dato Experimental Confiable:
Este dato nos suministra informacin para calcular el valor de R.
"El volumen molar normal de un gas ideal es 22.4 L". En esta redaccin
"elegante" estn camuflados los valores de las cuatro variables de estado, as:
V = 22.4 L (obvio)
n = 1 mol (por ser molar)
T = 273 K y P = 1 atm (por ser normal)
O mejor: Factor de conversin a CN o TPE
22.4 L
1 mol
Con los cuatro valores anteriores encontramos que: R =
0.082 atm L
mol K
Haciendo producto de medios igual a producto de extremos, obtenemos:
Ecuacin De Estado: PV = RTn
V n P T
directa
directa
Inversa
10
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Para asociar recuerde que la Polica Vial es un ReTen
Modificacin de la ecuacin de estado:
Como n =
W
Ya que por factores W g x
1 mol
= n mol, entonces:
Mw Mw g
PV = RT
x
W
, intercambiando Mw y V:
Mw
PMw = RT
x
W
, y como densidad d =
W
, entonces llegamos a:
V V
PMw = dRT: sta es la ecuacin de estado modificada
para asociar recuerde que la Pacho Maturana es un directoR Tcnico
Mezcla De Gases
Si en un recipiente hay una mezcla de gases, la Presin hidrosttica ( Ph ),
medida con la altura (h) del manmetro, es la presin total ( Pt ) que ejercen
todas las moles ( nt ) que estn contenidas en todo el volumen (Vt), a una
temperatura absoluta T.
h Ph Pt
Si aplicamos la ecuacin de estado
(PV=RTn) para la mezcla total con la
Pt, ejercida por y nt contenidas en el Vt
queda:
P
t
V
t
= RTn
t
C
Cmo nt = n + n
(las moles son
variable extensiva) sustituyendo en C
queda:
PtVt = RTn + RT n
C
Si quiero: la P ejercida por las moles de ( n ) a la temperatura T y
contenidas en el Vt , como no la puedo medir (el manmetro no es selectivo) ,
entonces la CALCULO con la ecuacin de estado, as:
P Vt = RT n C
De igual manera para el gas : P
Vt = RT n
C
Sustituyendo C y C en C queda:
PtVt = P Vt + P
Vt
h
11
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
simplificando Vt queda: Pt = P + P
C
En general, en una mezcla de gases, la presin total (Pt) es igual a la suma
() de las presiones parciales Pj de cada uno de los gases que forman dicha
mezcla, y cada Pj (Presin parcial) se calcula como si las moles parciales
(nj) ocuparan todo el volumen (Vt), lo anterior se conoce como la Ley de
Dalton de las Presiones Parciales (Pj) en una mezcla de gases, que en
forma "elegante" queda:
=
=
m
j
j t
P P
1
En forma menos elegante, esto es lo mismo que: Pt =P1 +P2 + + Pm
Donde m es el nmero de gases diferentes que forman la mezcla y:
PjVt = RTnj
NOTA 1: El subndice t nos indica que la variable es extensiva y por lo tanto es aditiva.
NOTA 2: La temperatura absoluta (T) no acepta el subndice t porque no es una variable
extensiva, no es aditiva; para aclarar este comportamiento imagnese un sancocho con el
caldo a 20 C, las papas a 20 C, la carne a 20 C, la yuca a 20 C, y usted no consumir ese
sancocho por pensar que se puede quemar, creyendo que est a 80 C. (Que pena con esta
ilustracin, pero es cotidiana)
Ley Hipottica de Amagat
Suponga que en la mezcla anterior, hipotticamente yo quiero que cada gas
parcial tenga una presin igual a la total, en lugar de la presin parcial que
realmente ejerce; esto se lograra separando hipotticamente los componentes de la mezcla
y limitando el movimiento de las molculas a una parte del volumen, as:
h Ph Pt
Pt Ph h
Si quiero calcular el volumen del gas (V) para que sus moles (n) ejerzan
una presin total (Pt) a la temperatura absoluta T, (usando la ecuacin de
estado), queda:
Pt V = RT n
V
P
t
n
V
P
t
n
12
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
De igual manera para el gas , usando en la ecuacin de estado Pt, V
y n
obtenemos:
Pt V
= RT n
C
Sustituyendo y C en C queda:
PtVt = Pt V + Pt V
Simplificando Pt queda: Vt = V + V
En general, en una mezcla de gases, el volumen total (Vt) es igual a la suma
de los volmenes parciales Vj de cada uno de los gases que forman dicha
mezcla, y cada Vj (volumen parcial) se calcula como si las moles parciales
(nj) ejercieran toda la presin (Pt); lo anterior se conoce como la Ley de
Amagat de los Volmenes Parciales (Vj), en una mezcla de gases, que en
forma "elegante" queda:
=
=
m
j
j t
V V
1
No se asuste, lo anterior es: Vt = V1 + V2 + + Vm
Donde m es el nmero de gases diferentes que forman la mezcla:
PtVj = RTnj
Ecuacin de Estado Modificada (PMw = dRT) para una mezcla de gases
Con subndices t (t de total) para las variables P, Mw y d, ya est claro que la
temperatura absoluta (T) no acepta el subndice t por ser variable intensiva
(acurdese del sancocho), dicha ecuacin quedara:
PtMwt = dtRT CCC, pero:
O dt = dj, esto es falso, C ya que la densidad es una variable intensiva
que no es aditiva; para evitar errores cambiemos el subndice t por el
subndice mezcla y la ecuacin de estado modificada quedara:
PtMwt = TRdmezcla CC
O Pt = Pj, esto si es vlido (Ley de Dalton).
O Mwt = Mwj, esto es falso C (Mw es variable intensiva que no es aditiva),
por lo tanto hay que cambiarle de subndice al Mw, entonces usemos
Mwmezcla, en ese caso la ecuacin de estado modificada quedara:
PtMwmezcla = dmezclaRT C
13
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
O Pero Mwmezcla tambin es falso, C ya que Mw se define para una
sustancia pura y una mezcla no es una sustancia pura; para obviar los
inconvenientes anteriores mejor lo llamaremos Mw( tambin se
representa como Mw av, donde av es la abreviatura de average) que se
lee "peso molecular promedio ponderado", y por fin:
PtMw av = dmezclaRT = Ecuacin de estado modificada para una mezcla de gases
Nota: Mw av en qumica no existe, pero aritmticamente es:
Mw av =
Wt
, pero Wt = Wj Mw av =
W1 + W2 + ...+ Wm
nt nt
Adems, Wj = Mwjnj, reemplazando: W1, W2,..., Wm
Mw av =
Mw1n1 + Mw2n2 + ...+ Mwmnm
nt
Sea Yj =
nj
Donde Yj es la fraccin molar del gas j (fraccin por ser la parte
sobre el todo y molar por estar la parte y el todo medido en moles)
nt
Sustituyendo las Yj, con j = 1,2,... m
Mw av = Mw1Y1 + Mw2Y2 +... + MwmYm O en forma elegante:
Mw av = Mwj X Yj
En la expresin anterior vemos que el peso total de una mol de mezcla es:
Mw av y el trmino MwjYj es la contribucin del gas j para este peso, por lo
tanto podemos originar la "fraccin peso de j" as:
Fraccin peso de j =
Mwj
x
Yj , si se multiplica por cien, se obtiene el
porcentaje en peso del gas j en la
mezcla
Mw av
%Wj =
Mwj
x
Yj
x
100%
Mw av
Mezcla Especial De Gases: "Un gas recogido sobre agua"
14
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Un gas recogido sobre agua A presin atmosfrica": esta mezcla es especial
porque hace referencia a solo un gas y por ser mezcla,
tcitamente existe otro gas que es el vapor del agua que se
evapora, y ejerce una presin parcial en la mezcla gaseosa.
Cuando se termina de recoger el gas, la columna hidrosttica se estabiliza y
existe un balance de presiones:
Presin interna = Presin externa
La presin externa es la presin atmosfrica, y es la presin A la cual se
recoge el gas.
Internamente actan tres presiones: La presin del gas, Pg. La presin de
vapor del agua, Pv (su valor se lee en una tabla de presiones de vapor en
funcin de la temperatura a la cual se recoge el gas) y la presin
hidrosttica, Ph que est dada por la altura h de la cabeza hidrosttica y hay
que transformarla a Torr, usando la relacin inversa de densidades, as:
Ph = h medida en mm
x
1
13.6
Si experimentalmente no se reporta la altura de la cabeza hidrosttica,
es porque ella no existe, es decir h = 0.
En el balance de presiones se cumple que:
Pt
Esta presin es del gas hmedo
Patmosfrica = Pg + Pv + Ph
hmm x
1
Presin A la
cual se
recoge el gas
13.6
Se lee en la tabla de presiones de vapor
Esta presin es del gas seco
El volumen medido del gas recogido no es Vj, es Vt, porque es un volumen
experimental y no un volumen imaginativo.
En esta mezcla especial de gases existen unos trminos especiales, as:
O Gas hmedo: Se refiere a la mezcla total: el gas ms el vapor del agua.
O Presin de gas hmedo: Es la presin total y No es la presin
atmosfrica (Patm),
Es la Patm menos Ph
O Gas seco: Se refiere al gas parcial sin considerar el vapor del agua.
15
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Porcentaje en peso del gas seco en el gas hmedo (%Wg): esto es.
%W
g
=
Mwg
x
Y
g
x
100% , donde:
Mw av
Mwg
: es el peso molecular del gas recogido.
Y
g
es la fraccin molar del gas recogido.
Mw av es el peso molecular promedio del gas hmedo que se calcula con:
Mw av = Mwg
x
Y
g + Mw vapor
x
Yvapor
Pero Mw vapor es 18, ya que el vapor es de agua y como la suma de las
fracciones es igual a la unidad, entonces Yv = 1 - Y
g, con lo anterior:
Mw av = Mwg
x
Y
g + 18
x
(1 Y
g
)
Ley de difusin de Graham: consulte esta ley en cualquier texto clsico de
Qumica General.
Resumen:
1. Para un gas: Leyes de Avogadro, Boyle y Charles.
Orden alfabtico Restriccin
n Avogadro P y T constantes V
= Ka
n
V P Boyle n y T constantes
V x P= Kb
Variable
dependiente T Charles n y p constantes V
= Kc
T
Ley combinada de Boyle - Charles, si y solo si las moles son constantes:
Vi x Pi x To = Vo x Po x Ti
Vipito igual a vopoti mejor: Vi = V0 x
Po Ti
Pi To
Ley combinada de Avogadro, Boyle y Charles:
PV = RTn Ecuacin de estado Polica Vial igual a ReTn
Con:
22.4 L
, a TPE R =
0.082 atm L
1 mol mol K
Como: n
x
Mw = W , y adems d
x
V = W PMw = dRT (ecuacin de estado modificada)
Profesor Montoya directoR Tcnico
16
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
2. Para una mezcla de gases:
Wt = Wj nt = nj Pt = Pj Vt = Vj
Ley de Conservacin de la masa Ley de Dalton Ley de Amagat
2.1. Escribimos la ecuacin de estado 3 veces:
O Para la ley de Dalton:
Pj ejercida por las nj en el Vt, a la temperatura absoluta T:
C PjVt = RTnj (esto es una parte)
O Para la ley de Amagat:
Vj de las nj ejerciendo la Pt, a la temperatura absoluta T:
C PtVj = RTnj (esto es una parte)
O Para la mezcla de gases:
Pt ejercida por las nt en el Vt, a la temperatura absoluta T:
C PtVt = RTnt (esto es el todo)
Como por concepto una fraccin =
La parte
, si dividimos "miembro a
El todo
a miembro" las ecuaciones C / C y C / C , llegamos a unas relaciones
muy interesantes que se dan en mezclas de gases, y son:
Pj
=
nj
=
Vj
=Yj, aqu vemos que la fraccin molar de un gas
Pt nt Vt
en una mezcla de gases, (Yj) se puede calcular con su fraccin presin
(a nivel prctico con mucha frecuencia) o con su fraccin volumen o con
su fraccin de moles.
2.2.Escribimos la ecuacin de Mw dos veces.
O Para el gas j: Mwj x nj = Wj
O Para la mezcla: Mw av x nt = Wt,
Recuerde que el subndice t para el peso molecular es absurdo (es
variable intensiva), y el subndice mezcla es ilgico para el Mw.
2.3.Escribimos la ecuacin de densidad (d), tambin dos veces:
O Para el gas j: dj x Vt = Wj
Este volumen no puede ser parcial, ya que el gas tiende a ocupar todo
el volumen, este solo o acompaado.
O Para la mezcla: dmezcla x vt = Wt
17
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Recuerde que el subndice t para la densidad es absurdo (es variable
intensiva), y el subndice mezcla es lgico para d.
2.4. Ecuacin de estado modificada (la escribimos dos veces)
O Para el gas j: PjMwj = djRT
O Para la mezcla: PtMw av = dmezclaRT
(Mw av = Mw1 x Y1 + Mw2 x Y2 + + Mwm x Ym ), Mejor: Mw av = Mwj x Yj
%Wj =
Mwj x Yj
X 100%
Mw av
2.5. Mezcla especial de gases
Nota: El volumen recogido
del gas es un Vt y nunca
un Vj , ya que es una
medida experimental y no
hipottica
Pt
Esta presin es del gas hmedo
Patmosfrica = Pg + Pv + Ph
hmm x
1
Presin A la
cual se
recoge el gas
13.6
Se lee en la tabla de presiones de vapor
Esta presin es del gas seco
Para "visualizar" las situaciones que involucran clculos del estado gaseoso,
sugerimos incluir en un recipiente (cilindro, tarro o pistn) las cuatro
variables de estado y asignarles su respectivo valor; si ste no se conoce,
asignarle una letra para cada caso particular, y posteriormente
correlacionarlas con la ley que los regule.
Si se trabaja con mezcla de gases, es indispensable asignar a la variable el
subndice adecuado, y organizar una columna para cada gas y para la
mezcla. Por el volumen parcial no se preocupe, a no ser que el enunciado
sea muy enftico en l.
Resumencito:
18
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Para un gas Para una mezcla de gases
PV = RTn
Dalton de las Pj
Amagat de los Vj
Para la mezcla total
P V = RTn
P V = RTn
P V = RTn
Esto es una parte
Esto es una parte
Esto es el todo
Fraccin =
Parte
todo
Pj
Pt
=
nj
nt
=
Vj
Vt
= Yj
Y1 + Y2 + = 1
n =
W
Mw
n =
W
Mw
n = W
Mw
(a)
(b)
Mwav = Mw1Y1 + Mw2Y2 +
%Wj = x100
MwjYj
Mwav
d =
W
V
d =
W
V
d =
W
V
PMw = dRT P Mw = d RT P Mw = d RT
C
C
C
C
C
C
Para el gas parcial (a)
Para la mezcla total (b)
Para el gas parcial (a)
Para la mezcla total (b)
Para el gas parcial (a)
Para la mezcla total (b)
CC
j t
j t j
j t j
t t t
j
j
j
t
t
j
j
av
t
t
t
mezcla
j j av mezcla
0.082 atm L
mol K
R = Con
22.4 L
1 mol
a CN
1.8C = F 32 K = C + 273
(a) (b)
1 atm = 760 mmHg = 760 torr = 14.7 psi
CC Gas sobre agua
Nota: El volumen
recogido del gas es un
Vt y nunca un Vj, ya
que es una medida
experimental y no
hipottica
Pt
Esta presin es del gas hmedo
Patmosfrica = Pg + Pv + Ph
hmm x
1
Presin A la
cual se
recoge el gas
13.6
Se lee en la tabla de presiones de vapor
Esta presin es del gas seco
Para un gas: pistn, 4 variables, leo: # letra
Para una mezcla: balance de presiones si es recogido sobre agua, pistn, 4
variables, columnas (una para cada gas y una para la mezcla), leo # letra
19
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
EJEMPLOS
1. Un recipiente de 5 L contiene un gas que ejerce una presin de 2 atm a
cierta temperatura. Otro recipiente de 3 L contiene otro gas que ejerce
una presin de 4 atm, a la misma temperatura del recipiente anterior. Si
se comunican ambos recientes, que presin se obtiene?
Solucin:
Tarro 1 Tarro 2 Tarro 3
Para un gas (A) Para otro gas (B) Para la mezcla
n = y n = z n = y + z (las moles son extensivas)
P = 2 atm P = 4 atm P = w?
T = x T = x T = x
V = 5 L V = 3 L V = 8 L
Aclaraciones:
T = X, en los tarros 1, 2 y 3, por enunciado.
En el tarro 1: n = y, porque no conocemos el valor de las moles.
En el tarro 2: n = z, por la misma razn anterior.
En el tarro 3: n = y +z, porque las moles son aditivas (ley de la conservacin de la masa).
En el tarro 3: V = 8 lt, porque los recipientes 1 y 2 al comunicarse "forman" el
tarro 3.
Usando la ecuacin de estado (Ecuacin O ):
En el tarro 1: 2 atm x 5 L = XRY C
En el tarro 2: 4 atm x 3 L = XRZ C
En el tarro 3: w atm x 8 L = XR(Y+Z)
Aplicando "distributividad de por con respecto a mas" (es decir destruyendo
parntesis), queda:
w atm x 8 L = XRY+XRZ C.
Sustituyendo C y C en C queda:
= w atm x 8 lt = 10 atm lt + 12 atm lt
w =2.75 atm
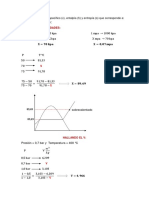
2. Una mezcla de N2 (g) y H2 (g) tiene una densidad de 0.5 g/L a 640 Torr y 27
C. Calcule el %W del N2 (g) en la mezcla.
Nota: la densidad nos lleva a pensar en la ecuacin para seleccionar las 4
variables.
Nota: Si usted interpreta de este enunciado que:
d = 0.5 g/L
P = 640 Torr.
20
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
T = 27 C
Nunca podr realizar el clculo pedido, porque le faltan los subndices
de d y P y la Temperatura tiene que ser absoluta; teniendo en cuenta lo
anterior la interpretacin del enunciado es:
Gas1 Gas2 Mezcla
N2 H2
d a b 0.5g/L
Mw 28 2 c
P e f 640 torr
T
300K
dmezcla =
0.5 g
Pt = 640 torr T = 300K %WN2 = x?
L
Punto de llegada %WN2 (Ecuacin C) siendo j el gas N2
%WN2 =
MwN2 YN2
X 100%, como MwN2 =28, nos falta calcular YN2 y Mw av.
Mw av
Si usamos la ecuacin (la informacin dada de dmezcla nos gua a
usarla), podemos calcular Mw av, as:
Mw av =
0.082 atm L
x300K
0.5 g 1 760 torr
Mw av = 14.61
Mol K L 640 torr 1 atm
(Mw av Sin unidades, no lo necesitamos como factor)
Con la ecuacin le damos uso al valor de Mw av para calcular YN2, as:
Mw av = MwN2 YN2 + MwH2 YH2
pero MwH2 = 2 y YH2 = (1 - YN2), entonces:
14.61 = 28 YN2 + 2(1 - YN2)
YN2 = 0.485 (Se recomienda tomar los tres decimales por ser una fraccin
propia, es decir: estar entre cero y uno).
Ahora s:
%WN2 =
28 x 0.485
x100% %WN2 = 92.95%
14.61
3. Una muestra de un gas ocupa un volumen de 1.2 L a una temperatura de
25 C y una presin de 1.2 atm. Cul ser su volumen si su presin se
aumenta a 2.4 atm. a igual temperatura ?.
Solucin:
21
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
3.1. Como solo vara el V y la P, aqu hay una aplicacin de la ley de Boyle;
como la presin se duplica (pasa de 1.2 atm a 2.4 atm); entonces el
volumen se reduce a la mitad (son dos variables inversamente
proporcionales), es decir, el volumen pasa de 1.2 L a 0.6 L
3.2. Tambin se puede plantear la solucin a esta situacin (este problema)
as:
Tarro 1
condiciones iniciales
Tarro 2
condiciones finales
n = x n = x
P = 1.2 atm P = 2.4 atmse duplica
T = 298K T = 298K
V = 1.2 L V = y?
Aclaracin:
El nmero de moles en los tarros 1 y 2 son X, ya que el enunciado no aclara
que las moles varen, y como no las conocemos las identificamos con esta
variable.
Usando la ecuacin de estado (ecuacin O):
En el tarro 1: 1.2 atm
x
1.2 L = R
x
298 K
x
X C
En el tarro 2: 2.4 atm
x
Y = R
x
298 K
x
X C
Si dividimos "miembro a miembro" las ecuaciones C/C, queda:
2.4 atm
x
y
= 1 y = 0.6 L
1.2 atm
x
1.2 L
Vi = 1.2 L Vo = Y?
3.3.Usando la ecuacin C con
Pi = 1.2 atm. Po = 2.4 atm.
Ti = 298 K To = 298 K
Queda:
1.2 L x
1.2 atm 298K
= Y. Tambin obtenemos que Y = 0.6 L
2.4 atm 298K
4. Con redaccin "elegante"
El volumen molar de un gas es 27 L y su densidad vale 1.41 g/L a ciertas
condiciones de temperatura y presin, calcular:
a. El peso molecular del gas.
b. La densidad de este gas a condiciones normales.
Solucin:
22
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Para el literal a:
4.1.Como tenemos 27 L (por qu?) , 1.41 gr y queremos Mw g
mol L mol
Por transformacin con factores iniciando con la densidad que aporta los
gramos requeridos en el numerador, nos queda:
1.41 g 27 L
=
38.07 g
Mw = 38.07
Sin unidades no lo requerimos como factor
L mol mol
4.2. Otro procedimiento, usando tarro:
Tarro 1
para la ecuacin de estado
Tarro 2
para la ecuacin de estado
modificada
n = 1(por que?) d = 1.41 g/L
P = x Mw = z ?
T = y P = x
V = 27 L T = y
Usando la ecuacinO: X
x
27 L = R y
x
1 mol C
Usando la ecuacin O:
X
x
Mw = y R
x
1.41g
C
L
Si dividimos "miembro a miembro" C/C = :
X
x
Mw
=
Y R
x 1.41g
Mw
= 1.41 Mw = 38.7
X
x
27 L R y
x
1 mol 27
Para el literal b, usando la ecuacin O con: P = 1 atm. y T = 273 K
(condiciones normales), queda:
d = 1 atm
x
38.07g 1 Mol K
d =
1.7 g
mol 273 K 0.082 at L L
5. Cierta cantidad de oxgeno se recoge sobre agua a 752 Torr y a 70 C;
el gas recogido ocupa un volumen de 380 mL. Si Pv = 233.7 mm Hg a
70C y la cabeza hidrosttica mide 27.2 cm, calcular:
a. El volumen de dicho gas seco a condiciones normales
b. Volumen del vapor a condiciones normales
c. Volumen del gas hmedo a condiciones normales
d. Peso molecular del oxgeno hmedo
e. El %W del O2 seco en el O2 hmedo
23
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Interpretacin incorrecta: Razn:
P = 752 Torr No especifica cual presin: PO2, Pt, Patm
T = 70 C Tiene que ser en K
V = 380 mL No especifica si es parcial o total
VO2= 380 mL El volumen es el total, es experimental.
PV = 233.7 mm. Hg. Mejor en Torr (es lo mismo)
Ph = 27.2 cm. Hay que corregirla a mm. Hg. o Torr.
Interpretacin Correcta: Razn:
Patm =752 Torr. Por ser la presin a la cual...
T = 343 K
VT = 380 mL Porque es el volumen recogido.
PV = 233.7 Torr.
Ph = 272 mm x
1
= 20 torr
13.6
Antes de distraernos, por ser un gas recogido sobre agua, usemos la
ecuacin CC con: P
g
= PO2
752 Torr = PO2 + 233.7 Torr + 20 Torr
PO2= 498.3 Torr
NOTA: No pierda tiempo pasando Torr a atm; esto se hace cuando el
procedimiento lo exija.
La informacin que nos importa de la mezcla especial es:
Gas1 Gas2 Mezcla
O2 seco H2O O2 hmedo
n a b c
P 498.3 233.7 732.0 torr
T
343 K
V no importan 380 mL
Como queremos el volumen que "ocupa a condiciones normales" y sabemos
que a CN, tenemos el factor
22.4 L
; entonces "aliando" el factor con la
mol
especificacin requerida queda para los literales a, b y c
a. para el O2 seco:
22.4 L O2
b. para el vapor de agua:
22.4 L vapor
mol O2 mol vapor
c. para el O2 hmedo:
22.4 L O2 hmedo
mol O2 hmedo
24
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Vemos, con los "alios" anteriores, que para llegar a L a CN usando los
factores, partimos de a moles de O2 en el literal a; de b moles de vapor en el
literal b; y c moles de O2 hmedo en el literal c.
Usemos la ecuacin C con j = O2, para calcular el nmero de moles de O2, la
variable a, si la PO2 = 498.3 torr y Vt = 380 ml; sustituyendo, queda:
a = nO2 =
mol K 498.3 torr
x
380 mL 1 L 1 atm
0.082 atm L
x
343 K 1000 ml 760 torr
factor para pasar de torr a atm
a = nO2 = 8.86 x 10
3
mol O2
Transformando stas moles a volumen y usando el factor aliado para el O2
a CN, queda:
8.86 x 10
3
mol O2
x
22.4 L O2 1000 ml O2
R / a. son 198.46 mL O2
1 mol O2 1 L O2
Usemos la ecuacin C con j = vapor, para calcular las moles de vapor b.
b = n vapor =
mol K 233.7 torr
x
380 mL 1 lt 1 atm
0.082 atm L
x
343 K 1000 ml 760 torr
factor para pasar de torr a atm
b = n vapor = 4.15 x 10
3
mol vapor
Tambin: n vapor = nt - nO2 (Por qu?)
Transformando stas moles a volumen y usando el factor aliado para el
vapor a CN, queda:
4.15 x 10
3
mol vapor
x
22.4 L vapor 1000 mL vapor
1 mol vapor 1 L vapor
R / b. son 92.96 mL vapor
Usemos la ecuacin C para calcular nt:
c = nO2 hmedo =
mol K 732 torr
x
380 mL 1 L 1 atm
0.082 atm L
x
343 K 1000 mL 760 torr
nt =
c = nO2 hmedo = 1.3 x 10
2
mol O2 hmedo
Transformando stas moles a volumen a CN, queda:
1.3 x 10
2
mol O2 hmedo
x
22.4 L O2 hmedo 1000 mL O2 hmedo
1 mol O2 hmedo 1 L O2 hmedo
R / c. son 219.49 mL O2 hmedo
NOTAS:
25
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
O Las respuestas R/a, R/b y R/c se expresan en mL para usar la misma
unidad de volumen del enunciado, ya que ste no especifica en que
unidad se requiere la respuesta.
O Los valores 198.46 mL O2 y 92.96 mL vapor NO se pueden considerar
como volmenes parciales ( Vj ) en la mezcla experimental (Por
qu?)
O El volumen que ocupar dicho gas seco a CN, tambin se puede
solucionar usando la sugerencia del recipiente, as:
Recipiente a CN o TPE
para el O2 seco
n = a = 8.86 x10
-3
P = 1 atm (CN)
T = 273 K (CN)
V = e?
Usando la ecuacin de estado, obtenemos tambin la respuesta pedida.
Nos piden el "peso molecular del gas hmedo". Esto es Mw av (Por qu?).
Usemos la ecuacin con: j = 1 = O2 y j = 2 = vapor.
MwO2 = 32, Mw vapor = 18
Se puede calcular YO2 con la ecuacin C en trminos de presiones; tambin
se puede en trminos de moles, pero es mejor calcularlo en funcin de la
informacin dada por el enunciado.
YO2 =
498.3 torr
YO2 = 0.681 Yvapor = 1 - YO2 (por qu?) Yvapor = 0.319
732 torr
Nota: la Yvapor tambin se puede calcular con la fraccin de presiones.
Con la informacin encontrada:
Mw av = 32
x
0.681 + 18
x
0.319
Mw av = 27.53 R / d.
Nota: Mw av, por ser un promedio ponderado entre 18 y 32, es un nmero
intermedio entre ellos pero ms cercano a 32, ya que el oxgeno posee una
fraccin molar (factor de ponderacin) mayor.
Nos piden %WO2, usemos la ecuacin C con j = O2:
YO2 = 0.681, MwO2 = 32 y Mw av = 27.53.
%WO2 =
32
x
0.681
x 100% %WO2 = 79.16% R/ e.
27.53
26
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
6. Qu presin ejercen 118.2 g de cloro gaseoso, confinados en un
recipiente cbico de 10 cm de lado, a una temperatura de 68 F?
Solucin:
Prembulo:
Como la variable de estado es moles y no peso, entonces:
nCl2 = 118 g Cl2 x
1 mol Cl2
= 1.66 mol Cl2
71 g Cl2
T en C =
68 32
= 20C T = 293K
1.8
V = 1 L (si no sabe por qu, es la definicin de litro).
Recipiente
n = 1.66
P = x?
T = 293 K
V = 1 L
Podemos usar la ecuacin de estado O, para calcular la presin.
P =
0.082 atm L
x 293 K x 1.66 mol x
1
P = 39.88 atm
Mol K 1 L
7. Una muestra de 0.109 g de un compuesto gaseoso ocupa un volumen de
112 mL a 100 C y 750 Torr, calcule el peso molecular del compuesto.
Recipiente
n =
0.109 g
Mw
P = 750 torr
T = 373 K
V = 112 L
Ecuacin O
750 torr
x
112 mL =
0.082 atm L
x
373 K
x
0.109 g 760 tor 1 x 10
3
mL
mol K Mw 1 atm 1 L
Mw =
30.16g
Mw = 30.16
mol
8. Un recipiente de 2.24 L contiene una mezcla de 0.202 g de H2 y 0.8 g de
O2. Calcule:
a. La presin en el recipiente a 25 C.
27
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
b. El peso molecular de la mezcla
Solucin:
Como el peso NO es variable de estado y las moles si, entonces:
nH2 = 0.202 g H2
x
1 mol H2
nH2 = 0.101 mol H2
2 g H2
nt = 0.126
nO2 = 0.8 g O2
x
1 mol O2
nO2 = 2.5 x 10
-2
mol O2
32 g O2
Como es una mezcla
2.24 L es el volumen total
Gas1 Gas2 Mezcla
O2 H2
inicial
n 0.025 0.101 0.126
P a b c?
T
298 K
V no importan 2.24 L
a. Nos piden Pt (c) a 298 K; si usamos la ecuacin C
Pt =
0.082 atm L
x
298 K
x
0.126 mol
x
1
Pt = 1.37 atm R/a
Mol K 2.24 L
b. Nos piden Mw av
O Lo podemos calcular con la ecuacin C(b) ya que tenemos
Wt = 1.002 y nt = 0.126
Mw av = 7.95
O Tambin con la ecuacin , ya que conocemos las moles
parciales y totales para calcular Yj.
Mw av = 2 x
0.101
+ 32 x
0.025
Mw av = 7.95 R/b
0.126 0.126
9. Una bolsa plstica se llen con CO2 y se pes. Se evacu, y luego se
llen con un gas desconocido X y se pes, se hizo lo mismo con otro gas
desconocido Y. Si la temperatura y la presin fueron constantes durante
las mediciones y las pesadas, descartando el peso de la bolsa, los pesos
fueron: 2 gr 2.5 gr y 0.8 gr, cual es el peso molecular de X y el peso
molecular de Y?.
De acuerdo a lo sugerido, dibujemos tarros:
28
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Para CO2 Para X Para Y
n =
2
(por que?) n =
2.5
n =
0.8
44 Mwx Mwy
P = w P = w P = w
T = a T = a T = a
V = z V = z V = z
Usando la ecuacin C para cada gas:
C WZ = Ra
x
2
C WZ = Ra
x
2.5
C WZ = Ra
x
0.8
44 Mwx Mwy
Si dividimos "miembro a miembro" C/C y C/C (para eliminar "factores
comunes")
2
C/C 1 =
44
Mwx =
44 x 2.5
Mwx = 55
2.5 2
Mwx
C/C, con idntico procedimiento MwY = 17.6
10. El aire tiene una composicin aproximada en volumen de 20.95 % de
O2(g), 78.09% de N2(g) , 0.93% de Ar(g) y 0.03% de CO2(g)
a. Cul es la presin parcial del CO2 en el aire de la ciudad de Medelln,
si la presin atmosfrica vale 640 mm Hg.
b. Cul es el %W del O2 en el aire?
c. Cuantas moles de N2 hay en una pulmonada de aire, si el volumen de
una inhalacin es 0.5 L, a 23C y a 700 mm Hg?
Nota: La informacin suministrada de %V es interpretada errneamente
como %W (aun no s por qu) por parte de algunos lectores, espero que
usted no sea uno de ellos.
Como un porcentaje es una fraccin por cien, entonces una fraccin es el
porcentaje dividido 100.
Si miramos la ecuacin C(b) observamos que el enunciado nos est
informando Yj, es decir:
YO2 = 0.295 YN2 = 0.7809 YAr = 9.3
x
10
-3
YCO2 = 3
x
10
-4
a. PCO2 = ?, si Pt = 640 Torr.
Con la ecuacin C(a)
PCO2
= YCO2 PCO2 = 0.191 torr
Pt
b. %WO2 =?, si usamos la ecuacin C:
29
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
%WO2 =
MwO2 xYO2
x 100%
Mw av
Como MwO2 = 32 y YO2 = 0.295
Nos falta Mw av y la calculamos con la ecuacin con cuatro sumandos (O2,
N2, Ar y CO2), as:
Mw av = MwO2 x
YO2 + MwN2 x
YN2 + MwAr x
YAr+ MwCO2 x
YCO2
Sustituyendo los valores de Yj, obtenidos del enunciado:
MwO2 = 32, MwN2 = 28, MwAr = 39.9 y MwCO2 = 44, obtenemos:
Mw av = 32 x
0.295 + 28 x
0.7809 + 39.9 x
9.3
x
10
-3
+ 44 x
3
x
10
-4
Mw av = 28.95
Nota: Como Mw av = es un "peso molecular promedio", su valor tiene que
estar entre el mximo valor 44 y el mnimo valor 28 pero mas cerca al que
mayor ponderacin aporte (valor de Yj). En este caso el que ms pondera es
el N2 y por eso, el valor promedio est ms cercano a 28.
%WO2 =
32x0.2095
x
100% %WO2 = 23.16%
28.95
Nota: Cuando usted "crezca" (termodinmica, mecnica de fluidos,, fsico
qumica, anlisis Orsat) agradecer haber pasado por este problemita en
particular.
c.
O2 N2 Ar CO2 mezcla
gas 1 gas 2 gas 3 gas 4
n a b? c e f
P g h i j 700 tor
T
296 K
V
No importan
0.5 L
No se preocupe por el abecedario, slo queremos el valor de b que
corresponde a la variable nN2 y como tenemos Pt y Vt, podemos usar la
ecuacin C y obtenemos:
De nuevo las variables n, V y P, sin su respectivo subndice, no son una
herramienta sino un ENCARTE.
n t =
mol K 700 torr
x
0.5 L 1 atm
n t = 1.9
x
10
-2
moles
0.082 atm L 296 K 760 torr
30
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Si usamos la ecuacin C(c) :
n N2
= YN2 nN2 = 1.9
x
10
-2
x
0.7809 n N2 = 1.48
x
10
-2
n t
Tambin puede calcular PN2 con C(a) y posteriormente nN2 con ecuacin C
11. Cierta cantidad de Carbonato Clcico se descompone por calentamiento.
El CO2(g) que se desprende ser recoge a 50C y 740 Torr. y ocupa un
volumen de 2.41 L. Cul es el peso del carbonato descompuesto?
Recipiente para CO2(g)
n = a?
P = 740 torr
T = 323 K
V = 2.41 L
Usando la ecuacin O
nCO2 =
mol K 740 torr
x
2.41 L 1 atm
nCO2 = 8.86
x
10
-2
moles
0.082 atm L 323 K 760 torr
12. Un cilindro de seguridad contra incendios (extintor tipo B C,
comnmente llamado qumico seco), contiene 5 L de CO2 (lquido) y su
densidad vale 1.53 gr/mL. Calcule el volumen que ocupar el CO2 al salir
del cilindro en estado gaseoso a 77 F y 12.5 psi.
Solucin: Primero transformemos los 5 lt. de CO2 () a la variable de estado
5 L
x
1000 mL 1.53 g 1 mol
nCO2 = 173.86 mol
1L 1 mL 44 g
Ahora transformemos la temperatura: K = 273 + 5
x
77 - 32
T = 298 K
9
La sugerencia del tarro:
Recipiente para CO2(g)
n = 173.86 mol
P = 12.5 psi
T = 298 K
V = x?
Usemos la ecuacin O
V =
0.082 atm L
x
298 K
x
173.86 mol
x
1 14.7 psi
V = 4996.17 L
Mol K 12.5 psi 1 atm
31
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
13. Un recipiente cerrado contiene una mezcla de 7 g de monxido de
carbono (anhdrido carbonoso) (CO), 3.2 g de metano (CH4), y 19.8 g de
dixido de carbono (anhdrido carbnico) (CO2). Si la presin parcial de
CO es 300 Torr, calcule la presin parcial de CH4
CH4 CO CO2 mezcla
gas 1 gas 2 gas 3
n = 0.2=
3.2
0.25=
7
0.45=
19.8
0.9
16 28 44
P = a? 300 b c
T = e
V = no son de inters f
Si usamos las ecuaciones C(a) y C(b), obtenemos:
nCH4
=
PCH4
C y
nCO
=
PCO
C
nt nt nt nt
Si dividimos C /C:
nCH4
=
PCH4
PCH4 = 300 torr
x
0.2
PCH4 = 240 torr
nCO
PCO 0.25
14. Muestras individuales de oxgeno (g), nitrgeno (g) y Helio (g) se
encuentran en tres recipientes de 3.5 L cada uno; cada gas ejerce una
presin de 1.5 atm y se encuentran a la misma temperatura. Si se
introducen las tres muestras en un recipiente de 1 L a la misma
temperatura:
a. Cul ser la presin resultante?
b. Cul ser la presin del O2 en la mezcla que resulta?
Tarro O2 Tarro N2 Tarro He Tarro mezcla
O2 N2 He
mezcla
n = y n = y n = y n = y y y 3y
P = 1.5 P = 1.5 P = 1.5
en atm
P = a? a a z?
T = x T = x T = x T = x
V = 3.5 L V = 3.5 L V = 3.5 L V =
no es de inters
1 L
Aclaracin: n = Y para los tres gases, porque las otras tres variables de
estado tienen el mismo valor (P, V, T).
Usemos la ecuacin O para un gas, no importa con cual:
1.5 atm
x
3.5 lt = RXY C
Usemos la ecuacin C para la mezcla de gases:
32
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Pt x 1 lt = RX
x
(3Y) C
Si dividimos C / C para eliminar factores comunes", obtenemos que:
Pt x 1 L
=
RX
x
(3Y)
Pt = 15.75 atm R/ a.
1.5 atmx3.5 L RXY
Ahora si aplicamos la ecuacin C con j = O2 en la mezcla
PO2 x 1 lt = RXY C
Si dividimos C / C:
PO2 x 1 L
=
RXY
PO2 = 5.25 atm R/ b.
1.5 atm
x
3.5 L RXY
Es obvio que el resultado anterior sea la tercera parte de la presin total.
15. Un recipiente contiene 20.1 g de un gas a 20 C y a 742 Torr; despus de
aadir al recipiente 2.48 g de He (g) la presin se eleva a 1863 Torr, sin
cambiar la temperatura, calcule:
a. El volumen del recipiente.
b. El peso molecular del gas inicial.
Solucin:
Recipiente inicial Recipiente final
gas He mezcla
n =
20.1
n =
20.1 2.48
=0.62 a
Mwg ? Mwg ? 4
P = 742 torr P= 742torr 1121
por diferencia
1863 torr
T = 293 K T =
293 K
V = X? V = No es de inters X?
Usemos la ecuacin C para el gas j = He, porque posee mas informacin en
la mezcla final:
1121 torr
x
X =
0.082 atm L
x
293 K
x
0.62 mol
x
760 torr
X = 10.1 L R/a)
mol K 1 atm
Ahora la ecuacin de estado para el gas inicial:
742 torr
x
10.1 L =
0.082 atm L
x
293 K
x
20.1 g 760 torr
Mw gas=48.97 R/ b)
mol K Mw gas 1 atm
Ejemplo 16
Al analizar una muestra de un compuesto se encuentra que tiene la siguiente
composicin porcentual en peso: 85.7 % de carbono y 14.3 % de hidrgeno.
33
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
A CN 100 mL del compuesto gaseoso pesan 0.188 g, determine la frmula
molecular del compuesto.
Solucin:
Segn lo indicado en la unidad de estequiometra con la "primera idea"
podemos encontrar la frmula emprica as:
Peso
Pa
peso atmico
N de at-gr
calclelos
por el menor
nmero de at-gr
Fe MFe
C 85.7 12 7.14 1
C1H2 14
H 14.3 1 14.3 2
Para continuar, se requiere el Mw, con la "segunda idea"; usando la
informacin suministrada en trminos de gases
Recipiente
n =
0.188 g
Mw
P = 1 atm
T = 273 K
V = 0.1 L
Con la ecuacin O
1 atm
x
0.1 L =
0.082 atm L
x
273 K
x
0.188 g
mol K Mw
Mw =
42g
Mw = 42 K =
42
K el factor para amplificar la Fe = 3
mol 14
Fm = 3 x (C1H2)
Fm = C3H6
Ejemplo 17
Un recipiente de 2.24 L contiene una mezcla de 0.202 g de H2 y 0.8 g de O2.
Calcule:
a. La presin en el recipiente a 25 C.
b. El peso molecular de la mezcla?
c. Si se hace saltar una chispa, ocurre la reaccin:
H2(g) + O2(g) H2O(g),
34
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Y la temperatura aumenta a 200 C, cul ser la presin al finalizar la
reaccin?
d. El peso molecular de la mezcla final.
Solucin:
Como el peso NO es variable de estado y las moles si, entonces:
nH2 = 0.202 g H2
x
1 mol H2
nH2 = 0.101 mol H2
2 gr H2
nt = 0.126
nO2 = 0.8 g O2
x
1 mol O2
nO2 = 2.5 x 10
-2
mol O2
32 gr O2
Como es una mezcla
2.24 L es el volumen total
Gas1 Gas2 Mezcla
O2 H2
inicial
n 0.025 0.101 0.126
P a b c?
T
298 K
V no importan 2.24 L
a. Nos piden Pt (c) a 298 K; si usamos la ecuacin C
Pt =
0.082 atm L
x
298 K
x
0.126 mol
x
1
Pt = 1.37 atm R/a
Mol K 2.24 L
b. Nos piden Mw av
O Lo podemos calcular con la ecuacin C(b) ya que tenemos
Wt = 1.002 y nt = 0.126
Mw av = 7.95
O Tambin con la ecuacin , ya que conocemos las moles
parciales y totales para calcular Yj.
Mw av = 2 x
0.101
+ 32 x
0.025
Mw av = 7.95 R/b
0.126 0.126
c. Como este numeral involucra clculos estequiomtricos, debemos
calcular: las moles que sobran de reactivo no-lmite y las moles que
se producen de agua.
0 0 4e
-
+1 -2
Reaccin
balanceada
2H2 + 1O2
2H2O
1x2 2x2
35
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
2 4
E =
4
E =
4
E =
4
2 1
2
2H2 + 1O2
2H2O
enunciado
0.101 mol H2 0.025 mol O2 ? mol H2O
Factor E
2 eq-gr H2 2 eq-gr O2 2 eq-gr H2O
1 mol H2 1 mol O2 1 mol H2O
Sobran los dems factores de normas de lectura; no hay PP% ni Ef% sobran los apodos
N de eq-gr
iniciales:
0.202
0.1
este es el RL
Calcule estos
valores
Eq-gr
transformados
-0.1 - 0.1 + 0.1
N de eq-gr
finales
0.102 0 0.1
N de moles
finales
0.051 se acab, es el RL 0.05
Calcule estos
valores
Despus de la reaccin tenemos:
Gas1 Gas2 Mezcla
H2 que
sobra
H2O
producida
final
n 0.051 0.05 0.101
P e f g?
T
473 K
V no importan 2.24 L
2.24 L = Vt ( no ha cambiado el recipiente, el volumen sigue siendo el mismo)
La Pt final (g) la podemos calcular con la ecuacin C, as:
Pt =
0.082 atm L
x
473 K
x
0.126 mol x
1
Pt = 1.75 atm R/c
Mol K 2.24 L
d. Nos piden el Mw av de la mezcla final, es decir la formada por 5.1 x10
-2
moles de H2 y 5 x10
-2
moles de H2O, como conocemos las moles y
podemos calcular con ellas las Yj, entonces con la ecuacin. :
Mw av = 2 x
0.051
+ 18 x
0.05
Mw av = 9.92 R/d
0.101 0.101
Ejemplo 18
36
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
Cierta cantidad de Carbonato Clcico se descompone por calentamiento. El
CO2(g) que se desprende ser recoge a 50C y 740 Torr. y ocupa un volumen
de 2.41 L
Cul es el peso del carbonato descompuesto? Si la reaccin es:
CaCO3(s) CaO(S) + CO2(g)
Esta es una situacin de "gases estequiomtricos"; la primera idea (primer
prrafo) es de gases y el segundo prrafo es de estequiometra (normas de
lectura unidad de estequiometra) y el empalme entre los dos prrafos es
nCO2(g)
Prrafo 1: Gases
Recipiente para CO2(g)
n = a?
P = 740 torr
T = 323 K
V = 2.41 L
Usando la ecuacin O
nCO2 =
mol K 740 torr
x
2.41 L 1 atm
nCO2 = 8.86
x
10
-2
moles
0.082 atm L 323 K 760 torr
Prrafo 2: (estequiometra, normas de lectura)
1e-
1CaCO3
1CaO + 1CO2
?W g sal 8.86
x
10
-2
mol CO2
E 1 eq-gr sal 1 eq-gr CO2
1 mol sal 1 mol CO2
g? si 100 gr sal no Factor de Mw no
1 mol sal
Como no hay PP% ni Ef%, no se requiere apodos terico - real - puro - impuro
puente 1 eq-gr sal
1 eq-gr CO2
Transformemos las moles de CO2 a gramos de sal usando los factores:
37
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
8.86x10
-2
mol CO2 x
1
eq-gr CO2 1
eq-gr sal 1
mol sal 100
g sal
= W g sal
1
mol CO2 1
eq-gr CO2 1
eq-gr sal 1
mol sal
W = 8.86 g
Estos son los gramos que se descomponen de la sal oxisal Carbonato
Clcico.
Ejemplo 19
Se recoge sobre agua una mezcla de 0.105 g de O2(g) y 0.197 g de un
hidrocarburo (HC) gaseoso, de frmula emprica (Fe) CH3 a 640 Torr y 27 C.
Si el volumen de gas recogido es de 300 mL, y la presin de vapor (Pv) del
agua vale 26.5 Torr a 27 C, determinar:
a. El %W del O2 en la mezcla seca.
b. El %W del O2 en la mezcla hmeda
c. La frmula molecular (Fm) del hidrocarburo.
Solucin: Como la mezcla es recogida sobre agua, entonces.
(Ecuacin CC): Patm = PHC + PO2 + Pv + Ph
Ph = 0, el enunciado no menciona la cabeza hidrosttica.
Pv = 26.5 Torr.
PHC =?
Patm = 640 Torr.
Calculemos la PO2 para as conocer la PHC.
O2 HC vapor mezcla
gas 1 gas 2 gas 3
n =
0.105 0.197
a b
32 MwHC
P = c e 26.5 torr f
T= 300 K
V= no son de inters 0.3 L
PO2 (c) se puede calcular con la Ley de Dalton (ecuacin C), ya que tenemos
informacin del O2.
PO2 =
0.082 atm L 300 K 0.105 mol 760 torr
PO2 = 204.41 torr
mol K 0.3 L 32 1 atm
Con lo anterior, en el balance de presiones: (ecuacin CC)
38
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
PHC= 640 Torr. - 204.41 Torr - 26.5 Torr.
PHC= 409.09 Torr.
La mezcla especial queda:
O2 HC vapor mezcla mezcla
gas 1 gas 2 gas 3 hmeda Seca, sin agua
n = 3.28x10
-3
0.197
a b
MwHC
P = 204.41 409.09 26.5 torr 640 613.5
T= 300 K
V= no son de inters 0.3 lt
a. %WO2 en la mezcla SECA
Usemos la ecuacin C
%WO2 =
MwO2 x
YO2
x100%
Mw av mezcla seca
YO2 =
PO2
YO2=
204.41
YO2 = 0.333
Pt mezcla seca 613.5
Mw av mezcla seca = MwO2 xYO2 + MwHC xYHC
YHC = 1 - YO2 YHC = 0.667
Debemos calcular MwHC, usando la ecuacin de Dalton: (ecuacin C si j es HC)
0.197 g
=
mol K 409.09 torrx0.3 L 1 atm
MwHC = 30
MwHC 0.082 atm L 300 K 760 torr
Mw av mezcla seca = 32 x
0.333 + 30 x
0.667
Mw av mezcla seca = 30.67
%WO2 =
32 x
0.333
x100% %WO2 en la mezcla seca = 34.74%
30.67
Nota: Este porcentaje tambin lo puede calcular con la informacin
suministrada inicialmente, as:
%WO2 =
WO2
x100%
WO2 + WHC
39
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
%WO2 =
0.105
x100% %WO2 en la mezcla seca = 34.76%
0.105 + 0.197
(Por aqu es ms fcil, rpido y preciso).
b.
2
%
O
W
en la mezcla HUMEDA
%WO2 =
MwO2 x
YO2
x100%
Mw av mezcal hmeda
YO2 =
PO2
YO2=
204.41
YO2 = 0.319
Pt mezcla hmeda 640
(Por qu cambi?) Nota: Aqu no podemos afirmar que: YHC =1 - YO2
Mw av mezcla seca = MwO2 x
YO2 + MwHC x
YHC + Mwvapor x
Yvapor
YHC =
PHC
YHC=
409.09
YHC = 0.639
Pt mezcla hmeda 640
Ya sabemos que MwHC = 30
Yvapor = 1 - YO2 - YHC
Yvapor = 4.2x10
-2
Mw av mezcla hmeda = 32 x0.319 + 30 x0.639 + 18 x4.2x10
-2
Mw av mezcla hmeda = 30.13
%WO2 =
32 x
0.319
x100% %WO2 en la mezcla hmeda = 33.88%
30.13
c. Como Mw = 30 y MFe (peso de la frmula emprica) = 15, entonces:
K =
30
K = 2 Por lo tanto Fm = 2(CH3) Fm = C2H6
15
Comentario: Esperamos que con los ejemplos anteriores, usted amigo lector
haya adquirido habilidad operativa y aptitud verbal para solucionar
situaciones que involucren gases. A continuacin hallar usted un listado de
ejercicios (taller) para que los solucione.
40
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
EJERCICIOS PROPUESTOS
1. Si la presin atmosfrica de Medelln es de 64 cm Hg, cual ser su
equivalencia en:
a) atm. b) dm de agua. c) Torr d) Psi.
R/ a) 0.84 b) 87.04 c) 649 d) 12.38
2. Si se mezclan 16 g de O2 y 1 g de H2 en un recipiente de 10 L a 27 C,
determine:
a) La PT. b) La presin parcial que ejerce cada gas.
R/ a) 2.46 atm b) 1.23 atm para cada uno
3. Determine que volumen el litros de O2 a 640 Torr y 25 C se pueden
obtener de la descomposicin trmica de KClO3, si se utilizan 20 g de
clorato Potsico y el rendimiento de la reaccin es del 80%, y la reaccin
es:
) ( 2 ) ( ) ( 3 g s s
O KCl KClO +
R/ 5.7 L
4. Un gas tiene una densidad de 3.2 g/L a CN. A qu presin 1 L de ese
gas pesar 2 g si la temperatura se mantiene constante?
R/ 0.63 atm
5. Si un mechero quema gas propano (C3H8) a una rata de 4 L/min
medidos a 780 Torr y 27 C, determinar:
a) Cuntas moles de C3H8 se queman en una hora. b) Qu volumen
ocupara esas moles a 10 atm y 25 C.
R/ a) 10.02 mol b) 24.48 L
6. Determine cuantas veces el H2 (g) se difunde ms rpido que el CO2 (g). (Ya
realiz la consulta de la Ley de Graham?)
R/ 4.7 veces
7. Coloque (V) (F) segn el caso:
a) Un gas real se aproxima al comportamiento ideal a bajas presiones y
altas temperaturas.
b) En un gas las molculas estn en continuo movimiento catico.
c) Las fuerzas intermoleculares son despreciables en el estado gaseoso
ideal.
41
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
d) Las fuerzas intermoleculares son despreciables en el estado gaseoso
real.
e) El He es un gas ideal por ser un gas noble.
f) 48 gr de O2 ocupa un volumen mayor que 2 gr de H2 medidos a las
mismas condiciones de temperatura y presin.
8. El HCl (g) y el NH3 (g) reaccionan as:
HCl(g) + NH3(g) NH4Cl(s)
Si en un tubo de 2.5 mt Se introducen simultneamente los dos gases
por extremos opuestos, determine a que distancia de la entrada del HCl
se produce el NH4Cl (es un slido de color blanco). (Ya realizo la
consulta de la Ley de Graham?)
R/ a 1m
9. Cul ser el volumen de un globo si se llena con 4 moles de un gas a
748 Torr y a 30 C?
R/ 101.4 L
10. Una muestra 0.109 g de un gas ocupa un volumen de 112 L a 750 Torr y
a 100 C, cul ser el peso molecular del gas?
R/ 30
11. Un recipiente cilndrico de 1.6 mt de dimetro y 5 mt de altura contiene
2.8 g de metano (CH4), 0.6 g de hidrgeno y 5.6 g de nitrgeno (N2) a una
temperatura de 77 F. Cul ser la presin que ejerce sta mezcla
gaseosa sobre las paredes del recipiente y cul ser la presin parcial del
H2?
R/ 1.25 torr y 0.55 torr
12. Cierta cantidad de oxgeno recogida sobre agua a 752 Torr y 70 C ocupa
un volumen de 380 mL. La presin de vapor del agua vale 233.7 Torr a
70C.
a. Qu volumen ocupar dicho gas seco a CN?
b. Qu porcentaje del peso del oxgeno hmedo es del oxgeno seco?
c. Si el O2 recogido es el producto de la descomposicin del clorato
potsico, cuntos gramos de clorato se descompusieron?
R/ a) 205.79 mL b) 79.8% c) 0.750 g
13. Se tienen 0.2 g de hidrgeno en un recipiente de 30 L a 27 C. Qu
presin ejercer este gas, si el volumen aumenta a 90 L?
R/ 0.027 atm
42
Qumica General...en la U. Gases
IQ Lus Fernando Montoya Valencia Lic. Jess Edison Durango Betancur
14. Un gas ocupa un volumen de 3 L a 17 C y 0.5 atm de presin. Calcular el
volumen ocupado por dicho gas a CN
R/ 1.41 L
15. Cierta cantidad de gas ocupa un volumen de 80 L a -20 C y 740 Torr,
cual ser su volumen a TPE (esto es lo mismo que CN)?
R/ 0.084 L
16. Cuando se quema nitroglicerina (C3H5N3O9) todos los productos que se
generan son gaseosos. La reaccin de combustin es:
) ( 2 ) ( ) ( 2 ) ( 2 2 9 3 5 3
10 4 4 12 1 O N H 4C
g g g g
O H NO N CO O + + + +
Si 100 g de nitroglicerina se queman en un recipiente de 200 mL y el material
del recipiente resiste 500 atm, determine si hay explosin cuando la
temperatura alcance un valor de 600 C.
R/ Si hay explosin, la presin > 500 atm
17. Al analizar un compuesto gaseoso se encuentra que tiene 85.7% de
carbono y 14.3% de hidrgeno. A CN, 100 mL del compuesto pesan
0.188g Cul ser la frmula molecular del compuesto?
R/ C3H6
18. Un gas de frmula emprica C1H1 tiene una densidad de 1.16 g/L a CN,
cul es su frmula molecular?
R/ C2H2
19. Una muestra de un compuesto gaseoso pesa 2.65 g y ocupa un volumen
de 428 mL, a 742.3 Torr. y 24.3 C. El anlisis de este compuesto revela
una composicin de 15.5 % de C, 23 % de C, 61.5 % de F. Cul es la
frmula molecular del compuesto?
R/ C2CF5
You might also like
- La Entriopia y Su Expresion MatematicaDocument8 pagesLa Entriopia y Su Expresion Matematicaallan100% (2)
- 1Document14 pages1chaito0% (1)
- Control CascadaDocument8 pagesControl CascadaGabriel León AriasNo ratings yet
- Control de Posicion de Motor DC MSDocument6 pagesControl de Posicion de Motor DC MSgori-rNo ratings yet
- OCW Tema 12 Diagrama Bode Asintotico 1Document33 pagesOCW Tema 12 Diagrama Bode Asintotico 1Darwin GualotoNo ratings yet
- Cascada BloquesDocument20 pagesCascada BloquesCarlos BellatinNo ratings yet
- Conceptos Básicos de Control Automático - Lazos de Control y Algebra de BloquesDocument2 pagesConceptos Básicos de Control Automático - Lazos de Control y Algebra de Bloquesgori-rNo ratings yet
- Accesorios Indispensables en La Red de AireDocument2 pagesAccesorios Indispensables en La Red de Airegori-rNo ratings yet
- Algebra de Bloques - Tabla de EjemplosDocument2 pagesAlgebra de Bloques - Tabla de Ejemplosgori-rNo ratings yet
- Ilustraciones TP1Document9 pagesIlustraciones TP1gori-rNo ratings yet
- GLPDocument27 pagesGLP1982fernan100% (2)
- Manual de InstrumentacionDocument222 pagesManual de InstrumentacionAmenhotep Übermensch100% (2)
- Parada de EmergenciaDocument5 pagesParada de EmergenciaMichael SweeneyNo ratings yet
- Inst01 PDFDocument11 pagesInst01 PDFjorgemarcial86No ratings yet
- Arian RTD ConexxionesDocument6 pagesArian RTD ConexxionesJose Ramon Escobar AlfaroNo ratings yet
- AislamientogalvanicoDocument8 pagesAislamientogalvanicoEduardo DuqueNo ratings yet
- Respuesta en FrecuenciaDocument49 pagesRespuesta en FrecuenciaJorge EscamillaNo ratings yet
- Diodo ZenerDocument3 pagesDiodo ZenerElias Vasquez ArgandoñaNo ratings yet
- COTIZACION 282-2021 - AlvacDocument4 pagesCOTIZACION 282-2021 - AlvacKrysthel Palomino PonceNo ratings yet
- Clasificación de Los Materiales Cerámicos y AplicacionesDocument19 pagesClasificación de Los Materiales Cerámicos y AplicacionesIsabel GarfioNo ratings yet
- Deflexiones concreto armadoDocument10 pagesDeflexiones concreto armadoluispccomputerNo ratings yet
- Principio de Le ChatelierDocument6 pagesPrincipio de Le ChatelierSofia Pineda Gomez67% (3)
- Informe Lab Quimica CalorimetriaDocument13 pagesInforme Lab Quimica CalorimetriaGisel0% (1)
- s23 Sec 1 Cyt Recurso 3 PDFDocument3 pagess23 Sec 1 Cyt Recurso 3 PDFREBECA REYES QUISPENo ratings yet
- Gases Ideales y Reales 2016-2Document85 pagesGases Ideales y Reales 2016-2joseNo ratings yet
- Fabricacion de Silla UniversitariaDocument3 pagesFabricacion de Silla UniversitariaArnold TorresNo ratings yet
- UNIDAD III, IV y VDocument10 pagesUNIDAD III, IV y VenocNo ratings yet
- Manual de Humedad PDFDocument134 pagesManual de Humedad PDFFastermanNo ratings yet
- Resumenes neumaticaAAADocument21 pagesResumenes neumaticaAAASamantha dominguezNo ratings yet
- Captar agua de la nieblaDocument3 pagesCaptar agua de la nieblaEliZabeTh FaUstOrNo ratings yet
- Los Instrumentos y Medidores para Nuestro Conocimiento.Document8 pagesLos Instrumentos y Medidores para Nuestro Conocimiento.Yeymi Franchesca Hernandez Parada100% (1)
- Fisica Hidrostática y Conservación en La Cantidad de FlujoDocument3 pagesFisica Hidrostática y Conservación en La Cantidad de Flujo57482984No ratings yet
- Fisica II 2021 - Modulo 3Document35 pagesFisica II 2021 - Modulo 3Elvira Medina Fernanda PatriciaNo ratings yet
- Cámaras ClimáticasDocument5 pagesCámaras ClimáticasDaniel Villavicencio RamosNo ratings yet
- El Ciclo Estacional de Un LagoDocument2 pagesEl Ciclo Estacional de Un LagoFabian CastilloNo ratings yet
- QuimicaaaaaDocument17 pagesQuimicaaaaajjsoiNo ratings yet
- Mapa Instalacion de Gas t4Document1 pageMapa Instalacion de Gas t4yolanda belenNo ratings yet
- PresiónHidróstáticaDocument4 pagesPresiónHidróstáticaAmador Coz Tucto67% (3)
- 1 9pracDocument9 pages1 9pracguido oscar huanca mamaniNo ratings yet
- ENERGÍADocument26 pagesENERGÍAElioAguilarFLoresNo ratings yet
- Taller 8 Tratamientos TermicosDocument4 pagesTaller 8 Tratamientos TermicosRober Andres Lemus AlmonacidNo ratings yet
- Cfe Sismo 1993Document436 pagesCfe Sismo 1993Guillermo Meza TapiaNo ratings yet
- Sílabos Meteo y Clim - 2019-IDocument5 pagesSílabos Meteo y Clim - 2019-IAnonymous xbXUskqyNo ratings yet
- Biología-Química Grado 11°Document8 pagesBiología-Química Grado 11°Jazmin OccidentalNo ratings yet
- Cinta 3M VHB G23F PDFDocument4 pagesCinta 3M VHB G23F PDFMarco Garcia PeñalozaNo ratings yet
- Estudio de La Temperatura de FundenteDocument5 pagesEstudio de La Temperatura de FundenteurielNo ratings yet