Professional Documents
Culture Documents
A Naftalina
Uploaded by
Luiz Fernando S. SantosCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
A Naftalina
Uploaded by
Luiz Fernando S. SantosCopyright:
Available Formats
A naftalina, quimicamente designada de naftaleno, um hidrocarboneto aromtico cuja molcula constituda por dois anis benznicos condensados, apresentando
do a frmula molecular C10H8. Pela frmula molecular, C10H8, poderia prever-se alto grau de insaturao, contudo, o naftaleno resistente s reaces tpicas de adio (caractersticas dos compostos insaturados. O naftaleno classifica-se como aromtico: est formado por anis hexagonais planos a estrutura apresenta nuvens p de seis electres (sexteto aromtico), como se pode verificar por considerao das orbitais atmicas. Na terminologia das ligaes, o naftaleno considera-se como um hbrido de ressonncia de trs estruturas:
Propriedades Fsico-qumicas O naftaleno apresenta um forte odor a alcatro, que habitualmente se sente a partir de 0,3 p.p.m. Por sublimao, emite vapores a partir da temperatura ambiente. Este composto arde com uma chama muito fuliginosa, libertando um fumo espesso e irritante; a sua decomposio trmica d origem a gases e vapores txicos, nomeadamente o monxido de carbono. Reage violentamente com os oxidantes. Quando fundido gera, em contacto com a gua e acima dos 110 C a formao de espuma que pode provocar uma subpresso no recipiente. Constantes fsicas: Massa molecular (g.mol-1) ponto de fuso ( C) ponto de ebulio ( C) Densidade (g.cm-3) ndice de refraco (nD) Solubilidade: gua lcool ter acetona benzeno clorofrmio cido actico insolvel solvel muito solvel muito solvel muito solvel muito solvel muito solvel 128,19 80,55 278 1,0253 20 1,4003 24
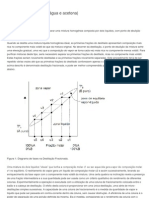
As curvas de aquecimento e resfriamento so obtidas a partir da construo de um grfico da temperatura em funo da quantidade de calor trocada pelo corpo ou do tempo percorrido. A temperatura varia at que o corpo atinja a mudana de estado (Slido - liquido; Liquido - slido) onde variando tambm sua energia potencial e energia cintica, quando ocorre a mudana de estado no h mudana na temperatura, varia somente a energia potencial. No entanto, as mistura no seguem esse padro, sendo assim, as curvas de aquecimento so bons indicadores de pureza de uma substncia, j que a mistura tm uma constante de variao de energia cintica que menos acentuada no momento da mudana de estado fsico da substncia. Objetivo O experimento tem como objetivo verificar a pureza da substncia naftaleno, atravs da construo da curva de aquecimento, que evidencia o seu ponto de fuso. Materiais: Tubo de Ensaio Rolha de Borracha Perfurada Termmetro Bcquer de 250 ml ou 500 ml
Tela de Amianto Trip de Ferro Suporte Universal com Garra Bico de Bunsen Reagentes: gua Naftaleno (C10H8) Mtodos: No bcquer coloca-se 200ml de gua que deve ficar esquentando, em seguida, pesa-se o naftaleno no papel de filtro. Coloca-se o naftaleno no tubo de ensaio, este tampado por uma rolha perfurada. Na rolha perfurada inserido o termmetro que fica em contato com o naftaleno, a cada minuto anota-se a mudana de temperatura continua. A temperatura anotada tida como ponto de fuso quando aparecer a primeira gota de liquido. Continua-se a anotar a variao de temperatura, at que o naftaleno se torne totalmente liquido, quando isso ocorrer, desliga-se o bico de bunsen e continuase a anotar a variao de temperatura, at que o naftaleno volte ao seu estado slido. Resultados: Do estado slido para o estado Liquido (Aquecimento) Tempo (minuto) e Temperatura ( C): 025C 125C 229 330 434 540 6 7 860 967 1072 (Chega-se ao ponto de fuso onde surge a primeira gota) 1176 1279 1384 (Chega-se ao estado liquido) 1486 1586 Do estado Liquido para o estado Slido (Resfriamento)
1685 1782 1880 1977 2074 2172 (Chega-se ao ponto de solidificao Inicio da cristalizao) 2270 2368 2466 2564 2663 (Chega-se ao estado Slido Totalmente cristalizado) Concluso: Nome comercial NAFTALINA: forma impura do naftaleno (C10H8). A partir dos grficos, as variaes ocorridas nas mudanas de estados, conclui-se que a substncia, naftaleno, no pura. Segundo estudos em pesquisas literrias uma substncia para ser pura no apresenta inclinaes grficas em todo experimento, o que ocorre em nosso caso. Segundo anotaes o ponto de fuso do experimento inicia-se a 72C e completa-se a 84C, j em estudo realizados o ponto de ebulio seria de 18C e o ponto de fuso teria que ser de 80C.
You might also like
- Relatório de Curvas de Aquecimento e de Resfriamento de SubstânciaDocument9 pagesRelatório de Curvas de Aquecimento e de Resfriamento de SubstânciaLeo DiasNo ratings yet
- Ponto de fusão do naftalenoDocument4 pagesPonto de fusão do naftalenoMatheus Mercês Ramos100% (1)
- Destilação Simples - Victor GuedesDocument6 pagesDestilação Simples - Victor GuedesVictor GuedesNo ratings yet
- Destilação Fracionada e Destilação Por Arraste de VaporDocument13 pagesDestilação Fracionada e Destilação Por Arraste de VaporNatáliaCabralNo ratings yet
- Equilíbrio de FasesDocument13 pagesEquilíbrio de Fasesvotapsm100% (1)
- Destilação Fracionada de Água e AcetonaDocument5 pagesDestilação Fracionada de Água e AcetonaEdu AntunesNo ratings yet
- Curva de Ebulição de Água e Solução SalinaDocument13 pagesCurva de Ebulição de Água e Solução SalinaMateus MedeirosNo ratings yet
- Síntese e Purificação Da AcetanilidaDocument8 pagesSíntese e Purificação Da AcetanilidaThais FaustinoNo ratings yet
- Destilação Fracionada PDFDocument6 pagesDestilação Fracionada PDFJohann Costa CastelliNo ratings yet
- DESTILAÇÃO1Document10 pagesDESTILAÇÃO1Roberta BelazNo ratings yet
- 1 - Relatório de Físico-QuímicaDocument20 pages1 - Relatório de Físico-QuímicaLarissa Diniz100% (1)
- Produção do estireno por desidrogenação do etilbenzenoDocument3 pagesProdução do estireno por desidrogenação do etilbenzenoLilianaNo ratings yet
- Relatório Propriedades ColigativasDocument9 pagesRelatório Propriedades ColigativasBruna Avelar100% (1)
- Destilação Fracionada: Separação de Acetona e ÁguaDocument12 pagesDestilação Fracionada: Separação de Acetona e ÁguaDeborah Oliveira100% (1)
- 3º RelatórioDocument7 pages3º RelatórioJoão RicardoNo ratings yet
- Destilação de EtanolDocument5 pagesDestilação de EtanolLucia Noemi TakahashiNo ratings yet
- Ponto PeritéticoDocument6 pagesPonto PeritéticoxdmarkosNo ratings yet
- 1 - Relatório de Físico-QuímicaDocument18 pages1 - Relatório de Físico-QuímicaLarissa DinizNo ratings yet
- Determinação de Constantes Físicas de Compostos OrgânicosDocument16 pagesDeterminação de Constantes Físicas de Compostos Orgânicoserico_gb100% (3)
- Química Experimental I Relatorio JakelineDocument23 pagesQuímica Experimental I Relatorio JakelineJakeline de Souza Bastos100% (3)
- Projetopedagogico Tudo É PossívelDocument24 pagesProjetopedagogico Tudo É Possívelrobson serraNo ratings yet
- Pratica 2 Medida de Ponto de Fusao e PonDocument7 pagesPratica 2 Medida de Ponto de Fusao e PonBruno EduardoNo ratings yet
- Síntese do cloreto de pentaminclorocobalto(IIIDocument5 pagesSíntese do cloreto de pentaminclorocobalto(IIIgalerosaNo ratings yet
- ISOMERIZAÇÃO - PPTDocument32 pagesISOMERIZAÇÃO - PPTYngrid KellyNo ratings yet
- Relatório 1 - SolubilidadeDocument19 pagesRelatório 1 - SolubilidadeJenniferCarvalhoNo ratings yet
- Pratica Destilação Do VinhoDocument5 pagesPratica Destilação Do Vinhoelizael01020305No ratings yet
- Ponto de fusão e ebulição de substânciasDocument6 pagesPonto de fusão e ebulição de substânciasAmanda AlmerindoNo ratings yet
- Destilação simples e fraccionadaDocument22 pagesDestilação simples e fraccionadaCristiana SantosNo ratings yet
- Relatorio Destilação SimplesDocument12 pagesRelatorio Destilação SimplesAngélica de OliveiraNo ratings yet
- Calor de neutralização ácido-baseDocument6 pagesCalor de neutralização ácido-baseBeatrizNo ratings yet
- Lista de exercícios 5 - Operações Unitárias IIIDocument7 pagesLista de exercícios 5 - Operações Unitárias IIInandasduarte15No ratings yet
- Curva miscibilidade água-fenolDocument10 pagesCurva miscibilidade água-fenolTarsila CarvalhoNo ratings yet
- Prática IV - Propriedades ColigativasDocument4 pagesPrática IV - Propriedades ColigativasRafael ConceiçãoNo ratings yet
- 5-Solucoes e SeparacaoDocument6 pages5-Solucoes e SeparacaoAdriano FuriniNo ratings yet
- Exp. Nº4 Físico-Química Exp. DayvsonDocument21 pagesExp. Nº4 Físico-Química Exp. DayvsonDayvison Coelho100% (2)
- Processo de destilaçãoDocument85 pagesProcesso de destilaçãoRicardo AbraãoNo ratings yet
- Determinação do ponto de fusão para caracterização de substânciasDocument3 pagesDeterminação do ponto de fusão para caracterização de substânciasRaynne SousaNo ratings yet
- AL 2.1 Destilação Fraccionada de Uma Mistura de Três ComponentesDocument9 pagesAL 2.1 Destilação Fraccionada de Uma Mistura de Três ComponentesAndré Narciso100% (1)
- Lista de ExercicioDocument5 pagesLista de ExercicioCosta NetoNo ratings yet
- Relatório Destilação Simples e FracionadaDocument3 pagesRelatório Destilação Simples e FracionadaBruna GomesNo ratings yet
- Equilíbrio Químico ExperimentalDocument4 pagesEquilíbrio Químico ExperimentalWelligton QueirozNo ratings yet
- Determinação Do Ponto de Ebulição de Um LíquidoDocument3 pagesDeterminação Do Ponto de Ebulição de Um LíquidoBruno EduardoNo ratings yet
- Relatorio Destilação Simples e FracionadaDocument11 pagesRelatorio Destilação Simples e FracionadaVictor MarquesNo ratings yet
- Recristalização da aspirinaDocument6 pagesRecristalização da aspirinaEstéphane AmilarNo ratings yet
- Calor Latente AcetonaDocument23 pagesCalor Latente AcetonaKamila Cavalcante0% (1)
- DestilaçaoDocument10 pagesDestilaçaoFilipe Diamantino SabelaNo ratings yet
- Crioscopia determina molecularidade de enxofreDocument9 pagesCrioscopia determina molecularidade de enxofreKarine SilvaNo ratings yet
- R1 FLÁVIA - Recristalização e PF 8,0Document13 pagesR1 FLÁVIA - Recristalização e PF 8,0flaviagoncalvesNo ratings yet
- Purificação de naftaleno por sublimaçãoDocument6 pagesPurificação de naftaleno por sublimaçãoAriane FerrazNo ratings yet
- Relatorio de Quimica NaftalenoDocument7 pagesRelatorio de Quimica NaftalenoMariana GuerraNo ratings yet
- Destilação de Uma Mistura BináriaDocument19 pagesDestilação de Uma Mistura BináriaIzabella BarbozaNo ratings yet
- Cristalização Do Sulfato de CobreDocument3 pagesCristalização Do Sulfato de CobreLuiz Fernando S. Santos100% (3)
- Experimento 4 - Extração Líquido-Líquido Com Solventes Interativos - Parte 2 - ModificadoDocument8 pagesExperimento 4 - Extração Líquido-Líquido Com Solventes Interativos - Parte 2 - ModificadoDebora FontesNo ratings yet
- Calcular efeitos de pressão no ponto de fusão da águaDocument23 pagesCalcular efeitos de pressão no ponto de fusão da águaPetroleo PlanaltoNo ratings yet
- Relatório 3 - Elv - Grupo 3Document25 pagesRelatório 3 - Elv - Grupo 3Fabricio VitorinoNo ratings yet
- Destilação Simples É Um Processo Que Permite A Separação de Um Líquido de Uma Substância Não VolátilDocument13 pagesDestilação Simples É Um Processo Que Permite A Separação de Um Líquido de Uma Substância Não VolátilValsergio BarrosNo ratings yet
- Pratica 1 RelatorioDocument8 pagesPratica 1 RelatorioClarissa BiancoNo ratings yet
- Luiz FernandoSantosProfileDocument2 pagesLuiz FernandoSantosProfileLuiz Fernando S. SantosNo ratings yet
- CorrecaoDocument6 pagesCorrecaoLuiz Fernando S. SantosNo ratings yet
- Exercicios Fisica 1Document8 pagesExercicios Fisica 1Luiz Fernando S. SantosNo ratings yet
- Conteúdo Programático - Cálculo I v4Document4 pagesConteúdo Programático - Cálculo I v4Luiz Fernando S. SantosNo ratings yet
- Conteúdo Programático - Cálculo I v4Document4 pagesConteúdo Programático - Cálculo I v4Luiz Fernando S. SantosNo ratings yet
- Cap 03Document3 pagesCap 03Welington VilelaNo ratings yet
- Conteudo Programatico Calculo IDocument2 pagesConteudo Programatico Calculo ILuiz Fernando S. SantosNo ratings yet
- Conteúdo Programático - Cálculo I v4Document4 pagesConteúdo Programático - Cálculo I v4Luiz Fernando S. SantosNo ratings yet
- Calculo I SUB 2o Sem 2006Document1 pageCalculo I SUB 2o Sem 2006Luiz Fernando S. SantosNo ratings yet
- Conteúdo Programático - Cálculo I v3Document2 pagesConteúdo Programático - Cálculo I v3Luiz Fernando S. SantosNo ratings yet
- Conteúdo Programático - Cálculo I v4Document3 pagesConteúdo Programático - Cálculo I v4Luiz Fernando S. SantosNo ratings yet
- Calculo I Substitutiva 2005 DepDocument1 pageCalculo I Substitutiva 2005 DepLuiz Fernando S. SantosNo ratings yet
- Conteudo Programatico Calculo IDocument2 pagesConteudo Programatico Calculo ILuiz Fernando S. SantosNo ratings yet
- Conteúdo Programático - Cálculo I v3Document2 pagesConteúdo Programático - Cálculo I v3Luiz Fernando S. SantosNo ratings yet
- Conteudo Adicional - Sabados - SIDocument1 pageConteudo Adicional - Sabados - SILuiz Fernando S. SantosNo ratings yet
- Calculo I 1a Prova Simulada 2005Document1 pageCalculo I 1a Prova Simulada 2005Luiz Fernando S. SantosNo ratings yet
- Calculo I 2a Prova 2005 DepDocument2 pagesCalculo I 2a Prova 2005 DepLuiz Fernando S. SantosNo ratings yet
- Calculo I SUB 2o Sem 2006Document1 pageCalculo I SUB 2o Sem 2006Luiz Fernando S. SantosNo ratings yet
- Calculo I 1a Prova Simulada 2005Document1 pageCalculo I 1a Prova Simulada 2005Luiz Fernando S. SantosNo ratings yet
- Calculo I Exame 2o Sem 2004Document2 pagesCalculo I Exame 2o Sem 2004Luiz Fernando S. SantosNo ratings yet
- Calculo I SUB 1o Sem 2006Document1 pageCalculo I SUB 1o Sem 2006Luiz Fernando S. SantosNo ratings yet
- Calculo I 1a Prova 2005 2o SemDocument2 pagesCalculo I 1a Prova 2005 2o SemLuiz Fernando S. SantosNo ratings yet
- Calculo I Exame 2o Sem 2004Document2 pagesCalculo I Exame 2o Sem 2004Luiz Fernando S. SantosNo ratings yet
- 1a Prova de Calculo I Do 1o Sem de SI 2006 BDocument1 page1a Prova de Calculo I Do 1o Sem de SI 2006 BLuiz Fernando S. SantosNo ratings yet
- Calculo I 1a Prova 2005 2o SemDocument2 pagesCalculo I 1a Prova 2005 2o SemLuiz Fernando S. SantosNo ratings yet
- Calculo I EXAME1o Sem 2006Document1 pageCalculo I EXAME1o Sem 2006Luiz Fernando S. SantosNo ratings yet
- Calculo I 2a Prova 2005 DepDocument2 pagesCalculo I 2a Prova 2005 DepLuiz Fernando S. SantosNo ratings yet
- Calculo I 1a Prova 2005 2o SemDocument2 pagesCalculo I 1a Prova 2005 2o SemLuiz Fernando S. SantosNo ratings yet
- Calculo I ExameDocument2 pagesCalculo I ExameLuiz Fernando S. SantosNo ratings yet
- Calculo I 2a Prova 2007 2o SemDocument1 pageCalculo I 2a Prova 2007 2o SemLuiz Fernando S. SantosNo ratings yet
- Problemas Praticas ACE 2019Document13 pagesProblemas Praticas ACE 2019Rui DiasNo ratings yet
- Guia para Seleção de Resistor de Frenagem - 0808Document5 pagesGuia para Seleção de Resistor de Frenagem - 0808pmoussatcheNo ratings yet
- Análise de Fraturas em MetaisDocument278 pagesAnálise de Fraturas em MetaisFelipe Dornellas SilvaNo ratings yet
- Texto - Astronomo Mirim - Guia Do ProfessorDocument25 pagesTexto - Astronomo Mirim - Guia Do ProfessorMarcos LeiteNo ratings yet
- GeometriaDocument14 pagesGeometriaJoseMarquesNo ratings yet
- Centrífuga Q222T - QuimisDocument13 pagesCentrífuga Q222T - QuimisBruno0% (1)
- Usinagem de VirabrequimDocument4 pagesUsinagem de Virabrequimbacalhaucsb0% (1)
- Apostila de Elementos de MaquinasDocument103 pagesApostila de Elementos de MaquinasRicardo ShimodaNo ratings yet
- Sabão e detergentes: propriedades e fabricaçãoDocument18 pagesSabão e detergentes: propriedades e fabricaçãoSarah AraujoNo ratings yet
- Relatório Oscilações Forçadas PDFDocument8 pagesRelatório Oscilações Forçadas PDFJoyce OliveiraNo ratings yet
- Quimica Conservacao e RestauroDocument13 pagesQuimica Conservacao e RestauroRosângela ReisNo ratings yet
- Valvula Rec Vapores 0413Document2 pagesValvula Rec Vapores 0413Juliano André PetryNo ratings yet
- Caderno de Atividades HidropneumáticasDocument20 pagesCaderno de Atividades HidropneumáticasrenatofcortesNo ratings yet
- Relatório 1 - PênduloDocument6 pagesRelatório 1 - PênduloAndresa AlvesNo ratings yet
- Projeto de blocos de transição em concreto armadoDocument13 pagesProjeto de blocos de transição em concreto armadoAdriano RodriguesNo ratings yet
- Transferência de calor fundamentosDocument7 pagesTransferência de calor fundamentosClaimir GuinzelliNo ratings yet
- ImpermeabilizaçãoDocument42 pagesImpermeabilizaçãopriscilla euqueres100% (1)
- Corte plasma: entenda o processo e suas aplicaçõesDocument4 pagesCorte plasma: entenda o processo e suas aplicaçõesRicardoNo ratings yet
- Segurança elétrica NR 10Document3 pagesSegurança elétrica NR 10Schwedler Andréia YuriNo ratings yet
- 2º Teste Fisico-QuimicaDocument5 pages2º Teste Fisico-QuimicaDavid SantosNo ratings yet
- Prensa HidráulicaDocument9 pagesPrensa HidráulicaArtaxerxes Saint'sNo ratings yet
- Planta de Instalação D700Document2 pagesPlanta de Instalação D700ErnestBohm0% (1)
- Cpen Ma11 PR Menu2 PMDocument18 pagesCpen Ma11 PR Menu2 PMAdélia GonçalvesNo ratings yet
- Manual07jun09 CorrenteDocument19 pagesManual07jun09 CorrenteKlebersonRamosNo ratings yet
- Aula 1 - Reatores Homogêneos e HeterogêneosDocument110 pagesAula 1 - Reatores Homogêneos e HeterogêneosFENFOG100% (1)
- História da eletroterapiaDocument190 pagesHistória da eletroterapiaJoão Victor CostaNo ratings yet
- Resistência à compressão da madeira determinada em laboratórioDocument15 pagesResistência à compressão da madeira determinada em laboratórioIsabela Tavares Rampim100% (1)
- BetoneiraDocument31 pagesBetoneiraGiuliano ArzamendiaNo ratings yet
- Exame Unificado de Pós-graduações em FísicaDocument61 pagesExame Unificado de Pós-graduações em FísicaJunior Lima67% (9)