Professional Documents
Culture Documents
El Proceso de Disolución
Uploaded by
Javier Andres Urrea0 ratings0% found this document useful (0 votes)
61 views3 pagesEl Proceso de Disolución
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentEl Proceso de Disolución
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
61 views3 pagesEl Proceso de Disolución
Uploaded by
Javier Andres UrreaEl Proceso de Disolución
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 3
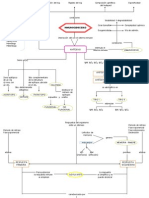
El proceso de disolución
Se forma una disolución cuando una sustancia se dispersa de manera
uniforme en otra. Con la excepción de las mezclas de gases, en todas
las disoluciones intervienen sustancias en fase condensada. En el
capítulo 11 vimos que las moléculas o iones de las sustancias en los
estados líquido y sólido experimentan fuerzas de atracción
intermoleculares que mantienen juntas a las partículas individuales. Las
fuerzas intermoleculares también operan entre las partículas de soluto
y las moléculas de disolvente. Cualesquiera de los diversos tipos de
fuerzas intermoleculares que vimos en el capítulo 11 puede operar entre
las partículas de soluto y de disolvente en una disolución. Las fuerzas
ion-dipolo, por ejemplo, dominan en las disoluciones de sustancias
iónicas en agua. En cambio, las fuerzas de dispersión dominan cuando
una sustancia no polar como el C6H14 se disuelve en otra no polar
como el CCl4. De hecho, un factor principal que determina si se forma
o no una disolución es la intensidad relativa de las fuerzas
intermoleculares entre las partículas de soluto y de disolvente. Las
disoluciones se forman cuando las fuerzas de atracción entre las
partículas de soluto y de disolvente son de magnitud comparable con la
de las que existen entre las partículas de soluto mismas o entre las
partículas de disolvente mismas. Por ejemplo, la sustancia iónica NaCl
se disuelve fácilmente en agua porque la interacción atractiva entre los
iones y las moléculas polares del H2O sobrepasa la energía de red del
NaCl(s). Examinemos más de cerca este proceso de disolución,
prestando especial atención a las fuerzas de atracción. Cuando se
agrega NaCl a agua (Figura 13.1 \), las moléculas de agua se orientan
en la superficie de los cristales de NaCl. El extremo positivo del dipolo
del agua se orienta hacia los iones Cl-, y el extremo negativo, hacia los
iones Na+. Las atracciones ion-dipolo entre los iones Na+ y Cl- y las
moléculas del agua tienen la fuerza suficiente para sacar dichos iones
de sus posiciones en el cristal. Una vez separados del cristal, los iones
Na+ y Cl- quedan rodeados por moléculas de agua, como se muestra
en la figura 13.1(b y c) y en la figura 13.2 ≫. Tales interacciones entre
el soluto y las moléculas del disolvente se denominan solvatación. Si
el disolvente es agua, las interacciones reciben el nombre de
hidratación.
Formación de disoluciones, espontaneidad y desorden
Cuando se mezclan tetracloruro de carbono (CCl4) y hexano (C6H14), una se disuelve
fácilmente en la otra en todas proporciones. Las dos sustancias son no polares y
tienen puntos de ebullición similares (77°C para el CCl4 y 69°C para el C6H14). Por
tanto, es razonable suponer que las magnitudes de las fuerzas de atracción entre las
moléculas (fuerzas de dispersión de London) son comparables en las dos sustancias
y en su disolución. Cuando se mezclan las dos, la disolución es espontánea; es decir,
tiene lugar sin un aporte adicional de energía de fuera del sistema. En los procesos
que ocurren espontáneamente intervienen dos factores distintos. El más obvio es la
energía; el otro es el desorden.
Si soltamos un libro, cae al piso a causa de la gravedad. Asu altura inicial, el libro
tiene mayor energía potencial que cuando está en el piso. Amenos que se le detenga,
el libro caerá y perderá energía. Este hecho nos lleva al primer principio básico
que identifica los procesos espontáneos y la dirección que siguen: los procesos en los
que el contenido de energía del sistema disminuye tienden a ser espontáneos. Los procesos
espontáneos suelen ser exotérmicos. • (Sección 5.4, “Estrategias en química: Uso
de la entalpía como guía”) El cambio tiende a efectuarse en la dirección que conduce
a un menor contenido de energía o de entalpía del sistema.
Algunos procesos, empero, no redundan en una reducción de la energía del sistema,
o incluso podrían ser endotérmicos, y aun así ocurren espontáneamente. Por
ejemplo, el NH4NO3 se disuelve fácilmente en agua, aunque el proceso de disolución
es endotérmico. Todos los procesos de esta índole se caracterizan por un aumento en el
desorden, o aleatoriedad, del sistema. El mezclado de CCl 4 y C6H14 es otro ejemplo
sencillo. Supongamos que pudiéramos quitar repentinamente una barrera que separa
500 mL de CCl4 de 500 mL de C6H14, como en la figura 13.6(a) ≫. Antes de quitarse
la barrera, cada líquido ocupa un volumen de 500 mL. Todas las moléculas de
CCl4 están en los 500 mL a la izquierda de la barrera y todas las moléculas de C 6H14
están en los 500 mL de la derecha. Una vez que se establece el equilibrio después de
quitarse la barrera, los dos líquidos juntos ocupan un volumen de cerca de 1000 mL.
La formación de una disolución homogénea ha producido un aumento en el desorden,
o aleatoriedad, en cuanto a que las moléculas de cada sustancia ahora están
revueltas y distribuidas en un volumen dos veces mayor que el que ocupaban antes
de mezclarse. La cantidad de desorden en un sistema está dado por una cantidad
termodinámica llamada entropía. Este ejemplo ilustra nuestro segundo principio
básico: los procesos en los que el desorden (entropía) del sistema aumenta tienden a ser espontáneos.
Cuando se juntan moléculas de diferentes tipos, el mezclado y el consecuente
aumento en el desorden serán espontáneos a menos que las moléculas sean detenidas
por fuerzas intermoleculares suficientemente intensas o por barreras físicas. Por
ello, los gases se mezclan y expanden espontáneamente si sus recipientes no los detienen;
en este caso, las fuerzas intermoleculares son demasiado débiles para detener
a las moléculas. En cambio, a causa de los fuertes enlaces que mantienen unidos
los iones sodio y cloruro, el cloruro de sodio no se disuelve espontáneamente en gasolina.
Estudiaremos otra vez los procesos espontáneos en el capítulo 19. Ahí, consideraremos
con mayor detalle el balance entre las tendencias hacia una menor energía
y hacia una mayor entropía. Por el momento, necesitamos tener presente que en el
proceso de disolución intervienen dos factores: un cambio de entalpía y un cambio
de entropía. En la mayor parte de los casos, la formación de soluciones se favorece por el
aumento en la entropía que acompaña al mezclado. Por consiguiente, se formará una disolución
a menos que las interacciones soluto-soluto o disolvente-disolvente sean
demasiado fuertes en comparación con las interacciones soluto-disolvente.
Formación de disoluciones y reacciones químicas
En todas nuestras explicaciones de las disoluciones, debemos tener cuidado de distinguir
entre el proceso físico de formación de una disolución y las reacciones químicas
que dan lugar a una disolución. Por ejemplo, el níquel metálico se disuelve al
entrar en contacto con una disolución de ácido clorhídrico porque se efectúa la reacción
química siguiente:
Ni(s) _ 2HCI(ac) :NiCI2(ac _ H2(g) [13.2]
En este caso, la forma química de la sustancia que se está disolviendo ha cambiado,
de Ni a NiCl2. Si la disolución se evapora a sequedad, se recuperará NiCl 2·6H2O(s),
no Ni(s) (Figura 13.7 A). En contraste, cuando NaCl(s) se disuelve en agua, no hay
reacción química. Si la disolución se evapora a sequedad, se recuperará el NaCl. En
este capítulo nos concentraremos en disoluciones de las cuales el soluto se puede
recuperar inalterado de la disolución.
You might also like
- Práctica 4 - Hidratos de CarbonoDocument8 pagesPráctica 4 - Hidratos de CarbonoFrancis Lozano HerreraNo ratings yet
- Acceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012From EverandAcceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012No ratings yet
- Reseña Histórica Acerca Del Origen Del Nombre de Nuestro País EcuadorDocument4 pagesReseña Histórica Acerca Del Origen Del Nombre de Nuestro País Ecuadorariminito100% (1)
- Citocinas: definición, propiedades y clasificaciónDocument23 pagesCitocinas: definición, propiedades y clasificaciónPetra CamposNo ratings yet
- Factores Que Influyen en La Disolucion de MedicamentosDocument50 pagesFactores Que Influyen en La Disolucion de Medicamentosmanuel jesus obeso tantapomaNo ratings yet
- Bacteriología Linea Del TiempoDocument7 pagesBacteriología Linea Del TiempoSandy GonzagaNo ratings yet
- Absorción glucosa glicemiaDocument7 pagesAbsorción glucosa glicemiaJHERICO YHURAK HUAMAN CERNANo ratings yet
- Fármacos Parasimpáticos (Colinérgicos)Document34 pagesFármacos Parasimpáticos (Colinérgicos)anapink18100% (1)
- Antecedentes Historicos de La ParasitologiaDocument2 pagesAntecedentes Historicos de La ParasitologiaRamon Cobos GuerreroNo ratings yet
- Resumen de La NOM-062-ZOO-1990Document4 pagesResumen de La NOM-062-ZOO-1990Amari SolisNo ratings yet
- Hidratos de CarbonoDocument69 pagesHidratos de CarbonoMarta Luquez RNo ratings yet
- Mecanismos de Transporte de Membrana CelularDocument15 pagesMecanismos de Transporte de Membrana CelularAlejandraSánchezNo ratings yet
- Lactancia Materna 2016Document68 pagesLactancia Materna 2016jorge villamizarNo ratings yet
- Obtencion de AntibioticosDocument6 pagesObtencion de AntibioticosJose Narciso Panta FiestasNo ratings yet
- Antifungicos UnuDocument61 pagesAntifungicos UnujussaraNo ratings yet
- 8.conceptos Basicos de La Ecologia MicrobianaDocument20 pages8.conceptos Basicos de La Ecologia MicrobianaNitgma Dc0% (1)
- Biotransformación y Excreción de FármacosDocument6 pagesBiotransformación y Excreción de FármacosMaría Paula Aguilar LeemowNo ratings yet
- Clasificacion de Las Bacterias Gram NegativasDocument19 pagesClasificacion de Las Bacterias Gram NegativasCinthiaLissetSantacruzSoto100% (2)
- Mapa Conceptual INMUNOGENICIDAD ScribDocument2 pagesMapa Conceptual INMUNOGENICIDAD ScribarmandolafarjaNo ratings yet
- Historia de La Medicina y Sus Corrientes BDocument7 pagesHistoria de La Medicina y Sus Corrientes BSalonA MedicinaNo ratings yet
- AdrenoleucodistrofiaDocument8 pagesAdrenoleucodistrofiaAlejandro Antonio García GarcíaNo ratings yet
- Etiologia Del CáncerDocument51 pagesEtiologia Del CáncerRosario LongoriaNo ratings yet
- Historia de La Salud ReproductivaDocument4 pagesHistoria de La Salud Reproductivamedico1No ratings yet
- EXOCITOSISDocument10 pagesEXOCITOSISMarco Antonio Ortiz SalgadoNo ratings yet
- 1examen Salud Reproductiva PrimerDocument5 pages1examen Salud Reproductiva PrimergeorgiaNo ratings yet
- Fármacos Agonistas ColinérgicosDocument33 pagesFármacos Agonistas ColinérgicosMauricio Ramírez100% (2)
- Ganglio linfático: estructura y funciónDocument42 pagesGanglio linfático: estructura y funciónEnriqe Ramirez100% (2)
- Ensayo Historia de La Medicina AztecasDocument2 pagesEnsayo Historia de La Medicina AztecasRaul Alfredo Araujo FloresNo ratings yet
- Taenia Soliun, Taenia Saginata Informe 10Document11 pagesTaenia Soliun, Taenia Saginata Informe 10valentino Rodríguez PalaciosNo ratings yet
- SinapsisDocument6 pagesSinapsisEfrainRodrigoAjataNo ratings yet
- Manual LABORATOTIO TESIES PDFDocument173 pagesManual LABORATOTIO TESIES PDFAndrea Melo RualesNo ratings yet
- Copia de Bomba Sodio-PotasioDocument13 pagesCopia de Bomba Sodio-PotasioJulieth Carina Monroy Lopez100% (1)
- ArqueasDocument4 pagesArqueasLorena GuevaraNo ratings yet
- Ecología MicrobianaDocument29 pagesEcología MicrobianaAna Belen Pradas100% (2)
- Anatomía Radiológica de Tórax - LUQUEdDocument40 pagesAnatomía Radiológica de Tórax - LUQUEdLuque Armando OrdoñezNo ratings yet
- Medicina en La Edad MediaDocument14 pagesMedicina en La Edad MediaLuis TipazNo ratings yet
- FARMACOSDocument9 pagesFARMACOScarolina castilloNo ratings yet
- Antibióticos CLASE 7Document47 pagesAntibióticos CLASE 7Damaris Suazo100% (1)
- Citologia (Celulas de La Pared Interna de La Cavidad Bucal)Document6 pagesCitologia (Celulas de La Pared Interna de La Cavidad Bucal)majitoruilova94No ratings yet
- Definiciones de MicologíaDocument3 pagesDefiniciones de MicologíaCamiloAndrésÁlvarezNo ratings yet
- Formas farmacéuticas y vías de administraciónDocument38 pagesFormas farmacéuticas y vías de administraciónHugoNo ratings yet
- Metabolismo de Los Carbohidratos 1Document5 pagesMetabolismo de Los Carbohidratos 1Aran VeraNo ratings yet
- Robert Koch, pionero de la microbiologíaDocument14 pagesRobert Koch, pionero de la microbiologíaWENDY VANESSA ROJAS CORTESNo ratings yet
- FARMACOLOGÍA: AGONISTAS, ANTAGONISTAS Y FACTORES QUE MODIFICAN LOS FÁRMACOSDocument7 pagesFARMACOLOGÍA: AGONISTAS, ANTAGONISTAS Y FACTORES QUE MODIFICAN LOS FÁRMACOSDorcary Marcano GuerraNo ratings yet
- Potencial de MembranaDocument18 pagesPotencial de MembranaRafael RequenaNo ratings yet
- Receptores de FármacosDocument22 pagesReceptores de FármacosRukia SakataNo ratings yet
- Clostridium Corynebacterium MycobacteriumDocument66 pagesClostridium Corynebacterium MycobacteriumYELTSINNNo ratings yet
- Farmaco Lab 1Document27 pagesFarmaco Lab 1Lorena Estefani Cespedes ChavezNo ratings yet
- D.E. Identificacion de Gram PositivosDocument12 pagesD.E. Identificacion de Gram PositivosJosé Carbajal0% (1)
- Hongos Filamentosos y LevadurasDocument37 pagesHongos Filamentosos y LevadurasBerenice S. OleaNo ratings yet
- Los antimicrobianos en la práctica médicaDocument267 pagesLos antimicrobianos en la práctica médicaCaro BurzioNo ratings yet
- Planificación Familiar y Riesgo ReproductivoDocument27 pagesPlanificación Familiar y Riesgo Reproductivoselma_abi100% (1)
- AspirinaDocument8 pagesAspirinaAlex ReyNo ratings yet
- Hormesis PDFDocument7 pagesHormesis PDFTomás JordánNo ratings yet
- Bomba Sodio PotasioDocument7 pagesBomba Sodio PotasioFrida Sehani Hernández ArroyoNo ratings yet
- StaphylococcusDocument18 pagesStaphylococcusElizabeth Monterroza CarriazoNo ratings yet
- Art - Propionibacterium 2Document5 pagesArt - Propionibacterium 2Kenny De la RochaNo ratings yet
- Disoluciones. Equilibrios de FaseDocument28 pagesDisoluciones. Equilibrios de FaseAlbertoNo ratings yet
- Actividad 2 Cambio de Fase y Fuerzas Intermoleculares BisDocument6 pagesActividad 2 Cambio de Fase y Fuerzas Intermoleculares BisLeiton BarbaNo ratings yet
- Genesisrock IGDocument2 pagesGenesisrock IGJavier Andres UrreaNo ratings yet
- La Energía SuperficialDocument3 pagesLa Energía SuperficialJavier Andres UrreaNo ratings yet
- Reseña y Acontecimientos Históricos de Las Vaguadas Ocurridas en El Estado VargasDocument7 pagesReseña y Acontecimientos Históricos de Las Vaguadas Ocurridas en El Estado VargasJavier Andres UrreaNo ratings yet
- Esterificación de FischerDocument1 pageEsterificación de FischerJavier Andres UrreaNo ratings yet
- Equilibrio químico: Reacción del ion tetraclorocobaltato(II) con aguaDocument1 pageEquilibrio químico: Reacción del ion tetraclorocobaltato(II) con aguaJavier Andres UrreaNo ratings yet
- Propiedad de Las Minas VnzlaDocument4 pagesPropiedad de Las Minas VnzlaJavier Andres UrreaNo ratings yet
- EstereoquimicaDocument1 pageEstereoquimicaJavier Andres UrreaNo ratings yet
- Construcción de diagramas de fases mediante análisis térmicoDocument1 pageConstrucción de diagramas de fases mediante análisis térmicoJavier Andres UrreaNo ratings yet
- La Energía SuperficialDocument3 pagesLa Energía SuperficialJavier Andres UrreaNo ratings yet
- Funciones de EstadoDocument1 pageFunciones de EstadoJavier Andres UrreaNo ratings yet
- El Fluir de La Conciencia HistoriografíaDocument4 pagesEl Fluir de La Conciencia HistoriografíaJavier Andres UrreaNo ratings yet
- CalorimetríaDocument1 pageCalorimetríaJavier Andres UrreaNo ratings yet
- La Estereoquímica Es El Estudio de La Estructura TridimensionalDocument1 pageLa Estereoquímica Es El Estudio de La Estructura TridimensionalJavier Andres UrreaNo ratings yet
- La Estereoquímica Es El Estudio de La Estructura TridimensionalDocument1 pageLa Estereoquímica Es El Estudio de La Estructura TridimensionalJavier Andres UrreaNo ratings yet
- La Energía SuperficialDocument3 pagesLa Energía SuperficialJavier Andres UrreaNo ratings yet
- ProcesosDocument1 pageProcesosJavier Andres UrreaNo ratings yet
- Compuestos MezclasDocument1 pageCompuestos MezclasJavier Andres UrreaNo ratings yet
- La Energía SuperficialDocument3 pagesLa Energía SuperficialJavier Andres UrreaNo ratings yet
- 2.1 La Teoría Atómica de La Materia: - (Sección 1.1)Document1 page2.1 La Teoría Atómica de La Materia: - (Sección 1.1)Aby MartinezNo ratings yet
- Quimica EstudiarDocument2 pagesQuimica EstudiarJavier Andres UrreaNo ratings yet
- Desarrollo de La Tabla PeriódicaDocument1 pageDesarrollo de La Tabla PeriódicaJavier Andres UrreaNo ratings yet
- Funciones de EstadoDocument1 pageFunciones de EstadoJavier Andres UrreaNo ratings yet
- Por Qué Estudiar QuímicaDocument1 pagePor Qué Estudiar QuímicaJavier Andres UrreaNo ratings yet
- Por Qué Estudiar QuímicaDocument1 pagePor Qué Estudiar QuímicaJavier Andres UrreaNo ratings yet
- Antes de Viajar A Una Ciudad DesconocidaDocument1 pageAntes de Viajar A Una Ciudad DesconocidaJavier Andres UrreaNo ratings yet
- Termodinamica Calor de Reaccion EntropiaDocument2 pagesTermodinamica Calor de Reaccion EntropiaJavier Andres UrreaNo ratings yet
- El Proceso de DisoluciónDocument1 pageEl Proceso de DisoluciónJavier Andres UrreaNo ratings yet
- El Potencial QuímicoDocument3 pagesEl Potencial QuímicoJavier Andres UrreaNo ratings yet
- El Proceso de DisoluciónDocument1 pageEl Proceso de DisoluciónJavier Andres UrreaNo ratings yet
- Protocolo Aquisicion MedicamentosDocument16 pagesProtocolo Aquisicion MedicamentosZully Marcela Riascos HernandezNo ratings yet
- Prueba Diag. Matematica 5ºDocument4 pagesPrueba Diag. Matematica 5ºKarina Cortez AguirreNo ratings yet
- Ley de Pascal y Prensa HidraulicaDocument4 pagesLey de Pascal y Prensa HidraulicaJos VicNo ratings yet
- Velocidades RelativasDocument4 pagesVelocidades RelativasFrancisco Julio0% (2)
- Distribución Inicial de FluidosDocument13 pagesDistribución Inicial de FluidosmariaNo ratings yet
- Informe DISEÑOS DE MEZCLADocument23 pagesInforme DISEÑOS DE MEZCLAdany contrerasNo ratings yet
- Ejercicios de Curso de Física y Química de 4º 1 PDFDocument9 pagesEjercicios de Curso de Física y Química de 4º 1 PDFhousegrjNo ratings yet
- BVNVVDocument13 pagesBVNVVLauraRodríguezSagásteguiNo ratings yet
- Informe 1 EmpalmadoraDocument4 pagesInforme 1 EmpalmadoraCamilo BautistaNo ratings yet
- Combustión de etinoDocument91 pagesCombustión de etinoPruden HidalgoNo ratings yet
- SistemaFotovoltaicoAisladoDocument3 pagesSistemaFotovoltaicoAisladoJhoanBecerraNo ratings yet
- A2. DioptraDocument11 pagesA2. DioptraJesús David PachecoNo ratings yet
- Sew VariadorDocument72 pagesSew VariadorRUBEN VALDIVIANo ratings yet
- Auxiliar No 2Document10 pagesAuxiliar No 2Daniel Calderon EspindolaNo ratings yet
- Interpretación radiográfica dentalDocument12 pagesInterpretación radiográfica dentalCarlos ChatoNo ratings yet
- Equipo de Laboratorio GeomecánicaDocument17 pagesEquipo de Laboratorio Geomecánicaflor yasminNo ratings yet
- Ejercicios EficienciaDocument3 pagesEjercicios EficienciaCamilo OñateNo ratings yet
- Calbradores de ProcesosDocument14 pagesCalbradores de ProcesosSteeven LoorNo ratings yet
- F-DC-02 Manual de Prácticas-Red de BravaisDocument3 pagesF-DC-02 Manual de Prácticas-Red de BravaisPorfirio SolNo ratings yet
- Aco MollendoDocument50 pagesAco MollendoAndrea Valdivia SalinasNo ratings yet
- Examen CCNNDocument2 pagesExamen CCNNMayustha León FloresNo ratings yet
- Spencer Blanco SC10002BDocument1 pageSpencer Blanco SC10002Bjerson andres sanchez sanchezNo ratings yet
- Segunda Ley de La TermodinámicaDocument4 pagesSegunda Ley de La TermodinámicaXimena Martínez100% (1)
- Porta FolioDocument8 pagesPorta FolioVicente GalindoNo ratings yet
- Ejercicios Seminario DERIVADADocument2 pagesEjercicios Seminario DERIVADAKevin Nieto CobeñasNo ratings yet
- Velocidad Media-1Document8 pagesVelocidad Media-1webjuancarlosNo ratings yet
- Circuitos RectificadoresDocument89 pagesCircuitos RectificadoresMaria Lucia Ospina Sepulveda100% (1)
- Informe de Concreto 2 - Grupo 6Document121 pagesInforme de Concreto 2 - Grupo 6Miguel Angel Silva CubasNo ratings yet
- FourierDocument11 pagesFourierJordanG.NoriegaNo ratings yet
- Practica 7 - Cultivo Por LotesDocument26 pagesPractica 7 - Cultivo Por LotesWilliam HuarachaNo ratings yet