Professional Documents
Culture Documents
Parte Del Informe Mejorado Inorganica
Uploaded by
Miguel SerranoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Parte Del Informe Mejorado Inorganica
Uploaded by
Miguel SerranoCopyright:
Available Formats
OBJETIVO:
Identificar propiedades importantes de algunos elementos de la tabla periódica .Realizar
la preparación de funciones químicas a partir de elementos libres e identificarlas
características más importantes de los productos.
RESULTADOS Y DISCUSIÓN
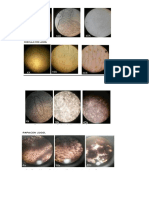
1 Oxido e hidróxido
Al pasar por el proceso de combustión un trozo cinta de magnesio, esta desprende una
luz muy brillante, esto se produce debido a que el magnesio reacciona con el oxígeno del
aire para producir oxido de magnesio (que es el residuo blanco o cenizoso) esta es una
reacción exotérmica debido a que reacciona gracias al calor.
Mg + O2 ----------- MgO oxido de magnesio
Luego al residuo ( oxido de magnesio) se le agrego 3 mL H2O lo cual al ponerlos en
contactos nos formó una base( Hidróxido de magnesio) , a lo cual al agregarle
fenolftaleína cambia de color rosa dependiendo de su PH
Mg + H2O ------ Mg (OH)2
1 .1
Al agrega 3mL de solución de FeCl3 0.2 M más varias gotas de NaOH 0.5 M , en un tubo
de ensayo de lo cual se formó un precipitado de hidróxido férrico
FeCl3 + 3 NaCl--------- Fe(OH) +3NaCl (AC)
2 óxidos ácidos y oxácidos
Al calentar el Azufre se da un proceso de combustión formando dióxido de azufre , se
buscó la forma de que el humo que se desprendía no se escapara , y así a este se le
agrego H2O , el gas ( humo) muy soluble en agua, sus disoluciones poseen características
ácidas y se les denomina coloquialmente soluciones de ácido sulfuroso H2SO3 , esto se
comprobó con el papel tornasol azul que cambio a color rojo esto se produjo porque es
la solución es un acido
3 sales
Primer ensayo
Se agregó 2mL de KI 0.1M con 1Ml de Pb (NO3)2, se pudo observar que estos dos
compuestos formaron un precipitado de color amarillo
Pb (NO3)2 + KI------- Pb2 + 2 KNO3
El precitado amarillo se debe al yoduro de plomo (ll) que no es soluble en agua
Segundo ensayo
Se agregó 2 Ml de MgCl2 con 2 mL de Na2CO3 formando un precipitado……………………….
No lo encontré.
Tercer ensayo
Al reaccionar 2Ml de sulfato de sodio (Na2SO4) con cloruro de Barrio (BaCl2) se forma
el sulfato de barrio (BaSO4) y cloruro de sodio, pero como es una disolución se formó un
precipitado blanco de sulfato de barrio
BaCl2 + 2NaSO4--------- BaSO4 + 2NaCl
Conclusión
Para nosotros, estudiantes de química y farmacia ha sido de gran importancia realizar la
preparación e identificación de las funciones químicas teniendo en cuenta sus
características más importantes de los productos obtenidos. Siendo así de suma
importancia la identificación de algunos de los elementos de la tabla periódica, conocer
las formulas y el nombre de compuestos químicos, ya que es parte del lenguaje de esta
ciencia, los métodos aplicados para la obtención de las distintas clases de sustancias no
son los únicos, pero si los más representativos de lo aprendido estamos en la capacidad de
reconocer los compuestos orgánicos .Los productos obtenidos de los compuestos
inorgánicos tienen una utilidad biomolecular mente
You might also like
- Bioquímica en La Vida Diaria El Equilibrio QuímicoDocument8 pagesBioquímica en La Vida Diaria El Equilibrio QuímicoMiguel SerranoNo ratings yet
- MlegalDocument3 pagesMlegalyudiNo ratings yet
- Práctica 6 - Quimica AnaliticaDocument8 pagesPráctica 6 - Quimica AnaliticaMiguel SerranoNo ratings yet
- Buenas Practicas de LaboratorioDocument3 pagesBuenas Practicas de LaboratorioMiguel SerranoNo ratings yet
- Ensayo de BioquimicaDocument1 pageEnsayo de BioquimicaMiguel SerranoNo ratings yet
- Taller Al Estudio de La Bioquimica 20128 2018.1 Martes TeoriaDocument3 pagesTaller Al Estudio de La Bioquimica 20128 2018.1 Martes TeoriaJavier SerranoNo ratings yet
- Trabajo de AnaliticaDocument4 pagesTrabajo de AnaliticaAndres David Meza SuarezNo ratings yet
- Quimica AnaliticaDocument3 pagesQuimica AnaliticaMiguel SerranoNo ratings yet
- Informe de HidrocarburosDocument18 pagesInforme de HidrocarburosMiguel Serrano100% (1)
- INFORME FISICO QUIMICA CalorimetroDocument7 pagesINFORME FISICO QUIMICA CalorimetroMiguel SerranoNo ratings yet
- Aborto: Causas, Tipos y ConsecuenciasDocument9 pagesAborto: Causas, Tipos y ConsecuenciasMiguel SerranoNo ratings yet
- Cuidadano Del MundoDocument3 pagesCuidadano Del MundoMiguel SerranoNo ratings yet
- Historia de La BioetcaDocument4 pagesHistoria de La BioetcaMiguel SerranoNo ratings yet
- Metodos de Aslamiento ViralDocument4 pagesMetodos de Aslamiento ViralMiguel SerranoNo ratings yet
- Cuidadano Del MundoDocument3 pagesCuidadano Del MundoMiguel SerranoNo ratings yet
- DocumentoDocument1 pageDocumentoMiguel SerranoNo ratings yet
- Inorganica LeoDocument7 pagesInorganica LeoMiguel SerranoNo ratings yet
- Doc2.Docx Laboratorio de BiologiaDocument2 pagesDoc2.Docx Laboratorio de BiologiaMiguel SerranoNo ratings yet
- Métodos físicos y químicos de esterilizaciónDocument3 pagesMétodos físicos y químicos de esterilizaciónMiguel SerranoNo ratings yet
- Métodos físicos y químicos de esterilizaciónDocument3 pagesMétodos físicos y químicos de esterilizaciónMiguel SerranoNo ratings yet
- Cuándo y Cómo Surgen Las Universidades en El MundoDocument3 pagesCuándo y Cómo Surgen Las Universidades en El MundoMiguel SerranoNo ratings yet
- Métodos físicos y químicos de esterilizaciónDocument3 pagesMétodos físicos y químicos de esterilizaciónMiguel SerranoNo ratings yet
- Agentes Quelantes y Sus AplicacionesDocument9 pagesAgentes Quelantes y Sus AplicacionesMiguel SerranoNo ratings yet
- Quimica AnaliticaDocument3 pagesQuimica AnaliticaMiguel SerranoNo ratings yet
- Agentes Quelantes y Sus AplicacionesDocument9 pagesAgentes Quelantes y Sus AplicacionesLuis100% (1)
- Informe de Enzimas Miguel y YerlysDocument4 pagesInforme de Enzimas Miguel y YerlysMiguel SerranoNo ratings yet
- Clase 6 Pirometalurgia 2020Document20 pagesClase 6 Pirometalurgia 2020yairNo ratings yet
- Proceso de Manufactura de TornillosDocument10 pagesProceso de Manufactura de TornillosJordan SolísNo ratings yet
- .Semana3.carguio y Transporte.Document4 pages.Semana3.carguio y Transporte.juan carlosNo ratings yet
- Informe N°2Document23 pagesInforme N°2Ernesto Vic Holg QuispeNo ratings yet
- 2do Grupo de Los CationesDocument27 pages2do Grupo de Los CationesAime CordovaNo ratings yet
- Trabajo Minera EscondidaDocument24 pagesTrabajo Minera EscondidaTomas MansillaNo ratings yet
- Lab5 Determinacion Del CuDocument19 pagesLab5 Determinacion Del CuRt JimNo ratings yet
- Minería en Panamá Años 2010 - 2011 2018-2019Document15 pagesMinería en Panamá Años 2010 - 2011 2018-2019Paul Rivera100% (1)
- Titulación de Una Tableta AntiácidaDocument5 pagesTitulación de Una Tableta AntiácidaJosué Monterroso0% (2)
- Ejercicios de Formulación de ÓxidosDocument2 pagesEjercicios de Formulación de ÓxidosClases particulares en la LagunaNo ratings yet
- Fórmulas - Sistema PeriódicoDocument2 pagesFórmulas - Sistema PeriódicoconsuelogarcueNo ratings yet
- Funciones Químicas: Práctica #4Document6 pagesFunciones Químicas: Práctica #4DANIEL JOEL RAMIREZ REYESNo ratings yet
- 149 - Unicoos PAU-Enlace QuímicoDocument22 pages149 - Unicoos PAU-Enlace QuímicoJoanCarlesLLopysNo ratings yet
- Materiales MetálicosDocument16 pagesMateriales MetálicosDahiana GómezNo ratings yet
- Creusabro 8000Document8 pagesCreusabro 8000PeterWay100% (1)
- Castillos de AceroDocument5 pagesCastillos de AceroJaneth EscobedoNo ratings yet
- Felix SuyoDocument9 pagesFelix SuyoMaickol Zapana RokaNo ratings yet
- Magnesio y aleaciones al magnesio: propiedades y aplicacionesDocument59 pagesMagnesio y aleaciones al magnesio: propiedades y aplicacionesAndres Fernando Cano Urrea100% (1)
- Ingeniería de Minas - Universidades y TestimoniosDocument4 pagesIngeniería de Minas - Universidades y TestimoniosferrecpNo ratings yet
- 09 97 13 - Recubrimientos para Control de CorrosionDocument13 pages09 97 13 - Recubrimientos para Control de CorrosionBraulio Candela NoriegaNo ratings yet
- Propuesta de Proyecto Dual PhaseDocument6 pagesPropuesta de Proyecto Dual Phaseisraelvf33No ratings yet
- Economia en VenezuelaDocument11 pagesEconomia en VenezuelaAMANANo ratings yet
- Clase Practica No 81Document2 pagesClase Practica No 81Hee SookNo ratings yet
- Contrato de Compromiso Por Campana para La Extracion de Material Metalico de Cobre de La Concesion Minera FenixDocument3 pagesContrato de Compromiso Por Campana para La Extracion de Material Metalico de Cobre de La Concesion Minera FenixgjaramillovNo ratings yet
- Unidad I Introduccion Al Diseño EstructuralDocument7 pagesUnidad I Introduccion Al Diseño EstructuralHéctor Medrano FloresNo ratings yet
- Resumen API 1104Document13 pagesResumen API 1104Giovanni FloresNo ratings yet
- Materiales de de Mecanica BasicaDocument11 pagesMateriales de de Mecanica BasicaFrank A. CnzNo ratings yet
- Reacciones Quimicas ImprimiiirDocument13 pagesReacciones Quimicas ImprimiiirMedalit MP100% (2)
- Normalizacion de Materiales No FerrososDocument6 pagesNormalizacion de Materiales No FerrososVittorNúñez100% (1)