Professional Documents
Culture Documents
Informe Aniones 20172 Finalizado
Uploaded by
Yelts JanampaOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Informe Aniones 20172 Finalizado
Uploaded by
Yelts JanampaCopyright:
Available Formats
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
UNIVERSIDAD NACIONAL DE INGENIERÍA
FACULTAD DE INGENIERÍA QUÍMICA Y TEXTIL
Departamento Académico de Ingeniería Química
“Marcha analítica de separación de aniones en grupos y del primer grupo”
GRUPO N° 5
INTEGRANTES: Janampa Rodriguez Yelts
Gonzales Huaman Javier
Landa Mandujano Mijail Alexander
DOCENTES: Ing. Morales Comettant, Carlos Humberto
Dra. Nieto Juarez, Jessica Ivana
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 1
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
LIMA – PERÚ
2017
Índice general
Portada ......................................................................... Error! Bookmark not defined.
Índice general............................................................................................................... 1
Marcha analítica de separación de aniones en grupos y el grupo 1Error! Bookmark not defined.
Objetivos .................................................................... Error! Bookmark not defined.
Fundamento teórico ......................................................... Error! Bookmark not defined.
pictogramas ................................................................................................................... 4
Parte experimental .......................................................................................................... 6
Observaciones ............................................................................................................ 6
Reacciones químicas y explicación ................................ Error! Bookmark not defined.
Conclusiones.............................................................................................................. 12
Recomendaciones...................................................................................................... 12
Bibliografía .................................................................... Error! Bookmark not defined.
Anexos ........................................................................... Error! Bookmark not defined.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 2
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
Práctica De Laboratorio Nº 7
MARCHA ANALÍTICA DE SEPARACIÓN E IDENTIFICACION DE ANIONES EN
GRUPOS Y ANALISIS DE IDENTIFICACION DEL PRIMER GRUPO
OBJETIVO
Desarrollar las habilidades prácticas necesarias para la correcta identificación de los
aniones presentes en una muestra de interés empleando las herramientas que provee
el análisis químico cualitativo.
Identificar los aniones de una solución acuosa en grupos mediante técnicas de
separación.
Analizar e interpretar las diferentes reacciones que se llevan a cabo para la identificar
tales aniones.
FUNDAMENTO TEÓRICO
Clasificación de las aniones. Varias clasificaciones de los aniones han sido
propuestas. Algunos autores presentan hasta 8 diferentes grupos mientras que otros
apenas llegan a los 3. Nosotros usaremos la siguiente clasificación
Grupo I Este grupo está compuesto de aniones que son precipitados desde una
solución ligeramente básica mediante el empleo de una mezcla de nitrato de bario. Los
aniones son: sulfato SO42- , sulfito SO32- , carbonato CO32- , silicato SiO32- , cromato
CrO42-, fosfato PO43-, entre otros.
Grupo II Este grupo está compuesto de aniones que son precipatos al agregar nitrato
de zinc a la solución alcalina, estos iones son: sulfuro S-, cianuro CN-, ferrocianuro
[Fe(CN)6]4-, ferricianuro [Fe(CN)6]3-.
Grupo III Este grupo está compuesto de aniones que son precipitados por nitrato de
plata en una solución diluida de ácido nítrico. Estos iones son: cloruro Cl-, bromuro Br-
,ioduro I-.
Grupo IV (grupo soluble) Este grupo está compuesto de aniones que no son
precipitados por los reactivos de los grupos previos, Ellos son: nitrato NO3-, nitrito NO2-,
acetato CH3COO-, permanganato MnO4-.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 3
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
Aniones del primer grupo
Estos aniones precipitan con el Ba, el anión carbonato debe identificarse directamente
en el problema original. Esta identificación se efectúa liberando CO2 por adición de
una acido mineral y reconociendo este CO2 con agua barita.
Los aniones de este grupo se separan de los aniones de los otros grupos por
precipitación con una mezcla de acetatos de calcio y de bario. Los precipitados
obtenidos se tratan con una mezcla de carbonato e hidróxido sódicos en disolución
concentrada; de esta manera, todos los precipitados sufren una doble
descomposición, más o menos total, pero suficiente para fines cualitativos, según
reacciones del tipo siguiente, muy desplazadas a la derecha por exceso de reactivo,
esto permite obtener una disolución conteniendo las sales alcalinas de los aniones de
este grupo, exenta de ion barico y cálcico y de los aniones de otros grupos. (Burriel,
2002)
PICTOGRAMAS
Ba(OH)2
Riesgos:
Si se inhala Irritación de las mucosas, tos y dificultad para respirar.
Provoca quemaduras, aumento de la tensión sanguínea, shock y
colapso circulatorio así como rigidez muscular.
Evitar la penetración del agua de extinción en acuíferos
superficiales o subterráneos.
Precauciones:
Manejar en un ambiente con aire fresco.
Cualquier contacto con el reactivo lavar con abundante agua.
En caso de fuga recoger en seco y proceder a la eliminación de
residuos. Aclarar. Evitar la formación de polvo.
Ba(NO3)2
Riesgos:
Algunos nitratos pueden explotar cuando se someten a choque, se
exponen al calor o las llamas, o por reacción química espontánea.
Tóxico. Causa dolor abdominal, náuseas, vómitos.
Puede tener una acción tóxica acumulativa si la eliminación es más
lenta que la absorción.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 4
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
Precauciones:
En caso de contacto con la piel lave la piel afectada con abundante
agua, por lo menos durante 15 min.
Se recomienda ventilación de escape local.
Almacénese en área color amarillo (oxidantes). Mantenga el
producto en zonas ventiladas.
Zn(NO3)2
Riesgos:
Puede actuar como fuente de iniciación para las explosiones de
polvo o vapor.
En contacto con la piel provoca enrojecimiento y dolor.
Si se inhala produce tos prolongada y dolor de garganta
Precauciones:
Extracción localizada o protección respiratoria.
No poner en contacto con sustancias combustibles e incompatibles
Evitar la dispersión del polvo.
Almacenar separado de sustancias combustibles y reductoras,
mantener en lugar fresco y seco.
AgNO3
Riesgos:
Provoca quemaduras en la piel.
Irritación de las vías respiratorias, irritación de la piel,
Irritación de los ojos.
Desprende humos tóxicos de óxidos de nitrógeno
Descargas de este material pueden contaminar el ambiente.
Precauciones:
No permita que entre agua al recipiente.
Evite el contacto con un material combustible (madera, papel,
aceite, tela).
Mantenga la sustancia húmeda usando rocío de agua.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 5
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
HCl
Riesgos:
Corrosivo puede causar inflamación, enrojecimiento, dolor y
quemaduras, dependiendo de la concentración
Las exposiciones repetidas a bajas concentraciones pueden
generar coloración café y daños en el esmalte de los dientes, y
dermatitis.
Puede ser fatal si se ingiere o se inhala.
Precauciones:
contacto con metales libera hidrógeno el cual es inflamable.
Almacenar en lugares ventilados, frescos y secos, lejos de fuentes
de calor, ignición y de la acción directa de los rayos solares.
Separar de materiales incompatibles tales como agentes
oxidantes, reductores y bases fuertes.
Evitar la liberación de vapor en las áreas de trabajo.
H2O2
Riesgos:
Oxidante fuerte.
Corrosivo al contacto con otro material puede causar fuego.
Puede ser dañoso si es ingerido.
Puede causar efectos en el Sistema nervioso central,
anormalidades en la sangre, irritación severa en los tractos
respiratoria y digestiva e irritación en la piel con posibles
quemaduras.
Precauciones:
Lugares ventilados, frescos y secos, mantener lejos de fuentes de
calor, chispa e ignición separar de materiales incompatibles.
Usar respirador con filtro para vapores inorgánicos.
Estable bajo condiciones normales de presión y temperatura.
PARTE EXPERIMENTAL
Observaciones
La muestra que nos habilita en la experiencia ya está alcalina, ya que si la solución
está ácida se va a descomponer el CO2
Al agregar 5 gotas de Ba(NO3)2 la solución tiene aspecto lechosa, pasamos a
centrifugar y luego decantar.
Los precipitados del primer grupo de aniones son blanquecinos, trabajamos con la
solución incolora para hallar los aniones del segundo grupo.
Los precipitados del segundo grupo también tienen coloración blanquecina.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 6
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
Al agregar AgNO3 el precipitado del tercer grupo es blanquecino pero con el tiempo se
vuelve un poco grisáceo, esto se debe a que la plata (Ag) es fotosensible a la luz es
por ello que en un tiempo se vuelve Ag metálico a esto se debe el color grisáceo del
precipitado.
Para la primera parte de la identificación de aniones del primer grupo, notamos que si
se decolora el papel de filtro nos confirma la presencia del CO32- y la solución es
blanquecina.
Para la segunda parte agregamos HCl(ac) 6M y luego calentamos aproximadamente 1
minuto y centrifugamos, notamos un precipitado de color blanco SO42-.
Para la tercera parte después de agregar H2O2 3% y hervir por aproximadamente 5
minutos al centrifugar notamos un precipitado blanco SO32-
Para la cuarta parte después de agregar ácido nítrico y molibdato de amonio al dejar
reposar notamos q la solución se vuelve amarillenta algo tenue esto nos indica la
presencia de PO43-
Reacciones químicas y explicación
Explicación de la separación de aniones en grupos
La solución muestra está alcalina para evitar la descomposición del ión carbonato o del
ión sulfito. Una vez alcalina la solución, se adiciona gota a gota nitrato de bario para
precipitar al ión carbonato, ión sulfato, ión sulfito y al ión fosfato, que son los aniones
del 1er grupo, así:
CO32– + Ba2+ = BaCO3(s)
SO42– + Ba2+ = BaSO4(s)
SO32– + Ba2+ = BaSO3(s)
2 PO43– + 3 Ba2+ = Ba3(PO4)2(s)
Al centrifugar y decantar, a la solución obtenida se le agrega nitrato de zinc hasta
precipitación completa de los iones sulfuros, iones ferricianuros y iones ferrocianuros,
que son los aniones del 2do grupo, así:
S2– + Zn2+ = ZnS(s) de color blanco
2 Fe(CN)63– + 3 Zn2+ = Zn3[Fe(CN)6]2(s) de color amarillo
Fe(CN)64– + 2 Zn2+ = Zn2Fe(CN)6(s) de color blanco
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 7
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
Al centrifugar y decantar, a la solución obtenida se le agrega nitrato de plata hasta
precipitación completa de los iones cloruros, iones bromuros y iones yoduros, que son
los aniones del 3er Grupo, así:
Cl– + Ag+ = AgCl(s) de color blanco
Br– + Ag+ = AgBr(s) de color amarillo
I– + Ag+ = AgI(s) de color amarillo pálido
Al centrifugar y decantar, la solución contiene los aniones del 4to grupo: CH3COO–;
MnO4–; NO3–
Explicación de la separación de aniones del primer grupo
1ra Parte del precipitado.-
BaCO3; BaSO4; BaSO3; Ba3(PO4)2
Al agregar el agua oxigenada, se oxida al ión sulfito dando ión sulfato, así:
SO3(ac)2– + H2O2 = SO4(ac)2– + H2O(l)
Esto se realiza para evitar que el sulfito de bario reaccione de la misma manera que el
carbonato de bario, en este precipitado mezcla, al agregarle ácido sulfúrico, ya que daría
SO2, así:
BaSO3(ac) + 2 H(ac)+ = Ba(ac)2+ + H2O(l) + SO2(g)
y este gas, dióxido de azufre, al reaccionar con el agua daría ácido sulfuroso.
El BaCO3 precipitado reaccionará con el ácido sulfúrico, así:
H2SO4(ac) = 2 H(ac)+ + SO4(ac)2–
BaCO3(s) + 2 H(ac)+ = Ba(ac)2+ + CO2(g) + H2O(l)
La solución de carbonato de sodio humedece el papel de filtro y al adicionar unas gotas
de fenolftaleina, se torna de color rosado debido a que esta sal es básica por lo siguiente:
Na2CO3(ac) = 2 Na+(ac) + CO32–(ac)
La hidrólisis el ión carbonato: CO3(ac)2– + HOH = HCO3(ac)– + OH(ac)–
Siendo los productos de la última reacción el ión bicarbonato un ácido débil y el ión
hidroxilo una base fuerte, por lo tanto la solución mezcla será básica, que colorea de
rosado por lo tanto al papel de filtro.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 8
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
El dióxido de carbono gaseoso evolucionará hacia el papel de filtro que está de color
rosado:
CO2(g) + H2O(l) = H2CO3(ac)
Finalmente este ácido carbónico reacciona con el ión carbonato que también se halla en
el papel de filtro humedecido, dando ión bicarbonato:
H2CO3(ac) + CO32–(ac) = 2 HCO3–(ac)
Siendo éste último, el ión bicarbonato, producto de la reacción anterior, que es de
carácter acídico, hace que la fenolftaleina al cabo de un tiempo, cambie de rosada a
incolora.
2da Parte del precipitado.-
BaCO3; BaSO4; BaSO3; Ba3(PO4)2
Al agregar ácido clorhídrico y calentar lentamente por poco tiempo, se produce la
descomposición del carbonato de bario y parte del sulfito de bario, quedando en
solución los iones sulfito, los iones fosfato y los iones bario.
Al agregar agua oxigenada, se produce la oxidación del ión sulfito a sulfato, éste último
con el ión bario, se produce sulfato de bario precipitado:
SO4(ac)2– + Ba(ac)2+ = BaSO4(s) que es de color blanco, dejando sólo a los iones
fosfato.
A la solución que contiene el ión fosfato se le acidifica con ácido nítrico, para luego
adicionarle molibdato de amonio que dará:
PO4(ac)3– + 3 H(ac)+ = H3PO4(ac)
H3PO4(ac) + 12 MoO4(ac)2– + 21 H(ac)+ + 3 NH4(ac)+ = (NH4)3PO4.12 MoO3(s) + 12
H2O(l)
El precipitado obtenido es de color amarillo, que nos indica la presencia del ión fosfato.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 9
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
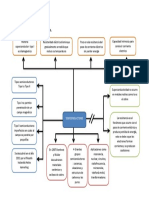
DIAGRAMA DE PROCESO
SOLUCIÓN MUESTRA : 1 mL
Si la solución muestra es ácida o neu-
tra, agregar gotas de Ba(OH)2 satura-
da para alcalinizarla.(Omita este paso
si la muestra es alcalina). Agregar
gota a gota Ba(NO3)2 saturada hasta
una completa precipitación. Centrifu-
gar y decantar
PRECIPITADO SOLUCIÓN [Aniones 2do, 3ro y 4to grupos]
Aniones del 1er grupo Agregar gotas de Zn(NO3)2 1M, hasta precipi-
[BaCO3; BaSO4; BaSO3; Ba3(PO4)2] tación completa. Centrifugar y decantar
PRECIPITADO SOLUCIÓN [Aniones 3ro y 4to grupos]
Aniones del 2do grupo Agregar unas gotas de AgNO3 0,1M hasta
[ZnS; Zn2Fe(CN)6; Zn3[Fe(CN)6] 2] precipitación completa. Centrifugar y decantar
PRECIPITADO SOLUCIÓN
Aniones del 3er grupo Aniones del 4to grupo
[AgCl; AgBr; AgI] [CH3COO–; MnO4–; NO3–]
Nota.- La determinación del ión nitrato debe realizarse en una porción de la muestra
original.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 10
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
SOLUCIÓN MUESTRA : 1 mL
Si la solución muestra es ácida o neutra agre-
gar gotas de Ba(OH)2 saturada para alcalini-
zarla(omita este paso si la muestra es alcalina).
Agregar gota a gota Ba(NO3)2 saturada hasta
precipitación completa. Centrifugar y decantar
PRECIPITADO SOLUCIÓN
Aniones del 1er grupo Aniones 2do, 3ro y 4to grupos
[BaCO3; BaSO4; BaSO3; Ba3(PO4)2]
Lavar con agua. Dividir el
precipitado en dos partes
1ra parte del precipitado 2da parte del precipitado
Agregar 5 gotas de H2O2 al 3%. Hume- Agregar1mL de HCl 6N y calentar lenta-
decer un papel de filtro (cuadrado) mente con agitación durante 1 minuto,
con la mezcla rosada de Na2CO3 0,5M centrifugar y decantar.
y 1 gota de fenolftaleina. Agregar lue-
go a la solución problema, 5 gotas de
H2SO4 2N teniendo cuidado de no
tocar la boca del tubo de ensayo con
este ácido y tapar de inmediato con
el papel de filtro la boca del tubo de
ensayo, observar al cabo de un tiempo,
decoloración confirma la presencia de
CO32–.
PRECIPITADO [BaSO4] SOLUCIÓN [SO32–;PO43–]
Color blanco, que confirma la Agregar 5 gotas de H2O2 al 3%, hervir centri-
presencia de SO42– fugar y decantar
PRECIPITADO [BaSO4] SOLUCIÓN [PO43–]
Color blanco, que confirma la Acidificar con HNO3 6N y agregar 3 gotas más
presencia de SO32– en exceso. Agregar 5 gotas de una solución
de (NH4)2MoO4, molibdato de amonio 1N,
calentar lentamente, agitar y luego déjese
reposar varios minutos. La presencia de un
precipitado amarillo confirma el PO43–.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 11
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
CONCLUSIONES
Para la identificación de los aniones del tercer grupo, el precipitado debería de ser de
color blanco sin embargo como la plata reacciona con la luz de Ag+ reduciéndose a
Ag(S) se torna de un color grisáceo.
El carbonato se identifica por la liberación de CO2(g) que al mezclarse con el agua del
papel filtro forma ácido carbónico que decolora el papel filtro.
El fosfato se identifica por la formación de un precipitado amarillo que es el
fosfomolibdato amónico (NH4)3PO4.12 MoO3(s).
La presencia del sulfato (𝑆𝑂42− ) se comprueba por la formación de un precipitado
blanco (𝐵𝑎𝑆𝑂4(𝑎𝑐) ) en medio ácido.
El sulfito se identifica por la formación del precipitado blanco 𝐵𝑎𝑆𝑂3(𝑠) .
RECOMENDACIONES
Organizar adecuadamente al equipo de trabajo para que la práctica se realice de manera
rápida, ordenada, precisa y eficiente.
Realizar la práctica de acuerdo a las indicaciones del docente a cargo y de acuerdo a la guía de
práctica para evitar una mala toma de datos o accidentes en el laboratorio.
Evitar el contacto directo con los reactivos ya que pueden causar irritaciones en la piel.
Al finalizar la práctica, dejar los materiales limpios y los reactivos ordenados.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 12
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
REFERENCIAS BIBLIOGRAFICAS
Libros:
Morales C. (2003).Guía de laboratorio de análisis químico cualitativo. Perú.
Arthur I. Vogel (1983), Química Analítica Cualitativa, Sexta edición, Buenos Aires, Ed.
Kapelusz, pag. 352-364.
Web:
La guía de la Química. Obtención del sodio. Recuperado de:
http://quimica.laguia2000.com/reacciones-quimicas/obtencion-del-
sodio#ixzz3aQWTR3cq
Lenntech (2015). Propiedades químicas del Magnesio. Recuperado de:
http://www.lenntech.es/periodica/elementos/mg.htm#ixzz3aQPHwccZ
Lenntech (2015). Propiedades químicas del Calcio. Recuperado de:
http://www.lenntech.es/periodica/elementos/ca.htm
Pino, F. (2003). Características del sodio. Recuperado de:
http://curiosidades.batanga.com/4410/caracteristicas-del-sodio
Profesor en línea (2001). Principales características del potasio. Recuperado de:
http://www.profesorenlinea.cl/Quimica/Potasio.htm
Sodio. Recuperado de:
http://herramientas.educa.madrid.org/tabla/6usos/na6.html
Universidad de oriente núcleo de Bolivia (2009). Marcha analítica de cationes.
Recuperado de:
https://es.scribd.com/doc/58926723/MARCHA-ANALITICA-DE-CATIONES
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 13
Universidad Nacional de Ingeniería
Facultad de Ingeniería Química y Textil
Aplicación:
ANALISIS DE AGUAS
En el tratamiento de aguas, los cloruros, fosfatos y nitritos son indicadores típicos de
contaminación residual doméstica. El ion cloro es altamente corrosivo y da lugar a
deterioros en las tuberías y sistemas de distribución de aguas.
Los sulfatos en altos contenidos generan la sal de CANDLOT-MICHAELIS conocida
como (Cáncer del cemento) y que destruye el hormigón. También se comprobó que
aguas con alto contenido de fluoruro generan problemas renales y descalcificación de
los huesos; por secuestra del calcio por el fluoruro dentro del organismo.
La identificación de aniones nos sirve para prevenir posibles riesgos por el alto
contenido de estos en aguas de posible consumo.
Laboratorio Nº 7 “Separación de los cationes del quinto grupo” Página 14
You might also like
- Balance de Materia OUDocument33 pagesBalance de Materia OUAlberto Rodriguez Perez0% (2)
- Sintesis de Compuestos InorganicosDocument16 pagesSintesis de Compuestos InorganicosChristian Obispo100% (1)
- Bosque Seco y Cambio ClimaticoDocument8 pagesBosque Seco y Cambio ClimaticoSandra SanchezNo ratings yet
- METODO DE CUADRICULA PresentacionDocument16 pagesMETODO DE CUADRICULA PresentacionLina Marcela Manjarrez Gallon100% (1)
- Informe de Curva de NivelDocument5 pagesInforme de Curva de NivelGuillermo JoseNo ratings yet
- Estudio Topografico Huaquirca - AntillaDocument14 pagesEstudio Topografico Huaquirca - AntillaAbel Salazar HuachuñahuinllaNo ratings yet
- Universidad Nacional Agraria de La SelvaDocument11 pagesUniversidad Nacional Agraria de La Selvasantiago pardo mesiasNo ratings yet
- Examen SustitutorioDocument1 pageExamen SustitutorioMilton Aycho100% (1)
- Cinta y Jalon 01Document17 pagesCinta y Jalon 01Marco Antonio Torrez TarifaNo ratings yet
- Coordenadas GeográficasDocument8 pagesCoordenadas GeográficasChristian QueuñaNo ratings yet
- Informe de PhotenotDocument10 pagesInforme de Photenotmarlon diaz cullaNo ratings yet
- Altimetria Con Teodolito PDFDocument16 pagesAltimetria Con Teodolito PDFleylaNo ratings yet
- Fundamento Conceptual Mediciones Directas e Indirectas 1 PDFDocument3 pagesFundamento Conceptual Mediciones Directas e Indirectas 1 PDFcatty2tatiana2ortiz2No ratings yet
- Instrumentos de TopografiaDocument38 pagesInstrumentos de TopografiaLeticia Ala VeraNo ratings yet
- TaquimetriaDocument14 pagesTaquimetriaBriggitte Stefany TarrilloNo ratings yet
- 01 Valor Economico de La BiodiversidadDocument4 pages01 Valor Economico de La BiodiversidadJair Mer FueNo ratings yet
- Cuáles Son Las Líneas Imaginarias de La Tierra y para Qué SirvenDocument2 pagesCuáles Son Las Líneas Imaginarias de La Tierra y para Qué SirvenbizfranNo ratings yet
- Informe 010Document6 pagesInforme 010Christian MaytaNo ratings yet
- Informe Radiacion SimpleDocument13 pagesInforme Radiacion SimpleMatthew DavidNo ratings yet
- JacarandaDocument5 pagesJacarandadafer_daniNo ratings yet
- Quimica Ars PresentableDocument21 pagesQuimica Ars PresentableEnmer Brañes100% (1)
- 2 Sistema de CoordenadasDocument4 pages2 Sistema de CoordenadasSebastián Alexis Pizarro MejiasNo ratings yet
- Glosario de TopografíaDocument15 pagesGlosario de TopografíaAlejandra Hernández AranyaNo ratings yet
- Geometría AnalíticaDocument31 pagesGeometría AnalíticafernandoNo ratings yet
- Sistema de Coordenada en TopografiaDocument32 pagesSistema de Coordenada en TopografiaLiz Romina Sosa GaleanoNo ratings yet
- Reconocimiento de Equipos TopográficosDocument18 pagesReconocimiento de Equipos TopográficosChristhopher Criollo OrtizNo ratings yet
- Bongara Descrip DefDocument78 pagesBongara Descrip DefDiego PlasenciaNo ratings yet
- AgricolaDocument5 pagesAgricolaMaria Lena ARUQUIPA GUARACHINo ratings yet
- Argumentos VálidosDocument33 pagesArgumentos VálidosBerman LiraNo ratings yet
- Trabajo Final TopografiaDocument16 pagesTrabajo Final TopografiaFranklin Alejandro Rueda VargasNo ratings yet
- Levantamiento Con Wincha y Jalones PDFDocument17 pagesLevantamiento Con Wincha y Jalones PDFTR DanieleNo ratings yet
- Caratula UncpDocument12 pagesCaratula UncpAdrian C LermoNo ratings yet
- Levantamiento Topografico - Poligonal Cerrada - ERERDocument21 pagesLevantamiento Topografico - Poligonal Cerrada - ERERTefy ReyesNo ratings yet
- Metodo Cuadricula PDFDocument6 pagesMetodo Cuadricula PDFGabriel RamosNo ratings yet
- Chiapas y Sus Recursos NaturalesDocument4 pagesChiapas y Sus Recursos NaturalesIsai Fraga0% (1)
- Levantamiento Con TeodolitoDocument8 pagesLevantamiento Con TeodolitoTejada A JhonatanNo ratings yet
- Caracterización Edafoclimática de La Microcuenca Bella-ExpoDocument45 pagesCaracterización Edafoclimática de La Microcuenca Bella-Expogianella jhadeNo ratings yet
- Introduccion Topografia - 2020Document10 pagesIntroduccion Topografia - 2020Gabriela Vasquez Vargas MachucaNo ratings yet
- Trabajo Completo de CristalografiaDocument13 pagesTrabajo Completo de CristalografiaDiorki ReateguiNo ratings yet
- Practica03 Grupo08 HuamánDocument27 pagesPractica03 Grupo08 HuamánHenderson Achic RemigioNo ratings yet
- Finalizar CV - Mi CV IdealDocument1 pageFinalizar CV - Mi CV IdealMarlon Rivera Jr.No ratings yet
- TOPOGRAFÍA PARA INGENIERÍA Minera PDFDocument162 pagesTOPOGRAFÍA PARA INGENIERÍA Minera PDFDavid RuizNo ratings yet
- Informe Topografico Radiacion SimpleDocument12 pagesInforme Topografico Radiacion Simpleerick sebastian vargas arango100% (1)
- Informe Perfil LongitudinalDocument8 pagesInforme Perfil LongitudinalCarlistos CarlitosNo ratings yet
- Nivel TopoDocument26 pagesNivel TopoAlexandra TrujilloNo ratings yet
- Método KrigingDocument5 pagesMétodo Krigingjoseph rodriguezNo ratings yet
- Sesion #07Document33 pagesSesion #07Roberto Bocanegra GarcíaNo ratings yet
- Topografia Minera Informe 1Document34 pagesTopografia Minera Informe 1Jorge Enrique Marin GonzalesNo ratings yet
- Universidad Nacional Agraria de La SelvaDocument3 pagesUniversidad Nacional Agraria de La SelvaCurilla Sosa CsaNo ratings yet
- 11 - Tratamiento Magnético Como Tecnica de Estimulante de Germinacion de Semillas de SojaDocument11 pages11 - Tratamiento Magnético Como Tecnica de Estimulante de Germinacion de Semillas de SojaNiyireth AriasNo ratings yet
- Solucionario TopografiaDocument4 pagesSolucionario TopografiaDIAZ CUBA ROGER JEANPOOL100% (1)
- Tipos y Metodos de NivelacionDocument30 pagesTipos y Metodos de NivelacioncristianNo ratings yet
- Segundo Examen Parcial TopografiaDocument1 pageSegundo Examen Parcial TopografiaDanielMendozaNarvaezNo ratings yet
- Geometria DescriptivaDocument6 pagesGeometria DescriptivaMarco MinayaNo ratings yet
- TopografiaDocument21 pagesTopografiaKarina DuarteNo ratings yet
- Topografía - ResumenDocument8 pagesTopografía - ResumenJosé Luís LeguizamónNo ratings yet
- Manual de TopografiaDocument30 pagesManual de TopografiaAlan Tapia VillaranNo ratings yet
- Labo N2 Separacion de Cationes en GruposDocument16 pagesLabo N2 Separacion de Cationes en GruposMiguelNo ratings yet
- 6 Info Lab de CualiDocument13 pages6 Info Lab de CualiKellyNo ratings yet
- 3 Info Cationes Segundo Grupo y Solucion ADocument22 pages3 Info Cationes Segundo Grupo y Solucion AKellyNo ratings yet
- Cuali Labo 7Document12 pagesCuali Labo 7Nelsi Paredes CalderónNo ratings yet
- Ficha Tecnica Del Niytrato de Plata CompletoDocument7 pagesFicha Tecnica Del Niytrato de Plata Completoat6210768No ratings yet
- P2 Leche y Derivados LácteosDocument16 pagesP2 Leche y Derivados LácteosYelts JanampaNo ratings yet
- Taller McdonaldDocument5 pagesTaller McdonaldYelts JanampaNo ratings yet
- Tamaño de La Bola en La Carga InicialDocument4 pagesTamaño de La Bola en La Carga InicialYelts JanampaNo ratings yet
- Laboratorio de Quimica OrganicaDocument13 pagesLaboratorio de Quimica OrganicaYelts JanampaNo ratings yet
- Parametros de Caracterizacion de Agua ResidualesDocument4 pagesParametros de Caracterizacion de Agua ResidualesYelts JanampaNo ratings yet
- Informe de Quimica Organica IIDocument20 pagesInforme de Quimica Organica IIYelts JanampaNo ratings yet
- Monografia Efectos Del Aire en Transitorios HidráulicosDocument18 pagesMonografia Efectos Del Aire en Transitorios HidráulicosYelts JanampaNo ratings yet
- CasiteritaDocument4 pagesCasiteritaYelts JanampaNo ratings yet
- Dimerización Del IsobutilenoDocument11 pagesDimerización Del IsobutilenoYelts JanampaNo ratings yet
- Reacciones Labo de Cuali Separacion de CationesDocument5 pagesReacciones Labo de Cuali Separacion de CationesYelts JanampaNo ratings yet
- Determinación Del Óxido de Calcio en El Carbonato de CalcioDocument12 pagesDeterminación Del Óxido de Calcio en El Carbonato de CalcioYelts JanampaNo ratings yet
- El GalioDocument14 pagesEl GalioYelts JanampaNo ratings yet
- Investigacion Del GalioDocument17 pagesInvestigacion Del GalioYelts JanampaNo ratings yet
- DeberDocument6 pagesDeberIbeth CajoNo ratings yet
- ADSORCIONDocument20 pagesADSORCIONBarrios Ibarra ElioNo ratings yet
- Como Hacer MMSDocument3 pagesComo Hacer MMSAldo OlivaNo ratings yet
- Qué Es Nomenclatura QuímicaDocument5 pagesQué Es Nomenclatura QuímicaFranklin Santiago SebastianNo ratings yet
- Ensayos No DestructivosDocument27 pagesEnsayos No DestructivosJuan Ferney Teran PuertaNo ratings yet
- Tarea 3 Ejercicio 3 - Nicolas Alvarez Diagrama MentefactoDocument1 pageTarea 3 Ejercicio 3 - Nicolas Alvarez Diagrama MentefactoDiasarmaNo ratings yet
- Diseño y Calificación de Un WPS, PQR y WPQ de Soldadura Según Norma Api 1104 para La Estación de Recolección Campo Escuela Colorado.Document80 pagesDiseño y Calificación de Un WPS, PQR y WPQ de Soldadura Según Norma Api 1104 para La Estación de Recolección Campo Escuela Colorado.kevinNo ratings yet
- CEYEDocument6 pagesCEYEEDITH ESMERALDA JIMENEZ VAZQUEZ100% (2)
- Laboratorio 333Document55 pagesLaboratorio 333Candy Chaca MonagoNo ratings yet
- Marco Teorico Conveccion Natural y Conveccion ForzadaDocument9 pagesMarco Teorico Conveccion Natural y Conveccion ForzadaDiego Muñoz100% (1)
- 153 496 1 SM PDFDocument10 pages153 496 1 SM PDFNathali ManayayNo ratings yet
- Cuestionario Previo 5Document5 pagesCuestionario Previo 5Elias Cruz JimenezNo ratings yet
- Catalogo de Colores 2020Document10 pagesCatalogo de Colores 2020Aída SiuNo ratings yet
- Aditivos de Alimentos - TransgenicosDocument72 pagesAditivos de Alimentos - TransgenicosExtra Plus OrdinaryNo ratings yet
- Examen FinalDocument6 pagesExamen FinalJesus Alvarez BravoNo ratings yet
- Eett Alcantarillado Sanitario 1438270809566Document59 pagesEett Alcantarillado Sanitario 1438270809566Roowsber Pompa CalderonNo ratings yet
- Informe de Biología 2Document13 pagesInforme de Biología 2Luis AvilaNo ratings yet
- 196-Texto Del Artículo-408-1-10-20180527Document6 pages196-Texto Del Artículo-408-1-10-20180527JeissonNo ratings yet
- Marco Teorico (Máquinas Eléctricas)Document4 pagesMarco Teorico (Máquinas Eléctricas)Julio Montilla CanoNo ratings yet
- Reporte 1 - Introduccion Al LaboratorioDocument6 pagesReporte 1 - Introduccion Al LaboratorioFranyel Perez MendezNo ratings yet
- PracticaDocument4 pagesPracticacarlos100% (1)
- Titulación Con IndicadorDocument22 pagesTitulación Con IndicadorDíaz Gutierrez AranzaNo ratings yet
- 5Document2 pages5Nelson Balvin HenaoNo ratings yet
- Triptico Clase3 Ismael MadrilDocument2 pagesTriptico Clase3 Ismael Madrilismael madridNo ratings yet
- Lípidos-2004-H-Protocolo para La Estandarización de La Fase Preanalítica en La Medición de Lípidos y LipoproteínasDocument4 pagesLípidos-2004-H-Protocolo para La Estandarización de La Fase Preanalítica en La Medición de Lípidos y LipoproteínasDavid AG100% (1)
- Informe 4 Laboratorio QuímicaDocument7 pagesInforme 4 Laboratorio Químicacesar HBNo ratings yet
- Cómo Funcionan Los AntiespumantesDocument2 pagesCómo Funcionan Los AntiespumantesAndres RodriguezNo ratings yet