Professional Documents
Culture Documents
QUIMICA
Uploaded by
carlosOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
QUIMICA
Uploaded by
carlosCopyright:
Available Formats
EXAME ÉPOCA NORMAL
QUÍMICA ANALÍTICA
2018
Escolhas múltiplas:
- A Química Analítica é uma ciência:
a) capaz de melhorar métodos analíticos já estabelecidos;
b) que aplica métodos conhecidos a novas amostras;
c) que desenvolve métodos analíticos entre outros;
d) A e B estão corretas;
e) Todas as afirmações estão corretas
-Quando falamos de complexometria:
a) a forma desprotonada de EDTA produz complexos mais estáveis;
b) podemos dizer que ligandos monodentados são mais eficazes;
c) o Zn2+ é um dos ligandos bidentados mais usuais;
d) o EDTA tem constante de formação baixa;
-(Não me lembro do enunciado):
a) quando temos adição de 2 reações, a constante de equilíbrio que resulta é a multiplicação
das 2;
b) quanto mais forte um ácido, mais forte a base conjugada
c) quando se sabe o valor de Ka, podemos saber Kb
-Algarismos significativos em que se falava sobre 0 à esquerda, à direita e 0 separados por um
separador decimal;
- 4 escolhas múltiplas sobre gravimetria e outra sobre volumetria redox;
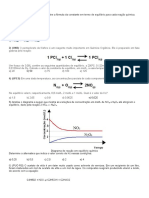
-variação do equilíbrio químico e da constante com a temperatura, pressão e outros
-Escolha múltipla referente ao ácido e base mais forte em solução (h3o+ e ho- respetivamente)
-Escolha múltipla com conceitos de titulação por retorno, por deslocamento e por
mascaramento
-Escolha múltipla em que a primeira alínea era sobre o permanganato não precisar de
indicador por perder a cor violeta ao reduzir-se e outra alínea era sobre a iodometria e
iodimetria
-utilização de pré redutores e pós-oxidantes (o certo era pré oxidantes), sobre o Cério precisar
de indicador e a sua titulação só poder ser feita com pH maior do que 1
- Quem era a Maria José Pereira
-(Não me lembro do enunciado):
a) Quando a eletronegatividade é igual, quanto maior é o n de oxidação maior a força do acido
b) o ácido perclórico é mais fraco que o clórico (acho)
c) igual n de oxidação, quanto maior a eletronegatividade maior a força do ácido
- Calcular o potencial de redução de uma pilha de Cu e Zn em concentração 1,0M e davam os
potenciais de redução;
-Exemplos de métodos instrumentais de análise;
-Relacionar eletronegatividade oxidação e oxiácidos;
Exercícios de “desenvolvimento” (2 valores cada)
1) Em que medida a Coca cola e a Pepsi atuam como medicamentos para o estômago?
2) Cálculo da concentração de um ácido concentrado?
Não me recordo dos valores mas é do género: exs. 5 e 6 da Folha 1, ex. 1 Folha 2:
F1 - 5. Uma solução de ácido perclórico foi preparada com 10,00 mL de ácido
concentrado (60%, δ = 1,53) em 500,0 mL de solução. Calcule a concentração do
ácido original e a da solução diluída.
F1 - 6. Como prepararia 250 mL de ácido clorídrico 1 M partindo de ácido
clorídrico concentrado (37% e δ = 1,19)?
F2 – 1. Uma solução concentrada de amónia (28,0% (p/p) NH3) tem massa
específica 0,899 g/mL. Qual é a concentração molar de NH3 nesta solução?
3) Calcule o pH de uma solução aquosa de NaOH 5 × 10-8.
Não tenho a certeza quanto aos dados, mas é um exercício no qual não se pode
desprezar a dissociação da água, tal como ex. 5 b) da folha 5:
5.1. Calcule o pH das seguintes soluções:
(b) 5 × 10-8 M em HCl;
4) … fizeram-se duas tomas de 25 mL para teste. Num primeiro teste, gastaram-se 2.9mL
de AgNO3 e na segunda 3.0mL cuja concentração era 0.02M . Exprima o teor do
cloretião em mg/mL.
5) Qual a solubilidade de cloreto de prata no soro que possui naturalmente NaCl
dissolvido - 0.09% de na cl…
Exercício do género: ex. 8.3. da folha 8:
8.3. Sabendo que a concentração de cloretião na água do mar é de 18,980 ‰
calcule a solubilidade de cloreto de prata em água do mar?
Cl = 35,453
Kps[AgCl] = 1,7 x 10-10
You might also like
- Apostila Química Orgânica: Carbono, Dienos E AromáticosFrom EverandApostila Química Orgânica: Carbono, Dienos E AromáticosNo ratings yet
- Quimica AnaliicaDocument8 pagesQuimica AnaliicaCamila MoreiraNo ratings yet
- Equilc3adbrio Ic3b4nicoDocument3 pagesEquilc3adbrio Ic3b4nicoromansara966No ratings yet
- Af Eq2021Document3 pagesAf Eq2021pedro.studart82No ratings yet
- Lista Sobre Equilíbrio Químico Química Geral PresençaDocument4 pagesLista Sobre Equilíbrio Químico Química Geral PresençaAriélly RolimNo ratings yet
- Revisão Qa313Document8 pagesRevisão Qa313Luis FelipeNo ratings yet
- Docs6b25u0grnk4ti3ev - Pdfresponse Content Disposition Attachment3b20fDocument6 pagesDocs6b25u0grnk4ti3ev - Pdfresponse Content Disposition Attachment3b20fVera Alexa 18310No ratings yet
- Prova 2 Analítica 1 2021 1Document3 pagesProva 2 Analítica 1 2021 1Italo MarquesNo ratings yet
- 5° Lista. Unidades 7 e 8. Eng, 2017. Final PDFDocument3 pages5° Lista. Unidades 7 e 8. Eng, 2017. Final PDFkaymenezes0% (1)
- APSA 21 - Acido Base - Titulações PDFDocument5 pagesAPSA 21 - Acido Base - Titulações PDFalmeida.agostinho8406No ratings yet
- Prova de Quã - Mica Iv BimestreDocument3 pagesProva de Quã - Mica Iv BimestreliineesoouzaaNo ratings yet
- 2º Lista de Exercícios - Quimica InorganicaDocument3 pages2º Lista de Exercícios - Quimica InorganicaliviacerbinoNo ratings yet
- 1a Lista de Exercícios QUI126 Oficial 2Document5 pages1a Lista de Exercícios QUI126 Oficial 2Eugenio ManuelNo ratings yet
- Lista Revisão PO 2oano - 2osemestreDocument10 pagesLista Revisão PO 2oano - 2osemestremauoscuroNo ratings yet
- Prova 2010.1 OkDocument2 pagesProva 2010.1 OkISRAEL DA LUZ RODRIGUESNo ratings yet
- Teste 3 - CeppeaDocument4 pagesTeste 3 - CeppeaMartins AiupaNo ratings yet
- Quest 07 - Revisão - GabDocument8 pagesQuest 07 - Revisão - GabmisaelinacioNo ratings yet
- Avaliacao de ConhecimentosDocument10 pagesAvaliacao de ConhecimentosMatheus CamachoNo ratings yet
- Lista AvaliativaDocument3 pagesLista AvaliativaEsthefany limaNo ratings yet
- 6 ESA Lista de Exercícios F - VolumetriaDocument3 pages6 ESA Lista de Exercícios F - Volumetriawalllll4564637468No ratings yet
- Lista de Exercícios Geral Química AnalíticaDocument6 pagesLista de Exercícios Geral Química AnalíticamarinsxpNo ratings yet
- Análise QualitativaDocument4 pagesAnálise QualitativaLUCIANENo ratings yet
- 7 Lista - Equilíbrio IônicoDocument2 pages7 Lista - Equilíbrio IônicoClertan Souza Martins de PaulaNo ratings yet
- Lista 05 PDFDocument5 pagesLista 05 PDFIlzonRamosNo ratings yet
- Avaliacao Parcial Sobre Efeitos Coligativos 2018Document17 pagesAvaliacao Parcial Sobre Efeitos Coligativos 2018Clebson RamosNo ratings yet
- Aula Titulometria 2022Document31 pagesAula Titulometria 2022Severino HortencioNo ratings yet
- 2o TRABALHO Ácidos e Bases e Eletroquímica - 2021Document2 pages2o TRABALHO Ácidos e Bases e Eletroquímica - 2021Gerald RodriguesNo ratings yet
- Ficha Acido BaseDocument4 pagesFicha Acido Basejoao sequeiraNo ratings yet
- Quimica 1Document4 pagesQuimica 1eusebiawatalaNo ratings yet
- Estudo Dirigido 1Document2 pagesEstudo Dirigido 1zeqs9No ratings yet
- Lista de Complexaçãoequilibrio e TitulaçãoDocument5 pagesLista de Complexaçãoequilibrio e TitulaçãoOrleans GlinstonNo ratings yet
- Analise Titrimetrica e Espctroscopia MolecularDocument2 pagesAnalise Titrimetrica e Espctroscopia MolecularSandra SilvaNo ratings yet
- Prova 2017.1Document2 pagesProva 2017.1ISRAEL DA LUZ RODRIGUESNo ratings yet
- 1 Lista Exercicios Quantitativa 2013Document4 pages1 Lista Exercicios Quantitativa 2013Emanuele Dal Pisol SchwabNo ratings yet
- EXERCÍCIOS QuantiDocument3 pagesEXERCÍCIOS QuantiLaysla BarbosaNo ratings yet
- fq8 BQ 00002 81088 85173Document6 pagesfq8 BQ 00002 81088 85173RaquelNo ratings yet
- Atividade de Química AnalíticaDocument3 pagesAtividade de Química AnalíticastehzilligNo ratings yet
- Aprofundamento-química-Mistura de Soluções Com Reação Química e Titulação-05-07-2022Document12 pagesAprofundamento-química-Mistura de Soluções Com Reação Química e Titulação-05-07-2022Sr. OrthusNo ratings yet
- Química Geral e Inorgânica I UEM - Fac. Ciências - Depto de QuímicaDocument7 pagesQuímica Geral e Inorgânica I UEM - Fac. Ciências - Depto de QuímicaGeremias Armindo ArmindoNo ratings yet
- Teste 2 8 Ano Reacoes QuimicasDocument4 pagesTeste 2 8 Ano Reacoes QuimicasMena DamilNo ratings yet
- Teste 4Document4 pagesTeste 4Martins AiupaNo ratings yet
- Ficha Trabalho Ácido-BaseDocument2 pagesFicha Trabalho Ácido-BasecristinajlopesNo ratings yet
- 21.2.lista de Atividades - Equilibrio QuimicoDocument5 pages21.2.lista de Atividades - Equilibrio QuimicoJulia CoutoNo ratings yet
- Prova de Quimica 3Document3 pagesProva de Quimica 3Enzo VasconcelosNo ratings yet
- Lista de Exercicios No 1 QADocument7 pagesLista de Exercicios No 1 QAVictor MartinsNo ratings yet
- 3 ProvaDocument13 pages3 Provalaura rojasNo ratings yet
- Exercícios de QuímicaDocument10 pagesExercícios de QuímicaBelsia AlmeidaNo ratings yet
- Quim Anl Rel.2 Preparação e Padronização de Soluções, e Volumetria Ácido BaseDocument9 pagesQuim Anl Rel.2 Preparação e Padronização de Soluções, e Volumetria Ácido BaseitodigoNo ratings yet
- Ficha Trabalho - UFCD6Document2 pagesFicha Trabalho - UFCD6cristinajlopesNo ratings yet
- Anapaulacosta-4 Lista de Volumetria de PrecipitaçãoDocument1 pageAnapaulacosta-4 Lista de Volumetria de PrecipitaçãorejaneNo ratings yet
- Exercícios Da Componente Laboratorial de Química 11º AnoDocument10 pagesExercícios Da Componente Laboratorial de Química 11º Anosofia martinsNo ratings yet
- Lista2-Eletrólitos EquilíbrioSólidoLíquidoDocument3 pagesLista2-Eletrólitos EquilíbrioSólidoLíquidoGabriela BuenoNo ratings yet
- 2 A Lista de Exerccios Qumica Analtica Clssica PDFDocument3 pages2 A Lista de Exerccios Qumica Analtica Clssica PDFAna MyrtaNo ratings yet
- 1º-Testelic ADocument5 pages1º-Testelic ARicardo MagalhãesNo ratings yet
- 1bi em 2serie Quimica ProfessorDocument15 pages1bi em 2serie Quimica ProfessorLucas PortilhoNo ratings yet
- Avaliação Individual 1 e 2 - Quimica Analitica QuantitativaDocument12 pagesAvaliação Individual 1 e 2 - Quimica Analitica QuantitativaEAD - Apoio Curso de Química100% (7)
- Exames de Ensino Médio (Química) : Gazeta de FísicaDocument2 pagesExames de Ensino Médio (Química) : Gazeta de Física331rogermannNo ratings yet
- 1a Lista - Equilibrio Quimico Homogeneo-HeterogeneoDocument4 pages1a Lista - Equilibrio Quimico Homogeneo-HeterogeneoOlympio Neto100% (1)
- Exercicios Análise InstrumentalDocument15 pagesExercicios Análise Instrumentalisma_jrNo ratings yet
- Prova Mestrado IQ Unicamp 2011-2sDocument7 pagesProva Mestrado IQ Unicamp 2011-2srennan_ps49950% (2)
- QuimicaDocument1 pageQuimicacarlosNo ratings yet
- Métodos AnáliseDocument8 pagesMétodos AnálisecarlosNo ratings yet
- QA - TP - Solubilidade e Gravimetria - Folha de Exercícios #8Document1 pageQA - TP - Solubilidade e Gravimetria - Folha de Exercícios #8carlosNo ratings yet
- Quantificação EnzimasDocument2 pagesQuantificação EnzimascarlosNo ratings yet
- Exercicios Exames 16 17Document6 pagesExercicios Exames 16 17carlosNo ratings yet
- Perguntas de Biologia CelularDocument8 pagesPerguntas de Biologia Celularcarlos100% (2)
- A VírgulaDocument3 pagesA Vírgulacarlos50% (2)
- Descartes - Ppt7Document21 pagesDescartes - Ppt7carlosNo ratings yet
- CelulaDocument21 pagesCelulacarlosNo ratings yet
- Formulário GDocument1 pageFormulário GcarlosNo ratings yet
- Março 10.º AnoDocument6 pagesMarço 10.º AnoRita Alexandra NeryNo ratings yet
- Poliedros e Sólidos PlatónicosDocument4 pagesPoliedros e Sólidos PlatónicoscarlosNo ratings yet
- Historia Da FarmaciaDocument3 pagesHistoria Da FarmaciacarlosNo ratings yet
- O Essencial Dos Heterónimos-Caeiro e ReisDocument1 pageO Essencial Dos Heterónimos-Caeiro e ReiscarlosNo ratings yet
- O Fingimento ArtísticoDocument2 pagesO Fingimento ArtísticocarlosNo ratings yet
- Grupo II OrpheuDocument3 pagesGrupo II OrpheucarlosNo ratings yet
- Grupo II OrpheuDocument3 pagesGrupo II OrpheucarlosNo ratings yet
- Ó Sino Da Minha AldeiaDocument2 pagesÓ Sino Da Minha AldeiacarlosNo ratings yet
- Formulário GDocument1 pageFormulário GcarlosNo ratings yet
- Os Maias Resumo Detalhado Por CapitulosDocument22 pagesOs Maias Resumo Detalhado Por CapitulosVera Alves58% (12)
- A VírgulaDocument3 pagesA Vírgulacarlos50% (2)
- EX Port639 F2 2016 V2 Net PDFDocument8 pagesEX Port639 F2 2016 V2 Net PDF10bNo ratings yet
- 11º Capít. 4. Arg. e Lógica Informal-50 L.Document37 pages11º Capít. 4. Arg. e Lógica Informal-50 L.carlos100% (1)
- Tipos de ConhecimentoDocument6 pagesTipos de Conhecimentocarlos100% (1)
- Plnos No Espaço PDFDocument1 pagePlnos No Espaço PDFcarlosNo ratings yet
- Michel TournierDocument1 pageMichel TourniercarlosNo ratings yet
- Maias Breve AnaliseDocument12 pagesMaias Breve AnalisecarlosNo ratings yet
- Estrutura Do Ato de ConhecerDocument15 pagesEstrutura Do Ato de ConhecercarlosNo ratings yet
- Procedimento Modelo Petrobras Jan 05Document6 pagesProcedimento Modelo Petrobras Jan 05orea1No ratings yet
- 3 Ano TesteDocument7 pages3 Ano TesteLeidiane SouzaNo ratings yet
- T1-22-Pesquisa Da Influência Do PH, Temperatura e Tempo No Alvejamento Com Hipoclorito de SódioDocument7 pagesT1-22-Pesquisa Da Influência Do PH, Temperatura e Tempo No Alvejamento Com Hipoclorito de SódioRasiah LadchumananandasivamNo ratings yet
- Alcool PolivinílicoDocument8 pagesAlcool PolivinílicoPatric Stella SanchesNo ratings yet
- Descontinuidades em Peças ForjadasDocument2 pagesDescontinuidades em Peças ForjadasFernando AsthNo ratings yet
- Carbonatos, Nitratos e BoratosDocument12 pagesCarbonatos, Nitratos e BoratosAna luizaNo ratings yet
- IFSC - Química Orgânica I 2021.2 - Aula 03 Funções OrgânicasDocument33 pagesIFSC - Química Orgânica I 2021.2 - Aula 03 Funções OrgânicasEduardo Bechara Filho100% (1)
- Tópico 1 - Introdução À Ciência Dos MateriaisDocument54 pagesTópico 1 - Introdução À Ciência Dos MateriaisLeonardo FrançaNo ratings yet
- 173509Document7 pages173509Karoline GimenezNo ratings yet
- Degradacao e Estabilizacao de PolimerosDocument228 pagesDegradacao e Estabilizacao de PolimerosPaula Bertolino Sanvezzo100% (1)
- Tinta Verniz PDFDocument67 pagesTinta Verniz PDFfabroto88No ratings yet
- Relatorio de Jar TestDocument3 pagesRelatorio de Jar TestMAX100% (1)
- Avaliação TeóricaDocument3 pagesAvaliação TeóricaDandara Baptista CostaNo ratings yet
- MUM-BUS-10-190-ED-06 RuralDocument146 pagesMUM-BUS-10-190-ED-06 RuralDaniel marquesNo ratings yet
- Edtudo DirigidoDocument2 pagesEdtudo Dirigidogabriel lucas marques de souzaNo ratings yet
- Lig Químicas PDFDocument30 pagesLig Químicas PDFEder Cezano GonçalvesNo ratings yet
- Blow Out Liter.2007Document4 pagesBlow Out Liter.2007bonte01100% (1)
- Relatório Da Síntese FinalDocument5 pagesRelatório Da Síntese FinalFelipe LameferNo ratings yet
- EPA-CB-AT-03 - Soda Cáustica Escamas RayonDocument3 pagesEPA-CB-AT-03 - Soda Cáustica Escamas RayonsoldierufmgNo ratings yet
- Catálogo Do Agente Encapsulador F 500 Português BRDocument6 pagesCatálogo Do Agente Encapsulador F 500 Português BRCarlos Locir JuniorNo ratings yet
- Relatorio Hexaaquacobalto IIDocument11 pagesRelatorio Hexaaquacobalto IIIbraima Bente DjaloNo ratings yet
- Relatório Aula 4 LBBM - Titulação Potenciométrica de Aminoácidos (G4)Document14 pagesRelatório Aula 4 LBBM - Titulação Potenciométrica de Aminoácidos (G4)gabu.sivieroNo ratings yet
- Matéria e EnergiaDocument6 pagesMatéria e EnergiaGladson Lima NeryNo ratings yet
- CodismonDocument16 pagesCodismonjbsantoNo ratings yet
- Propriedades Da MateriaDocument5 pagesPropriedades Da MateriaNicole Fernandes SerafimNo ratings yet
- Aula 1Document31 pagesAula 1Alcione GalvãoNo ratings yet
- 8 Argilominerais Filossilicatos e GibbsitaDocument62 pages8 Argilominerais Filossilicatos e GibbsitaJanete Vitória Souza Aflitos100% (1)
- Tabela de Propriedades Térmicas de Materiais de ConstruçãoDocument6 pagesTabela de Propriedades Térmicas de Materiais de ConstruçãoBruno de RossoNo ratings yet
- 2 Prova de MineralogiaDocument3 pages2 Prova de MineralogiaAndrade29No ratings yet
- Trocador de CalorDocument2 pagesTrocador de CalorRafael de LuccaNo ratings yet
- Treinamento cerebral: Como funcionam a inteligência e o pensamento cognitivo (2 em 1)From EverandTreinamento cerebral: Como funcionam a inteligência e o pensamento cognitivo (2 em 1)Rating: 4.5 out of 5 stars4.5/5 (29)
- Focar: Supere a procrastinação e aumente a força de vontade e a atençãoFrom EverandFocar: Supere a procrastinação e aumente a força de vontade e a atençãoRating: 4.5 out of 5 stars4.5/5 (53)
- Técnicas Proibidas de Manipulação Mental e PersuasãoFrom EverandTécnicas Proibidas de Manipulação Mental e PersuasãoRating: 5 out of 5 stars5/5 (3)
- Psicologia sombria: Poderosas técnicas de controle mental e persuasãoFrom EverandPsicologia sombria: Poderosas técnicas de controle mental e persuasãoRating: 4 out of 5 stars4/5 (92)
- Os Códigos do Mindset da Prosperidade: destrave os bloqueios em sua mente e cresça em todos os aspectos de sua vidaFrom EverandOs Códigos do Mindset da Prosperidade: destrave os bloqueios em sua mente e cresça em todos os aspectos de sua vidaNo ratings yet
- Estudo de Casos: Relatos de AvaliaçõesFrom EverandEstudo de Casos: Relatos de AvaliaçõesRating: 4 out of 5 stars4/5 (1)
- E-TRAP: entrevista diagnóstica para transtornos de personalidadeFrom EverandE-TRAP: entrevista diagnóstica para transtornos de personalidadeRating: 5 out of 5 stars5/5 (3)
- Elaboração de programas de ensino: material autoinstrutivoFrom EverandElaboração de programas de ensino: material autoinstrutivoNo ratings yet
- O psicólogo clínico em hospitais: Contribuição para o aperfeiçoamento da arte no BrasilFrom EverandO psicólogo clínico em hospitais: Contribuição para o aperfeiçoamento da arte no BrasilNo ratings yet
- Como aprender mais rápido: Métodos e dicas para se tornar mais inteligenteFrom EverandComo aprender mais rápido: Métodos e dicas para se tornar mais inteligenteRating: 3.5 out of 5 stars3.5/5 (8)
- Treinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisFrom EverandTreinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisRating: 4.5 out of 5 stars4.5/5 (169)
- Focar: Elimine distrações, perfeccionismo e faça maisFrom EverandFocar: Elimine distrações, perfeccionismo e faça maisRating: 5 out of 5 stars5/5 (21)
- As pulsões e seus destinos – Edição bilíngueFrom EverandAs pulsões e seus destinos – Edição bilíngueRating: 5 out of 5 stars5/5 (2)
- Inteligência artificial: O guia completo para iniciantes sobre o futuro da IAFrom EverandInteligência artificial: O guia completo para iniciantes sobre o futuro da IARating: 5 out of 5 stars5/5 (6)
- Simplificando o Autismo: Para pais, familiares e profissionaisFrom EverandSimplificando o Autismo: Para pais, familiares e profissionaisNo ratings yet
- Diálogo entre Terapia do Esquema e Terapia Focada na Compaixão: Contribuição à integração em Psicoterapias Cognitivo-ComportamentaisFrom EverandDiálogo entre Terapia do Esquema e Terapia Focada na Compaixão: Contribuição à integração em Psicoterapias Cognitivo-ComportamentaisRating: 5 out of 5 stars5/5 (1)
- Vou Te Ajudar A Fazer As Pessoas Clicar No Seu LinkFrom EverandVou Te Ajudar A Fazer As Pessoas Clicar No Seu LinkRating: 5 out of 5 stars5/5 (1)
- Psicanálise de boteco: O inconsciente na vida cotidianaFrom EverandPsicanálise de boteco: O inconsciente na vida cotidianaRating: 3.5 out of 5 stars3.5/5 (3)