Professional Documents
Culture Documents
Informe Paquetes F. C
Uploaded by
juan diegoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Informe Paquetes F. C
Uploaded by
juan diegoCopyright:
Available Formats
Universidad de la Amazonía
Facultad de Ciencias Básicas
Programa de Química
Laboratorio de Química II
PAQUETES FRÍOS Y PAQUETES CALIENTES
LESTHER MORA LAMPREA1, FERNEY ROMERO CAPERA.2 &JUAN DIEGO
RAMIREZ CASTRO3 NERLY LILIANA MOSQUERA MOSQUERA4
1,2&3
Estudiantes en formación del programa de química de la universidad de la Amazonía.
4
docente de la universidad de la amazonia.
1. INTRODUCCIÓN la diferencia entre la entalpía de la
“La entalpía de una reacción puede ser disolución final y la entalpía de los
positiva o negativa, según el proceso. Para componentes originales (es decir, soluto y
un proceso endotérmico (el sistema disolvente) antes de mezclarse” [2].
absorbe calor de los alrededores), ∆H es Además, la calorimetría es la técnica
positivo (es decir, ∆H > 0). Para un utilizada para determinar si una sal al
proceso exotérmico (el sistema libera calor entrar en contacto con agua servirá para la
hacia los alrededores), ∆H es negativo (es formación de un paquete frio o caliente,
decir, ∆H < 0)”. [1] dependiendo de su cambio de calor.
De manera que, “la disolución de una 2. REACTIVOS
sustancia en un disolvente produce Durante el desarrollo de la práctica se
cambios de calor que pueden medirse. A utilizaron 4 reactivos además del solvente
presión constante, el cambio de calor es universal (agua), los reactivos fueron el
igual al cambio de entalpía. El calor de cloruro de potasio (KCl), cloruro de calcio
disolución, o entalpía de disolución, (CaCl2), y el nitrato de amonio (NH4NO3)
∆Hdisol, es el calor generado o absorbido
cuando cierta cantidad de sustancia se 3. MATERIALES Y EQUIPOS
disuelve, La cantidad ∆Hdisol representa
para poder llevar a cabo la práctica fue cuanto a los materiales se hace
necesario hacer uso de equipos como la indispensable el uso del calorímetro de
plancha de agitación (Referencia BOECO icopor, el termómetro, agitador magnético
germany MAH 130), la balanza analítica y una probeta de 100 ml.
(Referencia RADWAG AS310.R2), en
4.METODOLOGIA
Este procedimiento de realizó con cada una de las sales utilizadas
Pesar calorímetro Agregar 100 ml
vacío H2O destilada
Pesar nuevamente Agitar durante 5
el sistema min, calculando T
por 30s
Pesar 6g de la sal,
Agitar sistema
agregar
calorímetro
Anotar temperatura
Pesar
cada 30s por 10m
sistema
5.DATOS
1. Datos para el cálculo del calor de disolución
KCl CaCl2
Masa de sal (g) 6,0087 g 4,0270 g
Masa del calorímetro vacío
6,2051 g 6,3087 g
(g)
Masa final del calorímetro
112,4214 g 112,3082 g
(g)
Masa de solución (g) 103,2289 g 103,0121 g
∆Temperatura (°C) -2 0
CpCalorímetro: 27,74 J/°C
6.RESULTADOS
Tabla 1. calor disolución, masa molar
Datos Valor
qDisolución KCl (J) 55,495 J
qDisolución CaCl2 (J) 0J
Masa molar de KCl 0,080 mol
Masa molar de la CaCl2 0,036 mol
Tabla 2. Entalpia disolución
Entalpía Valor (J/mol)
∆H KCl 688,54 J/mol
∆H CaCl2 0 J/mol
Tabla 3. Tipo producción
Producción de: Compuestos
Paquetes fríos KCl
Paquetes calientes ____________________
Tabla 4. Valor de los compuestos en el mercado
Compuesto Proveedor Precio por gramo (pesos/g)
CaCl2 Químigel 0,378
KCl Tianchong 0,065
Tabla 5. Valor necesaria producción paquetes
Paquete Cantidad (g) Costo (pesos)
CaCl2 _________ _______________
KCl 6,0087 0,391
7. DISCUSIÓN RESULTADOS producción de paquetes calientes, sin
Según los datos obtenidos embrago, experimentalmente no se puede
experimentalmente el compuesto más demostrar la ocurrencia de dicha reacción,
adecuado para la producción de paquetes esto se pudo haber presentado debido a los
fríos es el cloruro de potasio (KCl), esto se errores aleatorios como la falta de pureza
puede demostrar debido a que este de los reactivos, o baja concentración de la
compuesto presenta una entalpia molar de sal en la reacción, puesto que teóricamente
disolución aproximada de 688 J/mol, se encuentra que la producción de
evidenciándose una reacción de tipo paquetes calientes a partir de este
endotérmica, cuya característica es la compuesto es con una cantidad
absorción de calor de los alrededores, de aproximada de 40 g. de manera que la
esta manera al compararse estos datos concentración de la sal en la reacción tiene
obtenidos con valores teóricos se una diferencia de aproximadamente 89%,
determina que este resultado es veraz, diferencia que pude explicar dicho
además que el costo para la producción de resultado.
un paquete frio a base de este compuesto
es generalmente económico. 8. CONCLUSIONES
Teóricamente se encuentra que el La producción y viabilidad en la obtención
dicloruro de calcio se emplea para la de un paquete frio o caliente depende de la
concentración de sal presente en la Se pudo determinar que el KCl produce un
disolución. paquete frio, y que la producción tiene un
A través de la entalpia molar de disolución valor monetario adquirible
se pude determinar si un compuesto No se pudo determinar que compuesto es
produce un paquete frio o caliente el más apto para producir un paquete
caliente.
9.BIBLIOGRAFÍA
[1] Andrade, c. (2001). el calor y el frio de [2] Chang, R. (2010). química (10th ed.,
las reacciones químicas. Creces, (1), 22- pp. 258-261). México: McGraw-
24. Recuperado de Hill/INTERAMERICANA EDITORES,
http://www.creces.cl/new/index.asp?tc=3 S.a. DE C.V.
&nc=5&art=1176.
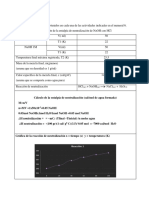
10. ANEXOS
Entalpia de disolución del cloruro de potasio (KCl)
110.99 J / 4 = 27.7475 J/mol
-q disolución =27.7475j/mol. * - 2 °C + q H2O
q disolución =55.495 J
ΔHdisolucion= q disolución / g sal * Pm
ΔHdisolucion = (55.495 J / 6.0087g KCl) (74,551g KCl / 1mol KCl) = 688.54 J/mol
Entalpia de disolución del cloruro de cobre dihidratado (CuCl * 2H2O)
-q disolución =27.7475J/mol * 0 + H20 = 0
ΔHdisolucion = 0 / 4.0527g CuCl * 2H2O * 110.984g CuCl * 2H2O =0
You might also like
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Informe Paquetes F. CDocument5 pagesInforme Paquetes F. Cjuan diegoNo ratings yet
- CALORPb FisicoquimicaDocument7 pagesCALORPb FisicoquimicaENRIQUE DE JESUS MARIN LOPEZNo ratings yet
- Informe Experimental Del Calor de Descomposición Del H2o2Document8 pagesInforme Experimental Del Calor de Descomposición Del H2o2Sheryl VegaNo ratings yet
- Determinación Del Calor de Reacción de Una Reacción ÁcidoDocument6 pagesDeterminación Del Calor de Reacción de Una Reacción ÁcidoJuanMiguel Arratia ValderramaNo ratings yet
- Experiencia NLeyde Hess Virtual LabDocument8 pagesExperiencia NLeyde Hess Virtual LabMARYLIN CECILIA ALVAREZ SOLANONo ratings yet
- Calor de Combustión PDFDocument6 pagesCalor de Combustión PDFAlexandra ArboledaNo ratings yet
- Informe TP de Laboratorio TermoquímicaDocument8 pagesInforme TP de Laboratorio TermoquímicaNadia SolarNo ratings yet
- Problemas Resueltos de Termoquimica (ANAYA)Document8 pagesProblemas Resueltos de Termoquimica (ANAYA)Victor García100% (1)
- Laboratorio de Quimica N7Document14 pagesLaboratorio de Quimica N7LINDER ANTONIO LOPEZ DOMINGUEZNo ratings yet
- Calor de NeutralizacionDocument14 pagesCalor de NeutralizacionJuly JBNo ratings yet
- Calorimetria Casos Especiales InformeDocument7 pagesCalorimetria Casos Especiales InformeFranzNo ratings yet
- Determinacion de La Curva de Solubilidad FINALDocument10 pagesDeterminacion de La Curva de Solubilidad FINALmariaNo ratings yet
- INFORME-7Document7 pagesINFORME-7AnaisBriggitJacintoChavezNo ratings yet
- Informe Fisicoquimik CALOR DE NEUTRALIZACIÓNDocument13 pagesInforme Fisicoquimik CALOR DE NEUTRALIZACIÓNCristian DiazNo ratings yet
- Determinacion de La Curva de SolubilidadDocument8 pagesDeterminacion de La Curva de SolubilidadmariaNo ratings yet
- Informe de Laboratorio 7 PDFDocument22 pagesInforme de Laboratorio 7 PDFFrank Perez ChavezNo ratings yet
- Informe 3 QG Invierno PDFDocument15 pagesInforme 3 QG Invierno PDFDiana Rita Pomez QuirozNo ratings yet
- FISICOQUIMICA Informe #1Document4 pagesFISICOQUIMICA Informe #1Valentina DiazNo ratings yet
- Determinacion Calor de SolucionDocument15 pagesDeterminacion Calor de Solucionsimon j ochoa aNo ratings yet
- Informe 4 Ley de HessDocument6 pagesInforme 4 Ley de HessOrtega Martinez JohanithaNo ratings yet
- Taller I Balance de EnergíaDocument6 pagesTaller I Balance de EnergíaAndres PaipaNo ratings yet
- Fq-Calor de CombustiónDocument8 pagesFq-Calor de CombustiónAndresDuranNo ratings yet
- Tarea 1 Natalia GalloDocument30 pagesTarea 1 Natalia GalloJaime CucaitaNo ratings yet
- Informe2 Determinación CalorDocument10 pagesInforme2 Determinación CalorMariaNo ratings yet
- Calor de Neutralización REVDocument6 pagesCalor de Neutralización REVRafael Arce FernándezNo ratings yet
- Calorimetría de Combustión.Document12 pagesCalorimetría de Combustión.Melissa Marvan50% (2)
- Calor de NeutralizaciónDocument8 pagesCalor de NeutralizaciónESTEFANIE MORALESNo ratings yet
- Calor de Neutralizacion de Un Acido Fuerte y de Una Base FuerteDocument12 pagesCalor de Neutralizacion de Un Acido Fuerte y de Una Base FuerteC JNo ratings yet
- Calor de CombustiónDocument6 pagesCalor de CombustiónCamila ArredondoNo ratings yet
- Informe 7Document10 pagesInforme 7Danilo GuerraNo ratings yet
- Laboratorio 1 Fisicoquimica - Entalpia de ReaccionDocument15 pagesLaboratorio 1 Fisicoquimica - Entalpia de Reaccionyerson mendoza roblesNo ratings yet
- Informe Caliza 1Document9 pagesInforme Caliza 1Brandon Scott Flores MuñozNo ratings yet
- Practica 3Document6 pagesPractica 3Shukopopsita EmolotikaNo ratings yet
- Lab de Termodinamica 3Document5 pagesLab de Termodinamica 3Daniel Alejandro Salamanca SantiagoNo ratings yet
- Determinación de La Entalpía de La Reacción de Neutralización PorDocument8 pagesDeterminación de La Entalpía de La Reacción de Neutralización PorjuanlariosNo ratings yet
- CalorimetriaDocument5 pagesCalorimetriaKrhis CamargoNo ratings yet
- Informe #2Document13 pagesInforme #2daniel felipe sandoval solanoNo ratings yet
- Informe Numero 7Document12 pagesInforme Numero 7Breyner SanchezNo ratings yet
- Informe P2Document10 pagesInforme P2veronica RodriguezNo ratings yet
- Entalpia de NautralizacionDocument6 pagesEntalpia de Nautralizacionantony usecheNo ratings yet
- Practica 6 Capacidad TermicaDocument9 pagesPractica 6 Capacidad TermicaDiego German R Aguilar100% (1)
- Práctica 10 Calor de CombustiónDocument8 pagesPráctica 10 Calor de CombustiónDaniel Rodriguez MonroyNo ratings yet
- Taller. TermoquímicaDocument2 pagesTaller. TermoquímicaNatalia TorresNo ratings yet
- Reporte 1 Quimica para Ingenieria CivilDocument16 pagesReporte 1 Quimica para Ingenieria CivilHeber CastellonNo ratings yet
- Informe de Lab 1Document6 pagesInforme de Lab 1Christian Marcelo Macías AguiarNo ratings yet
- Informe EstequiometriaDocument5 pagesInforme EstequiometriaLaurita MenesesNo ratings yet
- Informe 4 - Grupo 3 - Ing MinasDocument10 pagesInforme 4 - Grupo 3 - Ing MinasSebastian ZevallosNo ratings yet
- Guc3ada 8 Acido BaseDocument5 pagesGuc3ada 8 Acido BaseLuis Carlos AndradeNo ratings yet
- Unidad 5 Energia Reacciones QuimicasDocument25 pagesUnidad 5 Energia Reacciones Quimicasdaniela tapiaNo ratings yet
- Practica 8Document7 pagesPractica 8javierNo ratings yet
- Combustion Del AzúcarDocument4 pagesCombustion Del AzúcarMiiana ContentoNo ratings yet
- Laboratorio Acerca de La Ley de HessDocument5 pagesLaboratorio Acerca de La Ley de HessClaudia Marcela Campo YuleNo ratings yet
- Guía de Laboratorio Nº2 Grupo 3Document8 pagesGuía de Laboratorio Nº2 Grupo 3Renzo Josue Bados TapullimaNo ratings yet
- Calor Clase Previa CalorDocument13 pagesCalor Clase Previa Caloreddy lecoñaNo ratings yet
- Metodologia, Resultados y DiscusionDocument5 pagesMetodologia, Resultados y DiscusionMaria José Martinez AlvisNo ratings yet
- BrigadaNo1 InformeP8Document7 pagesBrigadaNo1 InformeP8Lalo AlvarezNo ratings yet
- Tarea 3 de Quimica Kleece PolancoDocument21 pagesTarea 3 de Quimica Kleece PolancoNadia CeballosNo ratings yet
- Informe de Laboratorio 4Document8 pagesInforme de Laboratorio 4farith.huaman.pNo ratings yet
- Informe de Orgánica 7Document2 pagesInforme de Orgánica 7juan diegoNo ratings yet
- Ferney Romero Articuo Física.Document7 pagesFerney Romero Articuo Física.juan diegoNo ratings yet
- Sin Título 1Document1 pageSin Título 1juan diegoNo ratings yet
- Practicas de LaboratorioDocument5 pagesPracticas de Laboratoriojuan diegoNo ratings yet
- Chalo 10º Propiedades PeriodicasDocument3 pagesChalo 10º Propiedades PeriodicaschaloNo ratings yet
- Práctica 0 QG Lab v2-2023Document9 pagesPráctica 0 QG Lab v2-2023GinaNo ratings yet
- Potencial ElectrocinéticoDocument3 pagesPotencial ElectrocinéticoJessica Valentina Zarama BuriticaNo ratings yet
- Procedimiento de Trabajo Seguro en CalienteDocument4 pagesProcedimiento de Trabajo Seguro en CalienteChristian Castro100% (2)
- MAMPOSTERÍADocument31 pagesMAMPOSTERÍAKokó DouilletNo ratings yet
- 018 Pintura Látex 09 02Document1 page018 Pintura Látex 09 02David TRNo ratings yet
- Fallas en Las Bombas de EngranajesDocument6 pagesFallas en Las Bombas de EngranajesOrlando LaureanoNo ratings yet
- Alexis Salazar Control 4Document4 pagesAlexis Salazar Control 4ale salaNo ratings yet
- Anhidrovolumetría Trabajo 2Document13 pagesAnhidrovolumetría Trabajo 2Jeff C Poessy67% (3)
- Conectores de CorteDocument1 pageConectores de CorteSANDRA TINTAYANo ratings yet
- Napko 3221Document2 pagesNapko 3221alexisNo ratings yet
- Condiciones de Seguridad SoldaduraDocument10 pagesCondiciones de Seguridad SoldaduraDaniel AvHdezNo ratings yet
- Epso MicrotopDocument1 pageEpso MicrotopevoristaNo ratings yet
- Ficha Técnica Politerm BluDocument8 pagesFicha Técnica Politerm BluEdwingonzaNo ratings yet
- RG04-IO3501 Plan de Calidad V1Document9 pagesRG04-IO3501 Plan de Calidad V1KDPRB100% (2)
- Reconocimiento de Las Fibras TextilesDocument8 pagesReconocimiento de Las Fibras TextilesMónica VelascoNo ratings yet
- Plantilla Matriz IperDocument14 pagesPlantilla Matriz IperElian DelacruzmesiasNo ratings yet
- Calificacion de SoldadoresDocument1 pageCalificacion de SoldadoresAlexander Canga100% (2)
- Esfuerzos Permisibles (Copia)Document17 pagesEsfuerzos Permisibles (Copia)Sharon HuertaNo ratings yet
- Arancel Aduanero Seccion VII Capitulos 39 Al 40Document13 pagesArancel Aduanero Seccion VII Capitulos 39 Al 40canito730% (1)
- Práctica 2Document5 pagesPráctica 2Renzo Vargas RamirezNo ratings yet
- Memoria de Calculo ESTRUCTURAS VIVIENDA CHICLAYODocument11 pagesMemoria de Calculo ESTRUCTURAS VIVIENDA CHICLAYODennys Javier Quesquen CumpaNo ratings yet
- Resumen Tecnico LAT - SK.jaba PDFDocument48 pagesResumen Tecnico LAT - SK.jaba PDFIgor Mardones EspinozaNo ratings yet
- Examen Sobre Seguridad y Protección EléctricaDocument6 pagesExamen Sobre Seguridad y Protección EléctricaDeysi CamposNo ratings yet
- Guia de TPsDocument25 pagesGuia de TPsGastón AristizabalNo ratings yet
- Dosificacion Metodo ACI 211Document9 pagesDosificacion Metodo ACI 211Manuel Jesus Martinez MatosNo ratings yet
- Deber - 17 - Clasificacion de Calizas FolkDocument6 pagesDeber - 17 - Clasificacion de Calizas FolkJefferson Játiva100% (1)
- Unidad III. Enlace QuimicoDocument45 pagesUnidad III. Enlace QuimicoAngel SigaranNo ratings yet
- Metodos de SeparacionDocument7 pagesMetodos de SeparacionRUBEN ALEXANDER RODRIGUEZ YAJIMOVICHNo ratings yet
- Exo QuimicaDocument26 pagesExo Quimicayuribel rodriguezNo ratings yet