Professional Documents
Culture Documents
Termodinâmica - Questões sobre calor, energia e 1a lei
Uploaded by
Vinicius Ribeiro Veloso0 ratings0% found this document useful (0 votes)
31 views3 pagesO documento discute conceitos de termodinâmica como calor, energia, trabalho e a Primeira Lei da Termodinâmica. Aplica esta lei para calcular o trabalho realizado e calor necessário para aquecer 1 kg de água de 100°C a vapor saturado a 180°C sob pressão constante. A alternativa correta é que o trabalho é de 0,14 kJ e o calor necessário é de 2,028 kJ.
Original Description:
termo 2
Original Title
Termodinâmica 06
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentO documento discute conceitos de termodinâmica como calor, energia, trabalho e a Primeira Lei da Termodinâmica. Aplica esta lei para calcular o trabalho realizado e calor necessário para aquecer 1 kg de água de 100°C a vapor saturado a 180°C sob pressão constante. A alternativa correta é que o trabalho é de 0,14 kJ e o calor necessário é de 2,028 kJ.
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
31 views3 pagesTermodinâmica - Questões sobre calor, energia e 1a lei
Uploaded by
Vinicius Ribeiro VelosoO documento discute conceitos de termodinâmica como calor, energia, trabalho e a Primeira Lei da Termodinâmica. Aplica esta lei para calcular o trabalho realizado e calor necessário para aquecer 1 kg de água de 100°C a vapor saturado a 180°C sob pressão constante. A alternativa correta é que o trabalho é de 0,14 kJ e o calor necessário é de 2,028 kJ.
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 3
Termodinâmica – 05/05
1. A respeito de calor e energia, assinale a opção correta.
(A) A quantidade de calor necessária para variar a temperatura de
um sistema depende do grau de variação da temperatura que se
pretende atingir e da pressão inicial do sistema.
(B) A energia interna de um sistema pode ser composta de
diferentes fontes, como energias química, eletrônica, nuclear e
cinética.
(C) Um material isolante térmico, como o isopor, e um material
plástico maleável requerem a mesma quantidade de calor para
serem aquecidos ou resfriados à mesma temperatura.
(D) Um sistema fechado não permite a saída nem a entrada de
matéria ou energia, ao passo que um sistema isolado permite a
passagem de energia, mas não de matéria.
(E) Conforme a primeira lei da termodinâmica, em um sistema
isolado, a energia total varia em função da temperatura.
2. A termodinâmica é a ciência que estuda a energia. Aspectos de
transferência e transformação de energia são conceitos importantes
para o entendimento de diversas situações práticas de atuação do
perito, dentro deste contexto. Assim, identifique a afirmativa correta:
(A) Calor é uma forma de energia que não se transfere.
(B) A transferência de energia se dá na forma de calor, trabalho e
fluxo de massa.
(C) A transferência de energia se dá na forma de trabalho e volume.
(D) A energia transferida é função exclusiva da massa do sistema.
(E) A energia transferida se perde ao final do processo.
3. Uma das maneiras de enunciar a 1a Lei da Termodinâmica é: “a
variação da energia do sistema tem que ser igual a energia
transferida através das suas fronteiras com as vizinhanças”. Assim,
para um sistema fechado sem reação química, ela pode ser expressa
pela equação:
∆U + ∆Ek + ∆Ep = Q + W
Sendo: ∆U: variação da energia interna (propriedade termodinâmica
da substância); ∆Ek e ∆Ep: variações das energias cinética e potencial,
respectivamente; Q: calor; W: trabalho que acompanha a variação no
volume do sistema. Aplicando-se a 1a Lei da Termodinâmica e
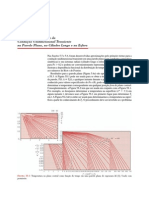
conhecendo-se as propriedades termodinâmicas da água (Tabela a
seguir), pode-se estimar a quantidade de trabalho realizado e o calor
necessário para uma massa de 1,0 kg de água líquida a 100C,
contida em um cilindro por um êmbolo a uma pressão de 0,7 MPa,
que é aquecida lentamente até ocupar todo o volume do cilindro.
Neste momento, o sistema é uma mistura de líquido mais vapor.
Transfere-se, então, mais calor ao sistema, até a água tornar-se
vapor saturado a 180 C.
Assinale a alternativa que representa, correta e respectivamente, o
valor do trabalho realizado e o calor recebido pelo sistema.
(A) 0,14 kJ e 2,028 kJ.
(B) 0,14 kJ e 0,14 kJ.
(C) 14,0 kJ e 202,8 kJ.
(D) 140,0 kJ e 140 kJ.
(E) 140,0 kJ e 2028 kJ.
You might also like
- Juizados EspeciaisDocument1 pageJuizados EspeciaisVinicius Ribeiro VelosoNo ratings yet
- Arqv PDFDocument1 pageArqv PDFVinicius Ribeiro VelosoNo ratings yet
- Estatuto RacialDocument1 pageEstatuto RacialVinicius Ribeiro VelosoNo ratings yet
- Maria Da PenhaDocument1 pageMaria Da PenhaVinicius Ribeiro VelosoNo ratings yet
- Termodinâmica - Problemas de compressão gasosa e transições de faseDocument2 pagesTermodinâmica - Problemas de compressão gasosa e transições de faseVinicius Ribeiro VelosoNo ratings yet
- Arqv PDFDocument9 pagesArqv PDFVinicius Ribeiro VelosoNo ratings yet
- PCPI - Química (2008)Document4 pagesPCPI - Química (2008)Vinicius Ribeiro VelosoNo ratings yet
- Estatuto IdosoDocument1 pageEstatuto IdosoVinicius Ribeiro VelosoNo ratings yet
- Resumo PCADocument24 pagesResumo PCAVinicius Ribeiro VelosoNo ratings yet
- Propriedade Dos Gases 2704Document2 pagesPropriedade Dos Gases 2704Vinicius Ribeiro VelosoNo ratings yet
- Tabela de SolubilidadeDocument1 pageTabela de SolubilidadeMarcus ViníciusNo ratings yet
- Vunesp - 10 QuestõesDocument18 pagesVunesp - 10 QuestõesVinicius Ribeiro VelosoNo ratings yet
- Propriedade Dos Gases 2804Document3 pagesPropriedade Dos Gases 2804Vinicius Ribeiro VelosoNo ratings yet
- Guia do Excel, Word e PowerPointDocument9 pagesGuia do Excel, Word e PowerPointVinicius Ribeiro VelosoNo ratings yet
- Termodinâmica - Problemas de compressão gasosa e transições de faseDocument2 pagesTermodinâmica - Problemas de compressão gasosa e transições de faseVinicius Ribeiro VelosoNo ratings yet
- Propriedade Dos Gases 2704Document2 pagesPropriedade Dos Gases 2704Vinicius Ribeiro VelosoNo ratings yet
- Rodrigopereira ApostilaDocument125 pagesRodrigopereira Apostilaguilhermenq2013No ratings yet
- Cinética e Equilíbrio Químico 0305Document2 pagesCinética e Equilíbrio Químico 0305Vinicius Ribeiro VelosoNo ratings yet
- Conservação de AlimentosDocument7 pagesConservação de AlimentosVinicius Ribeiro VelosoNo ratings yet
- Incropera - Tranferencia de Calor e Massa-GráficossDocument12 pagesIncropera - Tranferencia de Calor e Massa-GráficossItalo Lacerda Fernandes100% (1)
- Exame Unificado de Pós-graduação em FísicaDocument3 pagesExame Unificado de Pós-graduação em FísicaJackson BackupNo ratings yet
- Manual Bblend BPG40D Purus CompactadoDocument14 pagesManual Bblend BPG40D Purus CompactadoJoao Paulo StringuetoNo ratings yet
- Medidor multifuncional MMW03-CHDocument39 pagesMedidor multifuncional MMW03-CHRicardo Teixeira100% (1)
- Modulo VIII Nic NVC Nac NTCDocument36 pagesModulo VIII Nic NVC Nac NTCIon Nicu GordiciucNo ratings yet
- FT Termo Vertical VOLGA DIGITAL PT TuvaztDocument1 pageFT Termo Vertical VOLGA DIGITAL PT TuvaztPedro LouroNo ratings yet
- 06 - Linhas ElétricasDocument28 pages06 - Linhas Elétricasfaop91No ratings yet
- Eletrostatica ExerciciosDocument14 pagesEletrostatica Exerciciosbruna silvaNo ratings yet
- Ma200Document2 pagesMa200dimasdoidoNo ratings yet
- RelatórioDocument25 pagesRelatórioWallace CrisólogoNo ratings yet
- Plano de ensino para Materiais de fabricaçãoDocument5 pagesPlano de ensino para Materiais de fabricaçãoSergiooNo ratings yet
- Corrosão: Velocidade, Polarização e PassivaçãoDocument42 pagesCorrosão: Velocidade, Polarização e PassivaçãoJulyana IsidoroNo ratings yet
- Aço inoxidável: material perfeito para desenvolvimento sustentávelDocument11 pagesAço inoxidável: material perfeito para desenvolvimento sustentávelTúlio Barata FrançaNo ratings yet
- Esquema Eletrico FH D13ADocument161 pagesEsquema Eletrico FH D13AVinicius J. Veras94% (48)
- Demonstracoes - Financeiras - Anuais - Completas - de - 2019 WEG SADocument57 pagesDemonstracoes - Financeiras - Anuais - Completas - de - 2019 WEG SAJosé Vittor SiqueiraNo ratings yet
- Perfuração DirecionalDocument40 pagesPerfuração DirecionalMaycon SantosNo ratings yet
- ETU-165.1 - Religador de Circuito Automático MonofásicoDocument66 pagesETU-165.1 - Religador de Circuito Automático MonofásicoFelipeMoriNo ratings yet
- Informações Do EquipamentoDocument1 pageInformações Do Equipamentopontualservicos100% (1)
- Lista de Exercício - História - 8° Ano - 1° BimestreDocument2 pagesLista de Exercício - História - 8° Ano - 1° BimestreLauraNo ratings yet
- Bomba injetora: diagnóstico e manutençãoDocument12 pagesBomba injetora: diagnóstico e manutençãoAntonilson ConceiçãoNo ratings yet
- Exercicios 1 - 2011Document2 pagesExercicios 1 - 2011Jessika Avi CantieriNo ratings yet
- Auralite 23 CristaisDocument8 pagesAuralite 23 CristaisElias NetoNo ratings yet
- TECNOLOGIAS DE TRATAMENTO DE RESÍDUOS INDUSTRIAISDocument8 pagesTECNOLOGIAS DE TRATAMENTO DE RESÍDUOS INDUSTRIAISGustavo BittencourtNo ratings yet
- Ações Do Vento em EdificaçõesDocument33 pagesAções Do Vento em EdificaçõesVANRALUIZANo ratings yet
- Evaporador HeatcraftDocument6 pagesEvaporador HeatcraftUalisson FerreiraNo ratings yet
- FLUXOGRAMA DE ATIVIDADES APTDocument2 pagesFLUXOGRAMA DE ATIVIDADES APTsafengenharia2No ratings yet
- LSE200 ServiçoDocument96 pagesLSE200 ServiçoEdson Godinho100% (2)
- Apostila Produção Da CachaçaDocument14 pagesApostila Produção Da CachaçaJoana CordeiroNo ratings yet
- SI unidades e cargas elétricasDocument222 pagesSI unidades e cargas elétricasMiguel Vidal GalvãoNo ratings yet
- Meu Velho Chico: Memórias de Uma ExpediçãoDocument457 pagesMeu Velho Chico: Memórias de Uma ExpediçãoJoão Carlos Figueiredo100% (1)
- Relés de Nível ALTRONICDocument2 pagesRelés de Nível ALTRONICLeonardo José da Cruz100% (3)