Professional Documents
Culture Documents
Formulario Física Ley de Gases
Uploaded by
Aaron VenegasOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Formulario Física Ley de Gases
Uploaded by
Aaron VenegasCopyright:
Available Formats
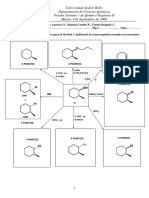
P = Presión V = Volumen n = mol Na = 6.
023x1023 J = Joule
𝑚2
𝑘𝑔( 𝑠2 )
k = Constante proporcionalidad
M = Masa molecular
T = Temperatura
Ley de Boyle Ley de Avogadro
Siempre que la masa y la temperatura de una muestra de gas se Volúmenes iguales de distintas sustancias gaseosas, medidos en
mantengan constantes, el volumen de dicho gas es inversamente las mismas condiciones de presión y temperatura, contienen el
proporcional a su presión absoluta. mismo número de moléculas.
𝑉 𝑉1 𝑉2
𝑃𝑉 = 𝑘 𝑃1 𝑉1 = 𝑃2 𝑉2 (Masa y T constantes) =𝑘 = (P y T constantes)
𝑛 𝑛1 𝑛2
Ley de Charles Moléculas por Mol
Mientras la masa y la presión de un gas se mantengan La razón del número de moléculas N al número de moles n debe
constantes, el volumen de dicho gas es directamente proporcional ser igual al número de Avogadro simbólicamente.
a su temperatura.
𝑁
= 𝑁𝑎
𝑉 𝑉1 𝑉2 𝑛
=𝑘 = (Masa y P constantes)
𝑇 𝑇1 𝑇2
Número de moles
Se divide su masa en gramos entre su masa molecular M por mol.
Ley de Gay – Lussac
𝑚
Si el volumen de una muestra de gas permanece constante, la =𝑛
𝑀
presión absoluta de dicho gas es directamente proporcional a su
temperatura.
𝑃 𝑃1 𝑃2 Ley General de los Gases ideales
=𝑘 = (Masa y V constantes) Forma más útil de una ley de gases cuando se conocen todos los
𝑇 𝑇1 𝑇2
parámetros a excepción de uno.
Ley General de los Gases 𝑚 𝑃𝑉
𝑃𝑉 = 𝑛𝑅𝑇 𝑃𝑉 = 𝑀 𝑅𝑇 𝑛𝑇
=𝑅
Relación general de las 3 leyes anteriores.
𝐽 𝑐𝑎𝑙
𝑃𝑉 𝑃1 𝑉1 𝑃2 𝑉2 R = 8.314 R = 1.99
=k = (Masa constante) 𝑚𝑜𝑙 𝐾 𝑚𝑜𝑙 𝐾
𝑇 𝑇1 𝑇2
𝐿 𝑎𝑡𝑚 𝑃𝑎 𝑚3
R = 0.0821 R = 8.314
𝑚𝑜𝑙 𝐾 𝑚𝑜𝑙 𝐾
Densidad de los gases
Correlación de la densidad a la ley de gases ideales.
𝑃 𝑀
𝜌= 𝑅 𝑇
You might also like
- Nomenclatura QuímicaDocument40 pagesNomenclatura QuímicaryrNo ratings yet
- Solemnes 1 quimorgIIUNABantiguasDocument66 pagesSolemnes 1 quimorgIIUNABantiguasclaudia0% (1)
- Integrales AreasDocument11 pagesIntegrales AreasSebastian gabriel zafraNo ratings yet
- Estatutos F.E.U.V.Document18 pagesEstatutos F.E.U.V.Enrique Herrera NoyaNo ratings yet
- Solemne Recuperativa Química Orgánica 2Document7 pagesSolemne Recuperativa Química Orgánica 2John Lobos FernándezNo ratings yet
- Solemne 3 OrganicaDocument5 pagesSolemne 3 OrganicaArianne Villagra YañezNo ratings yet
- Ejercicios Sobre IsomeríaDocument3 pagesEjercicios Sobre IsomeríaMarcos HernándezNo ratings yet
- Nomenclatura Quimica OrganicaDocument4 pagesNomenclatura Quimica OrganicaRafael Fonseca MartinezNo ratings yet
- Distribución CanónicaDocument14 pagesDistribución CanónicaAlexis QuirozNo ratings yet
- Solemnes 2 QuimorgIIUNABANTIGUAS 2016Document95 pagesSolemnes 2 QuimorgIIUNABANTIGUAS 2016Rodrigo A. MartinezNo ratings yet
- Ejercicios Resueltos Primer Parcial Nomeclatura e IsomeríaDocument8 pagesEjercicios Resueltos Primer Parcial Nomeclatura e IsomeríaErajh HertezNo ratings yet
- Capacidad Calorífica de Un SólidoDocument21 pagesCapacidad Calorífica de Un SólidoFabricio DávalosNo ratings yet
- Formulario TermodinamicaDocument25 pagesFormulario TermodinamicaPenélope ManzurNo ratings yet
- Formulario VectorialDocument3 pagesFormulario VectorialMisaMontielNo ratings yet
- 2.1 Cinetica de Las Reacciones Elementales-Cinética Química-JgalDocument17 pages2.1 Cinetica de Las Reacciones Elementales-Cinética Química-JgalEudaldo Cime FigueroaNo ratings yet
- Equilibrio QuímicoDocument18 pagesEquilibrio QuímicoMIldre666No ratings yet
- Problemas de ElectromagnetismoDocument6 pagesProblemas de ElectromagnetismoJose DoriaNo ratings yet
- Diferencia Entre Quimica e Ingenieria QuimicaDocument2 pagesDiferencia Entre Quimica e Ingenieria QuimicaJulissa PoloNo ratings yet
- Resumen Ecoe - Medicina Interna Ds CompressedDocument58 pagesResumen Ecoe - Medicina Interna Ds CompressedRandyNo ratings yet
- Introduccion Al Analisis Grafico de Datos ExperimentalesDocument229 pagesIntroduccion Al Analisis Grafico de Datos Experimentalesrobefi100% (1)
- Abigail Correa - Examen Parcial de Las Prácticas 3 y 4Document3 pagesAbigail Correa - Examen Parcial de Las Prácticas 3 y 4Abi CorreaNo ratings yet
- Tema 4.-Estados de Agregacion de La Materia. Parte I. GasesDocument73 pagesTema 4.-Estados de Agregacion de La Materia. Parte I. GasesDiana Diez PrietoNo ratings yet
- Apuntes Equilibrio y KpsDocument26 pagesApuntes Equilibrio y KpsanalazosNo ratings yet
- Formulario Electromagnetismo Completo FINALDocument6 pagesFormulario Electromagnetismo Completo FINALAndrick ANo ratings yet
- Leyes PonderalesDocument1 pageLeyes PonderalesMiriam AguirreNo ratings yet
- Informe 8 Termoquimica y Termodinamica PDFDocument5 pagesInforme 8 Termoquimica y Termodinamica PDFJuan Arias100% (1)
- BiofisicaDocument8 pagesBiofisicaLA PERRA Saray ValerioClaudio ,ME ENCANTA CHUPAR PINGANo ratings yet
- Trabajo DefinitivoDocument33 pagesTrabajo DefinitivoCata ManriquǝNo ratings yet
- Retroalimentacion Caso 2Document2 pagesRetroalimentacion Caso 2juanjoseNo ratings yet
- CineticaDocument6 pagesCineticaJisila JisilaNo ratings yet
- Apuntes ProfesorDocument174 pagesApuntes ProfesorBrayans Santiago Salazar CartagenaNo ratings yet
- Quimica SolucionDocument172 pagesQuimica SolucionFatima Montserrat Mendoza MatheyNo ratings yet
- 1.2 y 1.3 Teoría de Perturbaciones Independientes Del Tiempo PDFDocument10 pages1.2 y 1.3 Teoría de Perturbaciones Independientes Del Tiempo PDFCharlie HultgreenNo ratings yet
- Ejercicios de Tarea PDFDocument6 pagesEjercicios de Tarea PDFJimena AlvaradoNo ratings yet
- Examen de Quimica Organica Primer ParcialDocument1 pageExamen de Quimica Organica Primer ParcialRubenCerronCahuayaNo ratings yet
- Medidas Descriptivas: ÍndiceDocument27 pagesMedidas Descriptivas: ÍndiceMaribel R. OlgadoNo ratings yet
- Problemario Parcial 21Document5 pagesProblemario Parcial 21Mayra A Rivera SNo ratings yet
- VectoresDocument5 pagesVectoresJOSENo ratings yet
- Procesos TermodinámicosDocument16 pagesProcesos TermodinámicosRoberto PortilloNo ratings yet
- Práctica 2 - Sub.1 - Reactivo Limitante, Rendimiento Teórico y Rendimiento Real - Rivera Campos Juan Orlando - P.1 - 4 A LQDocument17 pagesPráctica 2 - Sub.1 - Reactivo Limitante, Rendimiento Teórico y Rendimiento Real - Rivera Campos Juan Orlando - P.1 - 4 A LQOrlando RiveraNo ratings yet
- Capacidad Calorífica A Volumen ConstanteDocument2 pagesCapacidad Calorífica A Volumen ConstanteMiguel Ángel Mejía BenitoNo ratings yet
- Glosario Nº3Document8 pagesGlosario Nº3Nicolas CocoNo ratings yet
- Tarea2 3Document2 pagesTarea2 3juan pabloNo ratings yet
- BancoEjerciciosRepaso - Parcial 1Document6 pagesBancoEjerciciosRepaso - Parcial 1Hector VillalobosNo ratings yet
- 507Document0 pages507Oscar E Andela100% (1)
- Manual de Practicas de Química General Ago 2021Document93 pagesManual de Practicas de Química General Ago 2021Gabriel HernandezNo ratings yet
- 1.1.1 Avances Científicos Echos Por La FísicaDocument7 pages1.1.1 Avances Científicos Echos Por La FísicaChris MondragonNo ratings yet
- DiapositivasDocument7 pagesDiapositivasKatherin P. Parra MercadoNo ratings yet
- Notacion Cientifica PDFDocument1 pageNotacion Cientifica PDFSusana Galian MelgarejoNo ratings yet
- Irrigación Del EncefaloDocument4 pagesIrrigación Del EncefaloAngelo Di RienzoNo ratings yet
- Unphu. QUI-111 Quimica General IDocument4 pagesUnphu. QUI-111 Quimica General Ianyaris menaNo ratings yet
- C Sem2 Q Números CuánticosDocument3 pagesC Sem2 Q Números CuánticosShausa KleanNo ratings yet
- Deberías Contárselo Todo A Tu ParejaDocument1 pageDeberías Contárselo Todo A Tu ParejaAlfredo JimenezNo ratings yet
- Nomenclatura de HidrocarburosDocument13 pagesNomenclatura de HidrocarburosLeandraNo ratings yet
- Fisica Mcu Al LibroDocument8 pagesFisica Mcu Al LibroLESLYENo ratings yet
- Coeficiente Adiabatico de Los GasesDocument14 pagesCoeficiente Adiabatico de Los GasesGilvert J Vasquez MendozaNo ratings yet
- Ley de Los Gases IdealesDocument27 pagesLey de Los Gases IdealesJP VSNo ratings yet
- Hoja 08 Sucesiones Pend 3esoDocument3 pagesHoja 08 Sucesiones Pend 3esoJuan Pérez0% (1)
- Ley de Los Gases IdealesDocument8 pagesLey de Los Gases Idealesgian chavezNo ratings yet
- Ley Gas IdealDocument6 pagesLey Gas IdealKomi SanNo ratings yet
- De Qué Manera Usted Como Usuario Puede Contribuir A Mejorar El Servicio de Las Empresas Prestadoras Del Servicio de Energía EléctricaDocument2 pagesDe Qué Manera Usted Como Usuario Puede Contribuir A Mejorar El Servicio de Las Empresas Prestadoras Del Servicio de Energía EléctricaJuan Pablo DuranNo ratings yet
- Aldeán Aguirre Wilman Tesis PDFDocument165 pagesAldeán Aguirre Wilman Tesis PDFJuan VasquezNo ratings yet
- Multimetro DigitalDocument9 pagesMultimetro DigitalJose Carlos Zevallos LopezNo ratings yet
- Curso FVHDocument50 pagesCurso FVHGonzalo BernalNo ratings yet
- Cert - Apoyo No. 4 Aislamiento Seguro de Plantas y EquiposDocument5 pagesCert - Apoyo No. 4 Aislamiento Seguro de Plantas y EquiposSergio David Guerrero LaverdeNo ratings yet
- Propuestas para Disminuir La ContaminaciónDocument4 pagesPropuestas para Disminuir La ContaminaciónLuis Enrique Paredes MaldonadoNo ratings yet
- Practica 08Document9 pagesPractica 08MarceloNo ratings yet
- CalderaDocument4 pagesCalderaDiana BustillosNo ratings yet
- S13 Sistema de Frenado Del VehículoDocument35 pagesS13 Sistema de Frenado Del Vehículoc07170100% (1)
- ZK6180BEVG CatalogoDocument1 pageZK6180BEVG Catalogocarlos moralesNo ratings yet
- Matriz ModalDocument5 pagesMatriz Modalchristian gonzalez100% (1)
- Memoria CalculoDocument7 pagesMemoria CalculoHuckleberry RiicoNo ratings yet
- Probador Audible de Continuidad JhonnyDocument9 pagesProbador Audible de Continuidad JhonnyJhonny Javier CasaNo ratings yet
- 1161-Texto Del Artículo-3966-1-10-20170315Document14 pages1161-Texto Del Artículo-3966-1-10-20170315Man MoralesNo ratings yet
- Anori Baxi CatalogoDocument8 pagesAnori Baxi CatalogoHelder LopesNo ratings yet
- Generalidades Sobre Las Radiaciones 2008Document48 pagesGeneralidades Sobre Las Radiaciones 2008Paulina GuevaraNo ratings yet
- Manual LX250 8Document34 pagesManual LX250 8carlosbeato86% (14)
- EvaporacionDocument18 pagesEvaporacionJeyson Alexander Vigo SaavedraNo ratings yet
- Arquitectura SustentableDocument60 pagesArquitectura SustentableRichard Valero QuispeNo ratings yet
- Yacumama (Quechua)Document44 pagesYacumama (Quechua)yanyoseNo ratings yet
- Los Aislantes Termicos y El Poliestireno E - Achipex SADocument3 pagesLos Aislantes Termicos y El Poliestireno E - Achipex SAkleinempfaengerNo ratings yet
- Normas de Seguridad en El Manejo de Explosivos y en La Destrucción de ExplosivosDocument23 pagesNormas de Seguridad en El Manejo de Explosivos y en La Destrucción de ExplosivosMiguelMondragonYuto100% (1)
- Circuito ElectricoDocument2 pagesCircuito Electricoflorelys diazNo ratings yet
- Curso Dimensionamiento Equipos de ProcesosDocument49 pagesCurso Dimensionamiento Equipos de ProcesosJarvikNo ratings yet
- Practica Punto Ebullicion PDFDocument9 pagesPractica Punto Ebullicion PDFくまのプーさん チトーNo ratings yet
- Impuesto Selectivo Al ConsumoDocument11 pagesImpuesto Selectivo Al ConsumoCeleste MontenegroNo ratings yet
- DMNX Enterprise Administration Guide ESDocument401 pagesDMNX Enterprise Administration Guide ESUriel VallejoNo ratings yet
- 1) Proyecto Oficial de Maquinas 1111Document81 pages1) Proyecto Oficial de Maquinas 1111ORESTES ALI MAYORGA RODRIGUEZNo ratings yet
- Fiche T300-ESP WEBDocument2 pagesFiche T300-ESP WEBJose MartinNo ratings yet
- Producción de Hidrógeno Vía Electrolítica para Su Uso en AutomociónDocument134 pagesProducción de Hidrógeno Vía Electrolítica para Su Uso en AutomociónLazaro100% (1)