Professional Documents
Culture Documents
Solubilidade Das Soluções PDF
Uploaded by
reykonpalOriginal Description:
Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Solubilidade Das Soluções PDF
Uploaded by
reykonpalCopyright:
Available Formats
Exercícios de Solubilidade das Soluções Volume molar a 12°C e pressão ambiente ..........................
24L/mol
(Com Gabarito) Volume da bolha a 12°C e pressão ambiente ......................
6,0 10–8L
Uma garrafa desse champanhe, resfriada a 12ºC, foi aberta
1) (Vunesp-2002) A poluição térmica, provocada pela à pressão ambiente e 0,10L de seu conteúdo foram
utilização de água de rio ou mar para refrigeração de usinas despejados em um copo. Nessa temperatura, 20% do gás
termoelétricas ou nucleares, vem do fato da água retornar dissolvido escapou sob a forma de bolhas. O número de
ao ambiente em temperatura mais elevada que a inicial. bolhas liberadas, no copo, será da ordem de
Este aumento de temperatura provoca alteração do meio a) 102
ambiente, podendo ocasionar modificações nos ciclos de b) 104
vida e de reprodução e, até mesmo, a morte de peixes e c) 105
plantas. O parâmetro físico-químico alterado pela poluição d) 106
térmica, responsável pelo dano ao meio ambiente, é: e) 108
(A) a queda da salinidade da água.
(B) a diminuição da solubilidade do oxigênio na água.
(C) o aumento da pressão de vapor da água.
4) (PUC - SP-2006) Os sais contendo o ânion nitrato (NO 3 )
(D) o aumento da acidez da água, devido a maior
dissolução de dióxido de carbono na água. são muito solúveis em água, independentemente do cátion
(E) o aumento do equilíbrio iônico da água. presente no sistema. Já o ânion cloreto (Cl –), apesar de
bastante solúvel com a maioria dos cátions, forma
substâncias insolúveis na presença dos cátions Ag+, Pb2+ e
2) (Mack-2004) Um exemplo típico de solução Hg2+.
supersaturada é: Em um béquer foram adicionados 20,0 mL de uma solução
a) água mineral natural. aquosa de cloreto de cálcio (CaCl2) de concentração
b) soro caseiro. 0,10mol/L a 20,0mL de uma solução aquosa de nitrato de
c) refrigerante em recipiente fechado. prata (AgNO3) de concentração 0,20mol/L. Após efetuada a
d) álcool 46°GL. mistura, pode-se afirmar que concentração de cada espécie
e) vinagre. na solução será
[Ag+] (mol/L) [Ca2+] (mol/L) [ Cl-] (mol/L)
[NO
3 ](mol/L)
3) (FUVEST-2006) A efervescência observada, ao se abrir
uma garrafa de champanhe, deve-se à rápida liberação, na A) 0 0,05 0 0,10
forma de bolhas, do gás carbônico dissolvido no líquido.
B) 0,20 0,10 0,20 0,20
Nesse líquido, a concentração de gás carbônico é
proporcional à pressão parcial desse gás, aprisionado entre C) 0,10 0,05 0,10 0,10
o líquido e a rolha. Para um champanhe de determinada
D) 0,10 0,05 0 0,10
marca, a constante de proporcionalidade (k) varia com a
temperatura, conforme mostrado no gráfico. E) 0 0,10 0 0,20
5) (UFSCar-2006) As solubilidades dos sais KNO3 e
Ce2(SO4)3 em água, medidas em duas temperaturas
diferentes, são fornecidas na tabela a seguir.
Sal Solubilidade, em g de sal/100g de água
10ºC 80ºC
KNO3 13,3 169,6
Ce2(SO4)3 10,1 2,2
Com base nestes dados, pode-se afirmar que:
Gás carbônico: A) a dissolução de KNO3 em água é um processo
Pressão parcial na garrafa de champanhe fechada, a 12°C exotérmico.
............. 6atm B) a dissolução de Ce2(SO4)3 em água é acompanhada de
Massa molar .................................. 44g/mol absorção de calor do ambiente.
1 | Projeto Medicina – www.projetomedicina.com.br
C) os dois sais podem ser purificados pela dissolução de b) a 0°C o nitrato de sódio é menos solúvel que o cloreto de
cada um deles em volumes adequados de água a 80ºC, potássio.
seguido do resfriamento de cada uma das soluções a 10ºC. c) o nitrato de sódio é a substância que apresenta a maior
D) se 110,1g de uma solução saturada de Ce2(SO4)3 a 10ºC solubilidade a 20°C.
forem aquecidos a 80ºC, observa-se a deposição de 2,2g do d) resfriando-se uma solução saturada de KClO3, preparada
sal sólido. com 100g de água, de 90°C para 20°, observa-se a se a
E) a adição de 100g de KNO3 a 100g de água a 80ºC dá precipitação de 30g desse sal.
origem a uma mistura homogênea. e) dissolvendo-se 15g de cloreto de potássio em 50g de
água a 40°C, obtém-se uma solução insaturada.
6) (PUC - SP-2006) Dados:
solubilidade do BaSO = 1,0 x 10-5 mol.L-1 8) (PUC - RJ-2008) Observe o gráfico abaixo.
solubilidade do CaSO = 5,0 x 10-3 mol.L-1
solubilidade do MgCO = 1,0 x 10-3 mol.L-1
solubilidade do Mg(OH) = 5,0 x 10-4 mol.L-1
solubilidade do NaC = 6,5 mol.L-1
Foram realizados 4 experimentos independentes, sendo
misturados volumes iguais de soluções aquosas dos
compostos indicados nas concentrações especificadas a
seguir.
Experimento 1:
BaCl2(aq) 1,0x10-3 mol.L-1 e Na2SO4 (aq) 1,0x10-3 mol.L-1
Experimento 2:
A quantidade de clorato de sódio capaz de atingir a
CaCl2 (aq) 6,0x10-3 mol.L-1 e Na2SO4 (aq) 1,0x10-2 mol.L-1
saturação em 500 g de água na temperatura de 60 °C, em
Experimento 3:
grama, é aproximadamente igual a:
MgCl2(aq) 1,0x10-2 mol.L-1 e Na2CO3 (aq) 1,0x10-3 mol.L-1
a) 70
Experimento 4:
b) 140
MgCl2(aq) 8,0x10-4 mol.L-1 e NaOH (aq) 1,0x10-4 mol.L-1
c) 210
d) 480
Houve formação de precipitado
e) 700
A) somente nos experimentos 1 e 3.
B) somente nos experimentos 2 e 4.
C) somente nos experimentos 1 e 4. 9) (UNICAMP-2009) A figura abaixo mostra a solubilidade
D) somente nos experimentos 1, 2 e 3. do gás ozônio em água em função da temperatura. Esses
E) em todos os experimentos. dados são válidos para uma pressão parcial de 3.000 Pa do
gás em contato com a água. A solubilização em água, nesse
caso, pode ser representada pela equação:
7) (Mack-2008) As curvas de solubilidade têm grande ozônio(g) + H2O(l) ozônio(aq)
importância no estudo das soluções, já que a temperatura a) Esboce, na figura apresentada abaixo, um possível
influi decisivamente na solubilidade das substâncias. gráfico de solubilidade do ozônio, considerando, agora,
Considerando as curvas de solubilidade dadas pelo gráfico, uma pressão parcial igual a 5.000 Pa. Justifique.
é correto afirmar que b) Considerando que o comportamento da dissolução,
apresentado na figura abaixo, seja válido para outros
valores de temperatura, determine a que temperatura a
solubilidade do gás ozônio em água seria nula. Mostre
como obteve o resultado.
a) há um aumento da solubilidade do sulfato de cério com o
aumento da temperatura.
2 | Projeto Medicina – www.projetomedicina.com.br
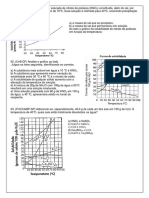
10) (Fuvest-1999)
NaCl e KCl são sólidos brancos cujas solubilidade em
água, a diferentes temperaturas, são dadas pelo gráfico A partir da análise desse gráfico, é CORRETO afirmar que
abaixo. Para distinguir os sais, três procedimentos foram os dois sistemas em que há precipitado são:
sugeridos: A) I e II.
I) Colocar num recipiente 2,5 g de um dos sais e 10,0 mL B) I e III.
de água e, em outro recipiente, 2,5 g do outro sal e 10,0 C) IV e V
mL de água. Agitar e manter a temperatura de 10 °C. D) V e VI.
II) Colocar num recipiente 3,6 g de um dos sais e 10,0 mL
de água e, em outro recipiente, 3,6 g do outro sal e 10,0
mL de água. Agitar e manter a temperatura de 28 °C. 13) (UFRJ-2002) Usando o diagrama de solubilidade abaixo,
III) Colocar num recipiente 3,8 g de um dos sais e 10,0 mL
determine a quantidade (em mols) de sal que precipita
de água e, em outro recipiente, 3,8 g do outro sal e 10,0
quando são adicionados 1,17 kg de NaNO3 em 1 litro de
mL de água. Agitar e manter a temperatura de 45 °C. água pura, a 20 0C.
Pode-se distinguir esses dois sais somente por meio:
a) do procedimento I.
b) do procedimento II.
c) do procedimento III.
d) dos procedimentos I e II.
e) dos procedimentos I e III.
11) (Unifesp-2002) Uma solução contendo 14g de cloreto 14) (Fuvest-2003) Uma mistura constituída de 45 g de
de sódio dissolvidos em 200mL de água foi deixada em um cloreto de sódio e 100 mL de água, contida em um balão e
frasco aberto, a 30°C. Após algum tempo, começou a inicialmente a 20 ºC, foi submetida à destilação simples,
cristalizar o soluto. Qual volume mínimo e aproximado, em sob pressão de 700 mm Hg, até que fossem recolhidos 50
mL, de água deve ter evaporado quando se iniciou a mL de destilado.
cristalização? O esquema abaixo representa o conteúdo do balão de
Dados: solubilidade, a 30°C, do cloreto de sódio = destilação, antes do aquecimento:
35g/100g de água; densidade da água a 30°C = 1,0g/mL.
A) 20.
B) 40.
C) 80.
D) 100.
E) 160.
12) (UFMG-2001) Seis soluções aquosas de nitrato de sódio,
NaNO3 , numeradas de I a VI, foram preparadas, em
diferentes temperaturas, dissolvendo-se diferentes massas a) De forma análoga à mostrada acima, represente a fase de
de NaNO3 em 100 g de água. Em alguns casos, o NaNO3 vapor, durante a ebulição.
não se dissolveu completamente. b) Qual a massa de cloreto de sódio que está dissolvida, a
Este gráfico representa a curva de solubilidade de NaNO3, 20 ºC, após terem sido recolhidos 50 L de destilado?
em função da temperatura, e seis pontos, que correspondem Justifique.
aos sistemas preparados: c) A temperatura de ebulição durante a destilação era igual,
maior ou menor que 97,4 ºC? Justifique.
Dados: Curva de solubilidade do cloreto de sódio em água:
3 | Projeto Medicina – www.projetomedicina.com.br
17) (Unifesp-2004) A lactose, principal açúcar do leite da
maioria dos mamíferos, pode ser obtida a partir do leite de
vaca por uma seqüência de processos. A fase final envolve
a purificação por recristalização em água. Suponha que,
para esta purificação, 100kg de lactose foram tratados com
100L de água, a 80°C, agitados e filtrados a esta
temperatura. O filtrado foi resfriado a 10°C. Solubilidade
da lactose, em kg/100L de H2O:
a 80°C .................. 95
a 10°C .................. 15
Ponto de ebulição da água pura a 700 mm Hg: 97,4 ºC A massa máxima de lactose, em kg, que deve cristalizar
com este procedimento é, aproximadamente,
15) (PUC - RJ-2005) As curvas de solubilidade das A) 5
substâncias KNO3 e Ca(OH)2 (em gramas da substância em B) 15.
100 g de água) em função da temperatura são mostradas C) 80
abaixo. A partir desses dados, analise as alternativas a D) 85.
seguir e assinale a que NÃO apresenta uma afirmativa E) 95
correta.
18) (ITA-2002) O frasco mostrado na figura abaixo contém
curva de solubilidade x temperatura para o KNO3 curva de solubilidade x temperatura para o Ca(OH) 2
uma solução aquosa saturada em oxigênio, em contato com
250 0,20 ar atmosférico, sob pressão de 1atm e temperatura de 25°C.
solubilidade (g/100 g de H2O)
solubilidade (g/100 g de H2O)
200
0,18
Quando gás é borbulhado através desta solução, sendo a
0,16
150
0,14
pressão de entrada do gás maior do que a pressão de saída,
100
0,12
de tal forma que a pressão do gás em contato com a solução
50
0
0,10 possa ser considerada constante e igual a 1atm, é
0 20 40 60
0
80 100 0,08 ERRADO afirmar que a concentração de oxigênio
temperatura ( C)
0,06
0 20 40 60 80 100 dissolvido na solução:
0
temperatura ( C)
Quando se adicionam 10,0 g de KNO3 em 12,0 g de água a
56 0C, se obtém uma solução insaturada.
Observa-se a formação de corpo de fundo quando uma
solução formada por 25 g de KNO3 e 50 g de água a 40 0C é
resfriada a 30 0C.
A solubilidade do nitrato de potássio aumenta com a
temperatura, enquanto a do hidróxido de cálcio diminui.
Duas substâncias puras podem apresentar a mesma curva de
A) permanece inalterada, quando o gás borbulhado, sob
solubilidade.
temperatura de 25°C, é ar atmosférico.
O hidróxido de cálcio é muito menos solúvel que o nitrato
B) permanece inalterada, quando o gás borbulhado, sob
de potássio em toda faixa de temperatura estudada.
temperatura de 25°C é nitrogênio gasoso.
C) aumenta, quando o gás borbulhado, sob temperatura de
15°C, é ar atmosférico.
16) (Fuvest-2002) Quando o composto LiOH é dissolvido D) aumenta, quando o gás borbulhado, sob temperatura de
em água, forma-se uma solução aquosa que contém os íons 25°C, é oxigênio praticamente puro.
Li (aq) + e OH (aq) . . Em um experimento, certo volume E) permanece inalterada, quando o gás borbulhado, sob
de solução aquosa de LiOH, à temperatura ambiente, foi temperatura de 25°C, é uma mistura de
adicionado a um béquer de massa 30,0 g, resultando na
massa total de 50,0 g. Evaporando a solução até a secura, a
massa final (béquer + resíduo) resultou igual a 31,0 g.
20) (Unifesp-2003) A fenolftaleína apresenta propriedades
Nessa temperatura, a solubilidade do LiOH em água é cerca
catárticas e por isso era usada, em mistura com á-lactose
de 11 g por 100 g de solução. Assim sendo, pode-se afirmar
monoidratada, na proporção de 1:4 em peso, na formulação
que, na solução da experiência descrita, a porcentagem, em
de um certo laxante. Algumas das propriedades dessas
massa, de LiOH era de
substâncias são dadas na tabela.
a) 5,0%, sendo a solução insaturada.
b) 5,0%, sendo a solução saturada.
c) 11%, sendo a solução insaturada.
d) 11%, sendo a solução saturada.
e) 20%, sendo a solução supersaturada.
4 | Projeto Medicina – www.projetomedicina.com.br
Temperatura g KNO3/100 g g CsNO3/100 g H2O
H2O
20oC 31,6 23,0
70oC 138,0 107,0
Deseja-se separar e purificar essas duas substâncias, em Em 100 g de uma amostra, contendo partes iguais de KNO3
uma amostra de 100g da mistura. Com base nas e CsNO3 foram adicionados 50 g de água a 70oC. Após
informações da tabela, foi proposto o procedimento resfriamento até 20oC, coletou-se o sólido cristalizado.
representado no fluxograma. Considerando-se que a solubilidade de um sal não é afetada
pela presença do outro sal, pode-se afirmar que se
cristalizaram
(A) 18,4 g de KNO3 e 27,0 g de CsNO3.
(B) 34,2 g de KNO3 e 38,5 g de CsNO3.
(C) 53,2 g de KNO3 e 42,0 g de CsNO3.
(D) 68,4 g de KNO3 e 77,0 g de CsNO3.
(E) 106,4 g de KNO3 e 84,0 g de CsNO3.
a) Supondo que não ocorram perdas nas etapas, calcule a
massa de lactose que deve cristalizar no procedimento
adotado.
b) Com relação à separação/purificação da fenolftaleína, 23) (ITA-2006) Considere um calorímetro adiabático e
• explique se o volume de etanol proposto é suficiente para isotérmico, em que a temperatura é mantida rigorosamente
dissolver toda a fenolftaleína contida na mistura. constante e igual a 40°C. No interior deste calorímetro é
• usando seus conhecimentos sobre a solubilidade do etanol posicionado um frasco de reação cujas paredes permitem a
em água, explique por que a adição de água à solução completa e imediata troca de calor. O frasco de reação
alcoólica provoca a cristalização da fenolftaleína. contém 100g de água pura a 40°C. Realizam-se cinco
experimentos, adicionando uma massa m1 de um sal X ao
frasco de reação. Após o estabelecimento do equilíbrio
21) (Vunesp-2005) Há décadas são conhecidos os efeitos da termodinâmico, adiciona-se ao mesmo frasco uma massa
fluoretação da água na prevenção da cárie dentária. Porém, m2 de um sal Y e mede-se a variação de entalpia de
o excesso de fluoreto pode causar a fluorose, levando, em dissolução ( H).
alguns casos, à perda dos dentes. Em regiões onde o
subsolo é rico em fluorita (CaF2), a água subterrânea, em
contato com ela, pode dissolvê-la parcialmente. Considere
que o VMP (Valor Máximo Permitido) para o teor de
fluoreto (F–) na água potável é 1,0mg x L–1 e que uma
solução saturada em CaF2, nas condições normais,
apresenta 0,0016% em massa (massa de soluto/massa de
solução) deste composto, com densidade igual a 1,0g x cm–
3
. Dadas as massas molares, em g x mol–1, Ca = 40 e F = 19,
é correto afirmar que, nessas condições, a água subterrânea
em contato com a fluorita:
A) nunca apresentará um teor de F– superior ao VMP.
B) pode apresentar um teor de F– até cerca de 8 vezes maior
que o VMP.
C) pode apresentar um teor de F– até cerca de 80 vezes
maior que o VMP.
D) pode apresentar um teor de F– até cerca de 800 vezes Utilizando estas informações e as curvas de solubilidade
maior que o VMP. apresentadas na figura, excluindo quaisquer condições de
E) pode apresentar valores próximos a 10 –1mol x L–1 em F–. metaestabilidade, assinale a opção que apresenta a
correlação CORRETA entre as condições em que cada
experimento foi realizado e o respectivo H.
22) (FMTM-2005) A tabela apresenta a solubilidade do A) Experimento 1: X = KNO3; m1 = 60g; Y = KNO3; m2 =
KNO3 e CsNO3 em água. 60g; H > 0
B) Experimento 2: X = NaClO3; m1 = 40g; Y = NaClO3; m2
= 40g; H > 0
C) Experimento 3: X = NaCl; m1 = 10g; Y = NaCl; m2 =
10g; H < 0
5 | Projeto Medicina – www.projetomedicina.com.br
D) Experimento 4: X = KNO3; m1 = 60g; Y = NaClO3; m2 = água (H2O) abaixo, indique a massa de K2SO4 que
60g; H = 0 precipitará quando a solução for devidamente resfriada de
E) Experimento 5: X = KNO3; m1 = 60g; Y = NH4Cl; m2 = 80°C até atingir a temperatura de 20°C.
60g; H < 0
Temperatura (°C) 0 20 40 60 80
100
K2SO4 (g) 7,1 10,0 13,0 15,5 18,0
24) (ITA-2002) Considere as seguintes afirmações relativas 19,3
ao gráfico apresentado abaixo:
A) 28 g
B) 18 g
C) 10 g
D) 8 g
26) (UFRN-2002) Durante uma atividade de laboratório,
Ana recebeu três frascos (I, II e III), cada qual contendo
uma substância sólida não identificada. O professor
informou que os frascos continham Mg(OH)2, Zn(OH)2 e
Ca(OH)2, cujas constantes de solubilidade, a 25 °C, eram
Mg(OH)2 Kps = 5,61 X 10-12
Ca(OH)2 Kps = 5,02 X 10-6
I. Se a ordenada representar a constante de equilíbrio de Zn(OH)2 Kps = 3,00 X 10-17
uma reação química exotérmica e a abscissa, a temperatura, Para identificar tais substâncias, Ana realizou o seguinte
o gráfico pode representar um trecho da curva relativa ao procedimento: inicialmente, usando água destilada,
efeito da temperatura sobre a constante de equilíbrio dessa preparou soluções saturadas das substâncias I, II e III. Em
reação. seguida, mediu a condutividade elétrica (a 25 °C) de cada
II. Se a ordenada representar a massa de um catalisador solução, verificando que os resultados obtidos satisfaziam a
existente em um sistema reagente e a abscissa, o tempo, o seguinte relação: (I) > (II) > (III). Concluindo o
gráfico pode representar um trecho relativo à variação da experimento, Ana identificou corretamente as substâncias
massa do catalisador em função do tempo de uma reação. dos frascos I, II e III, respectivamente, como:
III. Se a ordenada representar a concentração de um sal em A) Ca(OH)2, Zn(OH)2 e Mg(OH)2.
solução aquosa e a abscissa, a temperatura, o gráfico pode B) Ca(OH)2, Mg(OH)2 e Zn(OH)2.
representar um trecho da curva de solubilidade deste sal em C) Zn(OH)2, Ca(OH)2 e Mg(OH)2.
água. D) Mg(OH)2, Ca(OH)2 e Zn(OH)2.
IV. Se a ordenada representar a pressão de vapor de um
equilíbrio líquido gás e a abscissa, a temperatura, o
gráfico pode representar um trecho da curva de pressão de 27) (UFRJ-1999)
vapor deste líquido.
V. Se a ordenada representar a concentração de NO2 (g)
existente dentro de um cilindro provido de um pistão
móvel, sem atrito, onde se estabeleceu o equilíbrio N 2O4 (g)
2NO2 (g), e a abscissa, a pressão externa exercida sobre
o pistão, o gráfico pode representar um trecho da curva
relativa à variação da concentração de NO2 em função da
pressão externa exercida sobre o pistão, à temperatura
constante.
Destas afirmações, estão CORRETAS
A) apenas I e III.
B) apenas I, IV e V.
C) apenas II, III e V.
D) apenas II e V.
E) apenas III e IV. Os frascos a seguir contêm soluções saturadas de cloreto de
potássio (KCl) em duas temperaturas diferentes. Na
elaboração das soluções foram adicionados, em cada frasco,
25) (UFRN-2002) A dissolução de uma quantidade fixa de 400 mL de água e 200g de KCl (ver imagem 1).
um composto inorgânico depende de fatores tais como O diagrama a seguir representa a solubilidade do KCl em
temperatura e tipo de solvente. Analisando a tabela de água, em gramas de soluto/100 mL de H2O, em diferentes
solubilidade do sulfato de potássio (K2SO4) em 100 g de temperaturas (ver imagem 2).
6 | Projeto Medicina – www.projetomedicina.com.br
a) Determine a temperatura da solução do frasco I.
b) Sabendo que a temperatura do frasco II é de 20 ° C,
calcule a quantidade de sal (KCl) depositado no fundo do
frasco.
28) (UFRJ-2003) Industrialmente, a hidrólise de resíduos
celulósicos, visando à obtenção de açúcares, é realizada
pela ação do ácido sulfúrico, em temperatura e pressão
elevadas. Após a hidrólise, a solução apresenta
concentração de ácido sulfúrico igual a 49 g/L. Para
facilitar a purificação dos açúcares, a solução deve ser
neutralizada à temperatura de 50oC. As seguintes Considerando o gráfico, que representa a solubilidade do
substâncias foram disponibilizadas para a neutralização: KCl em água em função da temperatura, determine a que
óxido de cálcio (cal virgem), solução aquosa de hidróxido temperatura se deve resfriar a solução para que 40% do KCl
de sódio 0,5 mol/L e solução aquosa de hidróxido de cristalizem e classifique as soluções quanto à proporção
amônio 0,5 mol/L. entre soluto e solvente, antes e depois do resfriamento.
É desejável que, após a neutralização, a solução não tenha
sofrido um aumento significativo de volume e que não
apresente concentração elevada de íons. Baseado nas curvas 30) (Fuvest-2005) Industrialmente, o clorato de sódio é
de solubilidade dadas a seguir, indique qual é a substância produzido pela eletrólise da salmoura* aquecida, em uma
mais adequada para ser empregada na neutralização, cuba eletrolítica,
justificando a sua resposta. Escreva a equação da reação de tal maneira que o cloro formado no anodo se misture e
correspondente. Considere que a solubilidade dos diferentes reaja com o hidróxido de sódio formado no catodo.
sais na solução neutralizada seja a mesma que em água.
A solução resultante contém cloreto de sódio e clorato de
sódio.
2NaCl(aq) + 2H2O (l) → Cl2(g) + 2NaOH(aq) + H2(g)
3Cl2(g) + 6NaOH(aq) → 5NaCl(aq) + NaClO3(aq) +
29) (UFBA-2003) Uma amostra de material sólido, de massa 3H2O(l)
igual a 51,02g e contendo 98% de KCl, é dissolvida em Ao final de uma eletrólise de salmoura, retiraram-se da
100g de água a 80ºC e, em seguida, a solução resultante é cuba eletrolítica, a 90°C, 310g de solução aquosa saturada
colocada em repouso para que resfrie lentamente. Nessas tanto de cloreto de sódio quanto de clorato de sódio. Essa
condições, admite-se que, as impurezas são completamente amostra foi resfriada a 25°C, ocorrendo a separação de
solúveis e as perdas por evaporação da água são material sólido.
desprezíveis. a) Quais as massas de cloreto de sódio e de clorato de sódio
presentes nos 310g da amostra retirada a 90°C? Explique.
b) No sólido formado pelo resfriamento da amostra a 25°C,
qual o grau de pureza (% em massa) do composto presente
em maior quantidade?
c) A dissolução, em água, do clorato de sódio libera ou
absorve calor? Explique.
* salmoura = solução aquosa saturada de cloreto de sódio
7 | Projeto Medicina – www.projetomedicina.com.br
31) (ITA-2005) A 25°C, borbulha-se H2S(g) em uma solução 33) (ITA-2005) Esta tabela apresenta a solubilidade de
aquosa 0,020molL–1 em MnCl2, contida em um erlenmeyer, algumas substâncias em água, a 15°C:
até que seja observado o início de precipitação de MnS(s).
Neste momento, a concentração de H+ na solução é igual a Substância Solubilidade
2,5 10–7molL–1.
(g soluto/100gH2O)
Dados eventualmente necessários, referentes à temperatura
de 25°C: ZnS 0,00069
I. MnS(s) + H20(l) Mn2+(aq) + HS–(aq) + OH–(aq) ; KI =
ZnSO4 7H2O 96
3 10–11
II. H2S(aq) HS–(aq) + H+(aq) ; KII = 9,5 10–8 ZnSO3 2H2O 0,16
III. H20(l) OH–(aq) + H+(aq) ; KIII = 1,0 10–14 Na2S 9H2O 46
Assinale a opção que contém o valor da concentração, em
mol L–1, de H2S na solução no instante em que é observada Na2SO4 7H2O 44
a formação de sólido. Na2SO3 2H2O 32
A) 1,0 10–10
Quando 50mL de uma solução aquosa 0,10molL–1 em
B) 7 10–7 sulfato de zinco são misturados a 50mL de uma solução
C) 4 10–2 aquosa 0,010molL–1 em sulfito de sódio, à temperatura de
D) 1,0 10–1 15°C, espera-se observar
E) 1,5 104 A) a formação de uma solução não saturada constituída pela
mistura das duas substâncias.
B) a precipitação de um sólido constituído por sulfeto de
32) (FATEC-2006) A partir do gráfico abaixo são feitas as zinco.
afirmações de I a IV. C) a precipitação de um sólido constituído por sulfito de
zinco.
D) a precipitação de um sólido constituído por sulfato de
zinco.
E) a precipitação de um sólido constituído por sulfeto de
sódio.
Se acrescentamos 250 g de NH4NO3 a 50g de água a 60°C,
obteremos uma solução saturada com corpo de chão.
A dissolução, em água, do NH4NO3 e do Nal ocorre com
liberação de calor, respectivamente.
A 40°C, o Nal é mais solúvel que o NaBr e menos solúvel
que o NH4NO3.
Quando uma solução aquosa saturada de NH4NO3 ,
inicialmente preparada a 60°C, for resfriada a 10°C,
obteremos uma solução insaturada.
Está correto apenas o que se afirma em
a) I e II
b) I e III
c) I e IV
d) II e III
e) III e IV
8 | Projeto Medicina – www.projetomedicina.com.br
Gabaritos e Resoluções
1) Alternativa: B
2) Alternativa: C
3) Alternativa: D
4) Alternativa: A b)
36g de NaCl –––––––––– 100mL de H2O
5) Alternativa: E x –––––––––– 50mL de H2O
x = 18g de NaCl dissolvidos
6) Alternativa: A
c) Quando um solvente contém partículas dispersas, o seu
7) Alternativa: E ponto de ebulição aumenta (ebuliometria). Como o ponto
de ebulição da água pura a 700 mmHg é 97,4°C, o ponto de
8) Alternativa: E ebulição da água na solução é maior.
9) a) 15) Alternativa: D
16) Resposta: A
Resolução
Sabemos que:
massa total= massa béquer+ massa de solução
50 g= 30 g+ massa de solução
massa de solução= 20 g
Como, ao evaporarmos o solvente, a massa final resultou 31
g, concluímos que existia 1 g de hidróxido de lítio (LiOH)
dissolvido na solução.
Calculando a porcentagem em massa de LiOH temos:
% massa=(1g/20g)x100%= 5%
A curva para a pressão de 5.000 Pa está acima daquela para Como a solubilidade de LiOH em água é de 11% (11 g de
a pressão de 3.000 Pa, pois um aumento da pressão faz LiOH em 100 g de solução), concluímos que a solução está
aumentar a solubilidade do gás na água. insaturada.
b) Tomando-se um segmento linear da curva, teremos: y1 =
a x1 + b e y2 = a x2 + b. Tomando-se, por exemplo, os pares
(5;22 e 15;16), teremos:
a = (y2 – y1) / (x2 – x1) a = (22 -16) / (5 – 15) = a = - 17) Alternativa: C
0,60
b = y 1 – a x1 b = 22 – (-0,60 x 5) = 25,0 18) Alternativa: B
Assim, a solubilidade será zero para t = 41,7 °C (-0,60 x t +
25,0). 19) Resposta: V,V,F,F,F
10) Alternativa: C 20) a) 100g de mistura 20g de fenolftaleína
80g de -lactose · H2O
11) Alternativa: E
100mL etanol (25°C) dissolvem ----------------6,7g de
12) Alternativa: B fenolftaleína
350mL etanol (25°C) dissolvem ----------------x
13) Resposta: x = 23,45g de fenolftaleína.
1 mol de NaNO3 = 85 g
Solubilidade de NaNO3 a 20 C = 100 g/100ml = 1kg/L Conclusão:
Massa precipitada = 170 g = 2 mols Mistura (100g) Sólido = 80g de -lactose · H2O
Filtrado = 350mL etanol
14) Resposta: Nesse procedimento cristalizam 80g de -lactose · H2O.
a)
9 | Projeto Medicina – www.projetomedicina.com.br
Os 80g de -lactose · H2O dissolvem-se completamente Determinação da temperatura pela análise do gráfico
nos 100mL de H2O a 80°C, mas quando essa solução é Massa de KCl em solução: 50,0g 20,0g = 30,0g
resfriada a 25°C ocorre cristalização de parte da -lactose · Concentração final da solução: 30,0g de KCl em 100g de
H2O, pois: água.
Temperatura final: 20ºC.
100mL água (25°C) dissolvem -----------------25g de - Classificação das soluções antes e depois da cristalização
lactose · H2O As soluções inicial e final são saturadas.
Massa de -lactose · H2O cristalizada = 80 – 25 = 55g
b) • O volume de etanol (350mL) é suficiente para dissolver 30) A massa de solução colhida da cuba vale 310g, conclui-
toda a fenolftaleína (20g), como já foi justificado em (a). se que as massas presentes de NaCl e NaClO3 valiam,
• Ao adicionarmos água à solução de fenolftaleína em respectivamente, 40g e 170g.
etanol, há forte interação entre as moléculas de água e 94,6%
etanol (formação de pontes de hidrogênio), e isso diminui a A solubilidade de NaClO3 é favorecida pelo aquecimento.
disponibilidade de moléculas de etanol para dissolver a Logo, a dissolução desse sal é um processo endotérmico,
fenolftaleína, cristalizando-a. isto é, absorve calor.
21) Alternativa: B
22) Alternativa: B 31) Alternativa: D
23) Alternativa: B 32) Alternativa: B
24) Alternativa: E 33) Alternativa: A
25) Alternativa: D
26) Alternativa: B
27) Resposta:
a)
400 ml H2O 200g KCl
100 ml H2O x x = 50g KCl
No diagrama 50g KCl / 100 ml H2O 80 ºC
b)
No diagrama: 20 ºC 30g KCl / 100 ml H2O
30 100
x 400 x = 120g KCl em 400ml H2O
Quantidade depositada: 200 - 120 = 80 gramas
28) Resposta:
O CaO(s) não altera significativamente o volume da solução
neutralizada, a contrário dos demais neutralizantes que se
apresentam como soluções; o sal formado, CaSO4 , é
insolúvel não levando, pois, à ocorrência de concentração
elevada de íons;
CaO(s) + H2SO4 (aq) CaSO4 (s) + H2O
29) Massa de KCl dissolvido em 100g de água a 80ºC
Massa da amostra x percentagem de KCl
98
51,02g x = 49,999 50,0g
100
Massa de KC cristalizado
40
50,0g x = 20,0g
100
10 | Projeto Medicina – www.projetomedicina.com.br
You might also like
- Fisico Quimica Solubilidade Exercicios Gabarito PDFDocument10 pagesFisico Quimica Solubilidade Exercicios Gabarito PDFEmerson JuniorNo ratings yet
- Fisico Quimica Solubilidade ExerciciosDocument10 pagesFisico Quimica Solubilidade ExerciciosRubia MariathNo ratings yet
- Solubilidade de sais e efeitos da temperaturaDocument10 pagesSolubilidade de sais e efeitos da temperaturaLuana GregórioNo ratings yet
- Apostila QUÍMICA Com GabaritoDocument39 pagesApostila QUÍMICA Com GabaritoMichelle Alkmim50% (2)
- Lista+de+exercícios+para+1 +prova+Quimica+AnalíticaDocument5 pagesLista+de+exercícios+para+1 +prova+Quimica+Analíticabenedito.nasaNo ratings yet
- A) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Document5 pagesA) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Ágata Ferreira S.1.T.10No ratings yet
- Coeficiente de SolubilidadeDocument5 pagesCoeficiente de SolubilidadeRubia MariathNo ratings yet
- Solubilidade de sais: conceitos e curvas de solubilidadeDocument12 pagesSolubilidade de sais: conceitos e curvas de solubilidadeCarolynne MourãoNo ratings yet
- Soluções químicas e concentraçõesDocument39 pagesSoluções químicas e concentraçõesbio1988No ratings yet
- Solucoes PDFDocument15 pagesSolucoes PDFThiago Magno Tavares Machado100% (1)
- Lista de Exerc DensidadeDocument6 pagesLista de Exerc DensidadeRtyu IuytNo ratings yet
- Solução aquosa saturada de saisDocument4 pagesSolução aquosa saturada de saisMarko Aurelio Ferreira Da CostaNo ratings yet
- Soluções (Curvas de SolubilidadeDocument38 pagesSoluções (Curvas de SolubilidadeGleisonNo ratings yet
- Curva de solubilidade de cloreto de amônioDocument83 pagesCurva de solubilidade de cloreto de amônioThiago Alonso Rodrigues da Hora67% (3)
- DL 50Document11 pagesDL 50Rita Sofia Ramos MesquitaNo ratings yet
- 11FQ SolubilidadeDocument9 pages11FQ SolubilidadeJoana GulamhussenNo ratings yet
- 12 - Soluções Curvas de SolubilidadeDocument4 pages12 - Soluções Curvas de SolubilidadeRodrigo MetteNo ratings yet
- Equilibrio Quimico e Ionico Quimica Equilibrio IonicoDocument4 pagesEquilibrio Quimico e Ionico Quimica Equilibrio IonicoPaula SouzaNo ratings yet
- Solubilidade e curvas de solubilidadeDocument19 pagesSolubilidade e curvas de solubilidadeJoão PauloNo ratings yet
- DispersõeDocument5 pagesDispersõeHelton ClistenesNo ratings yet
- Solubilidade de sais em função da temperaturaDocument2 pagesSolubilidade de sais em função da temperaturalopesqui1766No ratings yet
- Exercicios SolucoesDocument12 pagesExercicios SolucoesEraclitoSL91% (11)
- 2012 - TMedicina - Quimica - Borges - Exercícios de Solubilidade - SiteDocument12 pages2012 - TMedicina - Quimica - Borges - Exercícios de Solubilidade - SiteDhieniffer FerreiraNo ratings yet
- Soluções e equilíbrio de solubilidadeDocument5 pagesSoluções e equilíbrio de solubilidadeneves312No ratings yet
- Exercicios 3 EstequiometriaDocument1 pageExercicios 3 EstequiometriaBruno OnofreNo ratings yet
- Capítulo 1 - SoluçõesDocument18 pagesCapítulo 1 - SoluçõesGerson LimaNo ratings yet
- Equilíbrio de SolubilidadeDocument3 pagesEquilíbrio de SolubilidadeAlda Maria Dinis GinjaNo ratings yet
- Lista de exercícios de equilíbrio químico e solubilidadeDocument2 pagesLista de exercícios de equilíbrio químico e solubilidadeRafael VictorNo ratings yet
- Prova de Estequiometria - Análise de Composição de MisturasDocument8 pagesProva de Estequiometria - Análise de Composição de Misturasadfs sadfasdfNo ratings yet
- SolubilidadeDocument38 pagesSolubilidadeLXM10% (1)
- Química: 3 Lista de ResoluçãoDocument5 pagesQuímica: 3 Lista de ResoluçãoJader Pereira de AraujoNo ratings yet
- 11FQA Ficha Trab Ini Q2.3 - N.º 1Document3 pages11FQA Ficha Trab Ini Q2.3 - N.º 1Andrei GalanNo ratings yet
- Coeficiente de SolubilidadeDocument38 pagesCoeficiente de SolubilidadeMarguiené BragaNo ratings yet
- Questoes-Solucoes-2º AnoDocument8 pagesQuestoes-Solucoes-2º AnoJonathan SoaresNo ratings yet
- Idade revelada pelo bolo de aniversárioDocument31 pagesIdade revelada pelo bolo de aniversárioJoão Victor PereiraNo ratings yet
- Soluções Aquosas e Equilíbrio de SolubilidadeDocument6 pagesSoluções Aquosas e Equilíbrio de SolubilidadeTiago SerranoNo ratings yet
- Soluções - PPM e TituloDocument37 pagesSoluções - PPM e TituloAna Beatriz OliveiraNo ratings yet
- Exercicios de SolubilidadeDocument6 pagesExercicios de Solubilidadesua mae de 4No ratings yet
- Gama - Módulo 19Document23 pagesGama - Módulo 19Koelho CoelhoNo ratings yet
- 56 20produto 20de 20solubilidade 20 - 20KpsDocument32 pages56 20produto 20de 20solubilidade 20 - 20KpsBelucio PedroNo ratings yet
- 126 Quimica ITA 95Document8 pages126 Quimica ITA 95Everton SilvaNo ratings yet
- 16 SolubilidadeDocument7 pages16 SolubilidadeFRANKE MERO TESTENo ratings yet
- Soluções saturadas de sais: propriedades e aplicaçõesDocument2 pagesSoluções saturadas de sais: propriedades e aplicaçõesromezioh7716No ratings yet
- EstequiometriaDocument21 pagesEstequiometriaWesley de PaulaNo ratings yet
- Solubilidade de sais em solventes diferentesDocument45 pagesSolubilidade de sais em solventes diferentesProfAlexandreOliveiraIINo ratings yet
- Exerc Equil-Analitica222Document4 pagesExerc Equil-Analitica222JefferoiNo ratings yet
- Solução saturada de ácido bóricoDocument3 pagesSolução saturada de ácido bóricoAlex CardozoNo ratings yet
- Reações InorgânicasDocument17 pagesReações InorgânicasPaulo Esteves NetoNo ratings yet
- Upe Qui2 2004Document4 pagesUpe Qui2 2004SCHELLDON DINIZNo ratings yet
- 16 SolubilidadeDocument6 pages16 SolubilidadeEverton FisicoNo ratings yet
- Lista Química 2º (A, B, C e D)Document4 pagesLista Química 2º (A, B, C e D)wwwisaque18No ratings yet
- IonicoDocument4 pagesIonicoJardel DibobuaneNo ratings yet
- Apostila Química Orgânica: Carbono, Dienos E AromáticosFrom EverandApostila Química Orgânica: Carbono, Dienos E AromáticosNo ratings yet
- Utilização do lodo gerado na ETA de Alvorada-RS na fabricação de blocos cerâmicosFrom EverandUtilização do lodo gerado na ETA de Alvorada-RS na fabricação de blocos cerâmicosNo ratings yet
- Apostila Química Orgânica: Terpenos E Rotas De SínteseFrom EverandApostila Química Orgânica: Terpenos E Rotas De SínteseNo ratings yet
- Como elaborar um resumo escritoDocument4 pagesComo elaborar um resumo escritoreykonpalNo ratings yet
- Óptica Geométrica - Lentes, instrumentos ópticos e óptica da visãoDocument46 pagesÓptica Geométrica - Lentes, instrumentos ópticos e óptica da visãoreykonpalNo ratings yet
- 02 - Mande Bem Na RedaçãoDocument24 pages02 - Mande Bem Na RedaçãoAndré BarbosaNo ratings yet
- RelatórioDocument10 pagesRelatórioreykonpalNo ratings yet
- Exercícios Concentração Molaridade GabaritoDocument10 pagesExercícios Concentração Molaridade GabaritoSelly LiraNo ratings yet
- Cartilha IBAPESPDocument26 pagesCartilha IBAPESPEmerson FittipaldiNo ratings yet
- Fundamentos Patologia Estruturas Pericias EngenhariaDocument58 pagesFundamentos Patologia Estruturas Pericias EngenhariaSogamesfm Flavio MacedoNo ratings yet
- Curso 23068 Aula 02 v3Document49 pagesCurso 23068 Aula 02 v3reykonpalNo ratings yet
- Análises de estabilidade e compressibilidade de aterros sobre solos molesDocument142 pagesAnálises de estabilidade e compressibilidade de aterros sobre solos molesreykonpalNo ratings yet
- Curso 23069 Aula 05 v1Document68 pagesCurso 23069 Aula 05 v1reykonpalNo ratings yet
- RedaçãoDocument15 pagesRedaçãoreykonpalNo ratings yet
- Cinética Química PDFDocument33 pagesCinética Química PDFreykonpalNo ratings yet
- Inca Agrotoxicos 06 Abr 15Document5 pagesInca Agrotoxicos 06 Abr 15Murilo Marques FilhoNo ratings yet
- Adjetivos pátrios e gentílicosDocument18 pagesAdjetivos pátrios e gentílicosreykonpalNo ratings yet
- ProjetDocument16 pagesProjetreykonpalNo ratings yet
- Simulados 2018Document1 pageSimulados 2018reykonpalNo ratings yet
- Análise sintáticaDocument33 pagesAnálise sintáticaMarquinhos Sabino100% (2)
- Curso 23073 Aula 00 v2Document76 pagesCurso 23073 Aula 00 v2reykonpalNo ratings yet
- UIA1Document38 pagesUIA1reykonpal100% (1)
- Etapa: Questão H 04Document1 pageEtapa: Questão H 04reykonpalNo ratings yet
- Atualidades Na Saúde Pública: Updates On Public HealthDocument1 pageAtualidades Na Saúde Pública: Updates On Public HealthreykonpalNo ratings yet
- Inca Agrotoxicos 06 Abr 15Document5 pagesInca Agrotoxicos 06 Abr 15Murilo Marques FilhoNo ratings yet
- Matematica para VenDocument32 pagesMatematica para VenRaphael Vicente100% (1)
- 1523056447guia Enem 2018Document64 pages1523056447guia Enem 2018Fernando NunesNo ratings yet
- Matematica para VenDocument32 pagesMatematica para VenRaphael Vicente100% (1)
- Comentario 288 Mais Enem PDFDocument33 pagesComentario 288 Mais Enem PDFRayssa PinheiroNo ratings yet
- Lista De Exercícios Sistemas Soloidais: μ = 10430Cp e ν = 174StDocument3 pagesLista De Exercícios Sistemas Soloidais: μ = 10430Cp e ν = 174StCamila RiguettiNo ratings yet
- Equação de Nernst: resolução de questões sobre potencial eletroquímicoDocument26 pagesEquação de Nernst: resolução de questões sobre potencial eletroquímicoLucas SantosNo ratings yet
- Atividade 23-07 Concentração MolarDocument1 pageAtividade 23-07 Concentração MolarAlfredo Sahade VespaNo ratings yet
- Falha de Energia de EmpilhamentoDocument60 pagesFalha de Energia de EmpilhamentoElenildo SilvaNo ratings yet
- Experimentos Qoi - CompiladosDocument38 pagesExperimentos Qoi - CompiladosCaroline KeladeNo ratings yet
- Análise de tecidosDocument26 pagesAnálise de tecidosFelipe Kreft BatistaNo ratings yet
- Concentração Soluções QuímicaDocument11 pagesConcentração Soluções QuímicaZilene AlvesNo ratings yet
- Guia de Coleta e Preservação de Amostra - CETESBDocument7 pagesGuia de Coleta e Preservação de Amostra - CETESBWilson JoséNo ratings yet
- Oxidação do Mentol a Mentona com Água SanitáriaDocument7 pagesOxidação do Mentol a Mentona com Água SanitáriaStefany Thábian VieiraNo ratings yet
- Importancia de Ter Agua Destilada PDFDocument7 pagesImportancia de Ter Agua Destilada PDFMax NunesNo ratings yet
- ExercíciosDocument2 pagesExercíciosLara SousaNo ratings yet
- Estudo Dirigido - TermoquimicaDocument4 pagesEstudo Dirigido - TermoquimicaThiago HenriquesNo ratings yet
- Nutrição Parenteral - Farmácia Hospitalar - Caroline Tannus - UNIMEDocument5 pagesNutrição Parenteral - Farmácia Hospitalar - Caroline Tannus - UNIMEEtcy TalNo ratings yet
- Propriedades Coligativas e Diagrama de FasesDocument12 pagesPropriedades Coligativas e Diagrama de FasesIsmael FreireNo ratings yet
- Simulação FT 11QDocument3 pagesSimulação FT 11QSérgio Marques100% (1)
- Apostila - Aulas Práticas de Ciência Dos MateriaisDocument34 pagesApostila - Aulas Práticas de Ciência Dos MateriaisKarine SNo ratings yet
- Relatório 4 - QA - Separação de Cátions Do Grupo IIIADocument5 pagesRelatório 4 - QA - Separação de Cátions Do Grupo IIIAEmílioDosSantosNo ratings yet
- Relatório Aula Prática Sistema TampãoDocument8 pagesRelatório Aula Prática Sistema TampãoRenas Pereira100% (3)
- Planejamento da Proposta Curricular de QuímicaDocument6 pagesPlanejamento da Proposta Curricular de QuímicaClaudinei Osorio de OliveiraNo ratings yet
- ABNT NBR 15693-Ensaios Não Destrutivos-Teste Por Pontos - 2013Document29 pagesABNT NBR 15693-Ensaios Não Destrutivos-Teste Por Pontos - 2013ALEX100% (1)
- 2 - RESUMO FARMACOTÉCNICA - Bloco 2Document24 pages2 - RESUMO FARMACOTÉCNICA - Bloco 2Beatriz Silva0% (1)
- Exercicio ResolDocument9 pagesExercicio ResolMarcio DanielNo ratings yet
- Procedimento Modelo Petrobras Jan 05Document6 pagesProcedimento Modelo Petrobras Jan 05orea1No ratings yet
- DesgaseificaçãoDocument2 pagesDesgaseificaçãoGabriel PortoNo ratings yet
- Document - Onl - Cosmetologia Avanada Programa de Disciplina Cosmetologia Prista LN ManualDocument84 pagesDocument - Onl - Cosmetologia Avanada Programa de Disciplina Cosmetologia Prista LN ManualAngélicaNo ratings yet
- Relatório 5Document6 pagesRelatório 5Keoma Lima CavalcanteNo ratings yet
- Extração de óleos e graxas em esgoto com hexanoDocument8 pagesExtração de óleos e graxas em esgoto com hexanoDario Ramos LemosNo ratings yet
- DESINFECÇÃODocument16 pagesDESINFECÇÃOFlavio Jorge Miranda PimentelNo ratings yet
- Materiais e reagentes para teste de miscibilidade e solubilidadeDocument2 pagesMateriais e reagentes para teste de miscibilidade e solubilidadeAlejandra GalterNo ratings yet
- Introdução Ao Laboratório FarmacotécnicoDocument6 pagesIntrodução Ao Laboratório FarmacotécnicoBrenda Cristina de Souza100% (1)