Professional Documents
Culture Documents
Cinetica Quimica
Uploaded by
Ismaél TerraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cinetica Quimica
Uploaded by
Ismaél TerraCopyright:
Available Formats
Unidad 3: Cintica qumica I.E.S.
Clara Campoamor (Getafe)
CINTICA QUMICA
CONTENIDOS
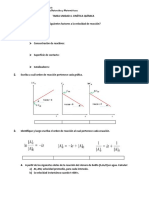
1.- Velocidad de reaccin (estudio cualitativo).
1.1. Expresin de la velocidad de una reaccin qumica.
1.2. Factores que afectan a la velocidad de una reaccin.
2.- Ecuacin y constante de velocidad.
2.1. Orden de reaccin. Forma de determinarlo.
3.- Mecanismos de reaccin. Molecularidad.
4.- Teora de las colisiones. Energa de activacin (Ea).
5.- Factores de los que depende la velocidad de una reaccin qumica:
5.1. Estado fsico y concentracin de los reactivos.
5.2. Temperatura (ecuacin de Arrhenius).
5.3. Catalizadores.
6.- Utilizacin de catalizadores en procesos de inters industrial y biolgico.
VELOCIDAD DE REACCIN.
Cuando se produce una reaccin qumica, las concentraciones de cada uno de los
reactivos y productos va variando con el tiempo, hasta que se produce el equilibrio qumi-
co, en el cual las concentraciones de todas las sustancias permanecen constantes.
La velocidad de una reaccin es la deriva-
[HI] da de la concentracin de un reactivo o producto
con respecto al tiempo tomada siempre como
valor positivo.
La velocidad de formacin de Es decir, es el cociente de la variacin de
un producto d[HI]/dt (tangente) la concentracin de algn reactivo o producto
va disminuyendo con el tiempo por unidad de tiempo cuando los intervalos de
tiempo tienden a 0.
t (s)
[Sustancia] d[Sustancia]
v = lim =
t 0 t dt
Ejemplo de velocidad de reaccin:
Tiempo (s) [Br2] (mol/l) vel. media
0 0,0120
3,8 x 105
50 0,0101
3,4 x 105
100 0,0084
2,6 x 105
150 0,0071
F. Javier Gutirrez Rodrguez Pgina 1 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
Sea la reaccin: Br2(ac) + HCOOH(ac) 2,4 x 105
2 HBr(ac) + CO2(g) 200 0,0059
Vamos a estudiar como vara la concentracin de Br2 a lo largo del tiempo:
La velocidad puede expresarse como:
d [Br2 ] d [HCOOH ] d [CO2 ] d [HBr ]
v
dt dt dt 2dt
Parece claro que la velocidad de aparicin de HBr ser el doble que la de aparicin
de CO2 por lo que en este caso la velocidad habr que definirla como la mitad de la deri-
vada de [HBr] con respecto al tiempo.
Expresin de la velocidad de una reaccin qumica
En la reaccin estndar: a A +b B c C +d D
d [ A] d [B ] d [C ] d [D ]
v
a dt b dt c dt d dt
Como la velocidad es positiva segn transcurre la reaccin hacia la derecha, es de-
cir segn va desapareciendo los reactivos, es necesario poner un signo delante de las
concentraciones de stos.
Ejemplo:
Expresar la velocidad de la siguiente reaccin qumica en funcin de la concentracin de
cada una de las especies implicadas en la reaccin: 4 NH3 (g) + 3 O2 (g) 2 N2 (g) + 6
H2O (g)
d [NH3 ] d [O2 ] d [N2 ] d [H2O]
v
4 dt 3 dt 2 dt 6 dt
ECUACIN DE VELOCIDAD
En general, la velocidad depende de las concentraciones de los reactivos siguiendo
una expresin similar a la siguiente para la reaccin estndar: a A + b B c C + d D
v k [ A]n [B]m
Es importante sealar que m y n no tienen porqu coincidir con los coeficientes
estequiomtricos a y b, sino que se determinan experimentalmente.
A la constante k se le denomina constante de velocidad (No confundir con KC o KP)
F. Javier Gutirrez Rodrguez Pgina 2 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
Ejemplos:
Las reacciones: a) H2 (g) + I2 (g) 2 HI (g) y b) H2 (g) + Br2 (g) 2 HBr (g)
tienen ecuaciones de velocidad diferentes: a) v = k x [H2] x [I2] b) v = k x [H2] x [Br2]1/2
Nota: El valor de k depende de cada reaccin.
Orden de reaccin
En la expresin: v = k [A]nx[B]m se denomina orden de reaccin al valor suma de
los exponentes n + m.
Se llama orden de reaccin parcial a cada uno de los exponentes. Es decir, la reac-
cin anterior es de orden n con respecto a A y de orden m con respecto a B.
Ejemplo:
Determina los rdenes de reaccin total y parciales de las reacciones anteriores:
a) H2 (g) + I2 (g) 2 HI (g) v = k x [H2] x [I2]
b) H2 (g) + Br2 (g) 2 HBr (g) v = k x [H2] x [Br2]1/2
a) H2 (g) + I2 (g) 2 HI (g) v = k x [H2] x [I2]
Reaccin de segundo orden (1 + 1)
De primer orden respecto al H2 y de primer orden respecto al I2.
b) H2 (g) + Br2 (g) 2 HBr (g) v = k x [H2] x [Br2]1/2
Reaccin de orden 3/2 (1 + )
De primer orden respecto al H2 y de orden respecto al Br2.
Determinacin de la ecuacin de velocidad
Consiste en medir la velocidad inicial manteniendo las concentraciones de todos los
reactivos constantes excepto la de uno y ver cmo afecta la variacin de ste al valor de
la velocidad.
Si por ejemplo, al doblar la concentracin de un reactivo la velocidad se multiplica
por cuatro, podemos deducir que el orden parcial respecto a ese reactivo es 2.
Experiencia [CH3-Cl] (mol/l) [H2O] (mol/l) v (moll1s
1)
1 0,25 0,25 2,83
2 0,50 0,25 5,67
F. Javier Gutirrez Rodrguez Pgina 3 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
Ejemplo: 3 0,25 0,5 11,35
Determinar el orden de reaccin: CH3-Cl(g) + H2O(g) CH3-OH(g) + HCl(g) usando los
datos de la tabla.
v k [CH3 -Cl]n [H2 O]m
En las experiencias 1 y 2 vemos que no cambia [H 2O] luego el cambio de v se de-
be al cambio de [CH3-Cl ]. Como al doblar [CH3-Cl] se dobla la velocidad podemos deducir
que el orden de reaccin r especto del CH3-Cl es 1.
En las experiencias 1 y 3 vemos que no cambia [CH3-Cl] luego el cambio de v se
debe al cambio de [H2O]. Como al doblar [H2O] se cuadruplica la velocidad podemos de-
ducir que el orden de reaccin respecto del H2O es 2.
Por tanto, la ecuacin de velocidad en este caso se expresar:
v k [CH3 -Cl] [H2 O]2
Y el orden total de la reaccin es 3. El valor de k se calcula a partir de cualquier
experiencia y resulta 181,4 mol2L2s 1.
Para determinar los rdenes de reaccin, tambin puede usarse logaritmos:
log v = log k + n x log [CH3-Cl ] + m x log [H2O]
Aplicamos dicha expresin a cada experimento:
(1) log 2,83 = log k + n x log 0,25 M + m x log 0,25 M
(2) log 5,67 = log k + n x log 0,50 M + m x log 0,25 M
(3) log 11,35 = log k + n x log 0,25 M + m x log 0,50 M
Si restamos dos ecuaciones en las que se mantenga constante uno de los reactivos,
podremos obtener el orden de reaccin parcial del otro. As, al restar (1) (2) eliminamos
k y [H2O]:
log (2,83/5,67) = n x log (0,25/0,50)
Anlogamente restando (1) (3) eliminamos k y [CH3-Cl]
log (2,83/11,35) = m x log (0,25/0,50)
2,83 2,83
log log
5,67 11,35
n 1 ; m 2
0,25 0,25
log log
0,50 0,50
F. Javier Gutirrez Rodrguez Pgina 4 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
Ejercicio A:
En la obtencin del cido ntrico, una de las etapas principales es la oxidacin del xido
ntrico a dixido de nitrgeno: 2 NO(g) + O2(g) 2 NO2(g). Para esta reaccin, se ha de-
terminado experimentalmente que su ecuacin de velocidad es: v = k [NO] 2 [O2] y que la
constante de velocidad, a 250 C, vale: k = 6,5 . 10 -3 mol-2L2s-1. Calcular la velocidad de
oxidacin del NO, a dicha temperatura, cuando las concentraciones iniciales (mol L -1) de
los reactivos son: a) [NO] = 0,100 M ; [O2] = 0,210 M; b) [NO] = 0,200 M; [O2] = 0,420 M.
Ejercicio B:
El oxido ntrico, NO, reacciona con hidrgeno formando xido nitroso, N 2O: 2NO(g) +
H2(g) N2O (g) + H2O (g). En una serie de experimentos se han obtenidos los siguientes
resultados: Determinar la ecuacin de la velocidad y calcular el valor de la constante de
velocidad.
Experiencia Concentracin inicial (mol L-1) Velocidad inicial (mol L-1s-1)
[NO] [H2]
1 0,064 0,022 2,6 . 10-2
2 0,064 0,044 5,2 . 10-2
3 0,128 0,022 0,10
MECANISMOS DE REACCIN. MOLECULARIDAD.
La reaccin: H2 (g) + I2 (g) 2 HI (g), cuya ecuacin de velocidad tiene la forma:
v = k [H2] x [I2], es una reaccin elemental (que sucede en una sola etapa) y para que su-
ceda es necesario el choque de dos molculas (una de H2 y otra de I2). Se dice que es
una reaccin bimolecular.
Se llama molecularidad al nmero de molculas de reactivos que colisionan simul-
tneamente para formar el complejo activado en una reaccin elemental. Se trata de un
nmero entero y positivo. As hablamos de reacciones unimoleculares, bimoleculares, tri-
moleculares, etc Generalmente, en reacciones elementales, coincide con el orden de
reaccin. Sin embargo, existen casos en los que no coinciden, como las reacciones de
hidrlisis en los que interviene una molcula de agua ya que al ser [H 2O] prcticamente
constante la velocidad es independiente de sta.
Es raro que una reaccin intervengan ms de tres molculas, pues es muy poco
probable que chocan entre s simultneamente con la energa y orientacin adecuadas.
Por dicha razn, la mayora de las reacciones suceden en etapas. El conjunto de es-
tas etapas se conoce como mecanismo de la reaccin. Las sustancias que van apare-
ciendo y que no son los productos finales se conocen como intermedios de reaccin.
F. Javier Gutirrez Rodrguez Pgina 5 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
La velocidad de la reaccin depender de las sustancias que reaccionen en la etapa
ms lenta.
Ejemplo de mecanismo de reaccin :
La reaccin siguiente: NO2 (g) + CO (g) NO (g) + CO2 (g) sucede en dos etapas:
1 etapa (lenta): 2 NO2 NO + NO3
2 etapa (rpida): NO3 + CO NO2 + CO2
La reaccin global es la suma de las dos. NO3 es un intermedio de reaccin.
Como en la etapa lenta intervienen dos molculas de NO2, v = k x [NO2]2
TEORA DE LAS COLISIONES. ENERGA DE ACTIVACIN (EA).
El nmero de molculas de pro-
ductos es proporcional al nmero de Productos
choques entre las molculas de los H H
reactivos. De stos, no todos son efec- H I I
tivos, bien porque no tienen la energa 2 I2
necesaria para constituir el complejo Complejo Choque eficaz
activado, (asociacin transitoria de Reactivos activado
molculas muy inestable, porque su I
energa es mayor a la de reactivos y H2 H H 2
productos por separado, pero por el 2 2
cual debe transcurrir necesariamente Choque no eficaz
la reaccin), o bien porque no tienen la Orientacin en el choque.
orientacin adecuada.
La energa de activacin es la necesaria para formar el complejo activado, a partir
del cual la reaccin transcurre de forma natural.
Ver vdeoclip (flash) (gif)
F. Javier Gutirrez Rodrguez Pgina 6 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
Perfil de una reaccin.
Entalpa
Complejo activado Complejo activado
Energa de activacin
productos
reactivos
reactivos
productos Entalpa de reaccin (H)
Reaccin exotrmica Reaccin endotrmica
FACTORES DE LOS QUE DEPENDE LA VELOCIDAD DE UNA REAC-
CIN QUMICA.
Naturaleza de las sustancias.
Estado fsico.
Superficie de contacto o grado de pulverizacin (en el caso de slidos)
Concentracin de los reactivos.
Temperatura.
Presencia de catalizadores.
Estado fsico de los reactivos.
Cuando los reactivos se encuentran en estado gaseoso o en disolucin las reaccio-
nes son ms rpidas que si se encuentran en estado lquido o slido.
En las reacciones heterogneas la velocidad depender de la superficie de contacto
entre ambas fases, siendo mayor cuanto mayor es el grado de pulverizacin.
Concentracin de los reactivos.
En la ecuacin de velocidad ya observamos la influencia que tenan los reactivos o
al menos alguno de ellos en la velocidad de la reaccin. En general, al aumentar la con-
centracin de stos se produce con mayor facilidad el choque entre molculas y aumenta
la velocidad.
F. Javier Gutirrez Rodrguez Pgina 7 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
Temperatura. (Ecuacin de Arrhenius).
Fraccin de molcu-
T1
La constante de velocidad, y por tanto EA
la velocidad de una reaccin, aumenta si
aumenta la temperatura, porque la fraccin
de molculas que sobrepasan la energa
T2
de activacin es mayor. As, a T2 hay un
mayor porcentaje de molculas con ener-
las
ga suficiente para producir la reaccin Energa
(rea sombreada) que a T1.
La variacin de la constante de la velocidad con la temperatura viene recogida en la
ecuacin de Arrhenius:
EA
k Ae RT
k = const. de velocidad
A = constante
T = temp. absoluta
Normalmente se expresa de forma logartmica para calcular EA.
EA
ln k ln A
R T
Ejemplo:
Cual es el valor de la energa de activacin para una reaccin si la constante de veloci-
dad se duplica cuando la temperatura aumenta de 15 a 25 C?
Sabemos que k2 (298 K) = 2 x k1 (288 K)
(1) ln k1 = ln A Ea/RT1; (2) ln 2 k1 = ln A Ea/RT2
Sustituyendo R = 8,31 Jmol1 K, T1 = 288 K y T2 = 298 K y restando (2) (1):
EA EA
ln 2
8,31 J mol 298 K 8,31 J mol 1288 K
1 1
Despejando EA se obtiene: E A 4,95 104 J mol 1
Catalizadores
EA sin catalizador
Intervienen en alguna etapa de la
Energa
reaccin pero no se modifican, pues se EA con catalizador
recuperan al final y no aparecen en la
reactivos H
F. Javier Gutirrez Rodrguez Pgina 8 de 11
productos
coordenada de reaccin
Perfil de la reaccin con y sin catalizador
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
ecuacin global ajustada. Modifican el mecanismo y por tanto la E a de la reaccin. Sin
embargo, no modifican las constantes de los equilibrios.
Pueden ser:
Positivos: hacen que v aumente, pues consiguen que EA disminuya.
Negativos: hacen que v disminuya, pues consiguen que EA aumente.
Los catalizadores tambin pueden clasificarse en:
Homogneos: en la misma fase que los reactivos.
Heterogneos: se encuentra en distinta fase.
Ejemplo de catlisis heterognea
En los catalizadores de los coches hay una mezcla de Pt y Rh sobre las que se pro-
ducen las siguientes reacciones:
2 CO (g) + O2 (g) 2 CO2 (g)
2 NO (g) + 2 CO (g) N2 (g) + 2 CO2 (g)
2 C2H6 (g) + 7 O2 (g) 4 CO2 (g) + 6 H2O (g)
con objeto de eliminar los gases txicos CO y NO, as como hidrocarburos que no se
hayan quemado del todo.
Ejercicio de Selectividad. (Madrid Junio 1998):
Energa
Teniendo en cuenta la grfica adjunta: a) Indique
si la reaccin es exotrmica o endotrmica b)
reactivos
Represente el valor de H de reaccin productos
c) Representa la curva de reaccin al aadir un
coordenada de reaccin
catalizador positivo. d) Qu efectos produce el
hecho de aadir un catalizador positivo?
Energa
a) Es exotrmica ya que Eproductos < Ereactivos.
b) Ver grfica.
EA
H
c) Ver grfica. reactivos
productos
d) Disminuye la Eactivacin y por tanto existe
coordenada de reaccin
una mayor cantidad de reactivos con energa
suficiente para reaccionar; por tanto aumentar la velocidad.
F. Javier Gutirrez Rodrguez Pgina 9 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
UTILIZACIN DE CATALIZADORES EN PROCESOS DE INTERS IN-
DUSTRIAL.
La mayora de los procesos industriales utilizan catalizadores slidos. Estos slidos,
de composicin altamente compleja (en ocasiones llegan a tener 10 o ms elementos en
su frmula), pueden ser sin embargo descritos en forma de tres componentes elementa-
les: la fase activa, el soporte y el promotor.
La fase activa, como su nombre lo indica, es la directamente responsable de la acti-
vidad cataltica. Esta fase activa puede ser una sola fase qumica o un conjunto de ellas,
sin embargo, se caracteriza porque ella sola puede llevar a cabo la reaccin en las condi-
ciones establecidas. Sin embargo, esta fase activa puede tener un costo muy elevado,
como en el caso de los metales nobles (platino, paladio, rodio, etc.) o puede ser muy sen-
sible a la temperatura (caso de los sulfuros de molibdeno y cobalto), por lo cual se requie-
re de un soporte para dispersarla, estabilizarla y proporcionarle buenas propiedades me-
cnicas.
El soporte es la matriz sobre la
cual se deposita la fase activa y el que
permite optimizar sus propiedades ca-
talticas. Este soporte puede ser poroso
y por lo tanto presentar un rea super-
ficial por gramo elevada.
El promotor es aquella sustancia
que incorporada a la fase activa o al
soporte en pequeas proporciones,
permite mejorar las caractersticas de
un catalizador en cualquiera de sus
funciones de actividad, selectividad o
estabilidad.
Catalizador de un coche. Tomado de:
http://www.oni.escuelas.edu.ar/olimpi99/autos-y-
polucion/cataliza.htm
Algunos enlaces interesantes:
http://www.indexnet.santillana.es/powerpoints/graficos/cinetica.ppt
http://www.uv.es/~baeza/cqtema3.html
http://www.oni.escuelas.edu.ar/olimpi99/autos-y-polucion/cataliza.htm
F. Javier Gutirrez Rodrguez Pgina 10 de 11
Unidad 3: Cintica qumica I.E.S. Clara Campoamor (Getafe)
Anmate a hacer esta breve evaluacin sobre cintica qumica:
http://perso.wanadoo.es/cpalacio/evalua/ecinetica.htm
F. Javier Gutirrez Rodrguez Pgina 11 de 11
You might also like
- EspiritualidadDocument4 pagesEspiritualidadIsmaél TerraNo ratings yet
- Control de Contenido de BotiquinDocument1 pageControl de Contenido de BotiquinIsmaél TerraNo ratings yet
- Rosa de LimaDocument11 pagesRosa de LimaIsmaél TerraNo ratings yet
- Detector de MetalesDocument3 pagesDetector de MetalesIsmaél TerraNo ratings yet
- Historia Del PeruDocument64 pagesHistoria Del PeruIsmaél TerraNo ratings yet
- Historia de MachupichuDocument29 pagesHistoria de MachupichuIsmaél TerraNo ratings yet
- Que Son Los OvnisDocument11 pagesQue Son Los OvnisIsmaél TerraNo ratings yet
- Control de Contenido de BotiquinDocument1 pageControl de Contenido de BotiquinIsmaél TerraNo ratings yet
- MedusaDocument7 pagesMedusaIsmaél TerraNo ratings yet
- Machupicchu HistoriaDocument27 pagesMachupicchu HistoriaIsmaél Terra0% (1)
- NATURALEZDocument18 pagesNATURALEZIsmaél TerraNo ratings yet
- ORACIONESDocument2 pagesORACIONESIsmaél TerraNo ratings yet
- Historia de MachupichuDocument29 pagesHistoria de MachupichuIsmaél TerraNo ratings yet
- La NauralezaDocument17 pagesLa NauralezaIsmaél TerraNo ratings yet
- La NauralezaDocument17 pagesLa NauralezaIsmaél TerraNo ratings yet
- EnergiaDocument2 pagesEnergiaISMAELNo ratings yet
- Fibra OpticaDocument9 pagesFibra OpticaIsmaél TerraNo ratings yet
- Mecánica CuánticaDocument7 pagesMecánica CuánticaIsmaél TerraNo ratings yet
- EnergiaDocument2 pagesEnergiaISMAELNo ratings yet
- Combustión QuimicaDocument8 pagesCombustión QuimicaLuis David Daza SalasNo ratings yet
- TERMOQUÍMICADocument13 pagesTERMOQUÍMICAMery Jane Greig BriceñoNo ratings yet
- Quimica OrganicaDocument19 pagesQuimica OrganicaIsmaél TerraNo ratings yet
- BIOQUIMICADocument118 pagesBIOQUIMICAIsmaél TerraNo ratings yet
- QUIMICADocument5 pagesQUIMICALalo OchoaNo ratings yet
- CARBOHIDRATOSDocument7 pagesCARBOHIDRATOSIsmaél TerraNo ratings yet
- Fuentes AlimenticiasDocument5 pagesFuentes AlimenticiasIsmaél TerraNo ratings yet
- 23 NutricionDocument13 pages23 NutricionVictor David Fernandez PeñaNo ratings yet
- Materiales de LaboratorioDocument13 pagesMateriales de LaboratorioIsmaél TerraNo ratings yet
- LIPIDOSDocument14 pagesLIPIDOSIsmaél TerraNo ratings yet
- Pirometalurgia - Pellasfinal-2-1Document55 pagesPirometalurgia - Pellasfinal-2-1Kleyjarh CorreaNo ratings yet
- Actividad 7.1Document7 pagesActividad 7.1Charly KentonNo ratings yet
- Práctica de punzonado: fundamentos y procedimientoDocument17 pagesPráctica de punzonado: fundamentos y procedimientoGustavo SalesNo ratings yet
- Aglomerado y CuradoDocument13 pagesAglomerado y CuradoAxel FuenzalidaNo ratings yet
- Clase 10 RX Sn1 y Sn2 - Parte IIIDocument33 pagesClase 10 RX Sn1 y Sn2 - Parte IIIAnonymous 6NTyip3y7eNo ratings yet
- Enzimas-estructura-funciónDocument6 pagesEnzimas-estructura-funciónKatherin Juliana Guerrero NiñoNo ratings yet
- Informe-4-SAPONIFICACION DEL ACETATO DE ETILO LAB REACTORESDocument11 pagesInforme-4-SAPONIFICACION DEL ACETATO DE ETILO LAB REACTORESAliTha AyalaNo ratings yet
- Teorema trabajo energía cinética laboratorioDocument8 pagesTeorema trabajo energía cinética laboratorioRina Mar Hdez AmayaNo ratings yet
- Guía N°2 - EnzimasDocument3 pagesGuía N°2 - EnzimasANA LAURANo ratings yet
- Lab 4 EnzimasDocument26 pagesLab 4 EnzimasMariana ReyesNo ratings yet
- Cinética QuímicaDocument8 pagesCinética QuímicaGinger Damaris Patso LoorNo ratings yet
- Métodos Integral y DiferencialDocument10 pagesMétodos Integral y DiferencialMelo Gomez Saul Eduardo100% (1)
- Reporte Práctica 6 FisicoquimicaDocument9 pagesReporte Práctica 6 FisicoquimicaIolani MirandaNo ratings yet
- Tratamiento Termico 1.4Document28 pagesTratamiento Termico 1.4Rocio MillaNo ratings yet
- Flotacion: Colisión o ImpactoDocument28 pagesFlotacion: Colisión o Impactorichard gutierrezNo ratings yet
- Ecuaciones Diferenciales UNMSMDocument4 pagesEcuaciones Diferenciales UNMSMXimena AcNo ratings yet
- Programa Analitico PRQ 207 - 201801 PDFDocument8 pagesPrograma Analitico PRQ 207 - 201801 PDFAnonymous 7L3gvbP5VFNo ratings yet
- Tarea Cinética Química AaDocument4 pagesTarea Cinética Química Aagustavo valdiviesoNo ratings yet
- Ing AmbientalDocument16 pagesIng AmbientalAmely Mamani HuancaNo ratings yet
- Manual Técnico Del Agua - Tratamiento EspecíficoDocument11 pagesManual Técnico Del Agua - Tratamiento EspecíficoMarco Antonio Cabrera PenicheNo ratings yet
- Taller Cinetica EnzimaticaDocument2 pagesTaller Cinetica Enzimaticalaura garciaNo ratings yet
- Semana 08. Cinetica Química, Electroquímica, TermoquímicaDocument4 pagesSemana 08. Cinetica Química, Electroquímica, TermoquímicaGabrielita RengoNo ratings yet
- Química Cinética y Equilibrio QuímicoDocument31 pagesQuímica Cinética y Equilibrio QuímicovictorNo ratings yet
- PlanQuímica2oBGUDocument5 pagesPlanQuímica2oBGUNathaly FalconíNo ratings yet
- 1F - 3T - Enzimas 2022Document55 pages1F - 3T - Enzimas 2022Karlita Luisa Huaman CortezNo ratings yet
- ENZIMOLOGÍA EXPERIMENTAL - Informe 2Document7 pagesENZIMOLOGÍA EXPERIMENTAL - Informe 2Francisca Pizarro CastilloNo ratings yet
- Informe # - 12 - TermodinámicaDocument11 pagesInforme # - 12 - TermodinámicaCESAR AUGUSTO CHAMPI PALOMINONo ratings yet
- 4to Examen RedoxDocument26 pages4to Examen Redoxchems pana cheemsNo ratings yet
- Informe de Teoria Cinetica Fisica 2.docx (1Document12 pagesInforme de Teoria Cinetica Fisica 2.docx (1Edwin Alexander Verdugo RincónNo ratings yet
- Coleccion de Problemas PDFDocument13 pagesColeccion de Problemas PDFjfm4No ratings yet