Professional Documents
Culture Documents
Trabajo de Quimica El Atomo
Uploaded by
javierdario plazas rinconOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Trabajo de Quimica El Atomo
Uploaded by
javierdario plazas rinconCopyright:
Available Formats
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
El tomo
Autor: Erik Bonaventura
C.I.: 16.019.476
Prof.(a)
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
ndice
INTRODUCCION..........................................................................3
ESTRUCTURA ATOMICA...........................................................4
CORTEZA ATOMICA..................................................................6
MODELOS ATOMICOS...............................................................6
MODELO ATOMICO DE DALTON..............................................8
MODELO ATOMICO DE BOHR..................................................9
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
INTRODUCCION
A lo largo de la todas las fases de la historia Universal se puede
observar que los seres humanos han estado en una constante
investigacin tanto teorica, hipottica, experimental, etc. de todo lo que
se encuentra en el entorno del planeta tierra, la via lctea y el universo
en general con la finalidad de entenderlo y asi poder desarrollar las
bases que demuestran el comienzo de todo para poder evolucionar a
partir de la herramienta mas til de la cual se puede disponer que es el
conocimiento.
En el desarrollo de las investigaciones el hombre dividi los esfuerzos
en ciencias aplicadas para poder focalizar debidamente segn el rea de
mas inters para el mismo, de all derivan la Matematica, Biologia,
fsica y qumica. Siendo estas ultimas dos antes mencionadas en la
cuales ha habido un desarrollo tan grande que hoy en dia se nos puede
mostrar la composicin de los elementos y con ello las unidades que lo
componen y su unidad mas pequea.
En fsica y qumica, tomo (del latn atomum, y ste del griego
, sin partes; tambin, se deriva de "a" (no) y "tomo" (divisible);
no divisible)1 es la unidad ms pequea de un elemento qumico que
mantiene su identidad udud o sus propiedades, y que no es posible
dividir mediante procesos qumicos. Es de vital importancia el
conocimiento del mismo para poder tal cual los humanos a travs de la
historia hicieron, entender y evolucionar en todas las areas cientficas y
de ingeniera.
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
ESTRUCTURA ATOMICA
En fsica y qumica, tomo es la unidad ms pequea de un elemento
qumico que mantiene su identidad udud o sus propiedades, y que no es
posible dividir mediante procesos qumicos.
El ncleo representa el 99.9% de la masa del tomo, y est compuesto
de bariones llamados protones y neutrones, rodeados por una nube de
electrones, que -en un tomo neutro- igualan el nmero de protones.
El concepto de tomo como bloque bsico e indivisible que compone la
materia del universo fue postulado por la escuela atomista en la
Antigua Grecia. Sin embargo, su existencia no qued demostrada hasta
el siglo XIX. Con el desarrollo de la fsica nuclear en el siglo XX se
comprob que el tomo puede subdividirse en partculas ms pequeas.
A pesar de que "tomo" significa "indivisible", hoy da se sabe que el
tomo est formado por partculas ms pequeas, llamadas partculas
subatmicas.
El ncleo del tomo es su parte central. Tiene carga positiva, y en l se
concentra casi toda la masa del mismo. Sin embargo, ocupa una
fraccin muy pequea del volumen del tomo: su radio es unas diez mil
veces ms pequeo. El ncleo est formado por protones y neutrones.
Alrededor del ncleo se encuentran los electrones, partculas de carga
negativa y masa muy pequea comparada con la de los protones y
neutrones: un 0,05% aproximadamente. Los electrones se encuentran
alrededor del ncleo, ligados por la fuerza electromagntica que ste
ejerce sobre ellos, y ocupando la mayor parte del tamao del tomo, en
la llamada nube de electrones.
El Electrn es la partcula elemental que constituye parte de cualquier
tomo, descubierta en 1897 por J. J. Thomson. Los electrones de un
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
tomo giran en torno a su ncleo, formando la denominada corteza
electrnica. La masa del electrn es 1836 veces menor que la del
protn y tiene carga opuesta, es decir, negativa. En condiciones
normales un tomo tiene el mismo nmero de protones que electrones,
lo que convierte a los tomos en entidades elctricamente neutras. Si un
tomo capta o pierde electrones, se convierte en un ion.
Estructura del tomo
El ncleo atmico
El ncleo del tomo se encuentra formado por nucleones, los cuales
pueden ser de dos clases:
Protn: descubierto por Ernest Rutherford a principios del siglo XX, el
protn es una partcula elemental que constituye parte del ncleo de
cualquier tomo. El nmero de protones en el ncleo atmico,
denominado nmero atmico, es el que determina las propiedades
qumicas del tomo en cuestin. Los protones poseen carga elctrica
positiva y una masa 1.836 veces mayor de la de los electrones o lo que
es igual; una partcula con carga elctrica positiva igual a una carga
elemental, y una masa de 1,67262 1027 kg.
Neutrn: partcula elemental que constituye parte del ncleo de los
tomos. Fueron descubiertos en 1930 por dos fsicos alemanes, Walter
Bothe y Herbert Becker. La masa del neutrn es ligeramente superior a
la del protn, pero el nmero de neutrones en el ncleo no determina
las propiedades qumicas del tomo, aunque s su estabilidad frente a
posibles procesos nucleares (fisin, fusin o emisin de radiactividad).
Los neutrones carecen de carga elctrica, y son inestables cuando se
hallan fuera del ncleo, desintegrndose para dar un protn, un electrn
y un antineutrino. Y se define como: partculas carentes de carga
elctrica, y con una masa un poco mayor que la del protn (1,67493
1027 kg).
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
CORTEZA ATOMICA
Tambien conocida como nube de electrones o nube atmica es la
parte externa de un tomo, regin que rodea al ncleo atmico, y en la
cual orbitan los electrones. Los electrones poseen carga elctrica
negativa y estn unidos al ncleo del tomo por la interaccin
electromagntica. Los electrones al unirse al ncleo desprenden una
pequea porcin de carga negativa y de esta se forma la nube de
electrones. Posee un tamao unas 50.000 veces superior al del ncleo
sin embargo apenas posee masa.
Alrededor del ncleo se encuentran los electrones que son partculas
elementales de carga negativa igual a una carga elemental y con una
masa de 9,10 1031 Kg.
La cantidad de electrones de un tomo en su estado basal es igual a la
cantidad de protones que contiene en el ncleo, es decir, al nmero
atmico, por lo que un tomo en estas condiciones tiene una carga
elctrica neta igual a 0.
A diferencia de los nucleones, un tomo puede perder o adquirir
algunos de sus electrones sin modificar su identidad qumica,
transformndose en un ion, una partcula con carga neta diferente de
cero.
El concepto de que los electrones se encuentran en rbitas satelitales
alrededor del ncleo se ha abandonado en favor de la concepcin de
una nube de electrones deslocalizados o difusos en el espacio, el cual
representa mejor el comportamiento de los electrones descrito por la
mecnica cuntica nicamente como funciones de densidad de
probabilidad de encontrar un electrn en una regin finita de espacio
alrededor del ncleo.
MODELOS ATOMICOS
En Ciencia, un modelo intenta explicar una teora mediante una
comparacin. Un modelo ser tanto ms perfecto cuanto ms
claramente explique los hechos experimentales. El modelo es vlido
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
mientras explica lo que ocurre en los experimentos; en el momento en
que falla, hay que modificarlo. Es por esto que Desde la Antigedad, el
ser humano se ha cuestionado de qu estaba hecha la materia. Unos
400 aos antes de Cristo, el filsofo griego Demcrito consider que la
materia estaba constituida por pequesimas partculas que no podan
ser divididas en otras ms pequeas. Por ello, llam a estas partculas
tomos, que en griego quiere decir "indivisible". Demcrito atribuy a
los tomos las cualidades de ser eternos, inmutables e indivisibles.
Sin embargo las ideas de Demcrito sobre la materia no fueron
aceptadas por los filsofos de su poca y hubieron de transcurrir cerca
de 2200 aos para que la idea de los tomos fuera tomada de nuevo en
consideracin.
Ao Cientfico Descubrimientos experimentales Modelo atmico
Durante el s.XVIII y principios del La imagen del tomo expuesta por
XIX algunos cientficos haban Dalton en su teora atmica, para
investigado distintos aspectos de las explicar estas leyes, es la de minsculas
reacciones qumicas, obteniendo las partculas esfricas, indivisibles e
1808 llamadasleyes clsicas de la inmutables,
Qumica. iguales entre s en
cada elemento
John Dalton qumico.
Demostr que dentro de los tomos De este descubrimiento dedujo que el
hay unas partculas diminutas, con tomo deba de ser una esfera de
carga elctrica negativa, a las que se materia cargada positivamente, en cuyo
llam electrones. interior estaban incrustados los
1897 electrones.
(Modelo atmico de
Thomson.)
J.J. Thomson
Demostr que los tomos no eran Dedujo que el tomo deba estar
macizos, como se crea, sino que formado por una corteza con los
estn vacos en su mayor parte y en electrones girando alrededor de un
su centro hay un diminuto ncleo. ncleo central cargado positivamente.
1911 (Modelo atmico de
Rutherford.)
E. Rutherford
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
Espectros atmicos discontinuos Propuso un nuevo modelo atmico,
originados por la radiacin emitida segn el cual los electrones giran
por los tomos excitados de los alrededor del ncleo en unos niveles
elementos en estado gaseoso. bien definidos.
1913 (Modelo atmico
de Bohr.)
Niels Bohr
MODELO ATOMICO DE DALTON.
John Dalton, profesor y qumico britnico, estaba fascinado por el
rompecabezas de los elementos. A principios del siglo XIX estudi la
forma en que los diversos elementos se combinan entre s para formar
compuestos qumicos. Aunque muchos otros cientficos, empezando
por los antiguos griegos, haban afirmado ya que las unidades ms
pequeas de una sustancia eran los tomos, se considera a Dalton como
una de las figuras ms significativas de la teora atmica porque la
convirti en algo cuantitativo. Dalton mostr que los tomos se unan
entre s en proporciones definidas. Las investigaciones demostraron
que los tomos suelen formar grupos llamados molculas. Cada
molcula de agua, por ejemplo, est formada por un nico tomo de
oxgeno (O) y dos tomos de hidrgeno (H) unidos por una fuerza
elctrica denominada enlace qumico, por lo que el agua se simboliza
como HOH o H2O.
Dalton formo el primer modelo atmico con bases cientificas, fue
formulado en 1808, este primer modelo tomico trataba de:
-La materia estaba formada por partculas muy pequeas llamadas
tomos, que no son visibles y no son desctructibles
-Los tomos de un mismo elemento son iguales entre si, tienen su
propio peso y cualidades propias. Los tomos de los distintos
elementos tienen pesos diferentes.
-Los tomos permanecen sin divisin, an cuando se combinen en las
reacciones qumicas.
-Los tomos, al combinarse para formar compuestos guardan
relaciones simples.
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
-Los tomos de elementos diferentes se pueden combinar en
proporciones distintas y formar ms de un compuesto.
-Los compuestos qumicos se forman al unirse tomos de dos o ms
elementos distintos.
sin embargo desaparecio mediante el modelo de thomson ya que no
explica los rayos caddicos, la radioactividad ni la presencia de
electrones (e-) o protones (p+)
MODELO ATOMICO DE BOHR
Para explicar la estructura del tomo, el fsico dans Niels Bohr
desarroll en 1913 una hiptesis conocida como teora atmica de Bohr
(vase teora cuntica). Bohr supuso que los electrones estn dispuestos
en capas definidas, o niveles cunticos, a una distancia considerable del
ncleo. La disposicin de los electrones se denomina configuracin
electrnica. El nmero de electrones es igual al nmero atmico del
tomo: el hidrgeno tiene un nico electrn orbital, el helio dos y el
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
uranio 92. Las capas electrnicas se superponen de forma regular hasta
un mximo de siete, y cada una de ellas puede albergar un determinado
nmero de electrones. La primera capa est completa cuando contiene
dos electrones, en la segunda caben un mximo de ocho, y las capas
sucesivas pueden contener cantidades cada vez mayores. Ningn tomo
existente en la naturaleza tiene la sptima capa llena. Los "ltimos"
electrones, los ms externos o los ltimos en aadirse a la estructura
del tomo, determinan el comportamiento qumico del tomo.
Todos los gases inertes o nobles (helio, nen, argn, criptn, xenn y
radn) tienen llena su capa electrnica externa. No se combinan
qumicamente en la naturaleza, aunque los tres gases nobles ms
pesados (criptn, xenn y radn) pueden formar compuestos qumicos
en el laboratorio. Por otra parte, las capas exteriores de los elementos
como litio, sodio o potasio slo contienen un electrn. Estos elementos
se combinan con facilidad con otros elementos (transfirindoles su
electrn ms externo) para formar numerosos compuestos qumicos.
De forma equivalente, a los elementos como el flor, el cloro o el
bromo slo les falta un electrn para que su capa exterior est
completa. Tambin se combinan con facilidad con otros elementos de
los que obtienen electrones.
Las capas atmicas no se llenan necesariamente de electrones de forma
consecutiva. Los electrones de los primeros 18 elementos de la tabla
peridica se aaden de forma regular, llenando cada capa al mximo
antes de iniciar una nueva capa. A partir del elemento decimonoveno,
el electrn ms externo comienza una nueva capa antes de que se llene
por completo la capa anterior. No obstante, se sigue manteniendo una
regularidad, ya que los electrones llenan las capas sucesivas con una
alternancia que se repite. El resultado es la repeticin regular de las
propiedades qumicas de los tomos, que se corresponde con el orden
de los elementos en la tabla peridica.
Resulta cmodo visualizar los electrones que se desplazan alrededor
del ncleo como si fueran planetas que giran en torno al Sol. No
obstante, esta visin es mucho ms sencilla que la que se mantiene
actualmente. Ahora se sabe que es imposible determinar exactamente la
posicin de un electrn en el tomo sin perturbar su posicin. Esta
incertidumbre se expresa atribuyendo al tomo una forma de nube en la
que la posicin de un electrn se define segn la probabilidad de
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
encontrarlo a una distancia determinada del ncleo. Esta visin del
tomo como "nube de probabilidad" ha sustituido al modelo de sistema
solar.
Modelo atomico de Bohr
NMEROS CUNTICOS
Los nmeros cunticos son valores numricos que nos indican las
caractersticas de los electrones de los tomos, esto esta basado desde
luego en la teora atmica de Neils Bohr que es el modelo atmico mas
aceptado y utilizado en los ltimos tiempos.
Los nmeros atmicos ms importantes son cuatro:
Nmero Cuntico Principal.
Nmero Cuntico Secundario.
Nmero Cuntico Magntico.
Nmero Cuntico de Spin.
Nmero Cuntico Principal (n)
El nmero cuntico principal nos indica en que nivel se encuentra el
electrn, este valor toma valores enteros del 1 al 7.
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
Nmero Cuntico Secundario (d)
Este nmero cuntico nos indica en que subnivel se encuentra el
electrn, este nmero cuntico toma valores desde 0 hasta (n - 1),
segn el modelo atmico de Bohr - Sommerfield existen adems de los
niveles u orbitas circulares, ciertas rbitas elpticas denominados
subniveles. Segn el nmero atmico tenemos los numeros:
l=0 s sharp
l=1 p principal
l=2 d diffuse
l=3 f fundamental
l=4 g
l=5 h
l=6 i
Nmero Cuntico Magntico (m)
El nmero cuntico magntico nos indica las orientaciones de los
orbitales magnticos en el espacio, los orbitales magnticos son las
regiones de la nube electrnica donde se encuentran los electrones, el
nmero magntico depende de l y toma valores desde -l hasta l.
Nmero Cuntico de Spin (s)
El nmero cuntico de spin nos indica el sentido de rotacin en el
propio eje de los electrones en un orbital, este nmero toma los valores
de -1/2 y de 1/2.
De esta manera entonces se puede determinar el lugar donde se
encuentra un electrn determinado, y los niveles de energa del mismo,
esto es importante en el estudio de las radiaciones, la energa de
ionizacin, as como de la energa liberada por un tomo en una
reaccin.
Maturn, Octubre del 2011
REPBLICA BOLIVARIANA DE VENEZUELA
INSTITUTO UNIVERSITARIO POLITCNICO
SANTIAGO MARIO
EXTENSIN MATURN
Principio de Exclusin de Pauli
El mismo dice "En un mismo tomo no puede existir dos electrones
que tengan los mismos nmeros cunticos" de esta manera podemos
entonces afirmar que en un mismo orbital no puede haber ms de dos
electrones y que los mismos deben tener distinto nmero de spin.
Maturn, Octubre del 2011
You might also like
- Hermosa A Los Ojos de DiosDocument265 pagesHermosa A Los Ojos de DiosJacquelineMoncayoChacon90% (20)
- Cesar Vidal ProfetismoDocument5 pagesCesar Vidal ProfetismoCamilo Andres Paez PuentesNo ratings yet
- Selección de Maquinaria Y EquipoDocument4 pagesSelección de Maquinaria Y EquipoRouse Calderón64% (11)
- EL SER PSIQUICO Sri AurobindoDocument123 pagesEL SER PSIQUICO Sri AurobindoMilagros García50% (2)
- Estimación media y varianza asistencia eventos deportivos coliseoDocument5 pagesEstimación media y varianza asistencia eventos deportivos coliseokust67% (6)
- Antropomorfismo y Su SuperaciónDocument12 pagesAntropomorfismo y Su SuperaciónSandra SeverinoNo ratings yet
- Diseño y cálculo de tiempos para semáforos en interseccionesDocument30 pagesDiseño y cálculo de tiempos para semáforos en interseccionesFreddy Antonio Ramírez MedranoNo ratings yet
- KantDocument14 pagesKantp85d10No ratings yet
- Conductores Eléctricos y Empalmes PDFDocument82 pagesConductores Eléctricos y Empalmes PDFivan.giraldo75% (8)
- Conductores Eléctricos y Empalmes PDFDocument82 pagesConductores Eléctricos y Empalmes PDFivan.giraldo75% (8)
- Conductores Eléctricos y Empalmes PDFDocument82 pagesConductores Eléctricos y Empalmes PDFivan.giraldo75% (8)
- Guia 1 Matematica BasicaDocument11 pagesGuia 1 Matematica Basicajavierdario plazas rinconNo ratings yet
- Evidecias Guia #8Document9 pagesEvidecias Guia #8javierdario plazas rinconNo ratings yet
- Clasificacion de Los Motores EléctricosDocument15 pagesClasificacion de Los Motores EléctricosAngel De Jesus Olvera BarreraNo ratings yet
- Formato Identificacion Estilos de Aprendizaje Final 2Document18 pagesFormato Identificacion Estilos de Aprendizaje Final 2Manue ZebalNo ratings yet
- Catalogo+DEWALT de Maquinas PDFDocument68 pagesCatalogo+DEWALT de Maquinas PDFjavierdario plazas rinconNo ratings yet
- 11 MARZO 2016 Comentarios de La Comision de ExpertosDocument20 pages11 MARZO 2016 Comentarios de La Comision de Expertosjavierdario plazas rinconNo ratings yet
- Fuentes LuminosasDocument68 pagesFuentes LuminosasErvin SmithNo ratings yet
- Bomba de PaletaDocument6 pagesBomba de PaletaLoreto Urizar Tapia100% (1)
- Energia HidraulicaDocument7 pagesEnergia Hidraulicaapi-240855504No ratings yet
- Clase 2Document54 pagesClase 2javierdario plazas rinconNo ratings yet
- Clase 2Document54 pagesClase 2javierdario plazas rinconNo ratings yet
- Electricidad Basica DiapositivasDocument19 pagesElectricidad Basica Diapositivasjavierdario plazas rinconNo ratings yet
- 11 MARZO 2016 Comentarios de La Comision de ExpertosDocument20 pages11 MARZO 2016 Comentarios de La Comision de Expertosjavierdario plazas rinconNo ratings yet
- Maquinas Electricas Diagramas Electronicos 2Document3 pagesMaquinas Electricas Diagramas Electronicos 2jorgedominNo ratings yet
- Electricidad Basica 3Document12 pagesElectricidad Basica 3vicotegNo ratings yet
- Empalmes EléctricosDocument12 pagesEmpalmes Eléctricosrodrigoamj100% (10)
- EEOLICA Febrero2012 G9 PDFDocument104 pagesEEOLICA Febrero2012 G9 PDFJuan PeraltaNo ratings yet
- Bomba de PaletaDocument6 pagesBomba de PaletaLoreto Urizar Tapia100% (1)
- Breakers O Tacos PDFDocument18 pagesBreakers O Tacos PDFCesar Carlos Caballero CardenasNo ratings yet
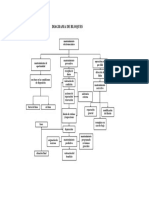
- Diagrama de BloqueDocument1 pageDiagrama de Bloquejavierdario plazas rinconNo ratings yet
- 2 Energias Unidades TiposDocument30 pages2 Energias Unidades Tiposjavierdario plazas rinconNo ratings yet
- Maquinas Electricas Diagramas Electronicos 2Document3 pagesMaquinas Electricas Diagramas Electronicos 2jorgedominNo ratings yet
- Bomba de PaletaDocument6 pagesBomba de PaletaLoreto Urizar Tapia100% (1)
- Conductores ElectricosDocument114 pagesConductores Electricosjavierdario plazas rinconNo ratings yet
- Reglamento PDFDocument36 pagesReglamento PDFDavid Gabriel Andrade PalauNo ratings yet
- Paradigmas personales: empoderamiento y autoconocimientoDocument2 pagesParadigmas personales: empoderamiento y autoconocimientoJhon VillacortaNo ratings yet
- Edinson Medina PDFDocument211 pagesEdinson Medina PDFjkl316No ratings yet
- Despido Objetivo - Ineptitud SobrevenidaDocument11 pagesDespido Objetivo - Ineptitud SobrevenidaPablo RfcNo ratings yet
- Análisis de Discurso-Andrea BecerraDocument2 pagesAnálisis de Discurso-Andrea BecerraJandrely SaavedraNo ratings yet
- Introducción A La ÉticaDocument4 pagesIntroducción A La Éticajosue SilvaNo ratings yet
- Pre-Tarea Jessica Paola Rojas Giraldo Grupo 344Document9 pagesPre-Tarea Jessica Paola Rojas Giraldo Grupo 344Raul Andres CastañedaNo ratings yet
- El Tensor de Cauchy PDFDocument5 pagesEl Tensor de Cauchy PDFSilvia RiveraNo ratings yet
- GUÍA PARA LA AUTOEVALUACIÓN DE LA UNIDAD DE APRENDIZAJE (Módulo 5) PDFDocument5 pagesGUÍA PARA LA AUTOEVALUACIÓN DE LA UNIDAD DE APRENDIZAJE (Módulo 5) PDFKbNo ratings yet
- La Noción de Razón y Proporción en GreciaDocument4 pagesLa Noción de Razón y Proporción en GreciakinitoNo ratings yet
- Conclusiones Campaña Contra El BullyingDocument8 pagesConclusiones Campaña Contra El BullyingTatiana SimpsonMuñozNo ratings yet
- Trazo de CurvasDocument21 pagesTrazo de CurvasNick Ramos ChavezNo ratings yet
- Examen T3Document9 pagesExamen T3Serafín MohínoNo ratings yet
- Modulo 3 - Organizacion y Gestion en Salud 1Document21 pagesModulo 3 - Organizacion y Gestion en Salud 1Virginia BenavidezNo ratings yet
- De León. Por Que No Hablar Con La LocuraDocument8 pagesDe León. Por Que No Hablar Con La LocuraMateo FaríasNo ratings yet
- Curso Desarrollo Infantil Temprano Post TestDocument2 pagesCurso Desarrollo Infantil Temprano Post TestPaul Colca50% (2)
- Estudio Del TrabajoDocument6 pagesEstudio Del TrabajoJuan EduardoNo ratings yet
- .archivetempPRUEBA N°10 1°BÁSICOS PDFDocument8 pages.archivetempPRUEBA N°10 1°BÁSICOS PDFCaroline Renee Rojas MirandaNo ratings yet
- Boaventura de Sousa SantosDocument92 pagesBoaventura de Sousa SantosJulieta CebolladaNo ratings yet
- Cálculo de límites y continuidad de funcionesDocument49 pagesCálculo de límites y continuidad de funcionesDOCENTE MATEMATICAS 2No ratings yet
- Guia de Practica Edo 1Document32 pagesGuia de Practica Edo 1joseNo ratings yet
- Anexo 11 (La Infografía)Document14 pagesAnexo 11 (La Infografía)Ronal Damián Calderón Pérez100% (1)
- Etica Del Ingeniero Civil en Relacion Al Patrimonio CulturalDocument11 pagesEtica Del Ingeniero Civil en Relacion Al Patrimonio CulturalCristianDavidNo ratings yet
- Jardín Infantil para La Comunidades IndígenaDocument2 pagesJardín Infantil para La Comunidades IndígenaSenia Garrido OsorioNo ratings yet