Professional Documents
Culture Documents
Formulario TA
Uploaded by
ThomasPolhCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Formulario TA
Uploaded by
ThomasPolhCopyright:
Available Formats
Formulario 1
Departamento de Ingeniera Trmica y de Fluidos
rea de Mquinas y Motores Trmicos
Formulario de Termodinmica Aplicada
Grado de Ingeniera Qumica
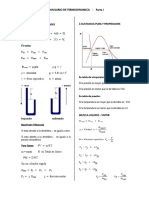
La Energa y el Primer Principio de la Termodinmica
Balance de Energa en Sistemas Cerrados
dE = Q - W
Rendimiento Termodinmico de Ciclos
Ciclo de Potencia Ciclo de Refrigeracin Ciclo de Bomba de Calor
W Q - QF Q QF QC QC
= ciclo = C = F = = =
QC QC Wciclo QC - Q F Wciclo QC - Q F
Propiedades de una Sustancias Pura, Simple y Compresible
Volumen, Energa Interna, Entalpa, Entropa (especficas).
= f + x ( g - f ) u = uf + x ( ug - uf ) h = hf + x ( hg - hf ) s = sf + x ( sg - sf)
Aproximacin de Fluido Incompresible (aproximacin adecuada sobre todo para agua-cuando no se
dispone de datos de lquido subenfriado)
Entalpa Energa Interna Entropa
h(p,T) = hf.(T) + vf(T)(p - psat.(T) u(p,T) = uf(T) s(p,T) = sf(T)
h(p,T) = hf(T)
Variacin de Entalpa Variacin de Energa Interna Variacin de Entropa
h2 h1 = c (T2 - T1) + v (p2 - p1) u2 - u1 = c (T2 - T1) T
s2 -s1 = c ln 2
T1
Modelo de gas ideal
P =R T u = u(T) h= h(T) = u(T) + R T
c p (T)
cp (T) = R + cv (T) k = (relacin de calores especficos)
c v (T)
Modelo de gas perfecto
h2 h1 = cp (T2 - T1) u2 - u1 = cv (T2 - T1)
R kJ
R= R (constante universal de los gases) = 8. 314
M kmol K
n 1
n 1
T2 p 2 n v
Procesos politrpicos de un gas ideal n
p V = constante = = 1
T1 p 1 v2
Anlisis Energtico de Sistemas Abiertos
dm VC
Balance de materia = m& - m&
dt e e S S
Termodinmica Aplicada Grado de Ingeniera Qumica
Formulario 2
dE VC ce2 c2
& - & + & (h + +g z e ) - m S +g z )
Balance de energa = Q & (h +
dt VC WVC e m e e 2 S S S 2 S
Entropa
Ecuaciones TdS T dS = du + pd T dS = dh - dp
Variacin de Entropa de un Gas Ideal
T dT T dT
s2 -s1 = T 2 c v (T) + R ln v2/v1 s2 -s1 = T 2 c p (T) - R ln p2/p1
1 T 1 T
T c p (T)
so(T) = 0 dT ; s2 -s1 = so(T2) - so(T1) - R ln p2/p1
T
Variacin de Entropa de un Gas Perfecto
T v T p v p
s2 - s1 = cv ln 2 + R ln 2 s2 - s1 = cp ln 2 - R ln 2 s2 - s1 = cp ln 2 + cv ln 2
T1 v1 T1 p1 v1 p1
Balance de Entropa en Sistemas Cerrados
2
Q
S 2 S1 =
1
+
T f
Balance de Entropa en Sistemas Abiertos
&
Q
dSVC j
= + m & s ss + & VC
& e s e - m
dt j T j e s
Mezclas no Reactivas de Gases Ideales. Psicrometra
n ; Fraccin molar: y = n
mi ni
N demoles de un componente: ni = ; N total de moles: n = i i
Mi
i
m
m i
Fraccin msica: fmi = i ; Masa molecular de la mezcla: M = i
m n
Clculo de las Variables Termodinmicas de una Mezcla. Se considera variable total , variable
especfica y variable molar de la propiedad. Donde puede ser U, H, S, Ex, Cp y Cv.
=
n i i ;
i
= yi i ;
i
=
M
Variacin de las Variables Termodinmicas de una Mezcla tras sufrir una Transformacin
Termodinmica. Considerando nuevamente la variable general , resulta:
= 2 1 = n (
i
i 2 1 ) i = 2 1 = y (
i
i 2 1 ) i
Variacin de Entropa en Mezclas de Gases Ideales
pi2
si = si0 ( T2 ) si0 ( T1 ) R ln
p i1
Psicrometra
Humedad Especfica Humedad Relativa
m pv p
= v = 0.622 = v
ma p pv p sat p,T
Termodinmica Aplicada Grado de Ingeniera Qumica
Formulario 3
Entalpa del Aire Hmedo H = ma (ha + hv)
Aproximaciones hv p,T
h g (T) hw p,T
h f (T)
Saturacin Adiabtica
h a (Tsa ) - h a (T1 ) + w [ h v (Tsa ) - h w (Tsa )] pg (Tsa )
1 = = 0.622
h v (T1 ) - h w (Tsa ) 1-p g (Tsa )
Calculo de la Entropa del Vapor de Agua Sobrecalentado en un Estado Termodinmico (pv, T)
s(pv, T) = sg (T) - Ragua ln(pv, T)
Mezclas Reactivas y Combustin
Entalpa Especfica de un Compuesto en un Estado Distinto al Estndar
0
[
h (T, p) = h f + h (T, p) h (Tref , p ref ) = h f + h ] 0
Balance de Energa para Sistemas Reactivos
&
Q vc - W vc =
n n
0 0
s (h f + h)s - e (h f + h)e (sistemas abiertos)
n& C n& C p R
n n (h
0 0
QW= (h f + h R Tp ) f + h R TR ) (sistemas cerrados)
p R
Entalpa de Combustin
h comb = n
p
s hs n
R
e he
Evaluacin de la entropa para sistemas reactivos
p
s(T,p)= s(T,p ref ) + s(T,p) - s(T,p ref ) ;
o
s(T,p) = s (T)- R ln (gas ideal)
p ref
p y p
o o
Componente i de una mezcla de gases ideales: s (T,pi )=s (T) - R ln i = s (T) - R ln i
i i p i p
ref ref
g(T,p) = g + g(T,p) - g(Tref ,p ref ) = g + g
o o
Funcin de Gibbs:
f
f
UNIDADES
Presin: 1 Pa =1N/m2 Energa: 1 J = 4.1868 cal
1 bar = 105 Pa Potencia de Refrigeracin: 1 Frigora = 1 kcal/h
1 atm = 1.01335 bar 1 bar 1 ton = 211 kJ/min
Fuerza:
1 N = 1 kg m/s2
NOTA: No se admitir ninguna anotacin en este formulario por parte del alumno
Termodinmica Aplicada Grado de Ingeniera Qumica
You might also like
- Practica CyclepadDocument52 pagesPractica Cyclepadroosvelt vasquez chicomaNo ratings yet
- Proceso PolitropicoDocument2 pagesProceso PolitropicoMarcos ZubietaNo ratings yet
- Cuestionario Previo 12 TERMO FIDocument5 pagesCuestionario Previo 12 TERMO FILui2McCartneyNo ratings yet
- Tarea 7 PRQ206 Deducción CV y CPDocument7 pagesTarea 7 PRQ206 Deducción CV y CPAndrés Mauricio RiberaNo ratings yet
- Introducción a la Mecánica de FluidosDocument178 pagesIntroducción a la Mecánica de Fluidosivanelcrack15100% (1)
- Mediciones calorimétricas: cálculo del calor de reacciónDocument3 pagesMediciones calorimétricas: cálculo del calor de reacciónT L Jho Jans WellNo ratings yet
- Formulario de Termodinamica 1Document2 pagesFormulario de Termodinamica 1Jaime muñoz portugalNo ratings yet
- Calorimetría de CombustiónDocument4 pagesCalorimetría de CombustiónDeyaniraNo ratings yet
- Evaluar T, v, u, a y g a partir de h(s,PDocument4 pagesEvaluar T, v, u, a y g a partir de h(s,PAyrton Jimenez InfantesNo ratings yet
- TEma 13 - Aplicacion de La Termodinamica A La Procesos de FlujoDocument26 pagesTEma 13 - Aplicacion de La Termodinamica A La Procesos de FlujoMar�a HidalgoNo ratings yet
- FormularioDocument1 pageFormularioKarina UrbanoNo ratings yet
- Termodinamica ExamenesDocument21 pagesTermodinamica ExamenesRicardo Anibal Arroyo Flores100% (1)
- TERMODINAMICA GASEOSADocument27 pagesTERMODINAMICA GASEOSAOmar Glez100% (1)
- FormularioTermoIDocument3 pagesFormularioTermoIrudeyNo ratings yet
- Apuntes TermodinamicaDocument110 pagesApuntes TermodinamicaIsrael Machuca100% (1)
- Ecuación de van der Waals para calcular volumen molar y factor de compresibilidad de amoniacoDocument2 pagesEcuación de van der Waals para calcular volumen molar y factor de compresibilidad de amoniacoHerbert Cervantes Miguel67% (3)
- Sesión 3 Sustancias-PurasDocument16 pagesSesión 3 Sustancias-PurasDarwin jose sernaque lescanoNo ratings yet
- Eeym U2 A3 JaqmDocument7 pagesEeym U2 A3 JaqmJavier Quintero MonsivaisNo ratings yet
- Ejercicios de termodinámica de la UNASAM CuscoDocument23 pagesEjercicios de termodinámica de la UNASAM Cuscocesar454No ratings yet
- Serie Ciclos. 21-IIDocument8 pagesSerie Ciclos. 21-IIAbigail AndreaNo ratings yet
- Cap 12Document20 pagesCap 12Jessy Ramirez100% (1)
- Clase 3Document48 pagesClase 3DIANA MILAGRO MIRANDA YNGA100% (1)
- Método de Tiempo de Vida MediaDocument1 pageMétodo de Tiempo de Vida Mediamipenene100% (1)
- Ley de Dalton y AmagatDocument2 pagesLey de Dalton y AmagatGerardoNo ratings yet
- Perfil de Temperatura en Un Alambre - SGB-YRDDocument11 pagesPerfil de Temperatura en Un Alambre - SGB-YRDSaúl GarduñoNo ratings yet
- Cap02 (1) Primera Ley y Otros Conceptos de La TermodinámicaDocument47 pagesCap02 (1) Primera Ley y Otros Conceptos de La TermodinámicaTeofilo Donaires Flores100% (1)
- Primera Ecuacion de BerthelotDocument8 pagesPrimera Ecuacion de BerthelotDanny Paredes Layza100% (1)
- Actividad 5. Ej 1Document6 pagesActividad 5. Ej 1DULCE GARCIA100% (1)
- Resumen EntropiaDocument4 pagesResumen EntropiaCindy Jara100% (1)
- Problemas Resueltos Unidad 5 Termo IQ-411Document10 pagesProblemas Resueltos Unidad 5 Termo IQ-411Jose Ignacio Manriquez AvendañoNo ratings yet
- Práctica Entropía TermoDocument22 pagesPráctica Entropía TermoEinar Christian Aruquipa SilvaNo ratings yet
- Combustion IsocoricaDocument5 pagesCombustion IsocoricaDaniel VargasNo ratings yet
- PDF Ecuacion de Peng Robinson - CompressDocument18 pagesPDF Ecuacion de Peng Robinson - CompressSuri Perez Maria TeresaNo ratings yet
- EVLDocument12 pagesEVLVíctor Hugo Castro TavaresNo ratings yet
- Numeros AdimensionalesDocument3 pagesNumeros AdimensionalesRoderick Xavier CastilloNo ratings yet
- Seleccion Refrigerante PowerPointDocument38 pagesSeleccion Refrigerante PowerPointMelissa Tufiño Ochoa100% (1)
- Guia de Ejercicios C3 - II - 2014 - Parte I PDFDocument2 pagesGuia de Ejercicios C3 - II - 2014 - Parte I PDFMirko San Martin0% (1)
- Cuadernillo de Reforzamiento de TERMODINÁMICA Momento IIIDocument12 pagesCuadernillo de Reforzamiento de TERMODINÁMICA Momento IIISebastian NuñezNo ratings yet
- Pd13-Equilibrio QuímicoDocument6 pagesPd13-Equilibrio QuímicoCARLOS ENRIQUE BERNAL AYBARNo ratings yet
- Ma642 202002 Semana 12 Síncrona Repaso Binomial y Exponencial PropuestosDocument2 pagesMa642 202002 Semana 12 Síncrona Repaso Binomial y Exponencial PropuestosGabriela ChimaycoNo ratings yet
- Termodinamica BásicaDocument324 pagesTermodinamica BásicaArias LauraNo ratings yet
- Tarea 3Document5 pagesTarea 3Uriel Fabián Del Río Félix100% (1)
- Lab 211611 6Document56 pagesLab 211611 6Andres LassoNo ratings yet
- Pre-Lab 5 TermoDocument8 pagesPre-Lab 5 TermoDzt100% (1)
- Energia Interna, Entalpía y Calores Especificos para Gases Ideales.Document5 pagesEnergia Interna, Entalpía y Calores Especificos para Gases Ideales.Paola PerezNo ratings yet
- Problema 9.36Document3 pagesProblema 9.36kevinNo ratings yet
- Presión vapor aguaDocument27 pagesPresión vapor aguaDea Carla JassoNo ratings yet
- Ejercicio de Entropía-5.38 de Smith Van NessDocument4 pagesEjercicio de Entropía-5.38 de Smith Van NesskenyacornejoNo ratings yet
- Unidad 2 Tarea 2 Lopez Guzman AngelDocument17 pagesUnidad 2 Tarea 2 Lopez Guzman AngelManuel Lopez GuzmanNo ratings yet
- Formulario ExergíaDocument4 pagesFormulario ExergíaDavid VilchisNo ratings yet
- Ejercicios Resueltos de Calor y TrabajoDocument8 pagesEjercicios Resueltos de Calor y TrabajoEdwin HernandezNo ratings yet
- Dop Del TequilaDocument51 pagesDop Del TequilaAlexander MontesNo ratings yet
- Guía Masa Variable PDFDocument19 pagesGuía Masa Variable PDFantony_3_31No ratings yet
- Metano LiquidoDocument3 pagesMetano Liquidojazmin acostaNo ratings yet
- Calorlatente 2018Document14 pagesCalorlatente 2018Federico BidermannNo ratings yet
- Capítulo 8 ResumenDocument5 pagesCapítulo 8 ResumenYarethsi SanchezNo ratings yet
- Factores de Conversión PDFDocument2 pagesFactores de Conversión PDFsantiago gañan zamoraNo ratings yet
- Ecuaciones de estado, balances energéticos y de exergía para sistemas termodinámicosDocument9 pagesEcuaciones de estado, balances energéticos y de exergía para sistemas termodinámicosTotoo SuescunNo ratings yet
- Problemas resueltos de Hidráulica de CanalesFrom EverandProblemas resueltos de Hidráulica de CanalesRating: 4.5 out of 5 stars4.5/5 (7)
- Variable Aleatoria UnidimensionalDocument22 pagesVariable Aleatoria UnidimensionalThomasPolhNo ratings yet
- Practica4b - Simulacion - Fiabilidad - Sistemas - 2015Document16 pagesPractica4b - Simulacion - Fiabilidad - Sistemas - 2015ThomasPolhNo ratings yet
- PROBLEMA EJEMPLO - Tema1Document1 pagePROBLEMA EJEMPLO - Tema1ThomasPolhNo ratings yet
- Hoja1 15 16 GenericaDocument2 pagesHoja1 15 16 GenericaThomasPolhNo ratings yet
- Fundamentos de Termodinamica Tecnica (Shapiro - Moran) - 2° EdiciónDocument888 pagesFundamentos de Termodinamica Tecnica (Shapiro - Moran) - 2° Ediciónpecamvero100% (2)
- 00 Presentación de La Asignatura.2016-2017Document8 pages00 Presentación de La Asignatura.2016-2017ThomasPolhNo ratings yet
- PsicometricoDocument4 pagesPsicometricoMarilyn Sanchez MontillaNo ratings yet
- Calculo de Carga de RefrigeracionDocument22 pagesCalculo de Carga de RefrigeracionconsolapaNo ratings yet
- Segundo CorteDocument80 pagesSegundo Cortenicolas garciaNo ratings yet
- Transferencia de Masa 1Document9 pagesTransferencia de Masa 1Cristofer Gallegos AlorsNo ratings yet
- Balance de Energía en sistemas aire-aguaDocument17 pagesBalance de Energía en sistemas aire-aguaJorge AlvaradoNo ratings yet
- 4 Carta HumedadDocument15 pages4 Carta HumedadGIANCARLONo ratings yet
- Tablas, Diagramas y FormularioDocument34 pagesTablas, Diagramas y FormularioRaúl100% (2)
- PitometriaDocument25 pagesPitometriaAngélica MontalvoNo ratings yet
- Curva de Sec A Do Manzana VerdeDocument23 pagesCurva de Sec A Do Manzana VerdeMarlon PerezNo ratings yet
- Tarea Semana 7 TermoDocument13 pagesTarea Semana 7 Termoevelyn ibaceta100% (1)
- Ejercicios de Graficos de Control Por VariablesDocument25 pagesEjercicios de Graficos de Control Por VariablesJoseph JimenezNo ratings yet
- Calor y Frío IndustrialDocument13 pagesCalor y Frío IndustrialArezou NDNo ratings yet
- Ilovepdf MergedDocument9 pagesIlovepdf MergedOrdaz KarelyNo ratings yet
- Carta Psicometrica - CarrierDocument1 pageCarta Psicometrica - Carrierdiego baron huelvasNo ratings yet
- Parcial Operaciones de Ing. IVDocument2 pagesParcial Operaciones de Ing. IVjose silvaNo ratings yet
- Diferencia entre aire seco y húmedoDocument5 pagesDiferencia entre aire seco y húmedoJohn Ramírez60% (5)
- Solucionario DefwebDocument66 pagesSolucionario DefwebSantaigo IgnacioNo ratings yet
- Carta PsicrométricaDocument20 pagesCarta PsicrométricaAleeFloresNo ratings yet
- Psychrometrics 2020102400Document3 pagesPsychrometrics 2020102400carlos berrios liberatoNo ratings yet
- Ejercicio 5Document3 pagesEjercicio 5Daniel LautaroNo ratings yet
- s7 Tarea Set C Termo1202Document4 pagess7 Tarea Set C Termo1202Matematica Fisica EstadisticaNo ratings yet
- Libro FluidosDocument106 pagesLibro FluidosJuan Manuel Soriano MasNo ratings yet
- Calidad 1Document103 pagesCalidad 1Debanhi jerusalem Reta RamírezNo ratings yet
- Psicometria 2semstre 2019Document34 pagesPsicometria 2semstre 2019YENIFER PAOLA VILLAMIZAR ANGARITANo ratings yet
- PsicrometriaDocument46 pagesPsicrometriaMiguel Jose LucenaNo ratings yet
- C920 Balance Térmico de Una Caldera Con Sistemas IntegradosDocument12 pagesC920 Balance Térmico de Una Caldera Con Sistemas IntegradosMijailCubaNo ratings yet
- PSICROMETRIADocument33 pagesPSICROMETRIAdiego murillo100% (1)
- Metodo de Calculo de Humedad RelativaDocument7 pagesMetodo de Calculo de Humedad RelativaEdith EstradaNo ratings yet
- Carta Psicometrica ClaseDocument23 pagesCarta Psicometrica ClaseHuxley Alexander Flores BustamanteNo ratings yet