Professional Documents
Culture Documents
Análisis Crítico Diagramas de Fases
Uploaded by
Estefany Rosales MOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Análisis Crítico Diagramas de Fases
Uploaded by
Estefany Rosales MCopyright:
Available Formats
Instituto Universitario
Politcnico Santiago Mario
Extensin Porlamar
Anlisis
Crtico sobre
diagrama de fases
(Operaciones unitarias 2)
Realizado por:
Estefany Rosales
Seccin: 3A
Profesor: Lic. Julin Carneiro
Ingeniera Qumica
Porlamar, agosto 2015
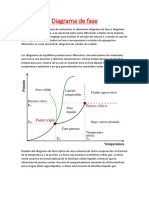
Los diagramas de Fase son un producto del equilibrio energtico
en el proceso de cambiar una fase de la muestra o el proceso de
cambiar de estado de cada sustancia involucrada donde bsicamente es
la combinacin de muchos de los materiales slidos que son un conjunto
de estructuras con propiedades fsicas que son tiles para nuestro
entorno y nos ayudan a formar parte en la funcin de una composicin y
sirven para el estudio de soluciones a diferentes composiciones en
diferentes temperaturas.
Los diagramas de fase estn muy relacionados a la ciencia de los
materiales la cual surgi despus de la Segunda Guerra Mundial, como
respuesta a la necesidad de producir materiales con propiedades
especializadas. Los primeros intentos de modificar cientficamente las
propiedades de la materia se remontan a principios del siglo pasado,
cuando los conocimientos de cristalografa, estado slido y fsica
atmica convirtieron el arte de la metalurgia en ciencia. De all parte la
creacin de nuevas aleaciones, como el acero, que es el resultado de las
aleaciones de hierro y carbono en diferentes proporciones.
Estos permiten conocer los diferentes tipos de estados de un
material, los cuales son sistemas que van en funcin de todas las fases
de cambios que representan determinadas condiciones de presin,
temperatura y composicin. A partir de los diagramas de fase se puede
obtener informacin como; conocer que fases estn presentes a
diferentes
composiciones
temperaturas
bajo
condiciones
de
enfriamiento lento (Equilibrio), averiguar la solubilidad, en el estado
slido y en el equilibrio, de un elemento (Compuesto) en otro,
determinar la temperatura en la cual una aleacin enfriada bajo
condiciones de equilibrio comienza a solidificar y la temperatura a la
cual ocurre la solidificacin, conocer la temperatura a la cual comienzan
a fundirse diferentes fases.
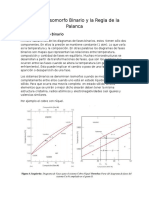
Po otro lado la regla de la palanca no es ms que una herramienta
que determina el porcentaje en peso de cada fase en un diagrama de
fases binario. Se usa para determinar el porcentaje en peso de las fases
lquida y slida de un sistema binario composicin-temperatura entre
lquido y slido. En regiones de una sola fase, la cantidad de
la fase simple es 100%. Al igual que la regla de Gibbs describe los
grados de libertad que posee el sistema dependiendo del tipo de
variables que consideremos.
En otro concepto de ideas la ebullicin y la congelacin son
ejemplos de cambios de fase que ocurren sin ningn cambio en la
composicin, es decir la tendencia del sistema a temperatura y presin
constantes a desplazarse hacia valores menores de la funcin de Gibbs
de un sistema es la misma que el potencial qumico, de forma que la
tendencia de cambio es en la direccin de la disminucin del potencial
qumico, esto es, estas formas alternas de expresar la direccin se
originan todas en la tendencia del universo a un desorden mayor, por lo
que la entropa del mismo aumenta. La funcin de Gibbs y el potencial
qumico no son otra cosa que la entropa total encubierta.
Podemos concluir diciendo que cualquier sustancia puede existir
en ms de un estado o fase de la materia. El equilibrio entre las fases es
dinmico; esto es, que existe una transferencia contina de partculas
de una fase a la otra. El equilibrio en este sistema dinmico se presenta
cuando la velocidad de transferencia entre las fases es similar. El cambio
de la materia de un estado a otro se denomina cambio de fase. Las
conversiones de un slido a lquido (fusin), de un slido a gas
(sublimacin), o de un lquido a gas (vaporizacin) son todos procesos
endotrmicos; es decir, que la entalpa de la fusin, sublimacin o
vaporizacin es positiva. El proceso inverso, la conversin de un lquido
a slido (congelacin), de un gas a slido (deposicin) o de un gas a
lquido (condensacin) son todos procesos exotrmicos, en esta forma
los cambios de entalpa para estos procesos son negativos.
Ejercicios
1. La figura muestra el diagrama de fases de las aleaciones binarias de
CobreNquel. Las resistencias del Cobre puro, Nquel puro y Metal
Monel (70%Ni-30%Cu), que representa la aleacin con mayores
caractersticas mecnicas de este sistema, son las siguientes: RNi =
34 MPa RCu = 17 MPa RMonel = 47 MPa Estima la carga de rotura que
tendr una pieza de aleacin 60%Ni- 40%Cu obtenida en un proceso
de colada sabiendo que la temperatura de solidus de la aleacin
medida en el proceso es de 1200C.
SOLUCIN: Para una aleacin 60%Ni- 40%Cu, se tiene una
temperatura de slidus de 1200C significa que la aleacin ha sufrido
segregacin dendrtica, lo que implica que el ltimo lquido que
solidificar tendr una composicin, segn el diagrama de equilibrio, del
20% de Ni, y por lo tanto ser la resistencia mecnica correspondiente a
este porcentaje en nquel la que caracterizar la resistencia mecnica de
toda la aleacin. Esta resistencia se obtendr de la grfica linealizada
del comportamiento de las aleaciones Cu-Ni, o bien interpolando entre la
resistencia del cobre puro y la del monel, de esta forma obtenemos que
la resistencia de la aleacin ser de 25.6 MPa
2. Construir el diagrama de fases del sistema Plomo-Antimonio y
completar las fases presentes en el mismo.
*Temperatura de fusin del plomo = 328C
*Temperatura de fusin del antimonio = 631C
*Composicin eutctica, 11 % de antimonio.
*Solubilidad del antimonio en plomo: mxima de 4% a 252C nula a
25C
*Solubilidad del plomo en antimonio: mxima de 5% a 252C 2% a
25C
SOLUCIN: La construccin del diagrama de fases puede
observarse en la figura donde cabe sealar la presencia del eutctico
con el porcentaje del 11% cuya temperatura de transformacin es de
252C. En el mismo diagrama se han representado las diferentes
zonas con sus fases correspondientes, principalmente, las zonas de
lquido, lquido + fase , lquido ms fase , zona monofsica , zona
monofsica , y zona bifsica + , que se divide en dos zonas, una
hipoeutctica (E + ) y otra hipereutctica (E + ).
3. Haciendo uso del diagrama Bi - Sb. Calcular para una aleacin con 45
% de Sb:
a) Transformaciones que experimenta al enfriarse lenta-mente desde el
estado lquido hasta la temperatura ambiente.
b) Dibjese la curva de enfriamiento.
c) * Si el enfriamiento no se verifica en condiciones de equilibrio, cul
ser la mxima diferencia de concentracin entre el centro de un grano
y su periferia?
d) A qu temperatura habr un 50 % de aleacin en estado lquido?
e) Porcentaje de las fases a 400C.
Solucin:
a) Por encima de 510C se encuentra en estado lquido (1 fase); por
debajo de 350C todo es solucin slida (1 fase); entre 510 y 350C
coexisten lquido y solucin slida (2 fases).
b) La curva de enfriamiento aparece representada junto al diagrama.
c) Al formarse un grano no homogneo, las concentracin de Sb vara
desde el 87.5 % (primera solidificacin) hasta el 10 % (final de la
solidificacin) para la concentracin considerada.
d) Cuando esto ocurre Lquido/Slido = 1, es decir, los segmentos a y b
deben de ser iguales. Esto ocurre a 415C. (Solucin grfica).
e) Lquido + Solucin slida a = 100 Lquido (45 - 20) = a (65- 45),
luego: Lquido = 44.4 % a = 55.6 %
You might also like
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesFrom EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNo ratings yet
- Ses 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaDocument40 pagesSes 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaMaria AquiseNo ratings yet
- Fases de Transformaciones de Los MetalesDocument8 pagesFases de Transformaciones de Los MetalesbryanNo ratings yet
- Actividad 10 Diagrama de FasesDocument8 pagesActividad 10 Diagrama de FasesCitlaly Montalvo100% (1)
- Trabajo AutonomoDocument7 pagesTrabajo AutonomoJeremy Daniel Mendoza SegoviaNo ratings yet
- ConclusiónDocument11 pagesConclusiónJose Enrique Siso100% (1)
- Analisis TermicoDocument11 pagesAnalisis TermicoKatherineNo ratings yet
- Diagrama de FaseDocument11 pagesDiagrama de FaseAnonymous o5FX4oqBNo ratings yet
- Solidificacion Proceso y VelocidadDocument9 pagesSolidificacion Proceso y VelocidadarielNo ratings yet
- Sistema EutecticoDocument10 pagesSistema EutecticoSteeven2511No ratings yet
- Unidad 5. - Tranformación EstructuralDocument14 pagesUnidad 5. - Tranformación EstructuralAlex Garcia Ulloa100% (1)
- Unidad 5. - Tranformación EstructuralDocument14 pagesUnidad 5. - Tranformación EstructuralAlex Garcia UlloaNo ratings yet
- Diagramas de FaseDocument27 pagesDiagramas de FaseDanniel BloomNo ratings yet
- Cuestionario Diagrma de FasesDocument5 pagesCuestionario Diagrma de FasesAndrés Gallardo AlbercaNo ratings yet
- Como Hacer Diagramas de FaseDocument9 pagesComo Hacer Diagramas de FaseArturo CollazosNo ratings yet
- Diagrama de FaseDocument5 pagesDiagrama de FaseKevin Perez YalleNo ratings yet
- Informe Equilibrio Liquido VaporDocument25 pagesInforme Equilibrio Liquido VaporPaolo Guerra SteinNo ratings yet
- Diagrama de FasesDocument32 pagesDiagrama de FaseslilisacasNo ratings yet
- Tecnologia de Losmateriales 2.corte 10%Document20 pagesTecnologia de Losmateriales 2.corte 10%Miguel MontañoNo ratings yet
- Diagamas de Fase y AleacionesDocument17 pagesDiagamas de Fase y AleacionesFrankNo ratings yet
- Diagrama de Fase y FisicoquimicaDocument4 pagesDiagrama de Fase y FisicoquimicaRonal Vásquez BautistaNo ratings yet
- Sistema Isomorfo Binario y La Regla de La PalancaDocument3 pagesSistema Isomorfo Binario y La Regla de La PalancaCarlos Abraham Paniahua Pérez100% (1)
- Suarez-Equilibrio de FasesDocument14 pagesSuarez-Equilibrio de FasesSusan Jeny Suarez AbadNo ratings yet
- Diagramas de FaseDocument15 pagesDiagramas de FaseDiego NogalesNo ratings yet
- Transformaciones de Fase o Cambios de EstadoDocument7 pagesTransformaciones de Fase o Cambios de EstadooswaldoNo ratings yet
- Informe-IV.-sólido Eutéctico - Grupo 1Document10 pagesInforme-IV.-sólido Eutéctico - Grupo 1Jorge ForeroNo ratings yet
- Guía Diagramas de FaseDocument5 pagesGuía Diagramas de FaseFelipe Peña PeñaNo ratings yet
- HandbookDocument277 pagesHandbookAlecita GabyNo ratings yet
- Ultimo Taller de CienciasDocument17 pagesUltimo Taller de CienciasCamilo Valencia57% (7)
- Clase 18 Diagrama de Equilibrio EutecticoDocument19 pagesClase 18 Diagrama de Equilibrio EutecticoJOSE VALENTIN FLORES RODRIGUEZNo ratings yet
- Diagrama de Fases, Isomorfos y SolidificacionDocument18 pagesDiagrama de Fases, Isomorfos y SolidificacionGustavoBolañosNo ratings yet
- Materiales 1 UNCDocument8 pagesMateriales 1 UNCSimon ReyesNo ratings yet
- CAP9 RevenidoDocument70 pagesCAP9 RevenidoFelipe Romario Hilario QuispeNo ratings yet
- Diagrama de FasesDocument12 pagesDiagrama de FasesJason Q. CruzNo ratings yet
- Apunte 7 Diagramas de FaseDocument18 pagesApunte 7 Diagramas de FaseAdolfo Rojas ArellanoNo ratings yet
- Apunte 7 Diagramas de Fase PDFDocument18 pagesApunte 7 Diagramas de Fase PDFJaime MendozaNo ratings yet
- Introducción Diagrama de FaceDocument12 pagesIntroducción Diagrama de FaceObed AguilarNo ratings yet
- Diagrama de FasesDocument5 pagesDiagrama de FasesJosue DávilaNo ratings yet
- Labo 4 Fiqui IDocument71 pagesLabo 4 Fiqui IMalu AisneNo ratings yet
- Taller Transformaciones Fisicas de Las Sustancias PurasDocument11 pagesTaller Transformaciones Fisicas de Las Sustancias Puraskevinj311No ratings yet
- Diagrama de FaseeDocument27 pagesDiagrama de FaseeCarolyn BennettNo ratings yet
- Practica #7Document8 pagesPractica #7Javier TabaresNo ratings yet
- Trabajo Diagrama de FasesDocument27 pagesTrabajo Diagrama de FasesAriana PérezNo ratings yet
- Equilibrio de FasesDocument34 pagesEquilibrio de FasesAndrea Gomez100% (1)
- Cuestionario Diagrama de Fase Regla de La Palanca y DurezaDocument8 pagesCuestionario Diagrama de Fase Regla de La Palanca y DurezaJuan Diego Riano MurciaNo ratings yet
- Diagramas de Fase y SolucionesDocument22 pagesDiagramas de Fase y SolucionesSnei FlorezNo ratings yet
- Guia 4Document11 pagesGuia 4RoyNo ratings yet
- Transiciones de Fases Unidad II Cinètica de Las Transformaciones de FaseDocument85 pagesTransiciones de Fases Unidad II Cinètica de Las Transformaciones de Fasecoreano63No ratings yet
- Energía en Los Cambios QuímicosDocument12 pagesEnergía en Los Cambios QuímicossofiaNo ratings yet
- Diagrama de Fases o Diagrama de Equilibrio 1 PDFDocument16 pagesDiagrama de Fases o Diagrama de Equilibrio 1 PDFSylvia RodriguezNo ratings yet
- Punto de Fusión de Sistemas BinariosDocument5 pagesPunto de Fusión de Sistemas BinariosJoaquin Montes FernandezNo ratings yet
- Diagrama de FaceDocument8 pagesDiagrama de FaceLeonardo Daniel Toledo PresaNo ratings yet
- IntroducciónDocument19 pagesIntroducciónYerson JunesNo ratings yet
- Gibbs Aliaciones Isoformas PDFDocument7 pagesGibbs Aliaciones Isoformas PDFAnderson Flores RiveraNo ratings yet
- U6 2C 2017Document32 pagesU6 2C 2017Flor MalamudNo ratings yet
- Unidad #6: Equilibrio de FasesDocument34 pagesUnidad #6: Equilibrio de FasesMilena QuijadaNo ratings yet
- Diagrama de FasesDocument16 pagesDiagrama de FasesOrlando FernándezNo ratings yet
- Mezcla EutecticaDocument25 pagesMezcla EutecticaTania Mireya VillarroelNo ratings yet
- T2 - Diagramas - Equilibrio Del Hierro CarbonoDocument12 pagesT2 - Diagramas - Equilibrio Del Hierro Carbonojose2277No ratings yet
- Informe de Diagrama de Fases U5 GjpsDocument16 pagesInforme de Diagrama de Fases U5 Gjpsjose jose prieto santanaNo ratings yet
- PCS Del GLPDocument4 pagesPCS Del GLPEduardo DávilaNo ratings yet
- Foro #03Document3 pagesForo #03Gheraldine Alejos NanfuñayNo ratings yet
- Tema4 - Pendulo, Areas-17-23Document7 pagesTema4 - Pendulo, Areas-17-23Luis Alexander Niiño FlorezNo ratings yet
- Estructura Atómica y Tabla PeriódicaDocument27 pagesEstructura Atómica y Tabla PeriódicaCristhian Ipanaque0% (1)
- Valvulas de ControlDocument22 pagesValvulas de Controleduardo191993No ratings yet
- Unidad 3. Arboles Articulados y Juntas UniversalesDocument26 pagesUnidad 3. Arboles Articulados y Juntas Universalesgabriel ulcuangoNo ratings yet
- 1er Trabajo EncargadoDocument7 pages1er Trabajo EncargadoSara Livingston0% (4)
- Silabo Quimica GeneralDocument2 pagesSilabo Quimica GeneralBrayanNo ratings yet
- Informe Final Del ProyectoDocument6 pagesInforme Final Del ProyectoedinsonNo ratings yet
- Definicion de Tratamiento y Recocido TotalDocument14 pagesDefinicion de Tratamiento y Recocido TotalAdrian Felipe Muñoz VegaNo ratings yet
- Práctica No3Document6 pagesPráctica No3Fernanda GarcíaNo ratings yet
- Ups KT00016Document205 pagesUps KT00016Segundo Velayarce LlanosNo ratings yet
- Mecanica de Los FluidosDocument9 pagesMecanica de Los FluidosLautaro Francisco Damian BarbonaNo ratings yet
- Mecanica de Suelos UnidadesDocument24 pagesMecanica de Suelos UnidadesSalma Del AngelNo ratings yet
- El Sonido y Sus CualidadesDocument19 pagesEl Sonido y Sus CualidadesPablo RomeroNo ratings yet
- Levas IntroduccionDocument15 pagesLevas IntroduccionIvan GarzonNo ratings yet
- Instrumentos de Medicion en Proyectos de Energia RenovableDocument17 pagesInstrumentos de Medicion en Proyectos de Energia RenovablemarceloNo ratings yet
- Fisca EjercicosDocument3 pagesFisca EjercicosBlady Sullcahuaman FloresNo ratings yet
- Ficha Técnica Rib SteelDocument6 pagesFicha Técnica Rib SteelRonald RojasNo ratings yet
- Pruebas A Una Bomba de Inyeccion Lineal en Un Banco de Pruebas de Bombas de Alta PresionDocument7 pagesPruebas A Una Bomba de Inyeccion Lineal en Un Banco de Pruebas de Bombas de Alta PresionZetamec Huayta67% (3)
- Recuperativo Segundo Parcial (2010-2011)Document2 pagesRecuperativo Segundo Parcial (2010-2011)José MenesesNo ratings yet
- Prelab #7 II 2021 Equilibrio de ReacciónDocument2 pagesPrelab #7 II 2021 Equilibrio de ReacciónDrawing and Artistic DecorationsNo ratings yet
- Selección Acoplamiento de Fuelle GSFDocument4 pagesSelección Acoplamiento de Fuelle GSFJamen Luis Quinonez BellidoNo ratings yet
- Resumen Estructura 1 Cátedra 10Document11 pagesResumen Estructura 1 Cátedra 10PaulaNo ratings yet
- Informe de Termodinamica. Sustancias Puras ..Document8 pagesInforme de Termodinamica. Sustancias Puras ..OrianaNo ratings yet
- PREMILINE 58 (Borrador Preliminar)Document106 pagesPREMILINE 58 (Borrador Preliminar)L GlezNo ratings yet
- Reporte de La Práctica 12 (Mesa 4)Document10 pagesReporte de La Práctica 12 (Mesa 4)JezzyNo ratings yet
- Determinacion de La Reflexion de La LuzDocument22 pagesDeterminacion de La Reflexion de La LuzJesus Fabian Guzman Cuevas100% (1)
- Estructura Atomica y Tabla PeriodicaDocument40 pagesEstructura Atomica y Tabla Periodicasc0rpi091No ratings yet
- Trabajo de ElectrotecniaDocument13 pagesTrabajo de Electrotecniagerman valenciaNo ratings yet