Professional Documents
Culture Documents
Ecuación de Gases Reales
Uploaded by
Ali DíazCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ecuación de Gases Reales
Uploaded by
Ali DíazCopyright:
Available Formats
Ecuacin de gases reales
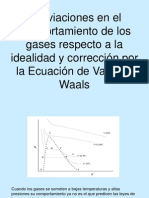
La ecuacin de estado de gas ideal solo es
vlida cuando se aplican a gases reales que
se encuentran a bajas presiones y
temperaturas altas, cuyas condiciones
corresponden a grandes volmenes molares,
a presiones altas los errores llegan incluso el
500%
No
cumplen
pV=nRT
debido
a
INTERACCIONES MOLECULARES
Las desviaciones son importantes a BAJAS T y
altas p
Ecuacin de van der Waals
Es la ms conocida de las ecuaciones cbicas de
estado y corrige las dos peores suposiciones de la
ecuacin del gas ideal: tamao molecular
infinitesimal
y
ausencia
de
fuerzas
intermoleculares.
RT
a
P
2
V b V
a y b se denominan constantes de van der Waals
y dependen del tipo de gas.
Ecuacin de van der Waals
Para n moles, como
V
V n V V
n
2
nRT
an
P
2
V nb V
b se denomina co-volumen, y se
debe al volumen intrnseco de
las partculas, y produce una
DESVIACIN POSITIVA.
nb es el volumen total ocupado
por las partculas de gas.
El trmino a tiene en cuenta
las interacciones ATRACTIVAS
entre las partculas. Este
efecto reduce la presin
porque reduce la fuerza y
frecuencia de colisiones. El
efecto sobre la presin es
proporcional al cuadrado de
la concentracin (n/V ).
Ecuacin de van der Waals
La Ecuacin de van der Waals tambin
se expresa de la siguiente forma:
a
P 2 n V n b nRT
V
La ecuacin de van der Waals es
una ecuacin cbica con
respecto al volumen molar y al
nmero de moles de manera
que hay tres races de Volumen
para cada valor de P.
Cuando existe una raz real y
dos complejas conjugadas,
estamos en la regin de gas en
la cual la condensacin a la fase
lquida no es posible. Cuando
hay tres races reales, la
isoterma de Van der Waals
tiene
el
comportamiento
similar a la letra S acostada. Esa
regin corresponde a la
coexistencia de fase lquida y
gaseosa
Ecuacin de van der Waals
En el punto crtico ocurre una inflexin (1ra y 2da derivadas nulas):
dP
RT
2a
3 0
2
dV
(V b) V
Las soluciones de estas ecuaciones son:
V C 3b
a
PC
27b 2
8a
TC
27bR
d 2P
2 RT
6a
4 0
2
3
(V b) V
dV
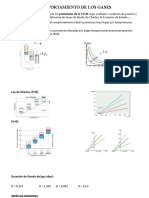
Constantes crticas experimentales
para diversas substancias
SUSTANCIA
Acetileno
Argn
Cloro
Cloruro de hidrgeno
Dixido de azufre
Etileno
Dixido de carbono
Hidrgeno
Isobutano
Metano
Monxido de carbono
n-Butano
Nitrgeno
Vc
3
-1
cm mol
Tc/K
Pc/bar
308,3
61,39
113
150,9
48,98
74,6
417,2
77,1
124
324,7
83,1
81
430,8
78,84
122
282,3
50,4
131
304,2
73,83
94
33,19
13,13
64,1
408,1
36,48
262,7
190,6
45,99
98,6
132,9
34,99
93,4
425,1
37,96
255
126,2
34
89,2
Ecuacin de van der Waals
Resolviendo las ecuaciones Pc y Tc se obtienen las constantes a y b:
2
27 R Tc
a
64 Pc
RTc
b
8Pc
Principio de los estados correspondientes:
Teniendo en cuenta la
Ecuacin de vdW y las
constantes crticas se
obtienen:
P
Pr
PC
T
Tr
TC
Vr
V
VC
Otras ecuaciones de estado
Ecuacin de Redlich-Kwong (RK)
R T
a
P
0,5
V b T V V b
Las constantes son:
R 2Tc 2,5
a 0,42747
Pc
RTc
b 0,08664
Pc
Fue introducida en 1949. La
ecuacin RK sigue la forma de la
ecuacin de Van der Waals (1873) y
la de Clausius (1880).
Otras ecuaciones de estado
Ecuacin de Soave Redlich-Kwong (SRK)
RT
a
P
V b V V b
Las constantes son:
R 2Tc 2
a 0,42747
Pc
RTc
b 0,08664
Pc
El trmino dependiente de la
temperatura a/(T)0,5, de la ecuacin
RK, fue reemplazado por la funcin
a(T,w),
involucrando
a
la
temperatura y al factor acntrico.
Esto fue propuesto por Soave
(1972),
1 0,48508 1,55171w 0,15613w 1 T
2
0, 5
r
Otras ecuaciones de estado
Ecuacin de Peng Robinson
R T
a
P
2
V b V 2 b V b 2
Las constantes son:
R 2Tc 2
a 0,45724
Pc
RTc
b 0,07780
Pc
Los parmetros se expresan en
funcin de la presin crtica, la
temperatura crtica y el factor acntrico.
Aumenta la eficiencia en los clculos
en la cercana del punto crtico.
La ecuacin se aplica en el clculo de
las propiedades de fluidos en los
procesos de gas natural.
1 0,37464 1,5422w 0,26992w2 1 Tr0,5
You might also like
- EdE cúbicasDocument26 pagesEdE cúbicasJulio DuarteNo ratings yet
- Unidad 4-Presentacion Ecuaciones de EdoDocument85 pagesUnidad 4-Presentacion Ecuaciones de EdoIvan HdezNo ratings yet
- Gases Reales PresentacionDocument48 pagesGases Reales PresentacionEdwinNo ratings yet
- Ecuaciones gases realesDocument13 pagesEcuaciones gases realesCristian Ccaso MamaniNo ratings yet
- Ecuaciones de EstadoDocument10 pagesEcuaciones de EstadoMiguel Angel PalominoNo ratings yet
- Ecuación Van der WaalsDocument5 pagesEcuación Van der WaalsCarlos CarhuayoNo ratings yet
- Ecuaciones de Estado para Gases No IdealesDocument29 pagesEcuaciones de Estado para Gases No IdealesFernando LópezNo ratings yet
- IntroIQ Clase 17 y 18Document27 pagesIntroIQ Clase 17 y 18AR QuímicaNo ratings yet
- MonografiaDocument19 pagesMonografiaLeydi Torcagua HuamaniNo ratings yet
- Diferencias Entre Gas Real e IdealDocument7 pagesDiferencias Entre Gas Real e IdealRosmery Orellana Nina100% (2)
- Ecuaciones de estado para gases ideales y realesDocument63 pagesEcuaciones de estado para gases ideales y realesCallejas Palominos Eduardo0% (1)
- Term Odin Á MicaDocument18 pagesTerm Odin Á MicaJose Pineda RamirezNo ratings yet
- Euaciones de EstadoDocument12 pagesEuaciones de EstadoEsther Ramos GonzalezNo ratings yet
- Ecuaciones de Estado para Gases RealesDocument25 pagesEcuaciones de Estado para Gases RealesKEVIN ARNOLDO PEREZ RIVASNo ratings yet
- IsotermasDocument6 pagesIsotermasSamu Benito100% (1)
- Artículo Peng-RobinsonDocument8 pagesArtículo Peng-RobinsonF5LucasNo ratings yet
- Quimica General IDocument18 pagesQuimica General ISofía Alvarez HernandezNo ratings yet
- KellogDocument19 pagesKellogKatheryn Contreras SanabriaNo ratings yet
- Gas RealDocument23 pagesGas RealAlejandra Adrian TejadaNo ratings yet
- Gases reales y ecuación de Van der WaalsDocument9 pagesGases reales y ecuación de Van der WaalsCamila PachecoNo ratings yet
- Trabajo de Fisicoquimica 2Document15 pagesTrabajo de Fisicoquimica 2Sayuri Elena Petro MaceaNo ratings yet
- Informe 2 Van Der Walls Grupo 2Document20 pagesInforme 2 Van Der Walls Grupo 2Sergio Carmelo ÑañezNo ratings yet
- Ecuacion de EstadoDocument13 pagesEcuacion de EstadoROSARIOMARTINEZ25No ratings yet
- Ecuacion de EstadoDocument7 pagesEcuacion de EstadoALEX FERNANDO MORENO CANONo ratings yet
- Licuefacción de gasesDocument46 pagesLicuefacción de gasesPablo CabreraNo ratings yet
- Gases Reales 20-IiDocument5 pagesGases Reales 20-IiDanny Palma AyalaNo ratings yet
- Ecuación de Estado de Van Der WaalsDocument3 pagesEcuación de Estado de Van Der WaalsDaniel Maldonado OroscoNo ratings yet
- Ecuaciones de estado para gases realesDocument6 pagesEcuaciones de estado para gases realesJüan Prz100% (1)
- Ecuaciones de Estado y Factor de CompresibilidadDocument4 pagesEcuaciones de Estado y Factor de CompresibilidadJesusEduardoPerezPerezNo ratings yet
- Gases IdealesDocument12 pagesGases IdealesCinthya MaldonadoNo ratings yet
- Ecuación de Estado de Van Der WaalsDocument3 pagesEcuación de Estado de Van Der WaalsHola Yesenia DiazNo ratings yet
- Ecuación de Estado de Van Der WaalsDocument3 pagesEcuación de Estado de Van Der WaalsHola Yesenia DiazNo ratings yet
- Ecuación de Estado de Van Der WaalsDocument3 pagesEcuación de Estado de Van Der WaalsHola Yesenia DiazNo ratings yet
- 4.-Modelo Matemático de Redlich-Kwong: R Constante de Los Gases (8.31451 J/mol K)Document4 pages4.-Modelo Matemático de Redlich-Kwong: R Constante de Los Gases (8.31451 J/mol K)Katherine JacayNo ratings yet
- Clase 5Document34 pagesClase 5Miguel AngelNo ratings yet
- Unidad. 1Document78 pagesUnidad. 1erick sanchezNo ratings yet
- Ecuacion de Van Der WaalsDocument3 pagesEcuacion de Van Der WaalsviridianaNo ratings yet
- Corre Laci OnesDocument46 pagesCorre Laci Onesdéborah_rosalesNo ratings yet
- Ecuación de Estado de Van Der WaalsDocument3 pagesEcuación de Estado de Van Der Waalsrosario_noyolaNo ratings yet
- Sustancias PurasDocument64 pagesSustancias PurasJaimeHoNo ratings yet
- Termo 3Document36 pagesTermo 3José Emilio GuardiaNo ratings yet
- Estados CorrespondientesDocument16 pagesEstados CorrespondientesCarlos AlarconNo ratings yet
- Gases RealesDocument17 pagesGases RealesGustavo Espinoza Rivera100% (2)
- Capitulo 1.2Document21 pagesCapitulo 1.2benru29No ratings yet
- Ecuación de Estado de Van Der WaalsDocument8 pagesEcuación de Estado de Van Der Waalsgeorgemith100% (1)
- Ecuaciones Cúbicas de EstadoDocument5 pagesEcuaciones Cúbicas de EstadoCATHERINE ALEJANDRA GALICIA RODRIGUEZNo ratings yet
- Taller Cálculos Con Ecuaciones Cúbicas de Estado para PetróleoDocument16 pagesTaller Cálculos Con Ecuaciones Cúbicas de Estado para PetróleoSantiagoVélezSNo ratings yet
- Isotermas de Gases RealesDocument15 pagesIsotermas de Gases RealesMiguel Lara RodriguezNo ratings yet
- Volumenmolarecuacionesdeestado 20441Document4 pagesVolumenmolarecuacionesdeestado 20441Marcos RdzNo ratings yet
- Trabajo de Termo Propiedades ResidualesDocument25 pagesTrabajo de Termo Propiedades ResidualesLuis Gamero50% (2)
- Comportamiento de Los GasesDocument25 pagesComportamiento de Los GasesElsa Marzana SanizoNo ratings yet
- Comportamiento de los gasesDocument25 pagesComportamiento de los gasesERIKA LOZADA RUSSELNo ratings yet
- Ecuación de van der Waals para calcular volumen molar y factor de compresibilidad de amoniacoDocument2 pagesEcuación de van der Waals para calcular volumen molar y factor de compresibilidad de amoniacoHerbert Cervantes Miguel67% (3)
- Ecuaciones de EstadoDocument13 pagesEcuaciones de EstadoDaniel AvendañoNo ratings yet
- Termo 2 IntroDocument5 pagesTermo 2 IntroNelson DiazNo ratings yet
- Modelo Matemático de Van Der WaalsDocument4 pagesModelo Matemático de Van Der WaalsSelegna PachecoNo ratings yet
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesFrom EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNo ratings yet
- Indice de Masculinidad Urbano Rural de PunoDocument6 pagesIndice de Masculinidad Urbano Rural de PunoAli DíazNo ratings yet
- Manual Banco de Tubos (Ali - Una)Document14 pagesManual Banco de Tubos (Ali - Una)Ali DíazNo ratings yet
- Apuntes de Congelación de AlimentosDocument67 pagesApuntes de Congelación de Alimentosricaton2000319992% (26)
- Problemas Ingenieria QuimicaDocument66 pagesProblemas Ingenieria Quimicaelcazador_047No ratings yet
- Apuntes de RefrigeracionDocument36 pagesApuntes de RefrigeracionAli DíazNo ratings yet
- Ejercicios Metodos NumericosDocument15 pagesEjercicios Metodos NumericosAli DíazNo ratings yet
- Manual Banco de Tubos (Ali - Una)Document14 pagesManual Banco de Tubos (Ali - Una)Ali DíazNo ratings yet
- Apuntes de RefrigeracionDocument36 pagesApuntes de RefrigeracionAli DíazNo ratings yet
- SeparacionFlash SRKDocument39 pagesSeparacionFlash SRKjose_guzman1No ratings yet
- Operaciones UnitariasDocument341 pagesOperaciones UnitariasPatricio Mix Sepulveda97% (33)
- Simulador EceDocument19 pagesSimulador EceAli DíazNo ratings yet
- Problprocesosseparacion PDFDocument45 pagesProblprocesosseparacion PDFOscar OvandoNo ratings yet
- Problemas DestilacionDocument19 pagesProblemas DestilacionAli Díaz75% (4)
- Termodinámica y química física: gases, calor y equilibrio químicoDocument2 pagesTermodinámica y química física: gases, calor y equilibrio químicoFANNY DEL LOMPARTE RAMOSNo ratings yet
- Gases IdealesDocument25 pagesGases IdealesVictor PereaNo ratings yet
- Ecuación Van der WaalsDocument16 pagesEcuación Van der WaalsMariia Pava ValenciiaNo ratings yet
- Practica20 PDFDocument2 pagesPractica20 PDFHyllary BorjaNo ratings yet
- Propiedades de Los Gases RealesDocument10 pagesPropiedades de Los Gases RealesEllen MacuilNo ratings yet
- REALES Punto CriticoDocument15 pagesREALES Punto Criticodenis jesus alcedoNo ratings yet
- Ecuación de Estado de Gases RealesDocument2 pagesEcuación de Estado de Gases RealesBryan FariasNo ratings yet
- Laboratorio N1Document13 pagesLaboratorio N1AlekatNo ratings yet
- Ecuación Van Der Waals resuelta numéricamenteDocument10 pagesEcuación Van Der Waals resuelta numéricamenteCitlali Jazmín100% (1)
- Diseño de Prototipo Cilindro-ÉmboloDocument16 pagesDiseño de Prototipo Cilindro-ÉmboloMiguel DominguezNo ratings yet
- Ecuación de Estado de Van Der WaalsDocument6 pagesEcuación de Estado de Van Der WaalsMiguelNo ratings yet
- FisicaI 3º ParteDocument199 pagesFisicaI 3º ParteAnabel AcostaNo ratings yet
- 1-Ecuación de Gas IdealDocument104 pages1-Ecuación de Gas IdealAlice AcevedoNo ratings yet
- Metodos Numericos Abiertos y Cerrados TermodinamicaDocument15 pagesMetodos Numericos Abiertos y Cerrados TermodinamicaPablo Andres Morales VidalNo ratings yet
- Informe 2 Van Der Walls Grupo 2Document20 pagesInforme 2 Van Der Walls Grupo 2Sergio Carmelo ÑañezNo ratings yet
- Propiedades Termodinámicas de Las Sustancias PurasDocument17 pagesPropiedades Termodinámicas de Las Sustancias PuraskevinNo ratings yet
- Practica #4 de Termodinamica I Gas Ideal (Semana N°4)Document5 pagesPractica #4 de Termodinamica I Gas Ideal (Semana N°4)elvergalargacm35No ratings yet
- Densidad y Peso Molecular Del AireDocument14 pagesDensidad y Peso Molecular Del AireChristopher David Alarcón AliagaNo ratings yet
- Gases RealesDocument7 pagesGases RealesPablo Elias Suarez RoaNo ratings yet
- Punto Critico-Grupo 2Document22 pagesPunto Critico-Grupo 2Angelo RodríguezNo ratings yet
- PDF 1er P Aux Pablo - CompressDocument60 pagesPDF 1er P Aux Pablo - CompressJuan M.L.No ratings yet
- Gases RealesDocument14 pagesGases RealesOsvaldo Herrera Palomares100% (1)
- INSTITUTO POLITECNICO NACIONAL PracticaDocument9 pagesINSTITUTO POLITECNICO NACIONAL PracticaAxel Castellanos AguilarNo ratings yet
- Ejercicios Gases Ideales y RealesDocument4 pagesEjercicios Gases Ideales y RealesJavier Sarmiento RojasNo ratings yet
- Hoja 6Document2 pagesHoja 6Ricardo VelazquezNo ratings yet
- Segunda Serie de Termodinámica AGO-DIC 2022Document3 pagesSegunda Serie de Termodinámica AGO-DIC 2022mmjNo ratings yet
- Taller N1 Ej FQDocument4 pagesTaller N1 Ej FQEFRAINNo ratings yet
- Banco de Preguntas T de Los GasesDocument6 pagesBanco de Preguntas T de Los GasesMartha Gabriela SanchezNo ratings yet
- Proyecto FinalDocument20 pagesProyecto FinalJenifer LópezNo ratings yet
- Gas ideal vs real: leyes y conceptosDocument24 pagesGas ideal vs real: leyes y conceptosangelkick42100% (2)