Professional Documents
Culture Documents
Guia QG2012
Uploaded by
GonzaL.ArataOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Guia QG2012
Uploaded by
GonzaL.ArataCopyright:
Available Formats
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Universidad Nacional de La Plata
Facultad de Ciencias Exactas
Departamento de Qumica
Ctedra de Qumica General
Edicin 2012
ndice:
Reglamento e instrucciones para las clases
Bibliografa recomendada
Fuerzas intermoleculares
Gases reales y cambios de estado
Trabajo prctico: presin de vapor
Slidos
Trabajo prctico: purificacin de sulfato de cobre comercial
Propiedades coligativas
Trabajo prctico: crioscopa
Cintica qumica
Trabajo prctico: cintica qumica
Equilibrio qumico
Trabajo prctico: equilibrio qumico
Equilibrios inicos
Trabajo prctico: electrolitos, pH e indicadores
Trabajo prctico: hidrlisis
Equilibrios heterogneos
Trabajo prctico: destilacin
Trabajo prctico: coeficiente de reparto
Electroqumica
Trabajo prctico: equivalente electroqumico
Trabajo prctico: celdas galvnicas (pilas)
2
2
3
4
6
11
14
21
23
27
28
31
33
40
44
56
63
65
75
80
81
88
Gua de Trabajos Prcticos de Qumica General Edicin 2012
REGLAMENTO E INSTRUCCIONES PARA LAS CLASES
Las clases son obligatorias. Se permite un mximo de 20 % de
inasistencias justificadas. El total de estas inasistencias no debe superar el
10 % de los trabajos de laboratorio.
La tolerancia para la entrada es de 5 minutos luego del comienzo del turno.
Excepto cuando se hagan las pausas o recreos programados para la clase, los
alumnos deben estar en el laboratorio.
Durante la realizacin de trabajos de laboratorio es absolutamente
imprescindible contar con guardapolvos de manga larga (no chaqueta) el que
deber estar prendido durante la realizacin del trabajo y con gafas de
seguridad (que regularmente provee la Facultad) y que debern mantenerse
colocadas correctamente durante el laboratorio. La ausencia de estos
elementos implicar la no realizacin del TP y la necesidad de recuperarlo en
otra instancia.
Por razones de seguridad, en lo posible los alumnos debern abstenerse de
utilizar ojotas o sandalias abiertas y shorts durante los trabajos de laboratorio.
Por el mismo motivo, se recomienda que el cabello largo se lleve recogido.
Durante la realizacin de trabajos de laboratorio, todos los efectos personales
(abrigos, mochilas, etc.) debern ubicarse en las mesadas laterales del
laboratorio pero no en las mesadas de trabajo.
Debido a que las clases se desarrollan en un laboratorio, no est permitido
bajo ningn concepto ingerir alimentos durante las clases.
La ingestin de bebidas podr hacerse, si el docente lo permitiese, excepto
durante los trabajos de laboratorio.
Durante la realizacin de los trabajos de laboratorio, los alumnos debern
seguir las instrucciones de la gua de TP y de los docentes, debern
abstenerse de realizar mezclas no autorizadas de compuestos y se
desplazarn, en caso necesario, con sumo cuidado dentro del laboratorio.
Instrucciones ms precisas sern indicadas por los docentes durante las clases
correspondientes.
BIBLIOGRAFA
Qumica. Raymond Chang.
Qumica General. Ralph H. Petrucci y William S. Harwood.
Qumica: la ciencia central. Theodore L. Brown, H. Eugene LeMay y Bruce E.
Bursten.
Qumica General. Kennet W. Whitten, Kennet D. Gailey, Raymond E. Davies.
Introduccin a la Qumica. Varios autores, coordinador Hctor P. Tedesco.
Principios de Qumica. Peter Atkins, Loretta Jones.
Chemistry: molecules, matter and change. Peter Atkins, Loretta Jones.
Chemistry. Martin S. Silberberg.
Elementos de Fisicoqumica. Glasstone S.
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Fuerzas intermoleculares
TEORA-SEMINARIO
Temario: Fuerzas de dispersin, dipolo-dipolo y puente hidrgeno.
1. Diferencie las fuerzas de dispersin de London y las dipolo-dipolo.
2. Prediga el orden creciente de las fuerzas de atraccin para los gases nobles.
3. Ordene en forma creciente de fuerzas de London las siguientes molculas: N 2, H2,
4.
5.
6.
7.
8.
9.
SF6, Cl2.
Ordene las siguientes molculas de acuerdo con el valor creciente del momento
dipolar: ICl, Cl2, IF, ClBr.
Describa las fuerzas tipo puente de hidrgeno e indique cuando se las espera.
La densidad del HF gaseoso a temperaturas moderadas es muy superior a la que
se espera considerndolo como un gas ideal. Justifique este comportamiento.
Indique cul o cules de las siguientes molculas tendr momento dipolar. Indique
qu tipos de fuerzas operarn entre sus molculas: Br2, ICl, CO2, SO2, CH4, BF3,
CO, HF.
Busque en un manual los puntos de ebullicin de las siguientes molculas ICl, Br 2,
O2, N2, NO, CH4, NH3. Liste el (los) tipo(s) de fuerzas intermoleculares para cada
una de ellas. Compare los puntos de ebullicin de las molculas con pesos
moleculares similares ([Br2 y ICl]; [O2, N2, NO]; [CH4, NH3]) y explique, en funcin
de dichas fuerzas, el orden de puntos de ebullicin en cada grupo.
Dada la siguiente tabla de puntos de ebullicin de hidrocarburos de cadena lineal:
metano
etano
propano butano pentano hexano heptano octano nonano
-161,5
-88,6
-42,1
-0,5
36,5
68,7
98,4
125,7 150,8
a) Indique qu hidrocarburos son gases y cules lquidos a temperatura ambiente.
b) Grafique los puntos de ebullicin versus el nmero de tomos de carbono y,
c) Sugiera una explicacin para la dependencia de los puntos de ebullicin con el
nmero de tomos de carbono encontrada en b).
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Gases reales y cambios de estado.
TEORA-SEMINARIO
Temario: Desviaciones del comportamiento ideal. Factor de compresibilidad. Ecuacin
de estado para gases reales (van der Waals). Isotermas de Andrews. Presin de
vapor. Termodinmica de los cambios de estado (Clapeyron-Clausius).
1. Dibuje las curvas PV vs P y PV/RT vs P que se esperan para 1 mol de un gas
ideal.
2. Qu es el factor de compresibilidad Z?
3. Dibuje las curvas de Z vs P para H2 y CO2 a temperaturas intermedias.
4. Dibuje las curvas de Z vs P para un tpico gas real a bajas y a altas temperaturas.
5. Escriba la ecuacin de van der Waals. Discuta el significado de los diferentes
trminos.
6. Utilice la ecuacin de van der Waals para explicar semicuantitativamente lo
observado en las curvas dibujadas en los ejercicios 3 y 4.
7. Usando la ecuacin de van der Waals, calcular la presin ejercida por 10,0 moles
de dixido de carbono (a = 3,59 L 2 atm/mol2; b= 0,0427 L/mol) contenido en un
recipiente de 2,0 L que se encuentra a 47C. Repetir el clculo usando la ecuacin
de estado para un gas ideal. Comparar estos resultados con la presin
experimentalmente observada: 82 atm.
8. Describir el experimento de Andrews. Dibujar en un diagrama P-V los resultados de
Andrews para el sistema "dixido de carbono". a) Indicar en qu estado(s) de
agregacin est el CO2 en distintas zonas del diagrama. b) Definir presin de vapor
de una sustancia pura. Indicar dnde se cumple experimentalmente esta definicin
en el diagrama del experimento de Andrews. c) Identificar la temperatura crtica.
Las sustancias puras en estado gaseoso, cuando su temperatura es inferior a la
temperatura crtica, suelen denominarse "vapores". Cmo podra distinguirse
experimentalmente si una muestra de una sustancia pura gaseosa puede ser
denominada vapor?
9. Desarrolle el concepto de que entre el lquido y el vapor se establece, en las
condiciones adecuadas, un equilibrio dinmico.
10. Discutir los fenmenos de cambio de estado (transformacin, por ejemplo de agua
lquida a vapor de agua) y equilibrio de fases (por ejemplo, agua lquida y vapor de
agua en equilibrio).
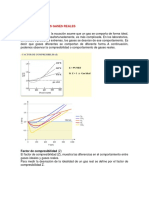
11. La figura es una representacin
grfica de la presin de vapor del
P
CO2 en funcin de la temperatura.
a) Qu relacin existe entre este
grfico y el diagrama de Andrews?
b) Cul es el lmite superior de la
5.2 atm
curva de presin de vapor vs.
temperatura? c) En qu estado se
encuentra el CO2 contenido en un
1 atm
cilindro a 150 atm ubicado en
nuestro laboratorio? d) Qu es el
hielo seco? e) Compare la
-57 o C
pendiente de la curva de equilibrio
slido-lquido en CO2 y en H2O. D
razones para la diferencia.
-78 oC
T
12. Describa el diagrama de fases P vs
T para una sustancia pura. Describa
en qu fase(s) se encuentra la
sustancia en cada lnea o regin del plano P-T que considere de inters. Indique
Gua de Trabajos Prcticos de Qumica General Edicin 2012
los nombres de las lneas y los puntos importantes. a) Defina temperatura (o punto)
de fusin normal y temperatura (o punto) de ebullicin normal. b) Discuta el
significado del punto crtico y del punto triple.
13. Escriba la forma diferencial de la ecuacin de Clausius-Clapeyron y defina cada
smbolo de la misma. a) Integre la ecuacin de Clausius-Clapeyron para el caso del
equilibrio lquido-vapor. Justifique las aproximaciones usadas e indique si son
vlidas o no para los dems equilibrios de fase posibles.
14. Dado el grfico de la figura 1, que indica las curvas de presin de vapor del etanol
y del agua, dibuje cules sern las alturas relativas de mercurio en un sistema
como el de la figura 2, cuando se haya agregado suficiente etanol y agua,
respectivamente, a cada campana de gases de modo que quede una gota de cada
lquido sobre el mercurio.
Figura 1
Figura 2
P
Etanol
Agua
T
15. Volviendo a los diagramas de Andrews, describa una isoterma siguindola en
ambos sentidos; indique las razones por las cuales la longitud de la meseta de
equilibrio L-V se achica al ascender la temperatura.
16. El siguiente grfico representa el aumento de temperatura en funcin del tiempo
cuando se le entrega energa trmica a una muestra de H 2O a una velocidad
constante (siempre la misma cantidad de calor por unidad de tiempo). De acuerdo
al grfico, qu cambio de fase requerir mayor energa? Por qu?
17. Los puntos de fusin y ebullicin normales del Xe son -112 y -108C,
respectivamente y su punto triple es de -121C a la presin de 282 mmHg. Realice
en forma esquemtica el diagrama de fases para el Xe y marque los tres puntos
anteriormente citados, e indique las reas en que cada fase es estable.
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Presin de Vapor
TRABAJO PRCTICO
Objetivo: Determinar la presin de vapor de un lquido puro y su variacin con la
temperatura.
Introduccin terica
Supongamos que colocamos, en un recipiente cerrado mantenido a temperatura
constante, una pequea cantidad de un lquido que se evapore fcilmente (es decir: un
lquido voltil). Al principio, las molculas pasarn del lquido al vapor (evaporacin). A
medida que transcurra el tiempo y aumente la cantidad de molculas en el vapor,
algunas de ellas volvern al lquido (condensacin). En algn momento, la velocidad
de evaporacin igualar a la de condensacin, cuando esto suceda, el lquido y el
vapor habrn alcanzado un equilibrio dinmico, representado por:
lquido
vapor
Una vez que se ha alcanzado el equilibrio, la cantidad de molculas en el vapor no
cambia en el tiempo. En otras palabras la presin ejercida por el vapor sobre el lquido
es constante.
La presin del vapor en equilibrio con el lquido se denomina presin de vapor.
Esta propiedad es caracterstica de cada lquido y vara de uno a otro segn la
intensidad de sus fuerzas intermoleculares.
Es importante resaltar que mientras haya lquido y vapor en el recipiente, la
presin ejercida por el vapor es independiente del volumen del recipiente.
La presin de vapor de un lquido siempre aumenta cuando aumenta la
temperatura: en nuestra experiencia cotidiana sabemos que el agua se evapora ms
rpidamente en un da clido y seco.
En la figura 1 estn representados grficamente los datos correspondientes de la
presin de vapor del agua, benceno y ter a diferentes temperaturas. Note que la
presin de vapor no depende linealmente de la temperatura, sino que aumenta ms
rpidamente cuanto ms alta es la temperatura.
Figura 1
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Esto refleja el hecho que hay dos factores que hacen crecer la presin de vapor
con la temperatura:
1. Cuando la temperatura aumenta, las molculas que hay en el vapor se mueven
ms rpidamente, chocan ms a menudo con las paredes y con ms fuerza, lo que
hace que la presin aumente.
2. Cuando la temperatura aumenta, una fraccin mayor de molculas adquiere
suficiente energa para escapar del lquido. Esto hace aumentar la cantidad de
molculas en el vapor y, por consiguiente, crece la presin. Se puede calcular que la
concentracin de molculas de agua en el vapor es 25 veces mayor a 100C que a
25C.
Cuando se trabaja con relaciones entre dos variables, tales como presin de
vapor y temperatura, siempre es preferible encontrar una ecuacin que las vincule a
travs de una relacin lineal. En lugar de representar la presin de vapor (P) frente a la
temperatura (T), representamos el logaritmo de la presin de vapor (log P) frente al
recproco de la temperatura absoluta (1/T). Este grfico, para el agua, est
representado en la figura 2.
3.0
Log p / Torr
2.5
2.0
1.5
1.0
0.5
0.0
2.6
2.8
3.0
3.2
3.4
3.6
1 / T x 103
Figura 2
La ecuacin general de la figura 2 es:
log P
H vap
(1)
2,3RT
donde Hvap es el calor de vaporizacin del lquido y A es una constante particular
de cada lquido.
En muchos casos es conveniente tener una ecuacin que permita relacionar la
presin de vapor (P2) a una temperatura (T2) con la presin de vapor (P 1) a otra
temperatura (T1). Esta relacin se obtiene aplicando la ecuacin anterior a dos
temperaturas:
log P1
H vap
log P2
2,3RT1
H vap
2,3RT2
Restando se elimina la constante A:
log
P2
P1
H vap T2 T1
2,3R
T2 T1
(2)
Gua de Trabajos Prcticos de Qumica General Edicin 2012
La ecuacin (2), conocida como ecuacin integral de Clausius-Clapeyron
relaciona la presin de vapor existente a una temperatura con la presin de vapor a
otra temperatura.
La ecuacin (1) es la base de un mtodo experimental muy utilizado para
determinar el calor de vaporizacin de un lquido ( Hvap), midiendo la presin de vapor
a distintas temperaturas. Los datos obtenidos se utilizan para construir un grfico
como el de la figura 2, de cuya pendiente se obtiene Hvap.
Parte experimental
Se determinar la presin de
vapor de una sustancia a distintas
temperaturas y se construir la
curva de equilibrio lquido vapor
para esa sustancia.
El manmetro con el que se
medirn las presiones en el
trabajo prctico est representado
esquemticamente en la figura 3.
El lquido al cual se le medir
la presin de vapor se introduce
en una ampolla (ver figura 4) del
siguiente modo: se calienta la
ampolla para eliminar parte del
aire contenido en ella; luego se
sumerge el pico de la ampolla en
el lquido y se deja enfriar.
De este modo, al disminuir la
presin dentro de la ampolla, el
lquido entra. La ampolla se fija al
bulbo de un termmetro y se
coloca en un tubo cerrado que
contiene agua suficiente como
para sumergir el bulbo y la
ampolla. El tubo se conecta al
Figura 4
Figura 3
manmetro en el punto c, y por
ltimo, se sumerge en un bao de
agua (figura 4).
Termmetro
Agua
A C (figura 3)
Bao
Termosttico
Ampolla
Una vez armado el equipo
adecuadamente se conecta la
bomba de vaco a la llave A y se
abre la llave A lentamente para
disminuir la presin en el sistema. Se
deja ascender la columna de Hg
hasta que el lquido en la ampolla
entra en ebullicin. En este momento
la presin de vapor del lquido
supera a la que hay dentro del
equipo. Se cierra entonces la llave A
y se abre la B, que conectada con la
atmsfera, para dejar entrar aire al
sistema y as aumentar la presin.
De este modo, utilizando ambas
llaves alternativamente, se debe
Gua de Trabajos Prcticos de Qumica General Edicin 2012
intentar que quede una burbuja de vapor de la sustancia en el extremo del capilar de la
ampolla.
En este momento, la presin de vapor del lquido de la ampolla ser igual a la del
sistema P ms la presin ejercida por la columna de agua del bao desde la punta del
capilar de la ampolla hasta la superficie (h ) (Figura 5)
Figura 5
. Pv = Psist + Ph
Patm=Psist + PH
Pv = Patm PH + Ph
La temperatura correspondiente a esa presin se lee en el termmetro adosado a
la ampolla.
El procedimiento anterior se repetir a distintas temperaturas.
Una vez tomados los datos de presin de vapor para cada temperatura, se
construye un grfico presin de vapor vs temperatura y log Pv vs 1/T. en papel
milimetrado (que el alumno deber traer al trabajo prctico). Utilizando la ecuacin de
Clausius-Clapeyron se calcula el calor de vaporizacin del lquido.
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Qu caractersticas debe tener el lquido del bao calefactor respecto de la
sustancia problema? Por qu?
2. Cmo se justifica el proceso de llenado de la ampollita?
3. A pesar de que el bao calefactor en el trabajo prctico contena agua, en el
balance de presiones no se considera la presin de vapor, por qu?
4. El objetivo del trabajo prctico es medir presiones de vapor a varias temperaturas,
para ello se determinan ............. a diferentes.........................
Gua de Trabajos Prcticos de Qumica General Edicin 2012
5. Compare las grficas obtenidas de log presin de vapor versus 1/T para dos
lquidos de diferente calor molar de vaporizacin y aproximadamente igual presin
de vapor a bajas temperaturas. Reptalo con las grficas presin de vapor versus
temperatura.
6. Cul ser la presin de vapor del agua a 65C si a 60C la presin de vapor es
149 torr y a 70C es 233 torr?
7. Cul ser la temperatura de ebullicin del agua cuando la presin externa sea
740 torr? El calor de vaporizacin del agua es 550 cal/g.
8. Las presiones de vapor del tetracloruro de carbono a diferentes temperaturas
estn presentadas en la siguiente tabla:
T (C)
20
30
40
50
60
70
80
Pv (mm Hg)
90,8
143,3
216,1
317,4
450,9
621,9
843,3
a) Represente grficamente Pv vs T
b) Cul es la temperatura normal de ebullicin del tetracloruro de carbono?
c) Calcule el calor medio de vaporizacin. Discuta la aplicabilidad de la ecuacin
de Clausius-Clapeyron.
d) La presin de vapor del agua a 95C es de 633,9 torr. Conociendo el punto de
ebullicin normal del agua, calcule el Hvaporizacin medio por gramo de agua.
9. Las presiones de vapor del tetracloruro de carbono a 23 y 58C son
respectivamente 100 y 400 torr. Calcule el calor molar de vaporizacin y el punto
de ebullicin normal (suponga constante al calor molar de vaporizacin).
10. En la experiencia de determinacin de presin de vapor se mide en el manmetro
una presin de 18 torr cuando la burbuja est en el extremo de la ampolla. Si el
extremo de la ampolla est sumergido 15 cm debajo del nivel de agua, cul es la
presin de vapor en la burbuja? Patm= 760 torr; Hg=13,6 g/mL.
11. Si la ecuacin de Clausius-Clapeyron es aplicable a los datos de presin de vapor
para un slido. Determine el calor de sublimacin del hielo de acuerdo a los
siguientes datos:
T (C)
-20,0
-16,0
-12,0
-8,0
-4,0
0.0
Pv (mmHg)
0,640
1,132
1,632
2,326
3,280
4,579
10
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Slidos
TEORA-SEMINARIO
Temario: Slidos amorfos y cristalinos. Celda unidad. Nmero de coordinacin.
Empaquetamiento compacto. Relacin de radios. Estructuras derivadas del
empaquetamiento cbico compacto. Ecuacin de Bragg.
NOTA: Los prefijos mili, micro, nano y pico (abreviados m, , n y p) representan
la multiplicacin de la unidad por 10-3, 10-6, 10-9, 10-12, respectivamente. As, por
ejemplo, 1 pm (1 picometro) es una longitud de 1 x 10 -12 m.
1. Enuncie las propiedades de los slidos cristalinos y de los amorfos.
2. Clasifique los slidos cristalinos en base a las fuerzas de interaccin de sus
constituyentes. Discuta las propiedades caractersticas de cada clase de slidos.
Indique a qu clase pertenecen los siguientes slidos: KCl, Fe, H2O(s), C(diamante),
CO2(s).
3. Dadas las propiedades indicadas en la tabla, deduzca a qu clase de slidos
cristalinos pertenecen las siguientes sustancias, de acuerdo con las fuerzas de
interaccin entre sus partculas.
Sustancia Propiedades Punto de
Conduccin elctrica
solubilidad en
mecnicas,
fusin
agua
color
(C)
A
Dura, blanca
800
Cuando se encuentra en
soluble
estado lquido o disuelta en
agua
B
Maleable,
1500
Alta
insoluble
brillante
C
blanda,
113
No posee
insoluble
amarilla
4. Las entalpias de fusin en el punto de fusin normal del Na y del Mg son 0,63 y 1,7
kcal/mol, y sus puntos de fusin 98 y 649C, respectivamente. Considerando el
modelo que describe los cristales metlicos como una red de cationes unida por un
mar de electrones deslocalizados, relacione estos datos experimentales para el
Na y el Mg con: a) el nmero de electrones con que cada tomo contribuira a la
red, b) los radios inicos (Na+ = 0,97 ; Mg2+ = 0,66 ), c) la red cristalina (Na = red
cbica centrada; Mg = red cubica compacta.
5. El desnivel de energa, entre la banda de conduccin y la banda de valencia, para
el diamante es 580 KJoule/mol y para el germanio 64 KJoule/mol. Uno de los dos
es un semiconductor. Indique cul y justificando su respuesta. En un metal ese
desnivel ser menor que el del germanio, mayor que el del diamante, o intermedio?
6. Los puntos de fusin del NaCl, KBr, CaF 2, Li2O y CaO son: 801C, 734C, 1423C,
>1700C y 2580C, respectivamente. Ordene los valores en forma creciente y
explique el origen de esta tendencia
7. Dadas las siguientes sustancias: NO, Zn, NaCl, N 2, NH3, C(diamante) y I2 , compare
sus puntos de fusin, sus conductividades elctricas en estado slido y fundidas,
su solubilidad en solventes polares y no polares y prediga sus estados de
agregacin a temperatura ambiente. Justifique.
8. Un slido cristaliza en una celda cbica centrada en el cuerpo en la que los tomos
de W ocupan los vrtices, los tomos de oxgeno los centros de las aristas y los de
Na el centro de los cubos. Calcule la densidad terica de este slido sabiendo que
la arista del cubo es de 3,86 .
9. Calcule el radio atmico del cobre sabiendo que este metal cristaliza en una celda
cbica centrada en las caras cuya arista mide 3,61.
10. Decida si la celda unidad de la plata metlica es cbica simple, centrada en las
11
Gua de Trabajos Prcticos de Qumica General Edicin 2012
caras o centrada en el cuerpo sabiendo que su arista es de 4,077 y su densidad
de 10,2 g/cm3.
11. El aluminio cristaliza en una celda cbica centrada en las caras. El radio metlico
del Al es 125 pm: a) Cul es la longitud de la arista de su celda unitaria? b)
Cuntas celdas unitarias hay en 1cm3 de ese metal?.
12. Determinar la densidad de los siguientes metales a partir de los siguientes datos:
a) Pt: empaquetamiento cbico compacto, ratmico= 138 pm. b) Cs:
empaquetamiento cbico centrado en el cuerpo, ratmico= 266 pm.
13. a) Cmo se pueden medir las distancias caractersticas de la celda unidad de un
slido cristalino? b) Deduzca la ecuacin de Bragg. c) Calcule la distancia entre
distintos planos caractersticos de un cristal si, al irradiar ste con rayos X de =
1,54 , los ngulos de difraccin de primer orden medidos fueron 10 o, 15o y 25o.
14. La difraccin de primer orden de rayos X de longitud de onda 0,090 nm producida
mediante un cristal metlico ocurre a un ngulo de 15,2. Cul es la distancia (en
pm y amstrongs) entre los planos responsables de esa difraccin?
15. La densidad del cloruro de sodio slido es 2,165 g/cm 3, y un mol pesa 58,442 g.
Calcule la longitud de la arista de un cubo que contiene un mol de NaCl slido. Si
la distancia entre los centros de los iones adyacentes de Na + y Cl- es 2,819 x10-8
cm. Cuntos iones de cada carga se encuentran a lo largo de una arista de dicho
cubo? Calcule el nmero de Avogadro a partir de estos datos.
16. El bario metlico cristaliza en una red cbica centrada en el cuerpo. La longitud de
la arista de la celda unitaria es de 502 pm, y la densidad del metal es de 3,50
g/cm3. Utilizando esta informacin calcule el nmero de Avogadro.
17. La red cbica simple consiste en ocho esferas idnticas, de radio R, todas en
contacto, colocadas en las esquinas de un cubo. Calcule, en funcin de R, el
volumen de la celda unidad de esta red cbica. Qu fraccin del volumen de la
celda unidad est ocupado por las esferas?
18. Se origina un hueco tetradrico en el centro de un cubo cuando los centros de
cuatro esferas iguales se colocan en los vrtices alternados de dos caras opuestas
del cubo.
Las esferas de la figura se han dibujado pequeas y separadas para que se vea
bien su ubicacin relativa, en realidad las esferas estn en contacto y, por lo tanto,
el largo de la diagonal de una cara de este cubo es igual a 2R (R = radio de las
esferas). a) Calcule la longitud de la diagonal que pasa por el centro del cubo, b)
Observe que el radio del hueco tetradrico es igual a la diferencia entre la mitad de
la diagonal que pasa por el centro del cubo y el radio R. Calcule el radio del hueco
tetradrico.
19. El mtodo de Bragg de difraccin de rayos X, aplicado a un cristal de NaCl,
produce una difraccin de primer orden a = 5 58'. La longitud de onda de los
rayos X es 0,586 . a) Calcule la separacin entre los planos cristalinos que
producen la difraccin. b) Si los planos que producen la difraccin son los planos
de iones paralelos a una cara de la red cbica de cara centrada, Cul es la menor
distancia entre los ncleos de los cationes sodio y los cloruros en el cristal? Cul
12
Gua de Trabajos Prcticos de Qumica General Edicin 2012
es la menor distancia entre los ncleos de los iones cloruro?
20. Los siguientes compuestos cristalizan en redes cbicas: ZnSe, NiO, SrSe, SrF2,
TlBr y CaS. Teniendo en cuenta los radios inicos y a la informacin dada en tabla
adjunta, que contiene una lista de las redes cbicas esperables para cristales
inicos en funcin de la estequiometra de la sal y la relacin de radios inicos,
prediga la red cristalina que le corresponde a cada compuesto.
Algunos tipos de redes cbicas de cristales inicos
en funcin de las estequiometras y la relacin de radios inicos
Relacin de radios
(Catin/anin)
Estequiometra 1:1
0,225 - 0,4141
0,414 - 0,732
0,732 - 1,000
Estequiometria 1:2
0,732 - 1,000
Tipo de red
Blenda
Cloruro de sodio
Cloruro de Cesio
Fluorita
DATOS: Radios de los iones en pm: Ca2+, 99; Ni2+, 70; Sr2+, 113; Tl1+, 156; Zn2+, 74; Br1-,
195, F-, 136; O2-, 140; S2-, 184; Se2-, 198.
21. A partir de medidas de difraccin de rayos X se encontr que cierto xido de
cobalto forma cristales en los cuales los iones xido forman un empaquetamiento
cbico compacto y 2/3 de los huecos octadricos estn ocupados por iones
cobalto. Escriba la frmula del xido.
13
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Purificacin de sulfato de cobre comercial
TRABAJO PRCTICO
Objetivo: Identificar y eliminar impurezas de una muestra comercial de sulfato de
cobre. Estudiar aspectos prcticos de la solubilidad.
Introduccin
Soluto y solvente: Suele llamarse soluto a la sustancia slida que se disuelve en un
lquido denominado solvente. La distincin entre soluto y solvente no es tan clara en
ciertos casos, como, por ejemplo, cuando se disuelve un lquido en otro y los lquidos
pueden mezclarse en cualquier proporcin (alcohol y agua). En esos casos se
conviene en llamar soluto a la sustancia que est presente en menor cantidad en la
solucin.
Solubilidad: Es la masa mxima de un soluto que puede disolverse en una cantidad
dada de un solvente, a una determinada temperatura. El resultado de disolver esta
cantidad mxima es una solucin saturada (a esa temperatura). La solubilidad suele
expresarse en gramos de soluto disueltos por cada cien mililitros de solvente, por
ejemplo: Si la solubilidad de una sustancia slida a 25 C es 12,5 g/100 mL, el
agregado, a 25 C, de 13,0 g de sustancia a 100 mL de solvente producir una solucin
saturada y 0,5 g de sustancia permanecern sin disolverse. El slido est en equilibrio
con la solucin saturada
En general, la solubilidad de las sustancias aumenta al aumentar la temperatura
(curva AB de la figura 1), pero existen sustancias cuya solubilidad disminuye con la
temperatura.
Concentracin
g/100 mL
3
Figura 1
1
2
A
Temperatura, C
Los puntos (pares de valores solubilidadtemperatura) de la curva AB
representan el conjunto de estados de equilibrio de solubilidad correspondientes a
aquellas soluciones en las cuales no es posible disolver ms soluto. Todo agregado de
soluto permanecer como slido sin disolver. Como se ha dicho ms arriba, estas
soluciones se llaman saturadas. Todos los punto de la linea AB corresponden a
soluciones saturadas a distintas temperaturas
Todos los puntos por debajo de la lnea AB (como los puntos 1 y 2, por ejemplo)
corresponden a sistemas que contiene menos soluto que el que es posible disolver en
el solvente a esa temperatura. Estas soluciones suelen calificarse (cualitativamente)
como diluidas, si el punto est alejado de la curva de solubilidad (punto 2), o
concentradas, si el punto es cercano a la curva de solubilidad (punto 1). Lo dicho hasta
ahora implica que una solucin no puede contener mayor cantidad de soluto que la
correspondiente a la solucin saturada. Esto es correcto para sistemas estables, sin
embargo, en forma temporaria, es posible obtener, generalmente por enfriamiento,
14
Gua de Trabajos Prcticos de Qumica General Edicin 2012
soluciones inestables que contienen mayor cantidad de soluto que la correspondiente
a la solucin saturada. Estos estados inestables se llaman soluciones sobresaturadas
(como ejemplo se indica el punto 3. la flecha indica un posible camino para llegar a
ese estado inestable desde un estado estable).
El estado inestable (sobresaturado) se estabiliza transformndose en una solucin
saturada. Todo el exceso de soluto disuelto precipita como slido. Esta transformacin
ocurre repentinamente y suele decirse que la sobresaturacin se rompe.
Experimentalmente la sobresaturacin puede romperse por agitacin de la solucin
o por agregado de algunos cristales del soluto. Se produce entonces la precipitacin
de una masa de cristales que corresponde a la diferencia de las concentraciones de
sobresaturacin y de saturacin y al volumen de solucin. Se produce entonces la
precipitacin de una masa de sal que corresponde a la diferencia entre la masa de sal
que contiene la solucin sobresaturada y la masa de sal que contiene la solucin
saturada a la temperatura final.
Al comenzar a romperse la sobresaturacin se forma una gran cantidad de
cristales microscpicos, que luego crecen rpidamente al cristalizarse sobre ellos todo
el exceso de soluto. Este tipo de cristalizacin genera cristales pequeos e
imperfectos, llamados usualmente microcristales.
Para formar cristales grandes y ms perfectos debe emplearse otro procedimiento:
El solvente de la solucin saturada se deja evaporar lentamente. La muy pequea
sobresaturacin causada al disminuir la cantidad de solvente hace que se formen muy
pocos cristales pequeos que crecen lentamente al continuar la evaporacin del
solvente.
La forma externa regular de los cristales sugiere una estructura interna ordenada.
En efecto los slidos cristalinos tienen una regularidad interna que se clasifica en base
a los llamados sistemas cristalinos. Cuando dos sustancias forman cristales del mismo
tipo de sistema cristalino, stas se denominan isomorfas (de la misma forma).
El FeSO4 y el CuSO4 son isomorfos. En las dos sales el anin es el mismo y los
cationes Fe+2 y Cu+2 son muy similares (misma carga elctrica y radios inicos 0,74 y
0,72 , respectivamente). Como los dos cristales son extremadamente similares
pueden crecer formando un slido que contiene las dos sustancias ya que no se crea
ninguna distorsin en el cristal si algunos ines Cu +2 se cambia por ines Fe+2.
Fundamento del prctico.
La purificacin por la tcnica de cristalizacin por enfriamiento es aplicable a
aquellas sales cuya solubilidad aumenta con la temperatura. El CuSO 4.5H2O
pertenece a este grupo de sales.
El procedimiento consiste esencialmente en preparar una solucin de la sustancia
impura a temperatura alta, filtrar la solucin, si es necesario para separar impurezas
insolubles y enfriarla rpidamente para que, al disminuir la solubilidad, el exceso de
soluto precipite.
El procedimiento es aplicable a sistemas donde las impurezas solubles existentes
se encuentran en una proporcin pequea y formen una solucin diluida, tanto a la
temperatura alta como a la baja. De esta manera no estarn presentes en el slido
precipitado. Que esto sea cierto depender del tipo y cantidad de impurezas de cada
muestra a purificar y debe comprobarse en cada caso particular.
Ntese que la cristalizacin implica una prdida de soluto, ya que cierta cantidad
quedar disuelta en el solvente a la temperatura baja
A continuacin se describen las impurezas del CuSO4.5H2O comercial y los
problemas que presentan par aplicar la tcnica de cristalizacin por enfriamiento
Impurezas. El sulfato de cobre comercial contiene silicatos y sulfato ferroso.
15
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Los silicatos son insolubles, por lo que son separables en forma directa por
disolucin de la muestra en agua y posterior filtracin.
El sulfato ferroso no puede separase por filtracin directa porque es soluble en
agua como el sulfato de cobre.
Tampoco puede eliminarse el sulfato ferroso por la cristalizacin a baja
temperatura ya que aunque est presente en pequea cantidad y debera permanecer
en solucin, puede incorporarse a los cristales de sulfato de cobre, debido a su
isomorfismo, como se ha discutido ms arriba. La incorporacin del sulfato ferroso se
facilita por la cristalizacin rpida de la solucin que fcilmente lo atrapar dentro de
los cristales mientras estos crecen rpidamente.
Para eliminar este problema se convierte el in ferroso en frrico, oxidndolo con
agua de bromo. El sulfato frrico, Fe2(SO4)3, tiene una estructura cristalina
completamente diferente de la del sulfato ferroso y no es isomorfo con el sulfato de
cobre.
Tareas a realizar.
Se divide en dos partes:
1) Observacin cualitativa de las impurezas por medio de ensayos previos a la
purificacin
2) Purificacin del CuSO4.5H2O por el mtodo de cristalizacin.
a) Ensayos previos
Silicatos
Se toman unos cristales de CuSO 4 y se los disuelve en tubo de ensayo usando
agua como solvente. La solucin as obtenida se filtra; se observar que en el filtro
quedan retenidos los silicatos, obtenindose en el tubo de ensayo una solucin lmpida
de sulfato de cobre.
Impurezas ferrosas
La siguiente secuencia de reacciones se utiliza para demostrar la presencia de
Fe2+ en la solucin anterior.
Adicin de agua de bromo: A la solucin lmpida se le agregan gotas de agua de
bromo. Este reactivo acta como agente oxidante llevando el Fe +2 a Fe+3. Como
consecuencia de ello el Br2 pasa a Br-.
Br2 + 2 e 2 Br.
2 Fe+2 2 Fe+3 + 2 e .
Br2 + 2 Fe+2 2 Br- + 2 Fe+3
Adicin de NH4OH: A la solucin que contiene los iones Fe +3 y Cu+2 se agregan
gotas de NH4OH. Esta base aporta oxhidrilos provocando la precipitacin de los
hidrxidos respectivos:
Fe+3 + 3 OH- Fe(OH)3
Cu+2 + 2 OH- Cu(OH)2
Se contina agregando NH4OH. El Cu(OH)2 se disuelve debido a la formacin de
un ion complejo [tetraamincprico = cuatro (tetra) amonacos (amin) unidos a Cu 2+
(cprico)]
Cu(OH)2 + 4 NH4OH Cu[NH3]4+2 + 2 OH- + 4 H2O
2+
El Fe no forma complejos solubles, por lo que el precipitado de Fe(OH) 3
permanece insoluble y puede ser separado del Cu 2+ por filtracin:
Filtracin: Se filtra para separa el precipitado de Fe(OH) 3 de la solucin de
Cu[NH3]4+2.
Adicin de HCl: El embudo conteniendo el precipitado de Fe(OH) 3 se lava con
abundante agua destilada usando una piseta. Luego se coloca sobre un tubo de
16
Gua de Trabajos Prcticos de Qumica General Edicin 2012
ensayo limpio y se dejan caer gotas de HCl 1:5 sobre la totalidad del papel de filtro. El
precipitado de Fe(OH)3 se disuelve y el in Fe3+ pasa a la solucin en el tubo de
ensayo::
Fe(OH)3 + 3 HCl FeCl3 + 3 H2O
Caracterizacin del in frrico: A la solucin del tubo de ensayo se le agregan
gotas de tiocianato de amonio, NH4SCN, lo que produce la siguiente reaccin:
FeCl3 + 3 NH4SCN Fe(SCN)3 +
3 NH4Cl
color rojo intenso
La intensidad del color rojo es proporcional a la concentracin de Fe +3 presente en
el sistema. La aparicin de esta coloracin es una demostracin de la presencia de
impurezas ferrosas en la muestra de sulfato de cobre comercial.
b) Purificacin de CuSO4.5H2 O
b1.Triturado de la muestra: Tiene por objeto reducir el tamao de los cristales a
efectos de aumentar la superficie especfica (superficie por unidad de peso) de los
mismos. De no realizarse, la disolucin sera muy lenta, debido a la poca superficie de
contacto entre los cristales y el solvente.
b2. Disolucin de la muestra en agua a ebullicin: Es necesario calcular el volumen
de solvente que se requiere para disolver los cristales triturados.
Se busca en tablas la solubilidad de la sal. Como la solubilidad es funcin de la
temperatura es necesario tomar el valor de solubilidad correspondiente a la
temperatura de la experiencia. Al valor encontrado se le adiciona un 20% para
compensar prdidas por evaporacin y asegurar la disolucin total. En nuestro caso se
usarn 70 mL de agua por cada 50 g de CuSO4 y se irn reponiendo las prdidas por
evaporacin mediante adiciones de 10 mL de agua destilada.
b3. Oxidacin de las impurezas ferrosas: con el fin de eliminar el isomorfismo entre
sales ferrosas y cpricas, se procede a oxidar las primeras mediante adicin de agua
de Br2
Como se ha mencionado, esta operacin es especfica de este sistema, los dems
pasos son comunes a cualquier proceso de cristalizacin.
b4. Filtracin: para separar los silicatos insolubles.
Durante la filtracin, que debe efectuarse en caliente, debe evitarse la precipitacin
de cristales sobre el papel de filtro. Para ello se deben compensar las prdidas por
evaporacin de solvente y debe recibirse el filtrado en un erlenmeyer que contenga
unos mL de agua en ebullicin a efectos de mantener caliente el embudo.
Nota: La varilla a utilizar no debe estar fra. El ayudante explicar el correcto
plegado del papel de filtro.
b5. Cristalizacin por enfriamiento: Se enfra el filtrado sobre un recipiente con
hielo. Se produce la precipitacin de los microcristales. La solucin saturada (a 0 C) en
equilibrio con los cristales se denomina agua madre de cristalizacin
b6. Filtracin: Se separan los microcristales de las aguas madres por filtracin en
un filtro Buchner. Las aguas madres se dejan en un cristalizador (similar a un vaso de
precipitados bajo y ancho) para asegurar una alta superficie del lquido que favorezca
la evaporacin y la formacin de macrocristales.
Rendimientos:
Como se ha dicho, la purificacin por cristalizacin por enfriamiento, slo es
factible cuando la solubilidad a alta temperatura es mayor que la solubilidad a baja
temperatura. La proporcin de soluto recuperado por precipitacin a baja temperatura
respecto del disuelto a alta temperatura se expresa a travs del rendimiento de
cristalizacin que es una cantidad experimental.
17
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Este rendimiento ser mayor si se enfran soluciones saturadas, cuanto mayor sea la
diferencia de solubilidades y cunto mayor sea la temperatura de partida y/o menor la
final.
Este rendimiento tendra un valor mximo terico dado por:
El rendimiento de cristalizacin se acerca a este valor terico si la solucin original
est saturada, si la impurezas son despreciables y si no hay prdidas significativas
(ver ms abajo, rendimiento operativo) en el proceso.
El rendimiento de cristalizacin es una limitacin natural del proceso de
purificacin, ya que depende de las naturalezas del soluto y del solvente. Sin embargo
las manipulaciones del proceso de purificacin producen inevitablemente prdidas en
forma de lquidos volcados o retenidos en los filtros, cristales formados en las paredes
de los vasos o varillas y en la superficie de los filtros, etc.
Asimismo, la separacin de las impurezas es tambin una prdida de la masa
original de la muestra.
Toda la masa original del soluto estar finalmente:
a) en los microcristales.
b) en el soluto contenido en las aguas madres.
c) en impurezas separadas.
d) perdido en las manipulaciones operativas
A los fines de analizar un proceso de purificacin industrial, resulta conveniente
definir, como una variable que permita medir la eficiencia de la operacin de
recristalizacin, el llamado rendimiento operativo:
En el caso particular del trabajo prctico, se calcular el peso de la sal en aguas
madres a travs de la medida de la densidad y el volumen de la solucin. La densidad
de soluciones de diversas concentraciones para distintas sustancias ha sido tabulada
por lo que el conocimiento del valor de la densidad permite directamente encontrar su
concentracin en la tabla adecuada (es decir, para el sulfato de cobre).
Otra forma de calcularla sera conociendo la solubilidad a dicha temperatura y el
volumen de la solucin, pues la solucin madre est saturada.
Parte experimental
1. Ensayo previo: En un tubo de ensayo colocar 5 mL de la solucin de
CuSO4.5H2O, agregar 0,5 mL de agua de bromo, calentar y luego dejar enfriar.
Agregar solucin de NH4OH 1:1, hasta coloracin azul del sistema y filtrar.
Al precipitado se lo lava con agua destilada, se disuelve en HCl 1:5 y se recoge la
solucin en un tubo de ensayo. Agregar gotas de solucin de NH 4SCN . Observar e
interpretar.
2. Triturar 50 g de CuSO4.5H2O en mortero hasta reducirlo a polvo fino.
18
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Colocar en vaso de precipitados de 250 mL, 70 mL de agua destilada y calentar a
ebullicin. Mantener en calentamiento suave y agregar la sal en porciones esperando
la disolucin de cada una de ellas. Reponer el agua que se pierde por evaporacin.
3. Oxidacin: A la solucin se le agregan 4 mL de agua de bromo, manteniendo el
sistema en ebullicin durante 2 minutos.
4. Filtracin: Disponer el material como se indica en la figura 2. El
erlenmeyer de 250 mL contendr 10 mL de agua destilada. Calentar
a ebullicin. Prestar especial atencin al correcto trasvase de la
solucin.
5. Cristalizacin: Enfriar bajo corriente de agua la solucin
filtrada. Filtrar usando un embudo Buchner. Lavar los cristales con
agua destilada fra. Medir el volumen de la solucin filtrada y su
densidad. Pasar a vidrio de reloj el papel conteniendo los cristales y
colocar en desecador. Pesar el producto seco.
Datos experimentales:
masa de microcristales:
volumen de solucin madre:
densidad de las aguas madres:
Figura 2
Clculos
Calcular el rendimiento de cristalizacin y el rendimiento operativo.
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Describa el proceso de cristalizacin en un grfico de solubilidad versus
temperatura.
2. Para qu realiza el ensayo previo?
3. Para qu agrega el agua de bromo durante el ensayo previo?
4. Por qu debe enjuagar reiteradamente el papel de filtro luego de la filtracin
posterior al agregado de amonaco?
5. Cmo modificara el proceso de purificacin si el ensayo previo da negativo?
6. Para qu lleva a ebullicin la solucin luego del agregado del agua de bromo?
7. Qu ocurre con el rendimiento de cristalizacin (en cada caso) si:
a) se parte de un volumen mayor de solucin saturada
b) se parte de una solucin saturada a mayor temperatura
c) se enfra a una temperatura ms baja
d) se parte de una solucin no saturada
8. Justifique con un anlisis en el grfico de solubilidad versus temperatura cuando
sea necesario.
9. Qu indicacin da el rendimiento operativo y cul el rendimiento de cristalizacin?
Cul es el que pretende optimizar en el prctico? Qu es el rendimiento mximo de
cristalizacin? Cundo se obtendra?
10.
Se disolvieron 50 g de CuSO4.5H2O en 70 mL de agua con el fin de purificarlos
por el mtodo de cristalizacin. Luego del proceso, el rendimiento experimental de
cristalizacin fue del 54%. Si el volumen de la solucin madre fue de 62,5 mL y su
19
Gua de Trabajos Prcticos de Qumica General Edicin 2012
densidad de 1,175 g/cm3 corresponde a una concentracin de 181,4 g/l. Cul fue el
rendimiento operativo?
11.
Las solubilidades de cierta sal en agua son 250 y 122 g cada 100 mL de agua
destilada a 100C y 0C respectivamente. Qu masa de microcristales se obtendr
cuando se saturen 250 mL de agua destilada con dicha sal a 100C y se la enfre
luego hasta 0C? Calcule el rendimiento de cristalizacin suponiendo un rendimiento
operativo del 100 %.
12.
Repita los clculos anteriores si el rendimiento operativo fue del 88 % y no se
perdi volumen durante la operacin.
13.
Calcule el rendimiento operativo para las condiciones del problema 10 si se
obtuvo la misma masa de microcristales pero slo se recogieron 200 mL de solucin
saturada a 0C.
14.
Al enfriar 500 mL de solucin saturada de sulfato de cobre a 100C hasta 0C
se obtienen 285 g de cristales y 500 mL de solucin saturada a 0C. Si el rendimiento
operativo es del 95 % y la solubilidad del sulfato de cobre a 100C es 700 g/L, cul es
la solubilidad a 0C y cul el rendimiento de cristalizacin?
15.
Qu son las manchas blancas depositadas sobre las paredes laterales del
frasco en el cual calienta la solucin de CuSO4?
16.
Puede aplicar este mtodo para una sustancia cuya solubilidad disminuya con
la temperatura? Qu modificacin realizara en ese caso?
17.
Cmo puede obtener macrocristales? Mustrelo en el diagrama de solubilidad
versus temperatura.
18.
Dnde queda el hierro luego del proceso de purificacin?
19.
Para qu debe lavar los cristales luego de la filtracin en Buchner? Qu
ocurre si lo hace con agua no demasiado fra?
20.
Por qu deben secarse los cristales?
21.
Calcule el rendimiento operativo de un proceso de purificacin si se prepar
originalmente una solucin saturada con 50 g de CuSO 4.5H2O y se obtiene finalmente
100 mL de una solucin saturada de CuSO 4 a 10C. La solubilidad del CuSO4.5H2O a
10C es 175 g/l. Los cristales obtenidos fueron secados a 160C obtenindose una
masa de 12,8 g de cristales incoloros completamente.
22.
Para determinar la cantidad de CuSO 4.5H2O en 35 mL de aguas madres
obtenidas en un proceso de purificacin, se agrega agua hasta completar 90 mL. En
ese momento se mide la densidad de la solucin obteniendo el valor 1,06 g/mL para la
cual corresponde un 6 % p/p de la sal anhidra. Calcule la concentracin en g/l de la sal
pentahidratada en la solucin original.
20
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Propiedades coligativas
TEORA-SEMINARIO
1. Enuncie la ley de Raoult.
2. Describa las propiedades coligativas en soluciones de no electrolitos.
3. Use un diagrama de fases para mostrar el ascenso ebulloscpico y descenso
crioscpico.
4. Defina smosis y presin osmtica.
5. Indique qu entiende por: a) electrolito; b) disociacin; 3) grado de disociacin.
6. Propiedades coligativas de soluciones de electrolitos: Factor i de Vant Hoff.
Deduzca su expresin en funcin del grado de disociacin.
7. Dibuje las curvas de enfriamiento que podra obtener para soluciones acuosas de
igual molalidad de NaCl, urea, CaCl2 y Na3PO4.
8. Cul es el grado de disociacin de un electrolito dbil que se ioniza dando 3 iones
por molcula si una solucin acuosa 0,250 molal del mismo tiene un punto de
fusin de -0,57C? (Kc (agua) = 1.86C/m).
9. Se prepara una solucin disolviendo 0,12 moles de un cido dbil AH en 200 g de
agua. Esta solucin congela a -1,3C. Calcule el grado de disociacin del cido.
(Kc (agua) = 1,86C/m).
10. Una solucin que contiene 7 g de un soluto no voltil y no disociado disuelto en
250 g de agua entra en ebullicin a 100,26C (ke = 0,52C/molal). Calcule el
aumento ebulloscpico y el peso molecular del soluto.
11. Calcule la presin osmtica correspondiente a una solucin de urea (CO(NH 2)2)
preparada disolviendo 3,0 g de soluto en agua suficiente para dar 120 mL de
solucin a 0C. (Kc (agua) = 1.86C/m).
12. Calcular la Pv a 25C de una solucin que contiene 0,4 moles de sacarosa
disueltos en 500 g de agua. Sacarosa: C12H22O11 Pv (agua a 25C)= 23,5 mmHg
13. Cuntos moles de glicerol (C3H8O11), que es un soluto no voltil y no disociado,
ser necesario disolver en 500 g de metanol (CH3OH), para obtener una solucin
con una Pv de 130 torr? La Pv del metanol puro a 30C es de 160 torr. Mmetanol= 32
14. Una solucin que contiene 7 g de un soluto no voltil y no disociado disueltos en
250 g de agua, entra en ebullicin a 100,26C. a) Cul ha sido el aumento
ebulloscpico? b) Cul es el peso molecular del soluto? Ke agua= 0,52 C/m
15. Una solucin que contiene 16,8 g de una sustancia no disociada disueltos en 250 g
de agua tiene un Pf de 0,744C. La sustancia est compuesta por 57,2 % de C,
4,7 % de H y 38,1 % de O. Cul es la frmula molecular del compuesto? K c(agua)
= 1,86C/m
16. Calcular la presin osmtica en torr de una solucin acuosa que contiene 5 g de
sacarosa por litro a 25C.
PROBLEMAS ADICIONALES
1. La siguiente tabla ha sido obtenida midiendo las temperaturas de congelacin de
soluciones acuosas de un soluto no voltil y no disociado:
T congelamiento (C)
molalidad
-0,021
-0,040
-2
1,13 10 2,18 10-2
-0,075
4,00 10-2
-0,090
4,88 10-2
-0,120
6,121 10-2
-0,240
1,27 10-1
a) Grafique T (congelamiento) vs m.
b) Determine por extrapolacin el valor de Kc. Se puede determinar Kc
correctamente midiendo el descenso crioscpico de una solucin 1 m?
c) Determine por interpolacin y analticamente la temperatura de fusin de una
solucin de la misma sustancia de una concentracin 0,088 m.
21
Gua de Trabajos Prcticos de Qumica General Edicin 2012
d) Si una solucin 0,19 % p/v de otra sustancia de comportamiento similar a la anterior
congela a 0,07C, calcule el peso molecular (= 1,12 g/mL)
2. En un diagrama P vs T grafique la curva de equilibrio lquido-vapor para: agua
pura, solucin de urea, solucin de NaCl y solucin de HNO 2 (electrolito dbil),
siendo todas estas soluciones acuosas de igual concentracin.
3. Por anlisis se determina que la composicin de cierta sustancia es de 11,9 % de
H; 8,5 % de O y el resto C. Una solucin de 1,5 g de dicha sustancia en 10 g de
benceno congela a 3,07 C. Cul es su frmula molecular? Pfbenceno=5,1C;
Kcbenceno= 5,1C/m
4. Se prepara una solucin con 10 g de CaCl2 en 162 g de agua. Calcule el aumento
de la temperatura de ebullicin. Cul ser el aumento para una solucin de K 3PO4
de igual molalidad? Suponga disociacin total de las sales.
5. Una solucin acuosa 0,030 molal (= 1,03 g/cm3) de un electrolito binario de peso
molecular 56 g/mol, presenta un soluto disociado en un 12 % a 25C. Calcule su
presin osmtica y sus puntos de fusin y ebullicin reales.
22
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Crioscopa
TRABAJO PRCTICO
Objetivo: Determinar la masa molecular de un soluto no voltil por medio de
crioscopa. Determinar el factor i de vant Hoff para una solucin de un electrolito.
Fundamento del mtodo
Al disolver un soluto no voltil (es decir, un soluto cuya presin de vapor es
prcticamente nula) en un disolvente, la presin de vapor del disolvente en la solucin
resulta menor que la presin de vapor del solvente puro. La relacin cuantitativa entre
dichos presiones de vapor y la composicin de la solucin es la ley de Raoult.
Pv Pd0 x d
(1)
donde Pd es la presin de vapor del disolvente en la solucin, P do es la presin de
vapor del solvente puro y xd es la fraccin molar del solvente en la solucin. La
presin de vapor del solvente en la solucin es igual a la presin de vapor de la
solucin, ya que la presin de vapor del soluto es nula. La ley de Raoult es aplicable
slo a soluciones diluidas.
Como la suma de fracciones molares del solvente y del soluto es igual a la unidad,
la ecuacin (1) puede escribirse como:
Pv Pd0 (1 x s )
(2)
donde xs es la fraccin molar del soluto. Despejando la x s de la ecuacin (2), se
obtiene:
Pd0 Pv
xs
(3)
Pd0
Note la parte izquierda de la ecuacin 3 es la disminucin relativa de la presin de
vapor del disolvente. La ecuacin 3 dice que dicho descenso relativo es igual a la
fraccin molar del soluto no voltil.
P
El descenso de la presin de
vapor de la solucin trae como
consecuencia directa el aumento
Pext
de su temperatura de ebullicin y
P
el descenso de su temperatura de
congelacin (tambin llamado
descenso crioscpico), respecto
de las del solvente puro. Esto
puede verse en un diagrama de
fases, como el de la figura (en la
cual el disolvente es agua).
Observamos que el descenso
0
Pd - Pv ( P) origina el aumento en
Te
Tc
T
el punto de ebullicin Te y un
descenso Tc en el punto de congelacin. En la figura, P ext es la presin externa a la
cual se efectan las mediciones.
Tanto el Te como el Tc son proporcionales a la concentracin molal de la
solucin, lo que se expresa por:
Te Te Te0 K e m
(5)
Tc
Tc0
Tc
Kc m
(6)
Las constantes de proporcionalidad K e y Kc (frecuentemente denominadas K f en la
literatura) se llaman constante ebulloscpica y constante crioscpica respectivamente;
para el agua Ke= 0,513 C/m y Kc= 1,86 C/m.
23
Gua de Trabajos Prcticos de Qumica General Edicin 2012
La molalidad de una solucin puede escribirse :
ms 1000
m
(7)
Ms md
donde ms y md son las masas de soluto y solvente respectivamente y Ms es la
masa molar del soluto. Reemplazando en (6) tenemos:
ms 1000
Tc
Kc
(8)
Ms md
de donde:
ms 1000
Ms
Kc
(9)
md Tc
Puede verse que conociendo las masas de soluto y disolvente de una solucin y
midiendo el descenso crioscpico, la ecuacin 9 nos permite calcular la masa molar
del soluto, objeto de este trabajo prctico.
El descenso de la presin de vapor, el descenso crioscpico y el aumento
ebulloscpico son propiedades de las soluciones que dependen exclusivamente del
nmero de partculas del soluto en la solucin. Las ecuaciones usadas suponen que el
soluto no se disocia (ni total ni parcialmente) en la solucin. Si esto ocurriera, el
nmero de partculas de soluto en la solucin aumentara y debera agregarse un
factor de correccin (conocido como factor i de Vant Hoff).
Las propiedades de las soluciones que dependen del nmero de partculas
disueltas se denominan coligativas. Otra propiedad coligativa importante es la presin
osmtica.
Para el caso particular del descenso crioscpico hay que aclarar que las
ecuaciones dadas son vlidas para el caso en el que, cuando se produce la
congelacin de la solucin, la fase slida est constituida por solvente puro, tal como
se observa en el diagrama de fases presentado ms arriba, en el cual la porcin de la
curva correspondiente el equilibrio slido-vapor es igual tanto para el solvente como
para la solucin. La ecuacin 9 no podra aplicarse a un soluto que formara soluciones
slidas con el solvente.
Parte experimental
El paso de un lquido enfriado al estado slido cristalino no siempre comienza a la
temperatura de congelacin, sino que, usualmente la formacin de la fase slida
comienza a una temperatura ms baja. Este fenmeno se denomina
sobreenfriamiento. Cuando se han formado suficientes cristales, estos actan como
ncleos de cristalizacin, y el proceso de cristalizacin se acelera. Como la
congelacin es un proceso exotrmico, la temperatura del sistema aumenta y alcanza
una temperatura de equilibrio (Tc), a la cual transcurre el resto de la cristalizacin.
En caso de que el sobreenfriamiento desee evitarse o disminuirse, pueden usarse
dos mtodos: el ms frecuente consiste en agitar el lquido sometido a enfriamiento
tan enrgicamente como sea posible; el segundo se basa en introducir un pequeo
cristal (llamado germen) sobre el cual comienza la cristalizacin. En el caso de
nuestras medidas de crioscopa, un sobreenfriamiento no demasiado grande es, como
se ver, recomendable para la determinacin del punto de congelacin de la solucin.
Modo operatorio
1) Se dispone de:
a) Una solucin preparada disolviendo 30 g de urea en 1000 g de agua y una
solucin de NaCl 0,5 molal.
b) Un recipiente aislante de telgopor con una tapa tambin aislante a travs de la
cual se pasar luego el tubo crioscpico y su camisa.
24
Gua de Trabajos Prcticos de Qumica General Edicin 2012
c) Un tubo de ensayo grande, que
llamaremos tubo crioscpico, limpio y
seco.
d) Un tubo de mayor dimetro que el tubo
crioscpico, que llamaremos camisa,
provisto de un tapn de goma perforado
a travs del cual puede insertarse el
tubo crioscpico (ver figura).
2) Preparar en el recipiente aislado una
mezcla frigorfica adicionando sal al hielo
granulado hasta que el termmetro marque
5 C (tratar de no formar una mezcla de
menor temperatura).
3) El tubo crioscpico se tapar con un tapn
con dos perforaciones adecuadas para
pasar por ellas un agitador y un
termmetro. Antes de taparlo se agrega al
tubo crioscpico limpio y seco, el solvente
puro (agua) hasta que cubra el bulbo del termmetro.
4) En el tubo camisa agregar solucin saturada de NaCl que acta como conductor
trmico. (Por qu solucin saturada?).
5) Introducir el conjunto de camisa y tubo crioscpico en el recipiente con la mezcla
frigorfica. Luego de un instante necesario para que se alcance el equilibrio
trmico, comenzar a tomar lecturas de temperatura a intervalos de 30 segundos.
Durante estas medidas debe mantenerse una agitacin suave (subir y bajar
lentamente el agitador).
6) Cuando la temperatura alcance el supuesto punto de sobreenfriamiento
(aproximadamente medio grado por debajo del punto de congelacin), agitar
bruscamente permitiendo la cristalizacin y aumento de temperatura.
7) Luego del ascenso se contina registrando la temperatura cada 30 segundos
durante 2 o 3 minutos. La temperatura del mximo es T (temperatura de
congelacin del solvente puro).
8) Con sumo cuidado abrir el aparato, quitar el termmetro y el agitador, volcar el
agua, enjuagar el tubo con una pequea porcin de la solucin a utilizar, aadir la
solucin de urea y proceder como se indica en 7). La temperatura del mximo, T,
corresponde a la temperatura de congelacin de la solucin.
9) Abrir el aparato con precaucin, volcar la solucin de urea, enjuagar el tubo
crioscpico con agua destilada y con la solucin a utilizar. Aadir solucin de NaCl
0,5 molal. Operar de la manera indicada en 7).).
10) Construir grficos Temperatura vs tiempo y calcular el descenso crioscpico de
ambas soluciones.
11) Calcular el peso molecular de la urea y el factor i para el NaCl.
12) Calcular el error absoluto y el error relativo porcentual de las medidas.
Precauciones experimentales
-Debe evitarse el error de paralaje en las lecturas del termmetro.
-El cierre de los tapones debe ser hermtico para evitar fluctuaciones de
temperatura.
-El bulbo del termmetro debe estar sumergido en el lquido y lejos de las paredes
del recipiente.
25
Gua de Trabajos Prcticos de Qumica General Edicin 2012
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1.
2.
3.
4.
5.
Por qu se coloca solucin saturada de NaCl en la camisa frigorfica?
Qu ocurrira si coloca agua destilada o aire?
Por qu no usa hielo en lugar de mezcla frigorfica?
Por qu no evita el sobreenfriamiento?
Dibuje las curvas de enfriamiento para solucin y solvente si agita fuertemente
durante todo el proceso.
6. La temperatura de congelacin de una solucin acuosa de urea es -0,15C, cul
es la molalidad y cul el % p/p de la solucin? El PMR de la urea es 60.
7. Una solucin que contiene 16,8 g de un soluto no voltil y no electrolito en 250 g
de agua, tiene una temperatura de congelacin es -0,744C. El soluto est
compuesto por un 57,2 % de C, 4,7 % de H y 38,1 % de O. Cul es la frmula
molecular del soluto?
8. Por anlisis qumico se comprueba que un compuesto contiene un 6,7 % de H,
53,3 % de O y 40,0 % de C. Una solucin que contiene 0,73 g de esta sustancia
(que es no voltil y no electrolito) y 10 g de benceno, congela a 3,07C. Determine
la frmula molecular del soluto. Kc(benceno)=5,01 C/molal; T f(benceno)=5,1C.
9. Qu sucede si el sobreenfriamiento es demasiado grande?
10. Por qu sube la temperatura luego de romper el sobreenfriamiento?
11. Cul es el slido que se forma durante el enfriamiento del solvente? y cuando
se enfra la solucin?
12. Si se usa un Beckmann durante la experiencia del enfriamiento del solvente,
puede utilizarse otro durante la experiencia del enfriamiento de la solucin?
13. Al romper el sobreenfriamiento de 25 g de una solucin de urea cuya molalidad es
0,35, se desprenden bruscamente 2,5 g de agua. Calcule la temperatura de
congelacin de la solucin que determinar y el error que cometer en el peso
molecular. Kc=1,86C/molal.
14. Debe medirse exactamente el volumen de solucin o de solvente que se agrega
al tubo crioscpico?
15. Qu ocurre si el soluto es un electrolito?
16. Calcule la temperatura de congelacin que determinar para una solucin acuosa
3 % p/p de NaCl. Repita los clculos para una solucin de igual molalidad de
Na2SO4 y para HF (electrolito dbil con un 3 % de disociacin). Kc=1,86C/molal.
17. Dibuje en un mismo grfico de temperatura versus tiempo, los enfriamientos para
agua y soluciones acuosas 0,1 m de KNO3, 0,1 m de K3PO4, 0,2 m de KNO3, 0,1 m
de urea, 0,2 m de urea y 0,1 m de HF (electrolito dbil). Realice lo mismo en un
grfico de presin de vapor versus temperatura.
18. Qu tienen en comn los trabajos prcticos de CuSO 4 y de crioscopa?
26
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Cintica Qumica
TEORA-SEMINARIO
1. Cmo se define la velocidad de una reaccin qumica? Exprsela
adecuadamente para una reaccin genrica.
2. Discuta el significado de orden de reaccin y velocidad especfica. Qu es el
tiempo medio de una reaccin qumica?
3. Discuta los grficos de velocidad versus concentracin de reactivo para las
reacciones de orden cero, uno y dos respecto de ese reactivo. Realice lo mismo
para los grficos de t1/2 versus concentracin.
4. En la reaccin: A
P, la velocidad de reaccin es 0,025 moles /(L x min) cuando
la concentracin de A es 0,40 M. Calcule cul sera el valor de la velocidad cuando
la concentracin de A es 0,10 M si la reaccin fuera: a) de orden cero b) de orden
uno respecto de A c) de orden dos respecto de A.
5. En la reaccin entre Cl2 y NO para dar ClNO se encuentran los siguientes datos:
velocidad(moles/L.h)
[Cl2]
[NO]
0,120
0,10
0,10
0,060
0,20
0,050
0,030
0,10
0,050
Escriba la ecuacin de velocidad y calcule la constante de velocidad.
6. La descomposicin de H2O2 en O2 y H2O es de primer orden. Su t 1/2 es 5,80
minutos. Calcule: a) La concentracin de agua oxigenada al cabo de 10 minutos si
la concentracin inicial es 0,50 M. b) El tiempo necesario para disminuir la
concentracin desde 0,50 M hasta 0,10 M. c) El volumen de O2 en CNPT liberado
luego de 1,00 hora si se parte de 1 litro de una solucin 1,0 M de H 2O2.
7. La descomposicin del Cl2SO2 en Cl2 y SO2 en fase gaseosa es de primer orden.
Luego de 6,7 minutos se descompone el 2,0 % del Cl 2SO2 inicial. Calcule la
constante de velocidad y el tiempo medio.
8. En la hidrlisis catalizada de un ster el 14,1 % del mismo se hidroliz luego de 30
minutos y el 70,3 % despus de 240 minutos. Demuestre que la reaccin es de
primer orden. Calcule k y t1/2.
9. Discuta la influencia de la temperatura en la velocidad de las reacciones qumicas.
Escriba la ecuacin de Arrhenius e indique el significado de cada factor.
10. Cul ser el valor de la energa de activacin de una reaccin cuya constante de
velocidad se duplica cuando la temperatura pasa de 27C a 37C?
11. Calcule la energa de activacin y la constante de velocidad a 650 K de una
reaccin de la cual se conocen las velocidades especficas: 0,0162 y 0,0238 s -1 a
640 y 646 K respectivamente.
12. Qu son los catalizadores? Diferencie catlisis homognea y heterognea.
13. Discuta qu se entiende por: a) etapa elemental, b) mecanismo de reaccin, c)
molecularidad.
14. Una reaccin se realiza en las etapas siguientes: A + B
C y B+2A
D
Cul es la reaccin total? Cul es la molecularidad de cada etapa? Indique, si
es posible, el orden de reaccin respecto de cada reactivo, A y B, si la primera
etapa es ms lenta que la segunda. Idem si ocurre lo contrario.
15. Analizar la velocidad de las reacciones qumicas y la influencia de los diversos
factores (concentracin, temperatura, catalizadores) bajo la ptica de la teora de
las colisiones y la teora del estado de transicin.
27
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Cintica Qumica
TRABAJO PRCTICO
Objetivo: determinar los parmetros cinticos para una reaccin qumica.
MATERIALES A UTILIZAR
Espectrofotmetro
Cronmetro
Buretas x 25mL
Pipeta de doble aforo x 5mL
Propipeta
Papel absorbente
Reactivos (*): etanol, K2Cr2O7 0,01667M, H2SO4 3,6M
(* para tratar los residuos: NaOH 3 M + virutas de Zn )
Precauciones:
El cromo en todos sus estados de oxidacin es txico. El dicromato de potasio
(K2Cr2O7) es un oxidante fuerte y est sospechado de ser carcinognico. Las
soluciones de dicromato podran causar enrojecimiento o quemaduras de la piel. El
cido sulfrico es corrosivo, por lo cual siempre debe utilizar la propipeta y no la boca
para manejarlo con la pipeta.
Primeros auxilios:
Para quemaduras con cido enjuague la piel (o los ojos si fuera necesario)
exhaustivamente con agua. Ver al mdico.
Cuando el dicromato se vierte sobre la piel, lavar con agua durante 5 min por lo
menos. Si se hubiera ingerido, enjuagar la boca muy bien y consultar al mdico.
Fundamento
La oxidacin suave de los alcoholes produce cetonas, aldehdos o cidos
carboxlicos, dependiendo de la naturaleza del alcohol y de las condiciones bajo las
cuales ocurre la reaccin. El agente oxidante es frecuentemente el dicromato de
potasio o el permanganato de potasio. En cada uno de estos casos, el oxidante
contiene un metal de transicin en un alto estado de oxidacin: Mn(VII) en el ion
permanganato y Cr(VI) en el dicromato. La extensin de la reaccin es fcil de
determinar colorimtricamente, procede a una velocidad moderada e involucra un
distintivo cambio de color. El anaranjado del ion Cr2O72- es consumido y aparece en su
lugar el color verde debido al ion Cr3+:
Cr2O72- + 3 CH3CH2OH + 8 H+
2 Cr3+ + 3 CH3CHO + 7 H2O
La ley general de velocidad para esta reaccin es bien conocida:
d Cr2O72
dt
2
7
k Cr2O
CH 3CH 2OH
3
1 d Cr
2
dt
Los exponentes a, b y c en la ecuacin anterior son los rdenes de reaccin
respecto al in dicromato, al protn y al alcohol respectivamente. Los valores de a, b y
c no coinciden necesariamente con los coeficientes estequiomtricos de la ecuacin
balanceada y deben ser determinados experimentalmente. Las expresiones
diferenciales en los extremos de la ecuacin indican que la reaccin podra ser
seguida tanto por la desaparicin del Cr 2O72- como por la aparicin del Cr3+. Sin
embargo, debido a la mayor intensidad del color del in Cr2O72-, es preferible utilizar a
28
Gua de Trabajos Prcticos de Qumica General Edicin 2012
ste ltimo para evaluar el progreso de la reaccin.
El experimento se realizar empleando un gran exceso de cido y de alcohol
respecto a la cantidad de in dicromato. De este modo, las concentraciones de H + y de
etanol permanecern aproximadamente constantes, mientras que el agente limitante
(Cr2O72-) es consumido. En estas condiciones experimentales, la ley de velocidad
diferencial queda representada por:
d Cr2O72
k ' Cr2O72
dt
El valor de a se convierte as en el orden de la reaccin global y es el parmetro
que se determinar experimentalmente.
En el mtodo de la velocidad integrada que se utilizar en el trabajo prctico, se
sigue la variacin de la concentracin del reactivo en defecto, en funcin del tiempo, a
medida que progresa la reaccin.
Si se grafican varias funciones de la concentracin (por ejemplo, la concentracin
misma y el logaritmo o la inversa de la concentracin), es posible determinar el orden
de la reaccin observando en que caso la curva experimental se asemeja a la curva
terica predicha para rdenes de reaccin 0, 1, 2, etc.
A partir de la ecuacin anterior:
d Cr2O72
2
7
Cr2O
k ' dt
se puede integrar para los diferentes valores posibles de a:
a=0
[Cr2O72-] = [Cr2O72-]0 - kt
(1)
a=1
ln [Cr2O72-] = ln [Cr2O72-]0 - kt
(2)
a=2
1 / [Cr2O72-] = 1 / [Cr2O72-]0 + kt
(3)
De este modo, se pueden graficar distintas funciones de la concentracin de
dicromato determinada experimentalmente ([Cr2O72-], ln[Cr2O72-] o 1/ [Cr2O72-]) en
funcin del tiempo (t) y se observa cul de los grficos obtenidos ajusta mejor a las
rectas predichas por las ecuaciones 1, 2 o 3. Debido a que dichas ecuaciones fueron
obtenidas suponiendo un orden de reaccin igual a 0, 1 o 2, respectivamente, es
posible deducir cul es el orden de reaccin para el in Cr 2O72-.
La concentracin de in Cr2O72- durante el experimento se puede determinar a
travs de la relacin que existe entre la Absorbancia (A) de la solucin y la
concentracin del in (c). Cuando incide una radiacin de una cierta longitud de onda
(p.ej. un haz de luz roja, verde, etc.) sobre una solucin conteniendo una sustancia
capaz de interactuar con dicha radiacin, parte de la misma es absorbida mientras que
el resto es transmitido a travs de la solucin. Una funcin de la cantidad de radiacin
absorbida (la Absorbancia) depende de la naturaleza de la sustancia absorbente ( ,
epsilon = absorptividad molar), la longitud del recorrido de la luz por la solucin
(camino ptico = b) y la concentracin de la sustancia que absorbe la luz (c). La
expresin matemtica que relaciona estos parmetros se conoce como Ley de
Lambert-Beer:
A=
bc
Dados una cierta sustancia de absorptividad molar conocida y un camino ptico, la
absorbancia es directamente proporcional a la concentracin de la solucin. Por
lo tanto, la disminucin de la concentracin del ion dicromato puede ser seguida
midiendo la disminucin de la absorbancia de la mezcla de reaccin a una cierta
29
Gua de Trabajos Prcticos de Qumica General Edicin 2012
longitud de onda. Debido a la ley de Lambert Beer, la absorbancia puede reemplazar a
la [Cr2O72-] en las ecuaciones (1), (2) y (3) y se puede determinar el valor del orden de
reaccin (a) a partir de los grficos A vs t, ln (A) vs t o 1/A vs t.
Parte Experimental
1) Seleccione en el dial de longitudes de onda del espectrofotmetro el valor 468
nm, que corresponde al valor apropiado para la absorcin de la especie dicromato.
2) Coloque el selector interno del espectrofotmetro en la posicin 2 (existe una
posicin conveniente para cada intervalo de longitudes de onda de trabajo).
3) Calibrado del Cero: utilice una solucin blanco preparada a partir de la mezcla
de 1,0 mL de H2SO4 3,6M; 2,5 mL de etanol y 9,0 mL de agua destilada. Coloque las
soluciones en una cubeta y lleve a cero el equipo en la posicin 0% de Absorbancia.
4) MEDIDAS DE ABSORBANCIA (A):
IMPORTANTE: EN TODOS LOS CASOS PROCURAR EL MEZCLADO DE LOS REACTIVOS EN
EL MENOR TIEMPO POSIBLE.
- Determinacin de A a tiempo cero (A t = 0): coloque 1,5 mL K2Cr2O7 0,01667 M en
un erlenmeyer limpio y seco. Agregue 1,0 mL de H2SO4 3,6 M y 10,0 mL de H2O
destilada. Mezcle bien, llene una cubeta del espectrofotmetro hasta
aproximadamente las 3/4 partes y registre el valor de absorbancia.
- Coloque 1,5 mL K2Cr2O7 0,01667 M; 1,0 mL H2SO4 3,6 M y 7,5 mL de H2O en otro
erlenmeyer limpio y seco. Mezcle bien y, en el instante de agregar 2,5 mL de etanol,
dispare el cronmetro. Llene una cubeta hasta aproximadamente las 3/4 partes y tome
lecturas de absorbancia cada 30 segundos. Contine tomando lecturas durante 10
minutos.
Clculos
1) Construya una tabla con el siguiente encabezado:
t / min
ln A
1/A
2) Represente grficamente:
A
vs
t / min
ln A vs
t / min
1 / A vs
t / min
y decida cul es la cintica que sigue el sistema, por comparacin con las
ecuaciones descriptas anteriormente (1, 2, 3).
3) Determine analtica y grficamente los valores de k y t1/2.
30
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Equilibrio Qumico
TEORIA-SEMINARIO
1. Discutir equilibrio qumico. Principio de Le Chatelier
2. Suponiendo que la siguiente reaccin: A(g) + B(g) C(g) (T=25 C) es completa,
calcule el nmero de moles que se obtienen si se mezclan 0,500 g de A con 0,700
g de B en un recipiente de 1,00 litros. PMR(A)=35,0 y PMR(B)=20,0.
3. Si la reaccin tiene un rendimiento del 75,0 % calcule la concentracin final de
cada especie.
4. Si se supone que el rendimiento del 75,0 % es debido exclusivamente a que la
reaccin es reversible, calcule Kc y Kp a esa temperatura.
5. Se desea medir la constante de equilibrio de la reaccin: I2 + I- I3-, para lo cual se
coloca en un recipiente 2,50 g de I2 (s) y se le agregan 200 mL de solucin de KI
0,510 M. Si al titular 10,00 mL de la solucin contenida en el frasco se gastan 8,45
mL de Na2S2O3 0,100 N y la solubilidad del I2 en agua a esa temperatura es 1,05
g/L, calcular la constante de equilibrio de la reaccin.
6. Dada la siguiente reaccin en equilibrio: 2Cl 2(g) + H2O(g) 4 HCl(g) + O2(g) +
calor, seale y explique el efecto (aumento, disminucin, invariabilidad) de los
cambios que figuran en la columna de la izquierda sobre las magnitudes de la
especie indicada en la columna de la derecha.
a
disminucin de la presin
nmero de moles de H2O
b
adicin de O2
nmero de moles de H2O
c
adicin de O2
nmero de moles de Cl2
d
adicin de O2
nmero de moles de HCl
e
aumento de la presin
nmero de moles de Cl2
f
aumento de la presin
nmero de moles de O2
g
aumento de la presin
Kp
h
aumento de la temperatura
Kp
i
aumento de la temperatura
nmero de moles de HCl
j
adicin de un catalizador
nmero de moles de Cl2
7. Dada la siguiente reaccin: C(s) + CO2(g) 2 CO(g) en equilibrio a una T=850 C y
en un volumen de 2,00 l, se encontraron las siguientes presiones parciales para los
gases en contacto con 1,00 g de C slido: PCO2= 0,0623 atm y PCO= 0,9377 atm.
Calcular: a) La constante de equilibrio. b) El cociente de reaccin (Q) y la presin
del sistema en el instante de agregar 5,00.10 -3 moles de CO. c) Las nuevas
presiones parciales y la presin total en el equilibrio. d) Cul es el efecto sobre el
equilibrio al agregar 2,00 g de C.
8. En un vaso de 2,00 L se coloca una mezcla de 3,0 moles de SO 2, 4,0 moles de
NO2, 1,0 moles de SO3 y 4,0 moles de NO. La reaccin de equilibrio que tiene
lugar es: SO2(g) + NO2(g) SO3(g) + NO(g). Cuando se alcanza el equilibrio a
700 C el vaso contiene 1,00 moles de SO 2. a) Calcule las concentraciones en el
equilibrio de NO, NO2 y SO3. b) Calcule Kc para esta reaccin a 700 C. c) Calcule
Kp para esta reaccin a la misma temperatura.
9. Un recipiente de 1,00 l se llena con 0,500 moles de HI a 448 C. El valor de Kc para
la reaccin de formacin del HI a esa temperatura es 50,5. Cules son las
concentraciones de H2, I2 y HI en el recipiente cuando se alcanza el equilibrio?
10. Calcular la entalpa media de reaccin para: Br2 + H2O BrOH + H+ + Br- , si los
valores a diversas temperaturas de la constante de equilibrio Kc son:
T C
10
25
30
35
Kc
1,760
5,80
8,20
11,30
11. En un recipiente de 2,00 L se colocan 0,280 g de N 2, 0,128 g de O2 y 0,800 g de
NO a 300C. La Kc para la formacin de NO vale 4,50 a esa temperatura. a)
Cules sern las concentraciones en el equilibrio? b) Si la reaccin es
31
Gua de Trabajos Prcticos de Qumica General Edicin 2012
exotrmica, la constante de equilibrio a 400C ser mayor, menor o igual que la
anterior? c) Qu sucede con el equilibrio, con las concentraciones y con la
constante al aumentar la presin de este sistema en equilibrio?
12. Para la reaccin: PCl5(g) PCl3(g) + Cl2(g), Kp a 760 K vale 33,3. Cules sern
las concentraciones en el equilibrio si se inyectan simultneamente 1,50 g de PCl 5
y 15,0 g de Cl2 en un volumen de 36,3 mL a 760 K?.
13. En un recipiente de 5,00 L a 500C se introducen 1,40 g de N2 y 0,0700 moles de
H2; al alcanzar el equilibrio se encuentran 0,0400 moles de H2. Calcule la constante
de equilibrio si la reaccin es: N2 + 3 H2 2 NH3
14. Para la reaccin C2H2(g)+ D2O(g) C2D2(g) + H2O(g), cuyo entalpa molar de
reaccin es 530 caloras y su constante (K p) a 25C es 0,820, calcule cuntos
moles de C2D2 se formarn a 100C cuando 1 mol de C2H2 y 2 moles de D2O se
ponen en contacto a la presin total de 1,20 atm.
15. Para la medida de la constante de equilibrio de la reaccin: 2 I - + 2 Fe3+ I2 + 2
Fe2+, se mezclan 100 mL de solucin 0,100 M de KI y 100 mL de solucin 0,200 M
de FeCl3. Cuando se alcanza el equilibrio 10,00 mL de la solucin son titulados con
4,50 mL de solucin de Na2S2O3 0,100 N. Calcule la constante de equilibrio.
Indique hacia dnde se desplazar el equilibrio y que pasar con la constante de
equilibrio cuando: a) se agrega ion frrico; b) se agrega tiosulfato; c) se aumenta la
temperatura (el proceso es endotrmico).
16. Discutir la dependencia de la constante de equilibrio con la temperatura. Ecuacin
de Van't Hoff.
17. Discutir la relacin entre la variacin de energa libre y la constante de equilibrio.
18. Realice una interpretacin cintica del equilibrio qumico.
32
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Equilibrio qumico
TRABAJO PRCTICO
Objetivo: Estudiar el comportamiento de procesos qumicos en equilibrio frente a
diferentes perturbaciones. Determinar la constante de equilibrio de un proceso qumico
Introduccin
Concentracin
Hasta ahora hemos considerado a todas las reacciones qumicas como completas,
o irreversibles, es decir que hemos supuesto que las reacciones continan hasta que
se acaba el reactivo en defecto, sin embargo, muchas reacciones qumicas no se
completan, sino que avanzan hasta un punto en el que no aumenta ms la
concentracin de productos an cuando todava haya reactivos presentes en el medio
de reaccin. Estas reacciones se denominan reversibles, incompletas o reacciones de
equilibrio. Como se recordar, al tratar la estequiometra de las reacciones qumicas,
se ha mencionado que existen reacciones que tienen rendimientos menores que el
100 %. Si bien la disminucin del rendimiento puede deberse a varias razones, como
prdidas de producto, o existencia de reacciones secundarias, la causa ms comn
es que la reaccin no sea completa.
Lo que sucede en realidad es que estas reacciones no slo ocurren en el sentido
formal indicado por la ecuacin qumica (reaccin directa) sino tambin en sentido
contrario, es decir, los "productos" se recombinan para dar "reactivos" (reaccin
inversa). Cuando se llega al punto en que ambas reacciones ocurren con la misma
velocidad, las concentraciones de reactivos y productos no cambian ms con el
tiempo. Por ejemplo, si para la reaccin reversible A + B C + D (las dos flechas
indican que la reaccin puede transcurrir en ambos sentidos), medimos las
concentraciones de reactivos y productos a medida que transcurre el tiempo, se
obtiene el siguiente grfico:
CD
tiempo
La concentracin inicial de A disminuye rpidamente al principio y ms lentamente
despus, hasta que a partir de cierto instante ya no vara y permanece constante. Lo
mismo ocurre con la concentracin de B.
Las concentraciones de C y D son nulas al comienzo pero aumentan rpidamente
al principio, ms lentamente despus y luego dejan de cambiar al mismo tiempo que
las de A y B. Al estado del sistema en el cual las concentraciones se mantienen sin
cambio se lo denomina de "equilibrio." Una vez establecido el equilibrio persistir
indefinidamente si no cambia ninguna de las variables que lo determinan (por ejemplo,
33
Gua de Trabajos Prcticos de Qumica General Edicin 2012
como veremos ms adelante, si no se cambia la temperatura del sistema, o no se
agregan o quitan reactivos o productos). La reaccin, como ya hemos dicho, no se ha
interrumpido, sino que transcurre a la misma velocidad tanto en sentido directo como
inverso. La situacin es similar a la del equilibrio lquido-vapor en el que no dejaba de
haber intercambio de molculas entre las fases, sino que este intercambio se
efectuaba a la misma velocidad en ambos sentidos. En ambos casos, esta situacin se
denomina equilibrio dinmico.
Experimentalmente se demuestra que cada reaccin particular tiene su propio
estado de equilibrio caracterizado por una relacin especifica entre las
concentraciones de las diversas sustancias. Si se realiza una serie de experiencias
todas a la misma temperatura, pero con distintas concentraciones iniciales de A y B,
se observa que si bien las concentraciones en el equilibrio son diferentes, existe una
relacin que es la misma en todos los casos: dividiendo el producto de las
concentraciones de C y D por el producto de las concentraciones de A y B, siempre se
obtiene el mismo nmero. Este nmero, llamado constante de equilibrio y simbolizado
por la letra K, es caracterstico de cada reaccin y slo vara si se altera la
temperatura. Para la reaccin general:
aA + bB cC + dD
donde a, b, c, d son los coeficientes estequiomtricos, la
constante de equilibrio resulta:
[C]c [D]d
, en la que los corchetes indican las concentraciones molares en el
[ A ]a [B]b
estado de equilibrio de la reaccin.
Para cualquier reaccin de equilibrio, el valor de K es independiente de las
concentraciones de reactivos y productos siendo la temperatura el nico factor que la
afecta. Los valores medidos de las constantes de equilibrio varan desde nmeros muy
pequeos (la reaccin directa ocurre en muy pequea proporcin), a muy grandes (la
reaccin directa es prcticamente completa), segn la reaccin de que se trate.
En el caso de reacciones que involucran sustancias gaseosas, la constante de
equilibrio puede expresarse en funcin de las presiones parciales de estas sustancias.
As, por ejemplo, para la reaccin: aA(g) + bB(g) cC(g) + dD(g),
la constante de equilibrio en funcin de las concentraciones ser:
[C]c [D]d
Kc
(1)
[ A ]a [B]b
pero si las sustancias gaseosas se comportan como gas ideal, la concentracin de
cada una de ellas ser:
nA PA
nB PB
[A]
[B]
V RT
V RT
n C PC
n D PD
[C]
[D]
V RT
V RT
Kc
Reemplazando en la expresin (1) :
PC
KC
PA
RT
A
RT
PD
PB
RT
B
PCCPDD (RT )A (RT )B
x
PAAPBB (RT )C (RT )D
(2)
RT
Si llamamos Kp a la constante expresada en funcin de las presiones de equilibrio
34
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Kp
PCCPDD
PAAPBB
reemplazando en (2) y reordenando queda:
Kp
K c (RT)
(3)
donde n es la diferencia entre el nmero de moles de gas en los productos y el
nmero de moles de gas en los reactivos.
Equilibrios Qumicos en los que existen fases condensadas puras.
Supongamos que, en un recipiente cerrado de volumen constante tenemos la
siguiente reaccin en equilibrio:
2C(s) + O2(g) 2CO(g)
(4)
Habr en el recipiente dos fases, la fase slida carbono y la fase gaseosa, que es
una mezcla de oxgeno y monxido de carbono. La expresin de la constante de
equilibrio ser:
[CO]2
K
[O 2 ][C]2
Ntese que podemos alterar la concentracin del CO en la fase gaseosa
agregando, por ejemplo, CO al sistema ya que, como el volumen permanece
constante, aumentar su concentracin. Del mismo modo podemos variar la
concentracin de O2. Sin embargo no es posible cambiar la concentracin de C (s) ya
que, al aumentar el nmero de moles de carbono, aumentaremos tambin el volumen
de la fase carbono (el slido carbono no est contenido en el volumen del recipiente
sino en el volumen de la misma fase slida carbono).
El nmero de moles por litro de cualquier slido lquido puro ser siempre el
mismo, sea cual fuere la cantidad de slido presente, siempre que no cambiemos la
temperatura. Debido a este hecho, podemos incorporar la concentracin (invariante)
de carbono slido en la fase carbono a la constante de equilibrio y escribirla de la
siguiente forma:
[CO]2
K/
[O 2 ]
Generalizando: siempre que en los reactivos o productos aparezcan sustancias
lquidas o slidas puras, se omitirn esas especies en la expresin de la constante de
equilibrio.
Desplazamiento del equilibrio.
Cuando se alteran (perturban) las condiciones que determinan que una reaccin
qumica se encuentre en equilibrio, las concentraciones de reactivos y productos
cambian nuevamente en el tiempo hasta que se alcanza un nuevo estado de equilibrio.
La direccin del cambio puede predecirse mediante el llamado principio de Le
Chatelier, que dice: si se cambia (perturba) el valor de cualquier variable que afecte el
equilibrio de un sistema, el sistema en equilibrio se modificar de modo de oponerse al
cambio que produce la perturbacin.
Consideremos, como ejemplo, el siguiente sistema en equilibrio en un recipiente
cerrado:
H2(g) + I2(g) 2 HI(g)
(6)
Las concentraciones de las tres sustancias no varan en tanto no se modifiquen las
condiciones del sistema. Sin embargo, stas pueden alterarse de varios modos:
35
Gua de Trabajos Prcticos de Qumica General Edicin 2012
1) introduciendo en el recipiente ms cantidad de algunos de los componentes;
2) extrayendo parte de ellos;
3) variando el volumen del recipiente;
4) modificando la temperatura del sistema y
5) aadiendo un catalizador.
Analizaremos el efecto de cada uno de estos factores aplicando el principio de Le
Chatelier.
1) Perturbacin: Se aumenta la concentracin de uno de los componentes
aadiendo mayor cantidad del mismo al sistema.
Respuesta: Al introducir, por ejemplo, ms hidrgeno en el recipiente, el sistema
en equilibrio se reajustar oponindose a ese aumento, para lo cual algunas molculas
de hidrgeno se combinarn con algunas de iodo formando ms ioduro de hidrgeno.
Ntese que, de acuerdo al principio de Le Chatelier, la concentracin de H 2 ha
aumentado menos de lo que lo hubiera hecho si el H2 hubiera sido agregado a un
sistema en el cual la concentracin de H2 no hubiera sido una variable del equilibrio.
2) Perturbacin: Se disminuye la concentracin de uno de los componentes
separando parte de l del sistema.
Respuesta: Si se disminuye la cantidad de hidrgeno, por ejemplo, el sistema se
reajustar a la accin externa descomponindose parte de las molculas de ioduro de
hidrgeno para reemplazar parte de las molculas de hidrgeno desaparecidas. El
efecto resultante es una disminucin de la concentracin de HI y un aumento en la del
iodo. Ntese que, de acuerdo al principio de Le Chatelier, la concentracin de H 2 ha
disminuido menos de lo que lo hubiera hecho si el H2 hubiera sido quitado a un
sistema en el cual la concentracin de H2 no hubiera sido una variable del equilibrio.
3) Perturbacin: Disminucin del volumen del recipiente.
Respuesta: Cuando el volumen disminuye, aumenta la concentracin de todas las
especies qumicas contenidas en l. Para oponerse a este cambio, el nmero total de
molculas del sistema debera disminuir para que la concentracin aumentara menos.
En el sistema H2 - I2 - HI, no hay mecanismo capaz de conseguirlo, puesto que por
cada dos molculas que desaparecen (una de H 2 y otra de I2) aparecen dos de HI. La
conclusin es que el volumen del recipiente (o la concentracin total de partculas) no
es, en este caso, una variable que afecte al equilibrio.
La situacin es diferente en el equilibrio:
N2(g) + 3H2(g)
2NH3(g),
cuando una molcula de nitrgeno reacciona con tres de hidrgeno, se forman dos
de amonaco. Si en un recipiente cerrado tenemos esta reaccin de equilibrio y
disminuimos el volumen del recipiente, el sistema se opondr al aumento general de
las concentraciones disminuyendo el nmero total de molculas, es decir,
favoreciendo la formacin de NH3. En general, en aquellas reacciones en las que vara
el nmero de moles gaseosos, toda disminucin de volumen favorece la reaccin en
que este nmero disminuye.
4) Perturbacin: Alteracin de la temperatura del sistema.
Respuesta: Supongamos que se trata de aumentar la temperatura del sistema.
Dado que al sistema se le entregar calor para lograrlo, la oposicin a este cambio
ser tratar de absorber calor sin aumentar la temperatura. Para ello el sistema
favorecer la reaccin que absorba calor (endotrmica). Desde luego, si la reaccin
directa es endotrmica, la inversa ser exotrmica y viceversa. En el equilibrio (6),
cuando desaparecen un mol de H2 y un mol de I2 se forman dos de HI y se liberan 3
Kcal. Si se aumenta la temperatura, el sistema se opondr favoreciendo la reaccin
inversa para absorber parte del calor suministrado.
36
Gua de Trabajos Prcticos de Qumica General Edicin 2012
5) Perturbacin: Agregado de un catalizador.
Respuesta: La introduccin de un catalizador en un sistema no ejerce el menor
efecto sobre las concentraciones en el equilibrio, ya que el catalizador lo nico que
hace es modificar la velocidad de las reacciones directa e inversa, pero no afecta el
estado de equilibrio final. Esto se discuti con ms detalle en el tema de cintica
qumica.
Parte experimental
Estudio cualitativo del equilibrio qumico. Principio de Le Chatelier.
1- Equilibrio cido-base de un indicador:
Se estudiar el equilibrio presente en la solucin acuosa de un indicador cidobase: el Verde de bromocresol. Un indicador cido-base tiene la particularidad de
existir en diferentes formas coloreadas de acuerdo a la cantidad de H + y OH- presentes
en la solucin.
El equilibrio puede representarse como:
HIn In- + H+
Se agregan 3 gotas de verde de bromocresol a 2-3 mL de agua destilada en un
tubo de ensayo. A este sistema se le aaden gotas de HCl en forma lenta y
observando luego de cada agregado. Luego de agregar no menos de 15 y no ms de
20 gotas, se agregan gotas de NaOH observando las variaciones que tienen lugar.
Interpretar.
2- Equilibrio del complejo coloreado formado entre el Fe 3+ y el tiocianato (SCN-)
Se estudiar el equilibrio de la siguiente reaccin:
Fe+3 + SCN
FeSCN+2
Se mezclan en un vaso de precipitados 1 mL de solucin de NH4SCN, 0,5 mL de
solucin de FeCl3 y 75 mL de agua destilada. De dicha solucin se toman 8 porciones
de 5 mL cada una volcndolas a sendos tubos de ensayo. Uno de ellos se deja como
testigo.
a) A uno de los tubos se le agrega solucin de FeCl 3 (unas gotas). Observar e
interpretar.
b) A otro de los tubos se le agrega unas gotas de solucin de NH 4SCN. Observar e
interpretar.
c) A los otros cinco tubos se les agrega cantidades crecientes de solucin de
NH4SCN: 2, 4, 8, 16, 20 gotas. Observar e interpretar. Finalmente, al ltimo de los
tubos se le agregar una gota de FeCl3. Interpretar.
Estudio cuantitativo del equilibrio qumico. Medida de Keq y de H de una
reaccin.
Determinacin de la constante de equilibrio de la reaccin del ion frrico con ion
yoduro
Objetivos: determinacin de la constante de equilibrio de la reaccin entre ion frrico
con ion yoduro. Clculo del H de reaccin.
Fundamento
Se mezclan soluciones de concentraciones conocidas de Fe 2(SO4)3 y KI. Se
incuban los sistemas a distintas temperaturas (temperatura ambiente y 40C).
La reaccin que tiene lugar es:
2 Fe3+ + 2I- I2 + 2 Fe2+
(1)
37
Gua de Trabajos Prcticos de Qumica General Edicin 2012
y es su constante de equilibrio:
[I2 ] [Fe2 ]2
[I ]2 [Fe3 ]2
la que pretende determinarse a dos temperaturas distintas.
El I2 producido durante la reaccin qumica (indicada por la ecuacin 1) se titula
con solucin de Na2S2O3, para calcular la [I2] en equilibrio.
Por titulacin con Na2S2O3, usando almidn como indicador, podemos calcular los
moles de I2 presentes. La reaccin que tiene lugar durante la titulacin es la siguiente:
2 S2O3=
S4O6= + 2eI2 + 2e
2 I
2S2O3= + I2
S4O6=+ 2 Icuyo punto final puede detectarse pues el almidn forma un complejo de color azul
con el I2 que desaparece al consumirse ste.
A partir de la [I2] en equilibrio y las concentraciones iniciales, se pueden calcular las
concentraciones de las otras tres especies en el equilibrio, simplemente a travs de
consideraciones estequiomtricas: la concentracin molar de Fe 2+ ser el doble de la
determinada para el I2 (de acuerdo a los coeficientes estequiomtricos de la ecuacin
(1), se genera siempre el doble de ion hierro(II) que de yodo molecular) mientras que
las concentraciones de los reactivos sern iguales a las iniciales respectivas menos el
doble de la concentracin determinada para el I2 (tambin puede comprobarse
observando los coeficientes estequiomtricos de la ecuacin (1)).
De este modo, si en la titulacin se determina que la concentracin molar de I 2 es x
mientras que las concentraciones iniciales de I- y de Fe3+ son respectivamente C1 y C2,
las concentraciones en el equilibrio sern las siguientes:
[I2] = x
[Fe2+] = 2.x
[I-] = C1 2.x
[Fe3+] = C2 - 2.x
A partir de estas concentraciones, pueden calcularse las constantes a las distintas
temperaturas. A partir de ellas y con la ecuacin de vant Hoff (ver ms abajo), puede
obtenerse el H de reaccin.
La variacin cuantitativa de la constante de equilibrio con la temperatura est dada
por la ecuacin de vant Hoff:
K2
H 1
1
ln
K1
R T 2 T1
donde K1 y K2 son las constantes de equilibrio de una reaccin a las temperaturas
T1 y T2, respectivamente, H es la variacin de entalpa de la reaccin y R la constante
general de los gases.
Parte operativa
Se agregan a un frasco color caramelo de 250 mL, 15 mL de solucin de KI (0,05
M), 30 mL de solucin Fe2(SO4)3 (0,1 M) y 200 mL de H2O. Previo a la mezcla las
soluciones tienen que estar a la temperatura de trabajo.
38
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Los sistemas se incuban a las temperaturas elegidas (temperatura ambiente y 40
C) en estufa para que el calentamiento sea homogneo en todo el volumen de la
solucin.
Se toman 10,00 mL de la solucin a distintos tiempos de incubacin (5 minutos, 30
minutos, 90 minutos y 120 minutos) y se titulan con solucin de Na 2S2O3 2,510-3 M,
en un bao de hielo y agua, usando una solucin de almidn como indicador. La
muestra se recibe en un matraz de Erlenmeyer con aproximadamente 30 mL de agua,
previamente enfriado en el bao de hielo y agua.
La titulacin debe ser rpida y el indicador debe agregarse al comienzo.
Una vez determinados los valores de constante de equilibrio, los grupos se
intercambiarn los valores de modo que cada grupo disponga de los valores de la
constante de equilibrio a las dos temperaturas experimentales. Con ambos valores de
Keq y la ecuacin de vant Hoff se determinar el H.
Clculos
Determinacin de la constante de equilibrio a ambas temperaturas
Determinacin de H
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Por qu es necesario enfriar durante la titulacin? Qu ocurrira si no lo hace?
2. Por qu es importante homogeneizar la temperatura hasta igualar la temperatura
deseada antes de realizar la mezcla?
3. Resulta conveniente completar el frasco tanto como sea posible y termostatizarlo
en la estufa. Justifique estos detalles experimentales.
4. Indique cuales de las siguientes magnitudes (concentracin de cada especie, Ke,
velocidad para alcanzar el equilibrio) variara y, en ese caso, si aumentara o
disminuira cuando: a) se utiliza una concentracin mayor de KI, b) se agrega agua
al recipiente de reaccin, c) se aumenta la temperatura (considere la variacin de
entalpa determinada experimentalmente), d) se utiliza una concentracin menor
de Fe2(SO4)3, e) parte del yodo se volatiliza
5. Indique qu tipo de errores cometer (por exceso, por defecto, ninguno) en la
determinacin de la constante de equilibrio si: a) utiliza una solucin de Na 2S2O3
ms concentrada que la que indica el rtulo; b) se volatiliza parte del yodo
contenido en el frasco; c) se volatiliza parte del yodo de la alcuota retirada para
titular; d) la solucin de KI era ms concentrada que lo que indica el rtulo; e) la
solucin de Fe2(SO4)3 era ms diluida que lo que indica el rtulo; f) no se enfra al
titular; g) se agrega agua al titular.
6. En un recipiente se encuentra en equilibrio la reaccin cuya K determin en la
prctica, indique qu reaccin, directa o inversa, favorecer si: a) agrega KI; b)
agrega Na2S2O3; c) diluye la solucin; d) agrega FeSO 4; e) disminuye la
temperatura (considere la variacin de entalpa determinada experimentalmente);
f) aumenta la presin;
g) favorece la volatilizacin y escape del yodo
39
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Equilibrios Inicos
TEORA-SEMINARIO
1. Extender el concepto de equilibrio qumico a los equilibrios inicos. Autoionizacin
del agua.
2. Electrolitos fuertes y dbiles. Procesos de disociacin de cidos y bases. pH y pOH.
3. Desarrolle los conceptos de cido y base segn Arrhenius y de Brnsted-Lowry.
Muestre ejemplos.
4. Dadas soluciones con las siguientes caractersticas, indicar si son cidas, bsicas o
neutras:
[H+] > [OH-]
pH = pOH
pH < pOH
pOH > 10
[H+] = 10-5 M
pH > 8
[OH-] > 10-7 M
[H+] = 2 x 10-8 g/L
5. Calcular el pH de las siguientes soluciones:
a) 100 mL de HCl 0,120 M.
b) 300 mL de HCl 0,120 M. Compare con el anterior.
c) solucin 3,00 % (p/p) y d= 1,12 g/mL de H2SO4.
d) solucin 6,00 % (p/v) de NaOH.
e) una mezcla de 100 mL de HCl 0,100 N y 300 mL de H2SO4 0,500 M.
f) una mezcla de 100 mL de NaOH 0,300 N con 0,100 g de Ba(OH)2 (suponer que
no hay cambio de volumen).
6. Indique cualitativamente cmo vara la concentracin de H + y el pH de 100 mL de
HCl 0,100 M cuando se le agregan:
a) 100 mL de HCl 0,100 M
b) 100 mL de H2SO4 0,100 M
c) 200 mL de HCl 0,100 M
d) 100 mL de NaOH 0,100 M
e) 200 mL de NaOH 0,100 M
f) 100 mL de H2O
g) 50 mL de Ca(OH)2 0,100 M
h) 100 mL de HAc 0,100 M
7. a) Calcular el pH de 30 mL de HClO4 0,025 M.
b) Calcular el pH de la solucin anterior cuando se agregan:
i) 30 mL de NaOH 0,075 M.
ii)10 mL de H2SO4 0,050 M
iii) 15 mL de Ba(OH)2 0,010 M y 15 mL de NaOH 0,020 M.
iv) 15 mL de Ba(OH)2 0,010 M y 15 mL de HCl 0,020 M.
8. Se tienen 80 mL de solucin de Ca(OH)2 0,80 % (p/p) y d= 1,03 g/mL y se le
agregan:
a) 20 mL de solucin de HCl 0,050 N.
b) 45 mL de solucin de HCl 0,050 N.
Calcular el pH final en cada caso y el volumen de solucin de HCl 0,050 N necesario
en la parte a) para neutralizar todo el Ca(OH)2 en exceso.
9. Explique qu es un indicador cido-base. Relacione el rango de viraje con la
constante de equilibrio del mismo. Justifique el hecho de que existen indicadores con
dos rangos de viraje. Uso de los mismos en titulaciones cido-base.
10.
Se tiene una solucin de NaOH aproximadamente 0,1 N:
a) Indique cul de los siguientes cidos ser el ms adecuado para titular la
solucin: H2SO4 concentrado (aproximadamente 36 N); HAc 0,100 N; HAc 1,00 N; HCl
6,00 N; HCl 0,100 N.
b) Cul/es de los siguientes indicadores usara en cada titulacin?:
azul de timol
(rojo - amarillo)
1,2 - 2,8
(amarillo-azul)
8,0 - 9,6
azul de bromotimol (amarillo - azul)
6,0 - 7,6
heliantina
(rojo - amarillo)
3,1 - 4,4
fenolftalena
(incoloro - rosa)
8,2 - 10,0
amarillo de alizarina (amarillo - violeta)
10,1 - 12,1
40
Gua de Trabajos Prcticos de Qumica General Edicin 2012
11.
En el laboratorio hay 3 frascos conteniendo soluciones 0,1 M de: HNO 3;
Ca(OH)2 y NaCl respectivamente. Cul/es de los indicadores del problema 6 podra
usar para distinguir las tres soluciones?
12.
Justifique la veracidad o falsedad de las siguientes proposiciones:
a) Cuando se agrega H2O sobre H2SO4 el pH disminuye porque cambia el nmero
de equivalentes del cido.
b) El grado de disociacin del HAc aumenta cuando aumenta la dilucin.
c) El pH de una solucin preparada pesando 0,056 g de KOH y llevando a 100 mL
es igual que el de otra solucin preparada pesando 0,0185 g de Ca(OH) 2 y llevando a
50 mL.
d) El pOH de las soluciones del inciso c) disminuye cuando se agregan 10 mL de
HCl 0,1 N.
13.
Ordenar cualitativamente (no es necesario hacer clculos) las siguientes
soluciones por orden decreciente de pH:
HCl 0,100 M
H2O
Ca(OH)2 0,00500 M
HAc 0,100 M (Ka = 1,8 x 10-5)
H2SO4 0,100 M
HCN 0,100 M (Ka = 4,9 x 10-10)
Ca(OH)2 0,0100M
HNO2 0,100 M (Ka = 4,5 x 10-4)
HCl 1,00 M
NH4OH 0,00500 M (Kb = 1,8 x 10-5).
14.
a) La Ka del HNO2 es 4,50x10-4. Calcular la [H+], [OH-], [NO2-], [HNO2] y el pH
de una solucin 0,200 M de HNO 2.
b) Se prepara una solucin con 2,48 g/l de NH 3. Calcular su pH si la Kb es 1,80 x
10-5.
c) Se mezclan 500 mL de HNO3 1,00 M con 20 mL de HCl de =1,14 g/mL y 35,0 %
p/p llevndose todo a volumen final de 800 mL. Calcule el pH y la concentracin de
todos los iones presentes.
15.
Suponga que Ud. est en el laboratorio y necesita preparar 10000 mL de una
solucin de H2SO4 de pH=2,00. Para ello dispone de H2SO4 98,0 % p/p y =1,84 g/mL,
pero por error, al preparar la solucin Ud. agrega 0,25 mL ms de H2SO4 concentrado.
Calcule el pH verdadero de la solucin y el volumen de NaOH 70,0 % p/v que deber
agregar para llevar la solucin al pH deseado (desprecie el efecto de dilucin por el
agregado de NaOH).
16.
Calcular la Ka de un cido monoprtico dbil si una solucin 0,0720 M del
mismo posee un pOH de 11,3.
17.
Calcular la concentracin de PO43-, PO4H2- , PO4H2- presentes en una solucin
de H3PO4 de pH=4,0, sabiendo que la concentracin de H 3PO4 en equilibrio es 0,050
M. K1 = 7,5x10-3, K2 = 6,2x10-8, K3 = 2,2x10-13.
18.
Se pesan 0,452 g de NaOH impuro y se llevan a 1000 mL con agua destilada.
La solucin resultante tiene un pOH=2,4. Calcular la pureza de la muestra en % p/p de
NaOH, suponiendo que la misma contiene impurezas que no afectan al pH.
Soluciones reguladoras
19.
Concepto de solucin reguladora. Composicin de los sistemas buffer.
Funcionamiento de los mismos.
20.
Se prepara una solucin reguladora mezclando 100 mL de NaAc 0,500 M con
200 mL de HAc 0,230 M. a) calcular el pH de la mezcla; b) calcular la variacin de pH
cuando se agrega: (i) 10,00 mL de HCl 0,0100 M, (ii) 10,00 mL de NaOH 0,0100 M; c)
re calcular y comparar con los resultados de b) si tales cantidades de cido o base se
agregan sobre 300 mL de agua destilada.
21.
Se dispone de una solucin 0,150 M de CH 3COOH y otra 0,100 M de
NaCH3COO. Qu volmenes de cada una de ellas se deben mezclar para obtener
100 mL de una solucin reguladora de pH = 5,30? Ka = 1,80.10-5.
41
Gua de Trabajos Prcticos de Qumica General Edicin 2012
22.
Calcular la variacin de pH que se producir al aadir 10,00 mL de HCl 0,100
M a 120,0 mL de una solucin buffer 0,150 M en NaHSO 4 y 0,150 M en Na2SO4
suponiendo volmenes aditivos. Ka = 1,26.10-2.
Hidrlisis
23.
Defina hidrlisis.
24.
Qu factores influyen en la hidrlisis y en qu forma?
25.
Explique el mecanismo de hidrlisis (a travs de las ecuaciones
correspondientes) de las siguientes soluciones. Especificar aquellos casos en que no
se produce la reaccin: a) acetato de sodio; b) cloruro de sodio; c) sulfuro de sodio; d)
hidrgeno carbonato de sodio; e) sulfato de sodio; f) cloruro de amonio; g) cloruro de
magnesio; h) acetato de amonio.
26.
Ordenar en forma creciente de pH las siguientes soluciones acuosas ( todas de
igual concentracin): HNO3; NH4Cl; HClO; KOH; KF; KClO; HF; H2SO4; NH4F; NH4NO3;
KNO3. (KNH4OH < KHClO < KHF).
27.
Indicar el medio de las siguientes soluciones justificando con ecuaciones: NaCl,
NH4NO3, NH4NO2, NH4Ac, NH4CN, NH4F, NaHCO3, Na2CO3, Na2S y NaHSO4.
Datos: KNH4OH = 1,8x10-5
KHNO2 = 4,5x10-4
KHAc = 1,8x10-5
KHCN = 4,9x10-10
KHF = 3,5x10-4
K1H2CO3 = 4,3x10-7
2
-11
1
-8
K H2CO3 = 5,61x10
K H2S = 9,1x10
K2H2S = 1,1x10-12
28.
Se prepara una solucin de NaAc (NaCOOCH 3) disolviendo 8,20 g de la sal en
cantidad de agua suficente como pata obtener un volumen final de 1000 mL. Calcular
las concentraciones de todas las especies existentes.
29.
Cmo se produce el proceso de hidrlisis durante la neutralizacin del cido
actico con hidrxido de sodio?Qu variacin de pH se produce?
30.
Cunto cambiara el grado de hidrlisis de una solucin de KCN si una
solucin 0,25 M se diluye hasta una concentracin 0,025 M ?. Ka = 4,9x10 -10.
31.
Calcular el pH antes y despus de cada agregado cuando a 10,0 mL de HAc
0,100 M se le adicionan sucesivamente 3 alcuotas de 5,00 mL de solucin de NaOH
0,100 M.
32.
Explique el fenmeno de la hidrlisis de las soluciones del cloruro de antimonio
y lo que ocurre cuando se agrega cido clorhdrico.
Solubilidad y Kps
33.
Desarrolle los conceptos de solubilidad y de Kps.
34.
Calcular la solubilidad del Mg(OH)2 en: a) agua pura; b) solucin de NaOH
0,0500 M; c) solucin de MgCl2 0,0500 M; d) solucin reguladora pH = 9,00 (Kps Mg(OH)2
= 8,90.10-12).
35.
Se mezclan 50,0 mL de solucin de AgNO3 5,20 10-5 M con 50,0 mL de NaCl
2,40.10-4 M. KpsAgCl = 1,70.10-10. Calcular: a) la concentracin final de todos los iones;
b) la masa de AgCl slido precipitado.
36.
Describir cualitativamente que ocurre si al sistema anterior se lo somete a cada
una de las siguientes operaciones: a) se separa parte del slido; b) se agrega agua; c)
se separa todo el slido; d) despus de c) se hace b); e) se agrega una pizca de AgCl
slido; f) se agrega NaCl; g) se agrega AgNO 3; h) se evapora hasta reducir su volumen
a 50 mL; i) se hace burbujear NH3 gaseoso (Ag+ + 2 NH3 Ag(NH3)2+ ); j) despus de
c) se hace i).
37.
A una solucin de Ca+2 0,100 M y Ba+2 0,100 M se le agrega lentamente
Na2SO4. Los Kps del CaSO4 y BaSO4 son: 2,40x10- 5 y 1,11x10-10 respectivamente.
Contestar las siguientes preguntas suponiendo que el volumen se mantiene constante:
a) cul es la concentracin de SO 4-2 en el instante en que empieza a precipitar el
primer slido? Cul es ese slido?; b) cul ser la concentracin de Ba +2 cuando
42
Gua de Trabajos Prcticos de Qumica General Edicin 2012
empieza a precipitar en segundo slido?; c) es posible separar el Ca +2 y el Ba+2 por
precipitacin selectiva de los sulfatos?
38.
Una solucin contiene iones Zn +2 y Ni+2 ambos en concentracin 0,0200 M. Los
Kps de sus sulfuros valen respectivamente: 1,00.10-22 y 3,00.10-21. Indicar entre qu
lmites habr que ajustar el pH de la solucin de manera que al saturarla con H 2S: a)
precipite slo el ZnS; b) precipiten ambos sulfuros.
K1(H2S) = 1,00x10- 8; K2 (H2S) = 1,00x10-12; [H2S]Solucin saturada = 0,100 M
43
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Electrolitos, pH e Indicadores
TRABAJO PRCTICO
Objetivos: Acotar el valor del pH y de la [H+] de soluciones por medio de indicadores.
Introduccin del concepto de solucin reguladora. Titulacin cido-base: Seleccin de
indicadores segn la fuerza de los electrolitos.
Parte Terica
Se denominan electrolitos las sustancias que conducen la corriente elctrica por
medio de iones. Son llamados conductores de segunda especie, y en ellos el pasaje
de la corriente determina modificaciones de carcter qumico; este proceso se conoce
con el nombre de electrlisis. Por el contrario, en los conductores metlicos o
electrnicos, llamados de primera especie, el pasaje de la corriente elctrica consiste
en un flujo de electrones, sin cambio qumico.
Hay dos grandes grupos de conductores electrolticos: el primero formado por
sustancias puras, por ejemplo sales fundidas y el segundo por disoluciones de sales,
cidos y bases.
Arrhenius fue el primero en observar que los cidos anhidros, como el sulfrico y el
actico glacial no conducen la corriente elctrica. Sin embargo, presentan esta
propiedad cuando se encuentran en solucin acuosa. Este fenmeno se debe a la
formacin de partculas cargadas llamadas iones. De esta manera, al disolverse un
cido en agua ocurre:
AH A- + H+
y si se disuelve una base:
BOH B+ + OHLos cidos al disociarse en agua forman un catin hidrgeno y un ion con carga
negativa (anin), y las bases se disocian en un anin hidroxilo y un ion con carga
positiva (catin). Por lo tanto en trminos de la teora de Arrhenius se considera que
una reaccin cido-base (conocida como reaccin de neutralizacin) se produce
especficamente entre H+ y OH- para formar agua, un anin y un catin, los cuales
forman una sal. En agua:
H+ + Cl- + Na+ + OH- H2O + Na+ + Clcido
base
sal
El mejor conocimiento de la estructura de la materia y de las disoluciones de
electrolitos en disolventes diferentes de agua origin definiciones ms amplias de
cidos y bases. As, Brnsted y Lowry tambin llaman cido a toda sustancia o grupo
atmico capaz de ceder un protn, pero redefinen base como toda sustancia o grupo
atmico capaz de captar un protn.
As, en la siguiente disociacin:
AH A- + H+
AH es un cido (cido conjugado de A -) porque puede ceder un protn y el ion A es una base (la base conjugada de AH) porque puede aceptar un protn.
Lewis ampli estas definiciones llamando cido a toda molcula o grupo atmico
que puede aceptar electrones y base a toda especie qumica que cede electrones.
Esta definicin abarca a otras sustancias (por ejemplo: BF3 es un cido de Lewis y
NH3 es una base de Lewis):
F
B
H N H
puede aceptar electrones
H
puede ceder electrones
44
Gua de Trabajos Prcticos de Qumica General Edicin 2012
El grado con que una sustancia disuelta se disocia en sus iones define su mayor o
menor fuerza como electrolito. Un electrolito fuerte es aqul que se disocia totalmente
o casi totalmente; y un electrolito dbil es aqul que se disocia slo parcialmente. Hay
una serie continua de cidos que va desde los totalmente disociados, como el HCl,
hasta los casi no disociados como el HCN. Un cido puede ser dbil en solucin
concentrada, pero fuerte en disolucin diluida.
CIDOS Y BASES FUERTES
CIDOS
BASES
Completamente disociados en concentraciones menores que 1M
HCl
HBr
HI
HClO4
HNO3
H2SO4
LiOH
NaOH
KOH
RbOH
CsOH
Completamente disociados en concentraciones menores de 0,01 M
HIO3
Sr(OH)2
Ba(OH)2
CIDOS Y BASES DBILES (Ejemplos)
CIDOS
BASES
CH3COOH
H2CO3
H3PO4
NH4OH
Fe(OH)3
Los principios del equilibrio qumico pueden ser aplicados al caso particular de los
equilibrios que consideran especies inicas.
Para un cido:
AH A- + H+
Ka
[H ][ A ]
[HA ]
Para una base:
BOH B+ + OHKb
[B ][OH ]
[BOH]
Ka y Kb son las constantes de disociacin para un cido y una base,
respectivamente.
Para un cido fuerte como el HCl y una base fuerte como el NaOH los valores de
las constantes de equilibrio son nmeros grandes. Consecuentemente, para
soluciones diluidas, la disociacin es prcticamente completa. En las reacciones
escritas a continuacin, esto est simbolizado con la longitud relativa de las flechas:
45
Gua de Trabajos Prcticos de Qumica General Edicin 2012
HCl
NaOH
H+ + Cl-
Ka
102
Na+ + OH-
Kb
102
Para un cido dbil como el actico y una base dbil como el amonaco, las
constantes de equilibrio son pequeas y la disociacin es incompleta:
CH3COOH
CH3COO- + H+
Ka = 1,8 . 10-5
NH3.H2O
NH4+ + OH-
Kb = 1,8 . 10-5
Si un electrolito se disocia en:
A- + B+
AB
su constante de disociacin ser:
K
[ A ][B ]
[ AB]
Esta constante es una medida de la disociacin del electrolito; no obstante existe
otro concepto que habitualmente usamos para cuantificar la disociacin: el grado de
disociacin.
El grado de disociacin de AB es igual a la concentracin de A - o de B+ en moles/L,
(ms estrictamente, los moles de AB disociados por litro) dividido por la concentracin
inicial de AB ([ AB ]0). En este caso:
donde [A-] es la concentracin en el equilibrio de A -, y [AB]o es la concentracin
inicial de AB.
Por la estequiometra de la reaccin, el nmero de moles de AB que se disocia es
igual al nmero de moles de A - o de B+ formado (en este caso particular). Como se ve,
el grado de disociacin representa la fraccin del electrolito disociado en sus iones; si
multiplicamos su valor por 100 obtendremos el porcentaje de disociacin del
electrolito.
Volviendo a los equilibrios en los cuales aparecen los H +, no se puede esperar que
estos mantengan su identidad en solucin. Debido a su pequeo tamao y a su
densidad de carga catinica, atraer a cualquier molcula o ion que tenga un par
electrnico libre; en agua es imposible encontrar protones aislados debido a la alta
densidad electrnica que rodea a los tomos de oxgeno en las molculas de agua.
As, se asocia a la molcula de agua dando el ion hidronio (H3O+)
+
H O H
H B
H O H
H
in hidronio
A su vez el ion hidronio puede hidratarse con ms molculas de agua aunque
habitualmente por comodidad escribiremos H3O+ o simplemente H+.
El agua como electrolito.
46
Gua de Trabajos Prcticos de Qumica General Edicin 2012
El agua es un electrolito dbil. A 20 C la relacin entre las molculas disociadas y
sin disociar es de 1 a 55.10 7. Se puede calcular la molaridad del H2O recordando que
su densidad es 1 g/mL y su peso molecular es 18 g.
18 g H2O _________________ 1 mol de H2O
1000 g H2O __________________ x = 55,5 moles H2O
Estos 55,5 moles estn contenidos en 1000 mL (1 g = 1 mL) entonces la molaridad
del agua es 55,5 M. As se observa que es posible calcular la molaridad para el caso
de un solvente puro.
El agua al disociarse produce iones H+ y OH- :
H2O OH- + H+
o bien
H2O + H2O H3O + + OHLa constante de disociacin se escribe:
K
[H3O ][OH ]
[H2O]
El agua, an siendo qumicamente pura, contiene cantidades mnimas de ambos
iones y es elctricamente neutra, ya que se generan cantidades iguales de H + y OH- :
[H+] = [OH-]
En la disociacin del agua se generan un mol de iones hidrgeno y un mol de iones
oxhidrilo por cada 55.10 7 moles de agua; estos moles representan un volumen cuyo
valor en litros es:
1 mol H2O __________________ 18 mL H2O
7
55.10 moles H2O __________________ X = 1010 mL = 107 l H2O
Luego:
-
[H2O] = 55 mol/litro .
puesto que en 1 litro, el nmero de moles por litro es:
-
Reemplazando los valores hallados se tiene:
que es la constante de disociacin del agua.
En esta expresin el valor 55, o sea la concentracin del agua permanece
prcticamente constante, ya se trate de agua pura o de soluciones diluidas. Por lo
tanto el numerador debe ser tambin una constante:
[H+].[OH-] = 10-14 = Kw
a 25C
o sea que el producto de las concentraciones de los iones del agua es una constante,
llamada producto inico del agua. El agua disociada parcialmente en iones hidrgeno
e hidroxilo pertenece a la categora de las sustancias que pueden actuar como cidos
o como bases, es decir, tiene carcter anftero.
El agua pura representa por convencin el medio de reaccin neutro (ntese que
en este caso el trmino neutro tiene un significado distinto que al hablar de
neutralidad elctrica), por lo tanto la neutralidad puede caracterizarse en trminos de
los valores de las concentraciones de H+ y de OH-. Es indistinto elegir las
concentraciones de uno u otro ion, porque ambas estn ligadas a la constante del
47
Gua de Trabajos Prcticos de Qumica General Edicin 2012
producto inico del agua. De acuerdo a ello se dice que un medio es neutro cuando
[H+] = [OH-] = 10-7. Podemos hablar entonces de soluciones cidas, neutras y bsicas,
dependiendo de las concentraciones relativas de H + y OH- en solucin, y si tenemos
en cuenta que el medio neutro est representado por el agua pura, y que adems en
ella [H+] = [OH-] = 10-7 M, entonces se cumple que:
en una solucin cida [H+] > [OH-] y [H+] > 10-7 M
en una solucin neutra [H+] = [OH-] = 10-7
en una solucin bsica [H+] < [OH-] y [H+] < 10-7 M
Las soluciones cidas se obtienen disolviendo sustancias que aportan H+ al medio
(o, lo que es equivalente, consuman OH -); en este caso la concentracin de protones
ser mayor que en el agua pura:
[H+] > 10-7 M
[OH-] < 10-7 M
Las soluciones alcalinas se obtienen disolviendo sustancias que aportan OH- al
medio (o que consuman H+); en este caso la concentracin de oxhidrilos ser mayor
que en el agua pura:
[H+] < 10-7 M
[OH-] > 10-7 M
Teniendo en cuenta Kw, una vez que se fija una concentracin de H + se puede
determinar la concentracin de OH-. Por lo tanto se suele establecer la acidez de los
medios acuosos, segn la concentracin de H +.
Resulta ms prctico, para trabajar con nmeros sencillos, definir pH como el
logaritmo decimal de la inversa de la concentracin:
por ejemplo:
[H+] = 10- 4
[H+] = 10- 7
[H+] = 10- 9
pH = 4
pH = 7
pH = 9
Por lo tanto, el pH de las soluciones cidas ([H+] > 10- 7 M), ser menor que 7, y el
pH de las soluciones alcalinas ([H+] < 10- 7 M) ser mayor que 7.
En el siguiente cuadro resumiremos las caractersticas de los medios cido, bsico
y neutro:
cido
Bsico
Neutro
[H+]
> 10- 7
< 10- 7
10- 7
[OH-]
< 10- 7
> 10- 7
10- 7
pH
<7
>7
7
pOH
>7
<7
7
Indicadores.
Los indicadores son sustancias que permiten reconocer si un medio es cido o
alcalino (nos referiremos aqu slo a los indicadores cido-base, aunque existen otros
indicadores sensibles a otras caractersticas del medio), por medio de coloraciones
que adquieren al ser agregados a las soluciones. Tienen la propiedad de presentar
formas estructurales o inicas de distinto color, segn la reaccin del medio. Los
indicadores se utilizan en soluciones con concentracin del orden del 0,05 % a 0,1 % y
se agregan algunas gotas a la solucin.
Una teora que interpreta el comportamiento de los indicadores parte de la base de
que se trata de sustancias cidas o alcalinas del tipo de los electrolitos dbiles a las
cuales corresponden colores distintos si se presentan en su forma ionizada o en su
forma molecular.
48
Gua de Trabajos Prcticos de Qumica General Edicin 2012
(1) Indicador de naturaleza cida
HIn
In- + H+
forma inica
forma molecular
(Color 1)
(2) Indicador de naturaleza bsica
In OH
(Color 2)
OH- + In +
forma molecular
forma inica
(Color 1)
(Color 2)
Para el primer indicador deber cumplirse (a una temperatura determinada) la
siguiente relacin:
K
[In ][H ]
[HIn]
K
[H ]
[In ]
[HIn]
Puede observarse que, para un indicador determinado, la relacin entre las
concentraciones de las dos formas en las que se puede encontrar el mismo depende
de la concentracin de H+. El color que adopte el indicador en la solucin depender
del predominio de la forma inica o molecular del mismo.
Tomemos por ejemplo el primer indicador. Si se agregan unas gotas de ste a una
solucin cida, por haber una alta concentracin de protones, la reaccin (1) estar
fuertemente desplazada hacia la izquierda y se ver el color 1 correspondiente a la
especie no disociada. En cambio, si el agregado se hace a una solucin alcalina, la
reaccin se desplazar hacia la derecha y se ver el color 2.
Para que el color de una forma domine sobre el color de la otra, la concentracin
de dicha especie deber ser por lo menos 10 veces superior a la de la otra especie, es
decir:
Si aplicamos la funcin p (- log) a ambos miembros de las expresiones anteriores,
queda:
pK > pH - log (1/10)
pH < pK - 1
(predomina el color 1)
pK < pH - log (10/1)
pH > pK + 1
(predomina el color 2)
donde pK es -log K.
Se puede ver que el pH al que predomina una especie sobre la otra depende de la
constante de disociacin del indicador, y por lo tanto de su naturaleza. Por ejemplo,
para un indicador cuya K = 10 -4, el color 1 predomina para pH < 4 - 1 y el color 2
predomina para pH > 4 + 1. Decimos entonces que el rango de viraje del indicador es
3 - 5 (color 1 - color 2). De este modo, unas gotas de este indicador impartir el color 1
a todas las soluciones cuyos pH sean menores e iguales que 3 e impartir el color 2 a
las soluciones con pH mayor o igual a 5. Por otro lado, al agregar el indicador a
soluciones con pH comprendido entre 3 y 5, ninguna de las dos especies estar 10
veces ms concentrada que la otra, y por lo tanto el color que el indicador comunica a
la solucin es intermedio entre el color 1 y el color 2.
49
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Para diferentes indicadores, esta zona de viraje es distinta ya que depende del
valor de la constante de equilibrio, la cual es propia de cada indicador.
A continuacin se presentan las caractersticas de algunos de los indicadores
cido-base ms comunes.
Indicador
Azul de timol
Naturaleza
cido
Heliantina
Rojo de metilo
Fenolftaleina
Amarillo de Alizarina
bsico
bsico
cido
cido
Zona de Viraje
1,2 - 2,8
8,0 - 9,6
3,1 - 4,4
4,2 - 6,3
8,2 - 10,0
10,1 - 12,1
Colores
rojo-amarillo
amarillo-azul
rojo-amarillo
rojo-amarillo
incoloro-rosa
amarillo-violeta
Soluciones reguladoras
Cuando es necesario mantener el pH constante durante el curso de una reaccin
que produce o consume protones, se utilizan las llamadas soluciones reguladoras o
soluciones buffer. Son soluciones bastante concentradas de un cido dbil y su base
conjugada (sal del anin) o de una base dbil y su cido conjugado (sal del catin
correspondiente).
Si en la reaccin se producen protones, reaccionan con la base conjugada para
formar ms cido, pero si se consumen protones, el cido dbil se disocia para dar
ms protones. Es decir, el fundamento en el funcionamiento de una solucin
reguladora est dado por el principio de Le Chatelier.
En una solucin que contenga un cido dbil AH, la constante de disociacin es:
[H ][ A ]
[HA ]
Ka
K a [H ]
[HA ]
[A ]
Si consideramos una mezcla de un cido dbil y la sal, la sal es un electrolito
fuerte, la concentracin del anin es prcticamente igual a la concentracin de la sal
(Cs). La sal hace disminuir la disociacin de AH porque provee de un in comn
(recurdese el principio de Le Chatelier). En la generalidad de los casos puede
considerarse que todo el cido est presente en la forma molecular (C a =
concentracin del cido).
C
[H ] K a a
Cs
Curvas de neutralizacin.
Una solucin diluida de un cido fuerte se puede considerar como completamente
disociada y la concentracin de iones hidrgeno ser igual a la concentracin del cido
no neutralizado.
A medida que se agregue una base durante una titulacin cido-base, la
concentracin de H+ ir disminuyendo y el pH aumentando. En la figura 1 se muestra
cmo vara el pH (en ordenadas) con el agregado de una base (abcisa en mL de
NaOH 0,1 N) cuando se parte de un cido fuerte o de un cido dbil. Las curvas se
denominan curvas de neutralizacin y las mostradas en la figura 1 fueron calculadas
para la titulacin de 10 mL de solucin de HCl 0,1 N o de cido actico 0,1 N, con
solucin de NaOH 0,1 N.
Se ve en la figura que se producen saltos importantes de pH cuando el agregado
de base es exactamente equivalente al contenido original de cido (punto de
equivalencia). Este salto se produce desde un valor de pH francamente cido en el
caso de un cido fuerte (y algo superior en el caso de uno dbil) hasta un pH
francamente alcalino (8, 9 10). De este modo, para visualizar el punto de
equivalencia debe utilizarse un indicador que vire dentro de esos lmites de pH.
50
Gua de Trabajos Prcticos de Qumica General Edicin 2012
14
12
HCl 0,1 N
HAc 0,1 N
10
Fenolftalena
pH
Heliantina
0
0
10
15
20
mL NaOH 0,1 N
Figura 1
14
HCl 0,1 N vs NaOH 0,1 N
12
HCl 0,01 N vs NaOH 0,01 N
HCl 0,001 N vs NaOH 0,001 N
10
pH
0
0
10
15
20
mL NaOH
Figura 2
51
Gua de Trabajos Prcticos de Qumica General Edicin 2012
En la figura 1 tambin se indica el rango de viraje de dos indicadores comunes:
heliantina (3,1 - 4,4) y fenolftalena (8,2 - 10,0). Puede observarse que ambos seran
adecuados para la titulacin de un cido fuerte 0,1 N con una base fuerte 0,1 N, pero
slo la fenolftalena sera adecuada para la titulacin de cido actico 0,1 N con NaOH
0,1 N.
Como muestra la figura 2, a medida que las soluciones usadas son menos
concentradas ser necesario usar indicadores en un rango ms estrecho de pH,
debido a que el salto en el punto de equivalencia no es tan pronunciado.
Cuando se calcula la concentracin de H+ en cualquier punto de la titulacin de un
cido fuerte con base fuerte deber considerarse:
a) la reaccin de neutralizacin
b) la dilucin que resulta por el aumento del volumen de la solucin.
En cambio, cuando se titula un cido dbil con base fuerte, el clculo es ms
complicado debido a que:
1) el cido est dbilmente disociado
2) la sal formada durante la neutralizacin retrograda la disociacin del cido
(formacin de una solucin reguladora que implica una zona prcticamente horizontal
en la curva de variacin del pH con el agregado de base).
3) la solucin de la sal no es neutra a causa de la hidrlisis (el punto de
equivalencia no coincide, como en el caso anterior con el pH = 7, sino que es
ligeramente ms alcalino; esto se discutir con algn detalle en el trabajo prctico de
hidrlisis).
Hay ecuaciones que permiten el clculo del pH en cada instante de la titulacin,
y que tienen en cuenta los factores anteriores.
En el caso del cido actico - hidrxido de sodio (cuya curva de titulacin se
mostr en la figura 1) se ve que el pH es levemente alcalino en el punto de
equivalencia. Si se usara anaranjado de metilo (heliantina) solamente un 30 % del
cido estara neutralizado al producirse el viraje; en cambio, indicadores como la
fenolftalena y el azul de timol son adecuados ya que su rango de viraje es ms
alcalino. Cualquier indicador que cambie por debajo de pH = 8 no sera satisfactorio
por dos razones:
-el color cambiara antes del punto de equivalencia.
-el cambio no sera brusco debido a la variacin relativamente gradual del pH
antes de ese valor.
Parte Experimental
Material a emplear:
Tubos de ensayos, buretas, soluciones de distintos indicadores, solucin valorada
de NaOH, soluciones a valorar de HAc (cido actico) y HCl, soluciones de HCl,
NaOH, NH3 y HAc cuyo pH debe determinarse.
Modo operatorio:
1) Determinacin del pH aproximado de distintas soluciones utilizando indicadores
cido-base
Para cada una de las soluciones cuyo rango de pH se pretende determinar se
realizar lo siguiente:
1- Se tomarn seis tubos de ensayo y en cada uno se colocarn aproximadamente
2 mL de la solucin de pH desconocido. A cada uno de los tubos se agrega 2 3
gotas de un indicador distinto (el tubo A contiene el indicador A, el tubo B contiene el
indicador B, etc.).
2- De acuerdo al color que toma cada uno de los indicadores, se tratar de acotar
el valor de pH de la solucin.
52
Gua de Trabajos Prcticos de Qumica General Edicin 2012
3- Preguntando al ayudante qu cidos y bases forman parte de cada solucin, se
tratar de acotar la concentracin de stas a partir de los valores de pH.
NOTA: Si se contase con papel indicador (un tipo de papel impregnado de una mezcla
de diferentes indicadores que puede dar diferentes colores en un amplio rango de pH),
se lo utilizar para verificar el pH acotado para las soluciones.
2) Titulacin de un cido dbil y de un cido fuerte con una base fuerte y utilizando
diferentes indicadores
1- Lavar en forma sucesiva la bureta con agua, agua destilada y la solucin de
NaOH valorada. Llenar la bureta y enrasarla con la solucin de NaOH. Usar papel de
filtro para secar la bureta exteriormente. Controlar que no pierda.
2- Lavar con agua y agua destilada un erlenmeyer y colocar en el mismo 10,00 mL
(medidos con pipeta de doble aforo) de la solucin a valorar de HCl. Aadir unas gotas
de fenolftalena y aproximadamente 50 mL de agua destilada. Agregar gota a gota
desde la bureta la solucin de NaOH, agitando permanentemente, hasta viraje del
indicador (leve tonalidad rosada-violeta persistente durante 30 segundos).
3- Proceder igual que en 2- pero utilizando heliantina en lugar de fenolftalena
como indicador. En este caso la titulacin se dar por concluida cuando la solucin
adquiera una tonalidad naranja (se contar con un patrn para la comparacin de
colores). Comparar los gastos de la solucin de NaOH. Calcular la concentracin de
cido.
4- Proceder como en 2- y 3- pero utilizando 10,0 mL de solucin de HAc a valorar
en lugar de la solucin de HCl. Comparar los gastos de la solucin de NaOH. Calcular
la concentracin de cido.Realizar las operaciones por duplicado.
3) Determinacin de la constante de disociacin de un cido dbil
1- Se prepara una serie de soluciones en funcin de contar con una escala de pH.
Para ello, se realizarn las siguientes mezclas utilizando sendas buretas:
Ac. Actico (0,1 M)/mL NaOH (0,1M)/mL
9,80
0,20
9,70
0,30
9,60
0,40
9,40
0,60
9,10
0,90
8,70
1,30
8,20
1,80
7,70
2,30
7,10
2,90
6,60
3,40
6,10
3,90
pH
3,0
3,2
3,4
3,6
3,8
4,0
4,2
4,4
4,6
4,8
5,0
Colocar alrededor de 5 mL de cada una de las soluciones en sendos tubos. A cada
tubo se le agrega 3 gotas de heliantina.
2- Se prepararn soluciones de cido cetico de distinta concentracin. Para ello,
inicialmente se toman 1,43 mL de c. actico glacial (99 - 100 %, 1,05 kg/L) y se llevan
a 250,0 mL con agua destilada en un matraz aforado. Esto dar una solucin
aproximadamente 0,1 M.
De esta solucin se hace una dilucin 1/10 (10,00 mL llevados a 100,0 mL) para
obtener una solucin de concentracin 0,01 M. De esta ltima solucin se hace
nuevamente una dilucin 1/10 para obtener otra solucin 0,001 M.
53
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Se toman 5 mL de las soluciones 0,01 M y 0,001 M en sendos tubos de ensayo y
se les agrega 3 gotas de heliantina a cada tubo. Se compara el color de las soluciones
de cido actico con la escala de pH. Se determina por observacin directa el pH de
las soluciones problema.
Con los valores de pH as obtenidos se calculan las concentraciones de H + de cada
solucin. A partir de la [H+] y la concentracin del cido actico se calcula la constante
de equilibrio (ecuaciones 1, 2 y 3).
donde [HAc]0 es la concentracin analtica del cido actico.
Con los valores de [HAc]0 y [H+] se puede calcular el grado de disociacin () de
cada solucin:
Se podra comparar los grados de disociacin obtenidos con los calculados
tericamente.
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Calcule el pH que tendr el sistema de partida en la titulacin de 10,00 mL de
solucin de HCl 0,100 M si son agregados 50,0 mL de agua destilada al
erlenmeyer. Idem para la titulacin de 10,00 mL de solucin de HF 0,100 M.
(KHF=1,7x10-4) al agregar la misma cantidad de agua.
2. Calcule el volumen de solucin de NaOH 0,085 M necesario para titular cada uno
de los sistemas anteriores.
3. Calcule el pH en el punto de equivalencia en cada caso (si es necesario espere
hasta el prctico de hidrlisis para resolver este punto).
4. Por qu puede agregar agua destilada al frasco erlenmeyer durante una
titulacin? Para qu lo hace? Altera el punto de equivalencia?
5. Calcule el pH si se agregaron 0,50 mL menos que los necesarios para alcanzar el
punto de equivalencia en cada caso.
6. Calcule el pH si se agreg solo la mitad del volumen necesario para neutralizar el
cido en cada caso.
7. Calcule el pH si se agreg 1 mL ms que el necesario para alcanzar el punto de
equivalencia en cada caso.
8. Calcule el pH de 20,0 mL de HCl 0,200 M cuando se agrega porciones sucesivas
de 5,00 mL cada una de una solucin de NaOH 0,200 M hasta haber agregado
25,0 mL de esta ltima.
54
Gua de Trabajos Prcticos de Qumica General Edicin 2012
9. Calcule el pH de 20,0 mL de HAc 0,200 M cuando se agrega porciones sucesivas
de 5,00 mL cada una de una solucin de NaOH 0,200 M hasta haber agregado
25,0 mL de esta ltima. KAcH = 1,8x10-5.
10. Cmo sern los volmenes gastados (igual, mayor, mucho mayor, etc), respecto
al punto de equivalencia, en las titulaciones de cierta solucin de HCl con una
determinada solucin de NaOH si se usaron los siguientes indicadores:
fenolftalena (8,2-10); azul de timol 1 (1,2-2,1); heliantina (3,4-4,2);
amarillo de alizarina (10,6-12,1); azul de timol (8-9,6)
11. Idem en la titulacin de una solucin de HF.
12. Por qu no deben agregarse demasiadas gotas de indicador durante una
titulacin?
13. Se pretende titular una solucin de NaOH de concentracin aproximada a 0,1 M.
Cul/es de las siguientes soluciones utilizara: HCl 6,0 N, HAc 0,12 N, H2SO4 1,0
N, HNO3 0,080 N? Qu indicadores podra utilizar (indique al menos dos)?
14. Indique el intervalo en el cual se encontrar el pH de una solucin que toma color
amarillo con azul de timol, incoloro con fenolftalena, y azul con azul de
bromotimol. Consulte los intervalos de viraje y los colores que toma cada indicador.
15. Suponiendo que la fenolftalena y la heliantina pueden tratarse como indicadores
de naturaleza cida, cul es ms fuerte como cido? Justifique.
16. Calcule el valor aproximado de la cte. de disociacin de un indicador cido cuyo
rango de viraje es 3-4,6.
17. Se pretende decidir si una solucin contiene HCl, KOH o KCl agregando una gota
de algn indicador. Cul podra utilizar?
55
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Hidrlisis
TRABAJO PRCTICO
Objetivo: Adquirir el concepto de hidrlisis y analizar los distintos casos que se
plantean. Estudiar los factores que modifican el equilibrio de hidrlisis y su influencia
sobre el mismo.
Parte Terica
Las soluciones acuosas de sustancias como las sales nos enfrentan con una
situacin distinta a la estudiada en el caso de soluciones de cidos y bases
(hidrxidos). Dado que las sales al disociarse no generan ni protones ni oxhidrilos
(exceptuamos por ahora a las sales hidrogenadas y a las bsicas), podra esperarse
que las soluciones acuosas de las mismas fueran neutras. Sin embargo, las
soluciones de carbonato y las soluciones de cianuro son bsicas, mientras que las
sales frricas son cidas. Esto implica que algn otro proceso que tiene lugar en
solucin acuosa es el responsable del carcter final del sistema.
Cuando se disuelve una sal en agua se produce una disociacin inica de ella y las
propiedades qumicas de la solucin sern las de todos los iones presentes. Por
tratarse de soluciones acuosas, al decir todos los iones estamos incluyendo a los H+
y OH- producidos por la disociacin inica del agua:
H2O
H+ + HO-
Para comprender esto, recordemos que en una solucin de un cido dbil como el
cido actico (HAc), el equilibrio que tiene lugar es:
HAc
H+ + Ac-
Esto implica que una solucin que inicialmente contiene HAc, al alcanzar el
equilibrio tendr tambin iones H+ y Ac-. Pero adems, si tenemos una solucin con H+
y Ac- tambin se alcanzar un estado de equilibrio en el cual deber existir el HAc. Es
decir que si se agrega una sal que contenga iones Ac - a agua, stos podrn reaccionar
con los H+ presentes de modo de cumplir el equilibrio correspondiente.
Esto puede extenderse a cualquier anin o catin. En el caso de provenir de un
cido o de un hidrxido fuerte, la asociacin no tendr lugar en forma apreciable.
Haremos ahora el anlisis de lo que ocurre cuando disolvemos, por ejemplo, NaAc
en agua. El Na+ proviene de un hidrxido fuerte y por ende no sufrir asociacin en
agua; en cambio el Ac-:
Ac- + H+
HAc
Pero tambin ocurre que:
H2O
H+ + HO-
Combinando ambos equilibrios obtenemos la reaccin neta denominada reaccin
de hidrlisis:
Ac- + H2O
HAc + HO-
que es fsicamente ms factible que la simple asociacin (resulta ms probable el
encuentro de Ac- y H2O que de Ac- y H+).
Este proceso, mediante el cual un anin (o un catin) que proviene de un cido (o
una base) dbil se combina con el agua para dar el electrolito dbil, en este caso HAc,
56
Gua de Trabajos Prcticos de Qumica General Edicin 2012
se denomina hidrlisis (del griego ruptura del agua). La constante de equilibrio
asociada al proceso, Kh, se denomina constante de hidrlisis.
Constante de hidrlisis.
Consideremos la hidrlisis del cianuro de sodio:
NaCN
Na+ + CN-
CN- + H+
HCN
H2O
H+ + OH-
Al ion cianuro se lo denomina base conjugada del cido cianhdrico, porque este
ion puede convertirse en cido tomando un H + (en este caso del H2O). De manera
similar el cido cianhdrico se denomina el cido conjugado del ion cianuro; sumando
las dos ltimas ecuaciones se obtiene la reaccin neta de hidrlisis:
CN- + H2O
HCN + OH-
La constante de equilibrio correspondiente es:
Kh
[HCN][ OH ]
[CN ]
La constante Kh se denomina constante de hidrlisis y es funcin de la
temperatura. Esta constante de hidrlisis puede obtenerse relacionando dos
constantes, Kw de la disociacin inica del agua y la constante de disociacin del cido
cianhdrico.
Kw
[H ][OH ]
Ka
[H ][CN ]
[HCN]
Kh
Kw
Ka
[HCN][OH ]
[CN ]
As, cuando se hidroliza un anin, puede comprobarse que: Kh = Kw / Ka
donde Ka es la constante de disociacin del cido del cual proviene el anin.
Cuando se hidroliza un catin (comprubelo Ud. mismo): Kh = Kw / Kb
donde Kb es la constante de disociacin del hidrxido del cual proviene el catin.
A la luz de estas ecuaciones puede observarse que la hidrlisis ser mayor cuanto
ms dbil (menor valor para K a o Kb) fuere el electrolito del cual proviene la especie
que se est hidrolizando.
Hemos visto que la hidrlisis de aniones produce OH -, de modo que el medio en
este caso ser bsico. En cambio, en la hidrlisis de cationes se producen protones,
generando un medio cido. Como ejemplo veamos la hidrlisis del NH4+:
NH4+ + H2O
NH4OH + H+
57
Gua de Trabajos Prcticos de Qumica General Edicin 2012
De acuerdo a la composicin de las sales, tendremos cuatro casos distintos:
1) Sal con catin proveniente de un hidrxido fuerte y un anin proveniente de un
cido fuerte. En este caso no habr hidrlisis y el medio ser neutro ya que slo queda
el equilibrio:
H2O
H+ + OH-
Ejemplos: KNO3, NaCl, Na2SO4.
2) Sal con catin proveniente de un hidrxido dbil y un anin proveniente de un
cido fuerte. En este caso se hidroliza el catin y el medio ser cido. Ejemplo: NH 4Cl.
El proceso que justifica el medio es:
NH4+ + H2O
NH4OH + H+
3) Sal con catin proveniente de un hidrxido fuerte y un anin proveniente de un
cido dbil. En este caso se hidroliza el anin y el medio ser alcalino. Ejemplo: NaAc.
El proceso es:
Ac- + H2O
HAc + OH-
4) Sal con catin proveniente de un hidrxido dbil y un anin proveniente de un
cido dbil. En este caso se hidrolizarn ambos y no puede generalizarse respecto del
medio que presentar la solucin. Es necesario aqu saber cul de los dos procesos
de hidrlisis est ms desplazado hacia la derecha. Como las concentraciones de
anin y catin son iguales (nos referimos al caso de sales de un solo catin y un solo
anin) es suficiente con analizar los valores relativos de las constantes de hidrlisis del
catin y del anin. Es evidente que se presentarn tres situaciones:
i) Khanin < Khcatin . Esto implica que Ka > Kb y en este caso el medio ser cido ya
que se hidrolizar ms el catin. Ejemplo: NH4NO2.
ii) Khanin > Khcatin . Esto implica que Ka < Kb y en este caso el medio ser bsico ya
que se hidrolizar ms el anin. Ejemplo: NH4CN.
iii) Khanin = Khcatin . Esto implica que Ka = Kb y en este caso el medio ser neutro ya
que ambos se hidrolizarn en igual medida. Ejemplo: NH 4Ac.
5) Sales de cidos poliprticos. Por ejemplo las hidrlisis del carbonato de sodio y
del bicarbonato de sodio se pueden representar por las ecuaciones de equilibrio
siguientes:
Na2CO3
2 Na+ + CO32-
H2O
H+ + OH-
CO32- + H+
HCO3-
NaHCO3
Na+ + HCO3-
H2O
H+ + OH-
HCO3- + H+
H2CO3
58
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Segn las ecuaciones anteriores se ve claramente que la hidrlisis de estas sales
genera la formacin de H2CO3 y HCO3-. Cuanto ms pronunciada es la hidrlisis,
mayores sern las cantidades que se forman de estos cidos. Puesto que la constante
de disociacin del HCO3- (Ka2: 5,61 10-11) es mucho ms pequea que la del H 2CO3
(Ka1: 4,30 10-7), se deduce que la primera reaccin de hidrlisis proceder en mayor
extensin que la segunda. Como consecuencia la solucin de carbonato de sodio ser
ms alcalina que la de bicarbonato.
Grado de hidrlisis.
Se llama grado de hidrlisis a la fraccin de iones del electrolito dbil que pasa a la
forma no disociada, o sea la fraccin de sal que se ha hidrolizado.
Si se considera la reaccin neta de hidrlisis de una solucin de Na 2CO3 se tiene:
CO32- + H2O
HCO3- + OH-
Si se partiera de una solucin 0,1 M de Na 2CO3 y la reaccin de hidrlisis fuera
completa, la concentracin de OH- sera 0,1 M y el grado de hidrlisis 0,1 / 0,1 = 1.
La concentracin de OH- determinada experimentalmente en la solucin es 0,004
M, por tanto el grado de hidrlisis es: 0,004 / 0,1 = 0,04 o 4%.
Factores que favorecen la hidrlisis.
a) La hidrlisis es ms intensa cuanto ms bajo sea el valor de la constante de
disociacin del cido o base formados, al disminuir Ka o Kb, aumenta Kh.
b) La hidrlisis se ve favorecida si uno de los productos es voltil o insoluble.
Ejemplos:
-hidrlisis de bicarbonato de potasio, con formacin de un producto gaseoso (CO 2):
KHCO3
HCO3- + K+
HCO3- + H2O
H2CO3 + OH-
H2CO3
CO2(g) + H2O
lo mismo ocurre en la hidrlisis del sulfuro de sodio por eliminacin del gas H 2S.
-hidrlisis de cloruro de magnesio con formacin de un producto insoluble
(Mg(OH)2):
MgCl2 + 2 H2O
Mg(OH)2(s) + 2 Cl- + 2 H+
c) El aumento de la temperatura favorece la hidrlisis, Kh aumenta con el aumento
de T, ya que Kw y Ka aumentan con la temperatura pero K w aumenta ms rpidamente
con T. Por ejemplo: Si se calienta una solucin de sales frricas es probable que
precipite Fe(OH)3 .
d) Se favorece la hidrlisis eliminando del medio los iones H+ u OH- generados por
la reaccin. Ej.: el brax en medio cido produce mayor cantidad de cido brico, ya
que se consumen los OH- producidos en la hidrlisis.
B4O72- + 7 H2O
4 H3BO3 + 2 OH-
59
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Adicionando H+ (HCl) se eliminan los OH- como agua, desplazando el equilibrio
hacia la derecha.
e) La dilucin favorece la hidrlisis, pues al producirse la disminucin de la
concentracin del sistema, el equilibrio se desplazar hacia la formacin de productos
a los fines de aumentar el nmero de moles.
Factores que retrogradan la hidrlisis
Por agregado de exceso de uno de los productos de la hidrlisis. Por ej.: podr
concentrarse una solucin de sulfato de amonio sin prdida de amonaco por
agregado de cido sulfrico.
(NH4)2SO4 + 2 H2O
2 H+ + SO42- + 2 NH4OH
Parte Experimental
Material necesario
a)
Reactivos
slidos:
NaHSO4;
(NH4)2SO4; NaHCO3.
b) Soluciones: NH4Cl 1 M; NaAc 1 M;
NH4Ac 1 M; Na2CO3 1 M; FeCl3 0,1 M; SbCl3
0,1 M; H2SO4 conc.; HCl conc. ; H2O
destilada; solucin saturada de brax
(Na2B4O710 H2O).
c) Soluciones de distintos indicadores.
d) Termmetro.
e) Material de vidrio: erlenmeyers, vaso
de precipitado de 100 mL, tubos de ensayo,
probeta de 100 mL, pipeta graduada de 10
mL,
varilla
de
vidrio,
tubo
de
desprendimiento.
f) Material de hierro: mechero de Bunsen, tela metlica, aro con nuez, trpode.
g) Se muestra a la derecha el esquema del aparato:
Modo operatorio
1) Estimacin del pH aproximado de diferentes soluciones utilizando indicadores
En tubos de ensayo colocar aproximadamente 1 mL de las soluciones que se
indican a continuacin y acotar su pH mediante el uso de las soluciones de
indicadores, agregando una o dos gotas de las mismas. Las soluciones a usar son:
NaAc 1 M, NH4Cl 1 M, Na2CO3 1 M y NaHCO3 (prepararla en el momento a partir del
reactivo slido).
2) Influencia de la temperatura sobre la hidrlisis
En tres tubos de ensayo colocar 5 mL de la solucin 0,1 M de FeCl3 y calentar
durante 5 minutos a 30, 60 y 100C, respectivamente. Observar.
3) Hidrlisis del brax
Preparar una solucin saturada de brax. Tomar una alcuota y ensayar el pH de la
misma, utilizando los distintos indicadores.
Por otra parte, tomar 2-3 mL de la solucin saturada y agregarle 2-3 mL de
H2SO4 concentrado (con cuidado!). Enfriar bajo canilla y observar.
4) Hidrlisis y retrogradacin de la hidrlisis del sulfato de amonio
60
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Disponer del aparato que figura en el esquema. Colocar en el erlenmeyer 2 g de
(NH4)2SO4 y 30 mL de H2O destilada. Agregar 4-5 gotas de solucin de verde de
bromocresol en el elenmeyer y de azul de bromotimol en el tubo de ensayo. Calentar a
ebullicin suave durante algunos minutos. Retirar el vaso y luego el mechero.
Comprobar la reaccin de las soluciones contenidas en ambos recipientes. Repetir la
experiencia, pero agregando al erlenmeyer 30 mL de H2SO4 diluido, en lugar de H2O
destilada. Observar e interpretar.
5) Hidrlisis del cloruro de antimonio(III)
En un tubo de ensayo colocar 1 mL de la solucin de SbCl3 y adicionarle H2O
destilada gota a gota hasta la formacin de precipitado o turbiedad. Cuando la
reaccin es evidente agregar poco a poco H2O destilada (observar e interpretar).
Adicionar, luego, gota a gota, solucin de HCl concentrado. Diluir nuevamente con
ms H2O.
6) Determinacin del pH de soluciones de sales hidrogenadas (hidrgeno sulfato
de sodio e hidrgeno carbonato de sodio)
En un tubo de ensayo disolver un pequeo cristal de NaHSO 4 en H2O destilada.
Dividir el contenido en 3 tubos y estimar el pH agregando una o dos gotas de las
soluciones de 3 indicadores que crea conveniente (tenga en cuenta los rangos de
viraje de los mismos).
Realizar el mismo procedimiento para NaHCO 3.
Expresin de resultados
Ensayo 1: consignar los resultados en una tabla segn,
Solucin
Ecuacin
pH (cido, neutro o bsico)
Escribir las reacciones de hidrlisis del FeCl 3 e indicar la influencia de la
temperatura.
Para el resto de los ensayos escribir las reacciones correspondientes e
interpretar.
Detalles prcticos: La limpieza cuidadosa del material y el uso de las cantidades de
los reactivos indicadas son indispensables para el correcto desarrollo del trabajo
prctico.
PROBLEMAS ADICIONALES
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Indique el/los procesos que tiene lugar en una solucin de NaAc. Qu especies
estn presentes en la solucin?
2. Por qu las soluciones de KCN se preparan en medio alcalino?
3. Recordando que el Fe(OH)3 no es muy soluble, cmo preparara una solucin de
FeCl3?
4. Escriba el equilibrio que tiene lugar en una solucin de KNO 2. Indique y justifique
qu ocurrir con el equilibrio, con la constante y con el pH cuando: a) se agrega
agua b) se agrega KOH c) se agrega HCl d) se agrega ms sal e) se enfra el
sistema f) se agrega HNO2
5. Cmo justifica la diferencia de pH entre una solucin de Na 2CO3 y una de
NaHCO3?
61
Gua de Trabajos Prcticos de Qumica General Edicin 2012
6. Cules son los equilibrios que tienen lugar en una solucin de NaHSO 4 y en una
de NaHCO3? Cul es el ms importante en cada caso? (tenga en cuenta el pH
cualitativo determinado en la prctica)
7. Repita la pregunta para el caso de soluciones de Na 3PO4, Na2HPO4, NaH2PO4 y
H3PO4. Tenga presente que las constantes de disociacin del H 3PO4 son 10-3,
10-8 y 10-13.
8. Cul es el pH que se espera para una solucin de NaF 0,15 M? K HF=1,7x10-4
62
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Equilibrios Heterogneos
TEORA-SEMINARIO
1. En un diagrama de fases para el agua predecir qu suceder cuando el agua a
10C y a 20 torr:
a) se la expande isotrmicamente hasta 5 torr.
b) se la comprime isotrmicamente hasta 25 torr.
c) se la enfra isobricamente hasta -5C.
d) se la calienta isobricamente hasta 18 oC.
Pv (H2O) a 10C: 9,2 torr; Pv (H2O) a 18C: 15,5 torr; Tf (hielo, 20 torr): 0C
2. Describir la regla de las fases. Aplicacin a los siguientes sistemas para determinar
el nmero de grados de libertad:
a) agua lquida.
b) agua lquida y vapor en equilibrio.
c) agua lquida y vapor en equilibrio a presin de 1 atm.
d) agua slida, agua lquida y vapor en equilibrio.
f) I2 repartido en agua y CCl4.
g) azufre rmbico, monoclnico y vapor.
3. Discutir los diagramas presin de vapor y temperatura de ebullicin versus
composicin para soluciones lquidas de dos componentes solubles
- ideales.
- con pequeas desviaciones.
- con formacin de azetropos.
Breve discusin sobre el caso de componentes no solubles.
Discusin del caso de la presin de vapor del componente en los dos extremos
posibles de composicin de la solucin: i) xa
1 (aproximacin asinttica a la ley de
Raoult); ii) xa
0 (ley de Henry). Aplicacin de la ley de Henry a las solubilidades de
gases en lquidos.
4. A 25C se recoge gas O2 sobre agua a una presin total de 1 atm. Si la solubilidad
del O2 en agua es de 0,0393 g/L, cul ser la solubilidad cuando la presin parcial de
O2 sea de 800 torr? Pv(agua) (25C) = 23,756 torr
5. Procesos de destilacin simple y fraccionada. Uso de los grficos anteriores.
Aplicacin al trabajo prctico.
6. Discusin sobre el equilibrio de reparto de un soluto entre dos lquidos no miscibles.
Aplicacin al trabajo prctico. Discusin de casos de asociacin o disociacin del
soluto en alguna de las fases.
7. Cmo se enuncia la ley de reparto o distribucin?
8. De qu depende el valor del coeficiente de reparto?
9. Qu condicin debe reunir el soluto para que cumpla con la ley de reparto?
10. Qu aplicaciones tiene el estudio del reparto de un soluto para la asociacin del
soluto entre dos solventes no miscibles?
11. Establecer las caractersticas de los equilibrios slido-lquido para sistemas con
dos componentes.
12. Utilizar los diagramas de temperatura versus composicin para sistemas con dos
componentes totalmente solubles en estado lquido e insolubles en estado slido con
formacin de eutctico. Aplicacin de la regla de las fases.
13. Discutir las curvas de enfriamiento en el caso anterior.
63
Gua de Trabajos Prcticos de Qumica General Edicin 2012
PROBLEMAS ADICIONALES
1. Dados los equilibrios:
SrCl2.6H2O (S)
SrCl2.2H2O (S) + 4 H2O (g)
Na2HPO4.12H2O (S)
Na2HPO4.7H2O (S) + 5 H2O (g)
Na2SO4.10H2O (S)
Na2SO4 (S) + 10 H2O (g)
Cuyas Kp a 0C son respectivamente: 6,89x10 -12; 6,25x10-13 y 4,08x10-25.
a) Calcular la presin de vapor en equilibrio con cada sustancia a 0C.
b) Estas sales se usan como agentes desecantes colocndolas en un recipiente
cerrado (desecador) junto con la sustancia que se desea mantener seca. El agente
desecante ms eficiente ser el que mantenga la menor presin de vapor de agua
dentro del desecador Qu sal ser el agente desecante ms efectivo a 0C:
SrCl2.2H2O, Na2PO4.7H2O Na2SO4?
2. a) Calcular los gramos de agua que debern vaporizarse a 25C para saturar con su
vapor una habitacin de 3x104 litros. La Pv de agua a 25C es 24 torr.
b) Cul ser la presin final del agua si slo hay 800 g de agua lquida para
vaporizar?
c) Idem si slo hay 400 g de agua.
3. A y B (solubles en fase lquida e insolubles en fase slida) forman un eutctico con
35 % p/p en A. Cuando se enfran 800 g de una solucin de A y B hasta una
temperatura apenas superior a la del eutctico se obtienen 125 g de A y una solucin
de composicin prcticamente igual a la del eutctico. Calcule la composicin de la
solucin original.
64
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Destilacin
TRABAJO PRCTICO
Objetivo: Realizar una destilacin simple de una mezcla binaria. Determinar las
composiciones de vapor en funcin de la temperatura. Realizar una destilacin
fraccionada de una mezcla binaria con formacin de azetropo de mximo punto de
ebullicin.
Introduccin Terica
El equilibrio lquido-vapor a nivel molecular
Antes de comenzar a desarrollar el tema especfico de la destilacin, ser
necesario recordar algunos conceptos correspondientes a trabajos prcticos
anteriores.
Si se coloca un lquido dentro de un recipiente al cual se le ha hecho vaco, y al
que se lo mantendr de algn modo a una temperatura constante, algunas molculas
de la superficie con suficiente energa cintica podrn vencer las fuerzas de atraccin
de las dems molculas pasando de este modo a la fase vapor (evaporacin). Se
formar as una fase vapor sobre la fase lquida introducida en el recipiente. Algunas
molculas de la fase vapor, chocarn con la superficie del lquido y quedarn retenidas
en el mismo (condensacin). Este ltimo proceso ser ms y ms importante a medida
que haya ms molculas en fase vapor. En algn momento, las velocidades de
evaporacin y condensacin se igualarn y se llegar a un estado de equilibrio
dinmico caracterizado por un cierto nmero de molculas por unidad de volumen en
la fase vapor.
La presin ejercida por dicho vapor sobre el lquido se denomina presin de vapor
del lquido. Su valor queda determinado slo por la naturaleza del lquido y por la
temperatura.
Por otro lado, el concepto de presin de vapor es importante para definir punto de
ebullicin, ya que sta es la temperatura a la cual la presin de vapor del lquido iguala
la presin externa (si sta es igual a 1 atmsfera, el punto de ebullicin se denomina
normal). Cuando un lquido alcanza el punto de ebullicin, las molculas pasan a la
fase vapor, no slo desde la superficie, sino desde cualquier lugar del lquido. Un
lquido puro que ha alcanzado la temperatura de ebullicin, no podr aumentar su
temperatura aunque se le entregue calor sino que invertir ste en producir el cambio
de estado.
Si un lquido presenta mayor presin de vapor que otro a la misma temperatura,
tambin tendr un punto de ebullicin menor (mayor presin de vapor => menor
temperatura de ebullicin). Por otro lado, es fcil comprender la relacin entre las
atracciones intermoleculares y la presin de vapor: un lquido cuyas molculas se
atraigan dbilmente tendr una presin de vapor ms alta, a igual temperatura, que
otro cuyas molculas se atraigan ms fuertemente.
La presin de vapor de mezclas de lquidos a temperatura constante
Consideremos una mezcla de dos lquidos A y B, cada uno de los cuales presenta,
a cierta temperatura T, las presiones de vapor P Ao y PBo cuando se encuentran puros.
Segn hemos visto previamente, la presin de vapor de cada uno de estos
componentes sufrir una modificacin cuando se los mezcle, que queda indicada por
la ley de Raoult:
PA = PAo . XAL
PB = PBo . XBL
(1a y 1b)
donde PA y PA son las presiones de vapor de los componentes A y B en la mezcla
65
Gua de Trabajos Prcticos de Qumica General Edicin 2012
y XAL y XBL son las fracciones molares de los componentes de la mezcla lquida.
La presin del vapor en equilibrio con la mezcla lquida (P T) ser, segn la ley de
las presiones parciales de Dalton:
PT = PA + PB = PAo . XAL + PBo . XBL
y recordando que la suma de fracciones molares debe dar 1:
PT = PAo . XAL + PBo . (1 - XAL)
PT = (PAo - PBo) . XAL + PBo
o bien: PT = PAo . (1 - XBL) + PBo . XBL)
o bien: PT = (PBo PAo) . XBL + PAo (2a y 2b)
La ecuacin (1) indica una dependencia lineal entre la presin de vapor de un
componente y su fraccin molar en el lquido. Tambin las ecuacines (2) nos
muestran una dependencia lineal entre la presin total de la mezcla lquida y la
fraccin molar de cualquiera de sus componentes. La relacin funcional (2) entre P T y
(por ejemplo) XAL es una recta de ordenada en el origen P Bo y pendiente (PAo - PBo), es
decir la resta de las presiones de vapor de los componentes puros (que son
constantes a temperatura constante) y una ordenada al origen que coincide con la
presin de vapor de uno de los componentes. La figura 1 es una representacin
grfica de estas relaciones:
Figura 1
PRESION
T = constante
PB0
P A + PB
PB
PA0
PA
XAL = 1
XBL = 0
Fraccin molar
XAL = 0
XBL = 1
Estrictamente, la ley de Raoult se cumple para mezclas lquidas ideales. Para que
una mezcla lquida sea ideal, al mezclar sus componentes no deben producirse
modificaciones de volumen (la suma de los volmenes debe dar el volumen total) ni de
temperatura (si los componentes estaban inicialmente en equilibrio trmico). Esto slo
ocurre cuando se mezclan lquidos de naturaleza muy similar, es decir, las molculas
de cada componente por separado se atraen aproximadamente del mismo modo que
las molculas de un componente con las del otro. Ejemplos: bromuro de etileno cloruro de etileno; n-hexano - n-heptano, etc.
Independientemente de que la mezcla lquida se comporte idealmente o no, los
vapores pueden comportarse idealmente y en ese caso cumplen la ley de las
presiones parciales (Dalton), y para cada componente:
PA = PT . XAV
PB = PT . XBV
(3a y 3b)
66
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Ntese que XAV y XBV son las fracciones molares de cada componente, pero en la
fase vapor.
Usando las ecuaciones (1), (2) y (3) puede obtenerse una expresin para la
fraccin molar de cada componente en el vapor en funcin de la composicin del
lquido (pruebe despejar PT de las ecuaciones 2a y 3b, igualar ambas expresiones de
PT y luego reemplazar PB segn 1b). Se puede as calcular la composicin del vapor
para cada composicin del lquido. La representacin grfica es la siguiente:
PRESION
T = constante
PB0
1
FASE LIQUIDA
P A + PB
FASE VAPOR
PA0
XAL = 1
XBL = 0
XAL = a
XAV = b
Fraccin molar
XAL = 0
XBL = 1
La recta superior nos da la presin de vapor de la mezcla en funcin de las
composiciones en fase lquida mientras que la curva inferior nos da la presin de vapor
de la mezcla en funcin de las composiciones en fase gaseosa. En el grfico anterior
se distinguen tres zonas:
1) Una zona superior a ambas curvas que corresponde a condiciones de presin y
composicin en las cuales la mezcla se encuentra en fase lquida, a la temperatura
constante a la que corresponde el grfico (altas presiones).
2) Una inferior a ambas curvas que corresponde a condiciones de presin y
composicin en las cuales la mezcla se encuentra en fase vapor, a la temperatura
constante a la que corresponde el grfico (bajas presiones).
3) Una zona interna a las curvas que corresponde al equilibrio lquido-vapor. Un
punto cualquiera dentro de esa curva (por ejemplo, 1) corresponde a un sistema
formado por una fase lquida de composicin XAL = a (y XBL = 1- a) y por una fase
vapor de composicin XAV = b (y XBV = 1 b). Cualquier punto de la linea horizontal en
la que est el punto 1 est formado por las mismas dos fases, difiriendo en la cantidad
relativa de cada fase.
Puede observarse en la figura que, para cualquier composicin de la fase lquida,
la fase vapor en equilibrio con ella contiene mayor proporcin del componente de
mayor presin de vapor (en el caso graficado es el componente B). Este hecho se
utiliza en un mtodo de separacin de mezclas lquidas denominado destilacin.
Temperatura de ebullicin de mezclas liquidas a presin constante
Dado que, en realidad, la mayora de las operaciones en el laboratorio, entre ellas
la destilacin, se realizan a presin constante, analizaremos grficos donde la presin
se mantenga constante y se utilice la temperatura como variable para separar los
componentes de la mezcla lquida. Aplicando las relaciones entre presin de vapor y
temperatura de ebullicin, es posible construir el siguiente grfico:
67
Gua de Trabajos Prcticos de Qumica General Edicin 2012
TEMPERATURA
P = constante
FASE VAPOR
TA
T1
TB
FASE LIQUIDA
XAL = 1
XBL = 0
XAL = a
XAV = b
Fraccin molar
XAL = 0
XBL = 1
donde TA y TB indican los puntos de ebullicin de A y B a la presin de trabajo. La
curva superior indica ahora la temperatura de ebullicin de la mezcla lquida en funcin
de la composicin en la fase vapor mientras que la inferior la indica en funcin de la
composicin en la fase lquida. Es interesante notar que los puntos de ebullicin de
mezclas de A y B de distinta composicin sern distintos.
Tambin en esta ltima figura se distinguen tres zonas; sin embargo, se han
invertido en relacin con el grfico de composicin vs presin a temperatura constante.
La zona superior es ahora la del vapor mientras que la
inferior es la del lquido. La zona interior a las curvas
sigue siendo la de equilibrio lquido-vapor.
Una mezcla lquida de composicin X AL = a, tendr
un punto de ebullicin T1 y el vapor en equilibrio con la
mezcla lquida tendr una composicin X AV. Si
condensamos este vapor tendremos un lquido con
mayor proporcin de B, mientras que la fase lquida
original se habr enriquecido en A. Este proceso es
denominado destilacin simple y puede realizarse
mediante un equipo como el mostrado en la figura de
la derecha. El equipo consta de un baln donde se
coloca la mezcla original que es calentada hasta lograr
la ebullicin. El vapor asciende y se introduce en el
refrigerante en donde es enfriado y condensado (en
general, por pasaje de una corriente de agua fra) y
posteriormente recibido en un recipiente adecuado.
Es importante notar que la mezcla entrar en ebullicin a cierta temperatura T 1, sin
embargo, en la medida que se libere vapor, el punto de ebullicin ir aumentando
gradualmente (pues se va enriqueciendo en A que es menos voltil).
La destilacin simple slo es eficaz en la separacin de componentes en el caso
de que una de ellos sea no voltil o muy poco voltil. El tpico caso de aplicacin de la
destilacin simple es la obtencin del agua destilada, en la que se separa el agua de
las sales disueltas que, por ser muy poco voltiles, permanecern en el baln.
Si el proceso de destilacin simple se realizara sucesivamente sobre cada
destilado obtenido (cada destilacin simple es representada por un escaln en la figura
68
Gua de Trabajos Prcticos de Qumica General Edicin 2012
siguiente) sera posible que la ltima destilacin permitiera obtener la sustancia B
pura.
TEMPERATURA
P = constante
TA
TB
XAL = 1
XBL = 0
Fraccin molar
XAL = 0
XBL = 1
Se puede realizar una operacin equivalente a esa serie de destilaciones simples
sucesivas mediante un proceso denominado destilacin fraccionada. En la siguiente
figura se muestra el esquema bsico de un aparato de destilacin fraccionada; la
diferencia fundamental est dada por la adicin al baln de una columna
fraccionadora, que consiste en un tubo de vidrio relleno con perlas o bolita de vidrio,
cermica, plstico, etc. para asegurar una gran superficie de contacto y de intercambio
de calor.
En una destilacin fraccionada, la mezcla lquida
original se lleva a ebullicin (comienzo de la primera
destilacin simple), el vapor asciende hasta encontrarse
dentro de la columna con una zona ms fra que logra
condensarlo; este lquido, que es ms rico en el
componente ms voltil y por lo tanto con menor punto de
ebullicin, desciende, en parte, escurriendo por las
paredes de la columna y del relleno hacia el baln y, en
parte se evapora porque es calentado por el vapor
ascendente caliente que proviene del baln (comienzo de
la segunda destilacin simple). El vapor formado sufre un
proceso similar en un tramo ms alto de la columna. De
este modo, zonas a diferente altura dentro de la columna
sirven de sucesivas destilaciones simples. Si el largo de la
columna es adecuado, en la zona superior llegar solo el
componente ms voltil que pasar al refrigerante y ser
recogido al final del proceso. El termmetro ubicado en
ese lugar marcar la temperatura de ebullicin de ese
componente. Mientras tanto el baln se ir haciendo cada
vez ms rico en el componente menos voltil el cual
pasar al destilado slo cuando se haya eliminado el otro
componente. Durante ese proceso el termmetro marcar la temperatura de ebullicin
del componente menos voltil.
La temperatura indicada por el termmetro en la cabeza de la columna se
mantendr constante mientras est destilando cada uno de los componentes de la
mezcla, pero la temperatura dentro del baln variar gradualmente desde T B hasta TA
69
Gua de Trabajos Prcticos de Qumica General Edicin 2012
y no se mantendr constante sino al final cuando solo quede A puro.
Desviaciones del comportamiento ideal
Lo desarrollado hasta el momento se aplica exclusivamente para el caso de
mezclas binarias ideales, sin embargo, muchas mezclas presentan desviaciones a la
ley de Raoult.
Cuando se mezcla un lquido de molculas polares con otro de molculas no
polares, la mezcla presentar una desviacin positiva a la ley de Raoult, esto es, la
presin de vapor total es mayor que la predicha por la ley (ejemplo: mezcla de
hidrocarburo y alcohol). Por el contrario, cuando se mezclan dos sustancias cuyas
molculas se atraen ms entre s que las molculas de cada sustancia por separado,
la presin total ser menor a la esperada por Raoult, lo cual constituye una desviacin
negativa (ejemplo: cloroformo-ter etlico).
MEZCLA CON DESVIACIN POSITIVA
PRESION
T = constante
PB0
P A + PB
PB
PA0
X AL = 1
XBL = 0
PA
XAL = 0
XBL = 1
Fraccin molar
MEZCLA CON DESVIACIN NEGATIVA
PRESION
T = constante
PB0
P A + PB
PB
PA0
PA
X AL = 1
XBL = 0
Fraccin molar
XAL = 0
XBL = 1
En ambos grficos se muestran con lneas punteadas lo esperado por la ley de
70
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Raoult.
Observe cmo las desviaciones respecto del comportamiento ideal son menores a
medida que se diluye la solucin (es decir, a medida que la composicin se aproxima a
la de los componentes puros).
En algunas mezclas las desviaciones positivas (o negativas) son muy grandes y
esto origina la formacin de una mezcla particular, denominada mezcla azeotrpica,
que presenta una presin de vapor mxima (o mnima) comparada con cualquier otra
composicin del mismo sistema. Existen sistemas que presentan azetropos de
mximo punto de ebullicin (mnima presin de vapor) y otros que presentan
azetropos de mnimo punto de ebullicin (mxima presin de vapor). A continuacin
se muestran los esquemas respectivos:
MEZCLA CON AZETROPO DE MXIMO PUNTO DE EBULLICIN
TEMPERATURA
P = constante
TZ
TA
Composicin
del azeotropo
XAL = 1
XBL = 0
Fraccin molar
TB
XAL = 0
XBL = 1
MEZCLA CON AZETROPO DE MNIMO PUNTO DE EBULLICIN
TEMPERATURA
P = constante
TB
TA
TZ
Composicin
del azeotropo
XAL = 1
XBL = 0
XAL = 0
XBL = 1
Fraccin molar
En ambos casos, TZ es la temperatura de ebullicin de la mezcla azeotrpica. Es
importante notar que la mezcla azeotrpica no es una sustancia pura, sino slo una
71
Gua de Trabajos Prcticos de Qumica General Edicin 2012
mezcla de composicin definida de los componentes originales.
Debido a que la mezcla azeotrpica tiene idntica composicin en fase lquida y en
fase vapor (cualquier otra mezcla binaria no cumple con esta condicin), al realizar
una destilacin fraccionada de un sistema con formacin de azetropo no podrn
separarse completamente los dos componentes sino que se obtendr el azetropo y
uno de los componentes (el que est en exceso con respecto a la composicin del
azetropo) o solamente el azetropo.
Las situaciones posibles en una destilacin fraccionada para los dos casos de
mezclas azeotrpicas son tres:
1) se parte de una mezcla binaria de composicin igual a la de la mezcla azeotrpica:
en este caso el sistema opera como si tuviese un componente puro y destila a
temperatura constante (TZ) slo el azetropo.
2) Se parte de una mezcla binaria que tenga un exceso de A respecto de la
composicin del azetropo. En el caso de un azetropo de mximo punto de
ebullicin, a medida que calentemos se eliminar ms fcilmente A que el
azetropo; comenzar a destilar A y la composicin del baln se ir acercando a la
composicin del azetropo con lo cual tambin crecer el punto de ebullicin.
Cuando el baln alcance la composicin de la mezcla azeotrpica, sta destilar a
temperatura constante. De este modo, en sistemas con formacin de azetropos de
mximo punto de ebullicin, destila primero el componente en exceso y luego el
azetropo. Si en cambio, el azetropo es de mnimo punto de ebullicin ocurre lo
contrario: primero destila el azetropo (pasa ms fcilmente a la fase vapor) y luego
el componente en exceso.
3) Se parte de una mezcla binaria que tenga un exceso de B respecto de la
composicin del azetropo. La destilacin fraccionada de una mezcla como sta es
igual al caso anterior slo que, en este caso, el componente en exceso es B.
Parte Experimental
A) Destilacin Simple
Se realizar una destilacin simple de una mezcla de HCl-H2O que forma
azetropo de mximo punto de ebullicin.
1) Se colocan 100 mL de la mezcla y trozos de cermica poroso en el baln (que
actan como reguladores de la ebullicin, evitando borbotones y proyecciones de
lquido) y se comienza a calentar lentamente el sistema.
2) Anotar la temperatura a la cual destila la primera gota. Mantener un rgimen de
destilacin de 1 gota/seg.
3) Recoger fracciones del destilado en los siguientes intervalos de temperaturas:
100-102; 102-104; 104-106, 106-108 y 108C.
4) Completada la destilacin, retirar el mechero y mantener la circulacin de agua en
el refrigerante durante unos 5 minutos.
5) Titular un volumen de 1 mL de cada una de las fracciones aisladas con la solucin
de NaOH valorada. Calcular la concentracin de HCl en cada caso.
6) Grficar las temperaturas medias de cada intervalo como ordenadas y las
concentraciones de HCl como abcisas. Conociendo el volumen y concentracin
inicial del sistema y las fracciones recogidas, es posible calcular la composicin
aproximada del lquido.
Es importante notar que las curvas obtenidas no abarcan todo el intervalo de
composiciones de mezclas HCl/H2O, sino que slo corresponden a la zona entre uno
de los componentes puros (agua) y el azetropo de mximo punto de ebullicin que
forman estas sustancias.
B) Destilacin Fraccionada
Se realizar una destilacin fraccionada de una mezcla de HCl-H2O. Para ello se
72
Gua de Trabajos Prcticos de Qumica General Edicin 2012
utilizar un equipo similar al esquema de la figura 7.
1) Se colocan 100 mL de la mezcla y el plato poroso en el baln, y se comienza a
calentar lentamente el sistema.
2) Anotar la temperatura a la cual destila la primera gota. Mantener un rgimen de
destilacin de 1 gota/seg.
3) Anotar la temperatura de ebullicin a intervalos de 5 mL de destilado.
4) Aislar las fracciones obtenidas a diferentes temperaturas.
5) Completada la destilacin, retirar el mechero y mantener la circulacin de agua en
el refrigerante durante unos 5 minutos.
6) Titule 1 mL de las diferentes fracciones obtenidas.
7) Realice el grfico de temperatura de ebullicin versus volumen de destilado.
8) Si es posible, calcular la composicin inicial de la mezcla.
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Indique en un diagrama de Te vs composicin, la destilacin fraccionada realizada
en la prctica
2. Indique cmo vara la temperatura en el termmetro ubicado en la zona superior
de la columna de destilacin y de un termmetro ubicado en el baln durante el
proceso de destilacin de una mezcla: a) de dos componentes que no presentan
grandes desviaciones, b) de una mezcla que forma azetropo de mximo punto
de ebullicin, c) de una mezcla que forma azetropo de mnimo punto de
ebullicin.
3. Durante la destilacin simple de una solucin de HCl se toman 5 fracciones a
diferentes intervalos de temperatura: 100-102; 102-104, 104-106, 106-108 y
108,5C. Las titulaciones de 0,50 mL de cada fraccin arrojaron gastos de 15,50
mL, 2,30 mL, 0,20 mL, 16,20mL y 6,70mL de una solucin de KOH 0,232 M.
Identifique cada fraccin con el correspondiente gasto en la titulacin.
4. Si en la destilacin anterior se haba partido de 150 mL de HCl 3,0 M y los
volmenes obtenidos 5,0; 12,5 mL; 25,0 mL y 42,8 mL para las primeras cuatro
fracciones al ir aumentando la temperatura, calcule la concentracin aproximada
de cada mezcla lquida a 101, 103, 105 y 107C.
5. Las presiones de vapor de dos sustancias A y B son respectivamente 300 y 520
torr a 40C. Calcule la presin de vapor total de una mezcla de ambos con una
fraccin molar en A igual a 0,25. Estar en su punto de ebullicin normal? Calcule
la composicin en la fase vapor (suponga ideales a la mezcla lquida y a la
gaseosa).
6. Acetona y cloroformo forman un azetropo de mximo punto de ebullicin de
composicin 20 % p/p de acetona. Si se realiza una destilacin fraccionada de 500
g de una mezcla con iguales masas de ambos compuestos, indique cul de las
sustancias destila primero y la masa terica de cada fraccin que se recibir en el
destilado.
7. Los puntos de ebullicin de cloroformo, etanol y del azetropo (que contiene un 93
% en cloroformo) que forman son 61C, 78C y 59C respectivamente. Cuando se
destilan 250 g de una mezcla de ambos se obtienen dos fracciones a 59C y 78C.
Si se obtuvieron 110 g de la ltima fraccin, cul era la composicin de la mezcla
original?
8. Cul ser la composicin (p/p) de un azetropo de mximo punto de ebullicin
que formarn dos sustancias A y B si al realizar una destilacin fraccionada de 300
g de una mezcla con un 35 % p/p en A, se obtienen 105 g de una primera fraccin
a la temperatura de ebullicin de B?
73
Gua de Trabajos Prcticos de Qumica General Edicin 2012
9. Calcule la presin de vapor total a 60C de una mezcla de cido actico y de
benceno (PMR = 60 y 78 respectivamente) si a esa temperatura sus presiones de
vapor son respectivamente 100 y 400 torr. La composicin de la mezcla es 40%
p/p en cido actico. a) Estar en ebullicin a esa temperatura y a la presin
externa de 1 atm? b) Cul es la composicin del vapor en equilibrio?
74
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Coeficiente de Reparto
TRABAJO PRCTICO
Objetivo: Determinar el coeficiente de reparto de un soluto entre dos solventes no
miscibles.
Introduccin
Si a un sistema heterogneo formado por dos fases lquidas (es decir, por dos
lquidos no miscibles por ser insolubles o muy poco solubles entre s), le agregamos
una sustancia soluble en ambos, esta sustancia (soluto) se distribuye o reparte
entre ambas fases. La concentracin de soluto en cada fase est dada por la ley de
distribucin o de reparto.
Como veremos, este fenmeno se utiliza para la purificacin de solutos por el
procedimiento denominado extraccin.
La ley de distribucin o de reparto establece que: dados dos solventes inmiscibles
en contacto (que distinguiremos como 1 y 2) en los que se disuelve una sustancia (A),
soluble en ambos, sta se distribuye entre las dos capas lquidas de modo que la
relacin de las concentraciones de A en cada capa sea una constante (constante de
reparto: K) que depende solamente de la temperatura. Es decir:
[A(2)]
[(A(1)]
La constante de reparto o coeficiente de reparto (K) es independiente de la
cantidad de sustancia disuelta: si se contina agregando soluto A, aumentarn [A(1)],
la concentracin de la sustancia A en el solvente 1, y [A(2)], la concentracin de A en
el solvente 2, pero su relacin (K) se mantendr constante (a T= cte).
Esta forma simple de la ley es vlida solamente para soluciones diluidas (las que
se aproximan al comportamiento ideal).
Adems, la ley es vlida para la misma especie molecular del soluto en ambos
solventes. El siguiente ejemplo puede aclarar esta ltima afirmacin:
Se sabe que el cido actico, de frmula CH 3COOH (que abreviaremos HAc), se
disuelve en agua y en benceno. Sin embargo, en benceno, el cido actico existe casi
totalmente en forma de molculas dobles (o asociadas o dmeros) de frmula
(HAc)2. En este caso existe una constante de reparto (K) del cido actico entre el
agua y el benceno que relaciona las especies moleculares idnticas, es decir HAc (en
agua) y AcH (en benceno):
K'
[HAc (en benceno )]
[HAc (en agua )]
(1)
Sin embargo, en benceno, existe el equilibrio de asociacin:
2 HAc (HAc)2
cuya constante de equilibrio de asociacin es:
K ASOC
[(HAc )2 (en benceno ]
[HAc (en benceno )]2
(2)
Reemplazando la concentracin de las molculas simples en benceno de la
ecuacin (1) en funcin de la ecuacin (2), resulta:
75
Gua de Trabajos Prcticos de Qumica General Edicin 2012
[(HAc ) 2 (en benceno )]
K ASOC
K'
[HAc (en agua )]
o, reagrupando:
K'
K ASOC
[(HAc ) 2 (en benceno )]
[HAc (en agua )]
(3)
Recordando que el HAc existe casi totalmente como molculas dmeras en
solucin de benceno y como el producto K x KASOC es tambin una constante (K),
resulta:
Concentrac ion total del acido acetico en benceno
Concentrac ion total del acido acetico en agua
(4)
Este resultado puede generalizarse de la siguiente manera: cuando una sustancia
A se reparte entre dos solventes 1 y 2, y se asocia fuertemente en uno de ellos (por
ejemplo, 2) para dar molculas A n se verifica que se cumple la constancia de la
relacin:
n
Concentrac ion total de A en el solvente 2
Concentrac ion total de A en el solvente 1
(5)
Parte Experimental
Determinacin de la constante de reparto
En el trabajo prctico se determinar el coeficiente de reparto del I 2 entre dos
solventes inmiscibles: ciclohexano (C6H12) y agua. El equilibrio que se establece es:
I2 (ac)
I2 (org)
K = [I2(org)] / [I2(ac)]
donde I2 (ac) y I2 (org) representan al yodo disuelto en agua y ciclohexano,
respectivamente. K es el coeficiente de distribucin o reparto.
Materiales
Frasco de 250 mL con tapa, probeta de 100 mL, pipetas de doble aforo de 2 mL, 5
mL y 50 mL, 2 erlenmeyers, bureta de 25 mL, soporte universal, vaso de precipitados,
embudo, solucin de iodo saturada en agua, solucin de tiosulfato de sodio 0,001M,
ciclohexano, solucin de almidn.
Discusin
Cuando un soluto (el yodo en este caso) se mezcla con dos lquidos no miscibles
en contacto entre s (el agua y ciclohexano), se disuelve el soluto en cada disolvente
hasta cierto punto, y as se distribuye entre las capas. Cuando el equilibrio se ha
alcanzado, la relacin
76
Gua de Trabajos Prcticos de Qumica General Edicin 2012
es constante, independientemente de ambas concentraciones individuales, pero
depende de la temperatura y la naturaleza del soluto y de los disolventes especficos
involucrados. K es la constante de equilibrio llamada coeficiente de distribucin. Para
el sistema yodo-agua-ciclohexano
K = [I2] en C6H12 / [I2] en H2O
donde K es el coeficiente de distribucin (o coeficiente de concentracin molar) de
yodo entre el agua y ciclohexano. Este tipo de procedimiento se utiliza en la tcnica de
separacin industrial comn conocida como "extraccin". Durante la extraccin, los
compuestos se separan mediante el aprovechamiento de sus solubilidades diferentes
en un par de disolventes inmiscibles. Frmacos y compuestos de plutonio son
ejemplos de sustancias separadas y purificadas utilizando tcnicas de extraccin.
En este experimento, el coeficiente de distribucin molar a temperatura ambiente
ser determinado por medio de la cuantificacin del yodo en la solucin acuosa antes
y despus de agitar con ciclohexano. El anlisis se llevar a cabo en la titulacin de
estas soluciones acuosas con una solucin de tiosulfato de sodio con indicador de
almidn. La ecuacin para la reaccin entre el yodo y el tiosulfato de sodio es
I2 + 2Na2S2O3 Na2S4O6 + 2NaI
En presencia de almidn (se aade una pequea cantidad de ste a la solucin
justo antes del final de la valoracin) todos los reactivos y productos son incoloros,
excepto I2, que forma un complejo azul intenso. La titulacin se contina hasta el punto
final indicado por la desaparicin del color azul.
Procedimiento
Se recomienda armar los sistemas y tomar las muestras bajo campana.
Finalizado el TP, los residuos de fase orgnica se colocan en un frasco
destinado a tal efecto.
1- Se toman con pipeta doble aforo 20,00 mL de solucin acuosa saturada con
yodo y se transfieren a un erlenmeyer de 250 mL. Se titula con solucin de tiosulfato
de sodio gota a gota hasta que solo quede una ligera coloracin de la solucin. En ese
instante se agregan unas gotas de solucin de almidn y se titula hasta decoloracin
total.
2- Se limpian y secan dos frascos de 250 mL para realizar la experiencia por
duplicado. Se colocan 70,0 mL de la solucin acuosa de yodo saturada en cada uno
de ellos. Se aaden a cada frasco 2,00 o 5,00 mL de ciclohexano (dependiendo del
grupo al que pertenezca). Se tapan los frascos y se agitan las mezclas durante 1
minuto, dejndolas reposar unos cinco minutos.
3- Se toman, con pipeta de doble aforo, 50,00 mL de muestra de la fase acuosa
(inferior) de cada frasco y se transfiere a un erlenmeyer de 250 mL. Se valora como
antes con la solucin de tiosulfato de sodio. El almidn se puede agregar al comienzo
de la titulacin.
Clculos
Del inciso 1 se calcula el nmero de moles de yodo en 20 mL de la solucin
acuosa antes de la extraccin con ciclohexano y con este valor se calcula la
concentracin inicial de yodo.
Del inciso 3 se calcula el nmero de moles de yodo en 50,0 mL de la solucin
acuosa de yodo despus de extraer con 2 mL o 5 mL de ciclohexano, segn
corresponda. De aqu se obtiene la concentracin molar de yodo luego de la
extraccin.
77
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Por diferencia entre el nmero de moles de yodo en los 70,0 mL de la solucin
acuosa inicial y el nmero de moles de yodo de la solucin acuosa luego del reparto
se obtiene la concentracin de yodo en ciclohexano, teniendo en cuenta los
volmenes de cada fase.
Preguntas Adicionales al Trabajo Prctico
1. Debe medir con precisin el volumen de cada fase agregada a los frascos?
2. Debe medir con precisin el volumen de alcuota extrada para titular?
3. Compare las concentraciones de I2 en cada fase y la K obtenidas si se usa el
sistema que utiliza 2 mL de C6H12 o si usa el sistema que utiliza 5 mL de C6H12.
4. Idem si los sistemas de partida hubieran sido:
a) sol. saturada de I2 en C6H12 y agua
b) sol. saturadas de I2 en agua y en C6H12
5. Por qu usa volmenes diferentes de cada fase al armar los sistemas?
6. Debe conocer con precisin la concentracin de la solucin de Na 2S2O3?
7. Qu tipo de error cometer en el valor de la K si al extraer la alcuota de fase
acuosa arrastra fase orgnica?
8. Qu tipo de error se cometera en la determinacin de la K si al armar el sistema,
inadvertidamente agrega un volumen mayor de C 6H12? Idem si agrega un volumen
mayor de solucin saturada de I2 en agua.
9. Qu ocurrir con el equilibrio ( , , no se desplaza) y con el valor de la K
determinada si al sistema con las dos fases en equilibrio se:
a) agrega agua b) agrega fase orgnica
c) agrega iodo slido
d) agrega IK
e) extrae parte de la fase acuosa f) agrega sol. saturada de I2
en agua
g) agrega sol. saturada de I2 en C6H12
10. Qu cambios hubiera realizado para determinar la constante de reparto de I2
entre agua y S2C teniendo en cuenta que la K es 620?
11. Cuntas veces ms soluble es el iodo en S 2C que en C6H12?
12. Se tienen 30 mL de una solucin 0,025 M de I2 en CCl4. Calcule el porcentaje de
iodo residual si se agregan:
a) 500 mL de agua (Kr = 80)
b) 10 mL de S2C
c) se hacen dos extracciones sucesivas con 250 mL de agua
13. Calcule el volumen de solucin de Na 2S2O3 0,010 M que se gastara en la titulacin
de 10,00 mL de la fase orgnica en equilibrio con fase acuosa cuya concentracin
en iodo es 0,00078 M. La K de reparto es 82.
14. Si en el caso anterior se tienen 30 mL de la fase orgnica y 400 mL de la fase
acuosa, qu masa total de iodo est presente en el sistema?
Problemas Complementarios al Trabajo Prctico de Coeficiente de Reparto.
1) Se tienen 100 mL de solucin 2,50 x 10-4 de I2 en agua a 20C. Calcular el % de I2
residual en cada caso:
a) con una extraccin con 20,0 mL de CCl4.
b) con dos extracciones con 10,0 mL de CCl4 cada una. Comparar con el anterior.
c) con una extraccin con 20,0 mL de S2C.
Las constantes de reparto del I2 entre CCl4 y agua y entre S2C y agua son
respectivamente 80,0 y 620, ambas a 20C.
2) En la distribucin del cido benzoico entre agua (C1) y benceno (C2) se obtuvieron
los siguientes datos:
C1 (mol/l): 2,304 x 10-3
4,608 x 10-3
7,299 x 10-3
9,964 x 10-3
-3
-3
-3
C2 (mol/l): 9,76 x 10
36,24 x 10
89,24 x 10
166,2 x 10-3
Demostrar que el cido benzoico existe como molcula doble (dmeros) en la fase
orgnica, si en agua existe como molcula simple (monmeros).
78
Gua de Trabajos Prcticos de Qumica General Edicin 2012
3) Se tienen 150 mL de solucin acuosa de I2 8,00 x 10-4 M y se le agregan 20,0 mL de
CHCl3. Luego de agitar se extraen 10,0 mL de la fase orgnica que se titulan con 4,80
mL de solucin de Na2S2O3 0,00800 N. Calcular la constante de reparto y la
concentracin final de I2 en H2O.
4) El iodo es 200 veces ms soluble en ter que en agua. Si 130 mL de una solucin
acuosa que contiene 2,00 mg de iodo se agita con 5,00 mL de ter, calcular:
a) Qu masa de iodo queda en el agua?
b) Qu masa de iodo queda en el agua luego de dos extracciones con 5,00 mL de
ter cada una?
79
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Electroqumica
TEORA-SEMINARIO
1. Qu es un proceso de xido-reduccin? De qu depende la espontaneidad de
una reaccin de este tipo?
2. Qu son las celdas electroqumicas? Qu es una celda electroltica? Y una
celda galvnica?
3. Escriba las ecuaciones ms importante que relacionan corriente (i), carga (Q) y
tiempo (t).
4. Describa las leyes de Faraday. Discuta el concepto de equivalentes qumico y
electroqumico.
5. En un electrodo se produce la hemirreaccin:
Al3+ + 3e
Alo (s)
a)Cuntos gramos de aluminio pueden obtenerse mediante el pasaje 0,68 F?
b)Cunto tiempo deber pasar una corriente de 0,0205 A por dicho electrodo
a fin de obtener 15 g de aluminio?
6. Por medio de la circulacin de una corriente elctrica de 1,5 A de intensidad por
una solucin acuosa de una sal durante 30 minutos se depositan en el ctodo 0,82
g del metal correspondiente al catin de la sal.
a) Calcular el equivalente qumico y el electroqumico del metal.
b) Calcular el peso atmico del metal si su estado de oxidacin es +3.
7. Describa algunos procesos electrolticos importantes.
8. Escribir las ecuaciones correspondientes a las electrlisis de :
a) solucin de NaCl concentrada.
b) solucin de NaCl diluida.
c) NaCl fundido.
d) solucin de CuSO4 con electrodos de Pt (metal inerte).
e) solucin de CuSO4 con electrodos de Cu.
9. Indique qu partes componen una pila. Cul es la funcin de cada una de ellas?
Cmo funciona una pila?
10. A qu se llama potencial de electrodo? Qu relacin tiene el potencial de
electrodo con la espontaneidad de un proceso?
11. Cmo puede predecir el funcionamiento de una pila a partir de los potenciales
redox? Qu se entiende por FEM normal de una pila? Cmo la calcula?
12. A partir de los potenciales de reduccin del Fe 3+ y del Cu2+, indique la ecuacin de
la pila y calcule la FEM normal de la misma.
13. Qu relacin existe entre la energa libre y el trabajo neto? Deduzca la ecuacin
de Nernst a partir de la ecuacin de Gibbs. Cmo se relaciona la constante de
equilibrio con los potenciales de electrodo?
14. a) Calcular el valor de Kc a 25C para la reaccin:
2 Ag+ + Zn
Zn2+ + 2 Ag
b) Si se hace funcionar la pila partiendo de concentraciones iniciales unitarias de
Zn2+ y Ag+, indique cuales sern las concentraciones cuando la FEM de la pila sea
1,51 V.
15. Describa brevemente las celdas galvnicas ms importantes.
16. Qu entiende por pilas de concentracin?
80
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Equivalente Electroqumico
TRABAJO PRCTICO
Objetivo: Determinacin de la carga que circula en un sistema electroltico.
Determinacin del equivalente electroqumico (del hidrgeno o del oxgeno), aplicando
las leyes de Faraday.
Introduccin
Las reacciones qumicas est acompaadas por la absorcin o liberacin de
energa. En el tema de Termoqumica hemos estudiado la relacin entre las
reacciones qumicas y la energa intercambiada en forma de calor, es decir; energa
trmica. Trataremos aqu las reacciones en las que la energa qumica se transforma
en parte en energa elctrica. Estas reacciones se denominan reacciones
electroqumicas. El transporte de la energa elctrica a travs de la materia, la
relacin entre la energa qumica y la elctrica y la interconversin de una en otra son
materia de estudio de la electroqumica.
Para que una reaccin electroqumica se lleve a cabo, es necesario que existan
especies conductoras de la electricidad. Las sustancias conductoras de la corriente
elctrica se clasifican en:
1. Conductores de primera especie o electrnicos: constituidos por los metales en
general; el transporte de la corriente elctrica se produce a travs del movimiento
de los electrones libres (lbiles) del metal.
2. Conductores de segunda especie o electrolticos: constituidos por las soluciones de
los cidos, bases y sales en general y tambin por sales fundidas. En los
electrolitos el pasaje de la corriente elctrica se produce a travs del movimiento de
los iones de la solucin.
El proceso por el cual se produce una reaccin qumica como consecuencia del
pasaje de una corriente elctrica a travs de un electrolito se denomina electrlisis.
Un circuito electroltico (esquematizado en la figura siguiente) consta de un recipiente
que contiene una solucin conductora (electrolito) y dos lminas metlicas llamadas
electrodos, las cuales se conectan mediante hilos conductores (generalmente de
cobre, que es muy buen conductor) a una fuente de energa elctrica, que puede ser
una pila, una batera, etc. El electrodo conectado al polo positivo de la fuente de
energa se denomina nodo y el que se une al polo negativo, ctodo. El sistema en
conjunto constituye una cuba o celda electroltica.
Pila, batera o fuente de potencial
i
nodo
ctodo
e-
+
-
Cuando los electrodos de una celda electroltica se conectan a la fuente de energa
81
Gua de Trabajos Prcticos de Qumica General Edicin 2012
elctrica, se forma un circuito por el que circula una corriente elctrica (i). En los
conductores metlicos los portadores de la corriente elctrica son los electrones; en
la solucin electroltica, la corriente elctrica es transportada mediante el movimiento
de los iones hacia los electrodos.
Supongamos que la solucin electroltica posee cationes M+ y aniones N- que se
mueven libremente dentro de la solucin. Al ser conectada la fuente de corriente se
genera un campo elctrico que obliga a los electrones a recorrer los alambres
conductores en el sentido indicado en la figura, acumulndose en el electrodo de la
derecha y alejndose del de la izquierda (note que el sentido de la corriente elctrica,
como indica la flecha rotulada i, es el contrario. Esto es debido a que la corriente
elctrica se define como el movimiento de cargas positivas).
Como consecuencia del movimiento de los electrones, se produce una
acumulacin de carga negativa en el ctodo y positiva en el nodo. El electrodo
cargado negativamente (ctodo) atraer a los iones positivos de la solucin, los que se
movern hacia l. Del mismo modo, los iones negativos migrarn hacia el nodo.
Sin embargo, el movimiento de cargas (la corriente elctrica) cesar rpidamente a
menos que se produzca algn hecho que haga que los electrones desaparezcan del
ctodo y se formen en el nodo para poder seguir circulando por el circuito externo.
Este hecho puede consistir en transformaciones de carcter qumico. Si la diferencia
de potencial entregada por la fuente es suficiente, en el ctodo, hacia donde migran
los cationes, se producir una reduccin y los cationes tomarn electrones del
electrodo. En el nodo, hacia donde migran los aniones, stos se oxidarn cediendo
electrones al electrodo.
Ms arriba hemos introducido las denominaciones de ctodo o nodo para los
electrodos segn a qu terminal de la pila o batera los conectamos. La definicin
correcta de estos nombres es la siguiente: El ctodo es el electrodo en el cual se
produce una reduccin (ganancia de electrones) y el nodo es el electrodo en el
que se produce una oxidacin (prdida de electrones).
Supongamos que el electrolito es NaCl fundido y que los electrodos son metales
inertes (no se oxidan, no reaccionan con los iones de la sal ni con los productos de las
reducciones u oxidaciones). En ese caso, dado que en la sal fundida slo hay cationes
Na+ y aniones Cl-, la reaccin catdica ser:
Na+ + e- Na (reduccin)
y la reaccin andica ser:
2 Cl- Cl2 + 2 e- (oxidacin)
En el ctodo la energa elctrica se ha utilizado para transformar a los iones sodio
(Na+) en tomos neutros (Na), mientras que en el nodo, los iones cloruro (Cl -) se han
convertido en tomos neutros de cloro (Cl), los cuales inmediatamente se unen de a
dos y originan molculas de cloro (Cl2).
Si se suman las dos hemi-reacciones anteriores se tendr la reaccin electroltica
total. A fin de que los electrones no se acumulen, deben desaparecer tantos en el
ctodo como los que aparecen en el nodo; para lograr ese ajuste, se multiplican las
hemi-reacciones por los coeficientes adecuados, de modo que al sumar las
ecuaciones parciales desaparezcan los electrones en la ecuacin total:
2( Na+ + e- Na)
2 Cl- Cl2 + 2 e
2 Na+ + 2 Cl- 2 Na + Cl2
82
Gua de Trabajos Prcticos de Qumica General Edicin 2012
En el ejemplo anterior slo haba una reaccin posible en cada electrodo pero en
general existen varias reacciones de oxidacin andica y de reduccin catdica
posibles, de acuerdo a los aniones y cationes que contenga el electrolito. Adems
pueden oxidarse o reducirse otras especies, como solutos moleculares o el solvente
mismo, as como tambin es posible que se oxide el metal del nodo.
Leyes de la electrlisis
Las leyes que rigen la electrlisis fueron descubiertas por el qumico ingls Michael
Faraday y se enuncian a continuacin:
1ra. ley: La masa de un elemento determinado depositada en una electrlisis es
independiente de la composicin qumica de electrolito, siempre que el elemento acte
con el mismo nmero de oxidacin.
Esto implica que si se instalan varias celdas electrolticas en serie conteniendo
distintas sales de un mismo metal, se encuentra que las cantidades de metal que
reaccionan (se depositan sobre el electrodo) en un tiempo determinado en las distintas
celdas son iguales, siempre que el metal tenga el mismo nmero de oxidacin en
todas las sales de las celdas conectadas.
2da. ley: Las masas de distintos elementos depositadas en un mismo circuito
electroltico son directamente proporcionales a sus equivalentes qumicos.
Si se instalan varias celdas en serie que contienen soluciones de distintos metales
(por ejemplo, CuSO4, ZnCl2, AgNO3, etc.) se observa que las cantidades depositadas
de metal en cada una de ellas son directamente proporcionales a los pesos atmicos e
inversamente proporcionales a los nmeros de oxidacin respectivos.
3ra. ley: La cantidad (masa) de un elemento determinado depositada en una celda
electroltica depende exclusivamente de la cantidad de electricidad que ha circulado
por ella y es directamente proporcional a la misma.
Esta tercera ley, que ser demostrada experimentalmente en el trabajo prctico,
queda expresada as:
m=E.q
(1)
donde: m es masa depositada en el ctodo (o disuelta en el nodo), q la carga
elctrica, y E es una constante de proporcionalidad que depende de cada elemento.
Esta constante de proporcionalidad E se denomina equivalente electroqumico y es
la masa de sustancia que reacciona en un electrodo por el pasaje de una unidad
de carga elctrica, es decir, por el pasaje de un culombio. Si la intensidad de la
corriente que fluye es constante, la carga elctrica q (expresada en culombios, C) ser
igual al producto del valor de la intensidad de corriente elctrica i (expresada en
amperios, A) por el tiempo t (expresado en segundos):
q = i . t.
Volvamos ahora a la segunda ley de Faraday. Cuando una sustancia interviene en
una reaccin redox, su peso equivalente se define como el peso molecular relativo,
dividido por el nmero moles de electrones puestos en juego en esa reaccin. Dicho
de otra manera, el peso equivalente es la masa de sustancia que reacciona (o se
produce) debido al intercambio de 1 mol de electrones. La carga total de un mol de
electrones es 96500 C. Esta cantidad se denomina constante de Faraday, y se
simboliza F. Entonces
1 F = 96500 C
83
Gua de Trabajos Prcticos de Qumica General Edicin 2012
As, puede definirse el peso equivalente de una sustancia como la masa que se
deposita (o que reacciona de otra manera, de acuerdo a una ecuacin redox) en
un electrodo por el pasaje de un Faraday.
Las leyes de Faraday se pueden aplicar para medir la carga elctrica que ha
circulado. El mtodo consiste esencialmente en pesar el depsito metlico o medir el
volumen de gas desprendido cuando circula cierta corriente elctrica a travs de un
electrolito durante cierto tiempo. Conociendo el equivalente electroqumico
correspondiente puede aplicarse la ecuacin (1) para obtener el valor de q. Las celdas
electroqumicas especialmente diseadas para esta tarea se denominan
culombmetros. Por razones histricas, el culombmetro en el que se produce la
electrlisis del agua y se mide la carga elctrica por medio del volumen de oxgeno o
hidrgeno producidos se denomina voltmetro de Hoffmann. Los culombmetros ms
comunes son los de cobre/sulfato de cobre, plata/nitrato de plata y el voltmetro de
Hoffmann.
Parte Experimental
Se arma un circuito como el
representado en la figura, que
consta de una fuente de corriente
elctrica continua (puede ser una
batera o la misma corriente
elctrica alterna de la lnea
convenientemente rectificada, es
decir convertida en corriente
continua por medio de un
rectificador), un culombmetro de
cobre (electrodos de cobre y
electrolito de sulfato cprico) y un
voltmetro de gas (electrodos de
platino y agua acidulada como
electrolito).
Ambas
celdas
electroqumicas (culombmetro y
voltmetro), se conectan en serie.
1. Se pulen cuidadosamente los
electrodos de cobre para
+eliminar el xido que se forma
en su superficie. Luego se
enjuagan con agua y acetona, y
se secan en estufa a 60oC durante cinco minutos.
2. Se pesa en balanza analtica el electrodo de cobre que acta como ctodo.
3. En el voltmetro de gas se lleva a cero el nivel del electrolito de cada una de las
ramas.
4. Se conectan las celdas a la fuente de corriente y se inicia la electrlisis.
5. Se interrumpe la electrlisis cuando se hayan acumulado un volumen de gas de
aproximadamente 20 mL en la rama del voltmetro donde se ha desprendido
hidrgeno.
6. Una vez interrumpida la electrlisis, se retira el ctodo de cobre y se enjuaga,
cuidando de no desprender y arrastrar el cobre depositado, primero con agua y
despus con acetona. Se seca en estufa y se vuelve a pesar en balanza analtica.
5
84
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Las reacciones que se producen en las celda electroqumicas son:
Voltmetro de Hoffmann:
2 H+ + 2 e
H2
2 H2O
O2 + 4 H+ + 4 e
(ctodo)
(nodo)
[1]
[2]
Culombmetro de cobre:
Cuo
Cu+2 + 2 e
+2
Cu + 2 e
Cuo
(nodo)
(ctodo)
[3]
[4]
Clculos
Se calcula la masa de cobre (mCu) depositada sobre el ctodo de cobre por
diferencia de pesada de dicho electrodo antes y despus de la electrlisis
La hemireaccin redox [4] indica que 1 mol de cobre se deposita por el pasaje de 2
moles de electrones, con lo que se puede calcular la carga que circul para depositar
la masa mCu:
63,5 g Cu requieren para reducirse desde Cu+2
mCu g Cu requerirn
2 x 96500 C
qC
De esta manera se ha calculado la carga que ha circulado por el circuito
electroltico. Si la corriente elctrica que circul por el circuito hubiera sido constante,
este clculo tambin podra haberse hecho intercalando en el circuito elctrico un
ampermetro para medir la corriente elctrica (i) y midiendo adems el tiempo de
electrlisis (t). La carga hubiera sido entonces q = i . t.
Para calcular el equivalente electroqumico del hidrgeno
B
es necesario conocer tambin la masa de H 2 que se ha
desprendido en el ctodo del voltmetro, la cual se calcula
utilizando la ecuacin de estado de los gases ideales.
En la figura se observa la rama del voltmetro donde se ha
h
recogido el hidrgeno. La presin ejercida sobre el plano B es
5
0
la presin atmosfrica PATM. La presin a la altura del plano A
4
est dada por la suma de presin atmosfrica ms la presin
0
3
hidrosttica de la columna de lquido (h): P A = Patm + h.
A
0
Del lado de la bureta para gases, donde est contenido el
2
0
H2 producido, la presin en el plano A es la suma de las
1
presiones parciales de los gases contenidos en el volumen
0
medido, es decir, el H2 y el vapor de agua a la temperatura de
0
trabajo: PA = PH2 + Pv(H2O) .
Igualando ambas expresiones para P A y despejando la
presin del H2 resulta:
PH2 = Patm + h - Pv(H2O)
Conociendo la presin del hidrgeno, el volumen que ocupa (ledo directamente del
voltmetro) y la temperatura de trabajo, se calcula la masa de gas m H2. Esta cantidad
se produjo por el pasaje de q culombios en el circuito, por lo que el equivalente
electroqumico del H2 es:
EH2
mH2
q
Se calcular el error relativo porcentual cometido en la determinacin tomando
como valor aceptado del EH2 = 0,01045 mg/culombio.
85
Gua de Trabajos Prcticos de Qumica General Edicin 2012
PREGUNTAS ADICIONALES
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
Cmo se clasifican las sustancias conductoras de la corriente elctrica?
Qu entiende por electrlisis y qu leyes rigen la misma?
Qu tipo de reaccin qumica se produce en cada uno de los electrodos de una
celda electroqumica? De acuerdo con esto, cmo se denomina cada uno de los
electrodos?
Qu es el equivalente electroqumico de un elemento? Qu dimensiones
tiene?
Qu es un Faraday y cul es su valor?
Qu reacciones qumicas se producen en los electrodos del voltmetro de gas?
Escriba las ecuaciones correspondientes.
Cmo calcula la masa de los gases desprendidos en un voltmetro de gas?
Por qu el agua del voltmetro de Hoffmann debe ser acidulada? Podra ser
HCl?
Por qu pesa el ctodo y no el nodo?
Para qu sirve el culombmetro de CuSO 4?
Qu ocurre con la concentracin de la solucin de CuSO 4 durante la
electrlisis?
Indique qu procesos tendran lugar si el ctodo y/o el nodo fuesen de platino.
Al construirse un voltmetro de Hoffmann se cuenta solo con un electrodo de
platino y otro de cobre. Puede funcionar correctamente? Cmo? Qu ocurre
si los coloca inadecuadamente?
Indique un par de razones por las cuales podra no cumplirse la relacin 2 a 1 en
trminos de volumen para las dos ramas del voltmetro.
Por qu el gas liberado en el ctodo asciende ms rpido que el del nodo?
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Los electrodos en una electrlisis semejante a la de la prctica contienen 10 mg
de hierro expuesto. Calcule el error que cometera en la determinacin de la
cantidad de electricidad circulante al utilizar la diferencia de masas del nodo si el
ctodo aument su masa en 82 mg (suponga que el hierro se oxida ms fcilmente
que el cobre y que se transforma en ion ferroso).
2. Indique si el error hubiera sido mayor o menor en el caso de que en lugar de
hierro, el nodo hubiera contenido cinc, cadmio o aluminio (suponga que todos
estos metales se oxidan ms fcilmente que el cobre). El tipo de error ser el
mismo en todos los casos?
3. Si la electrlisis indicada en el ejercicio 1 dur 55 minutos, cul fue la intensidad
media de corriente durante la electrlisis? Calcule el nmero de electrones
circulantes por minuto.
4. Cul sera la concentracin molar final de 150 mL de una solucin de CuSO4 0,15
M al electrolizarla utilizando electrodos de platino con una intensidad de corriente
de 0,05 A durante 50 minutos?
5. Calcule la cantidad de electricidad circulante cuando en un coulombmetro de
cobre se depositan 35 mg en el ctodo.
6. En ocasiones donde se requiere mayor precisin se utiliza el culombmetro de
AgNO3. Calcule la variacin de masa que sufrira el ctodo de este culombmetro si
hubiera estado en serie con el del ejercicio anterior.
7. Se realiza una electrlisis en un voltmetro de Hoffmann durante cierto tiempo y
luego se enrasan ambas ramas. Posteriormente se realiza una electrlisis
86
Gua de Trabajos Prcticos de Qumica General Edicin 2012
obteniendo un volumen de 24,5 mL en la rama catdica. Si los niveles en cada una
de las ramas del voltmetro estn ubicados a 50,0 cm, 32,8 cm y 36,7 cm medidos
desde cierto nivel de referencia, la presin atmosfrica es 755 torr y la presin de
vapor de agua es 22,6 torr, calcule el volumen recogido en la rama andica.
8. Calcule la masa de gas que recoger en el ctodo de un voltmetro de Hoffmann
durante una electrlisis, si en el culombmetro de CuSO 4 en serie con l aumenta
la masa del ctodo en 75 mg.
9. Qu corriente pasar por un conductor en el que se transportan 1,27 x 10 18
electrones por minuto? (carga del electrn = 1,60 x 10 -19 culombios). b) Cuntas
horas se necesitan para transportar 96500 culombios mediante una corriente de
4,67 mA?. c) Por un conductor pasa una corriente de 1,80 A; cuntos culombios
y faradays pasarn por un punto dado en 1,36 minutos?
10. Cuntos culombios habrn circulado en una cuba electroltica que contiene Ag + si
el ctodo ha experimentado un aumento de masa de 0,207 g?.
11. a) Para electrolizar ZnCl2 fundido, se hace pasar una corriente de 0,0225 A durante
una hora. Cuntos gramos de Zn se depositarn en el ctodo? b) Cuntos
gramos de ZnCl2 se habrn electrolizado?
12. Se somete a electrlisis 50,0 mL de una solucin de NaCl 0,100 M. Durante
cunto tiempo debe pasar una corriente de 0,500 A para que el pH de la solucin
final sea 12? (suponer que no hay cambio de volumen).
13. Se tiene una celda con solucin acuosa de AgNO3 conectada en serie con otra que
contiene solucin acuosa de HCl. Si en la primera se depositan 0,0198 g de Ag,
calcular cuntos moles de H2 se producirn en el ctodo de la segunda.
14. Qu volumen de H2 y de O2 en CNTP se producirn mediante la electrlisis de
una solucin acuosa de H2SO4 si se emplea una corriente de 0,084 A durante
media hora? Escriba las ecuaciones correspondientes.
15. Cuando se electroliza H2SO4 acuoso en una celda con electrodos inertes, en el
ctodo se forma H2 y en el nodo O2, en una relacin de volumen de 2 a 1. Sin
embargo, al intentar la experiencia se observa que la relacin no es 2 a 1,
principalmente debido a que parte de la corriente andica convierte algo en H 2O en
H2O2. Si en un experimento dado se forman 43,76 mL de H2 en el ctodo (hmedo,
presin total 765 torr, 29 C) y 21,32 mL de O2 en el nodo (hmedo, presin total
755 torr, 29 C), qu porcentaje de la corriente andica podr suponerse habr
producido H2O2?
16. Se electrolizan 500 mL de una solucin 0,100 M de KCl. La electrlisis se detiene
cuando en el ctodo se han producido 45,0 mL de gas a 27 C y 1,10 atm. a)
Calcular la masa de gas obtenida en el nodo.b) Si la electrlisis se realiz con
una corriente de 15,0 mA, cul es el tiempo de electrlisis?. c) Cul es el pH de
la solucin final?.
17. Una corriente elctrica fluye durante cierto tiempo a travs de una cuba con
solucin de AgNO3, producindose un depsito de 54,0 g de Ag. Cuntos gramos
de Pb se podrn depositar en igual tiempo al circular la misma corriente por una
solucin de Pb(NO3)2?
87
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Celdas Galvnicas (Pilas)
TRABAJO PRCTICO
Objetivo: Determinar el potencial de un electrodo tomando otro como referencia.
Construir una tabla de potenciales de electrodo. Predecir el potencial de distintas pilas
y comprobarlo experimentalmente. Usar un electrodo de referencia de calomel.
Verificar el principio del funcionamiento de las pilas de concentracin.
Introduccin Terica
En el curso de Introduccin a la Qumica se estudiaron las reacciones de xidoreduccin establecindose cualitativamente las tendencias relativas de una serie de
elementos (H, Cu, Zn, Ag) a oxidarse o reducirse. En este trabajo prctico se
cuantificarn esas tendencias.
Para comenzar, retomemos los conceptos relacionados con las reacciones de
oxido-reduccin: el proceso qumico de oxidacin-reduccin consiste en una reaccin
qumica en la que una especie pierde electrones (se oxida) y otra especie gana esos
electrones (se reduce). Si, por ejemplo, introducimos una barra de cinc metlico dentro
de una solucin de CuSO4, se producir un depsito de Cu metlico sobre la barra de
Zn, mientras que parte de sta se oxida introduciendo iones Zn 2+ en la solucin (de
esa manera, parte del sulfato de cobre originalmente en solucin se transforma en
sulfato de Zn). La reaccin neta que ocurre puede representarse mediante la siguiente
ecuacin:
Zn + Cu2+
Zn2+ + Cu
La reaccin total puede desdoblarse en dos hemi-reacciones:
Zn
Zn2+ + 2 e2+
Cu + 2 e
Cu
Zn + Cu2+
Cu + Zn2+
Si se separan fsicamente las especies intervinientes (Zn; Cu; Zn 2+; Cu2+),
colocando en recipientes separados las sustancias intervinientes en cada
hemireaccin:
Cu
Zn
2+
Cu
Cu2+
Zn2+
Resulta claro que la reaccin no puede ocurrir porque los electrones no pueden
transferirse desde la barra de Zn, donde son liberados al formarse Zn2+ a la barra de
Cu (donde deben ser transferidos al in Cu 2+).
Si se permitiera el pasaje de electrones entre las dos barras metlicas (por
ejemplo, unindolas por medio de un conductor metlico), entonces se produciran
algunos iones Zn2+ en el compartimiento de la derecha y algunos electrones estaran
disponibles (habiendo circulado hacia la barra de Cu) para reducir algunos iones Cu 2+
a Cu. Sin embargo, la reaccin se interrumpira casi inmediatamente debido a que la
solucin de la derecha adquirira una carga positiva (debida a los iones Zn 2+
producidos) y la de la de la izquierda una carga negativa (debida a la desaparicin de
algunos iones Cu2+). En otras palabras: para que la reaccin pueda tener lugar debe
cerrarse el circuito conectando elctricamente tanto las barras metlicas como las
88
Gua de Trabajos Prcticos de Qumica General Edicin 2012
soluciones electrolticas. Para lograr esto ltimo, los compartimentos se conectan
mediante lo que se denomina un puente salino. Este es un tubo de vidrio acodado que
contiene una solucin electroltica (y por lo tanto conductora de la electricidad)
concentrada. Se usa comnmente una solucin de KCl disuelta en una solucin de
gar (una especie de gelatina). La gelatina impide que se mezclen entre s las
soluciones de los dos compartimientos (qu sucedera si la solucin de Cu 2+ pasara
al compartimiento en el que est la barra de Zn?).
El dispositivo completo es entonces:
Cu
Zn
2+
Cu
Cu2+
Solucin
saturada de
KCl + agar
Zn2+
En este dispositivo, denominado pila galvnica, pila voltaica o simplemente pila,
se convierte energa qumica en energa elctrica: la reaccin qumica redox causa
que una corriente elctrica circule por un conductor metlico externo.
Las barras de metal y las soluciones electrolticas que estn en contacto con ellas
constituyen los electrodos de la pila. La pila formada por una barra de Cu en contacto
con una solucin de Cu2+ y otra de Zn en contacto con una solucin de Zn 2+ se llama
pila de Daniell.
Resumiendo, el funcionamiento de la pila es el siguiente: la barra de Zn se oxida
generando iones Zn2+ y electrones libres; los iones Zn 2+ se alejan del electrodo y
entran en la solucin de ZnSO 4 mientras que los electrones recorren el conductor
metlico exterior desde el electrodo de Zn hacia el electrodo de Cu. Los electrones
que circulan por el conductor metlico exterior llegan al electrodo de Cu y son
capturados por los iones Cu 2+ provenientes de la solucin de CuSO 4. De este modo,
se produce la reduccin de los iones Cu 2+ sobre la superficie del electrodo,
depositndose sobre l como Cu.
El electrodo de Zn constituye el nodo de la pila, en tanto que el de Cu es el
ctodo. Debe remarcarse que el nodo es siempre el electrodo en el cual se produce
una oxidacin y el ctodo el electrodo en el que se produce una reduccin, ya sea una
pila galvnica o una celda electroltica.
Funcionamiento del puente salino.
Al funcionar la pila, en el compartimento que contiene el par Cu/Cu 2+ van
desapareciendo los iones Cu 2+ en la zona prxima a la barra de Cu, mientras que otros
llegan desde el seno de la solucin de CuSO 4. En el otro compartimento se producen
iones Zn2+ en las inmediaciones de la barra de Zn, que van difundiendo hacia el seno
de la solucin. Como ya se ha sealado, esto producira una carga positiva neta en el
compartimiento andico (Zn) y una carga negativa neta en el catdico (Cu). El puente
salino evita esta acumulacin de carga, permitiendo a los iones negativos del puente
(Cl-) difundir hacia el nodo y a los iones positivos (K +) hacia el ctodo. Si este
intercambio de iones no se produjera, la carga neta acumulada interrumpira el flujo de
electrones en el circuito externo y se detendra la reaccin redox. Este movimiento de
89
Gua de Trabajos Prcticos de Qumica General Edicin 2012
iones es una corriente elctrica, de la misma manera que el movimiento de electrones
por el circuito externo.
Si se reemplaza el conductor que conecta los electrodos de la pila por un aparato
de medidas de diferencia de potencial (voltmetro), ste acusa un valor que es
caracterstico para cada pila (depende de la naturaleza de los elementos que
constituyen los electrodos y de la concentracin del electrolito). En la pila de Daniell,
por ejemplo, si se realiza la medida a 298 K y las respectivas soluciones de CuSO4 y
ZnSO4 son de igual concentracin, la diferencia de potencial es de 1,1 V (voltios). Este
valor es independiente del tamao de los electrodos y de la pila en su conjunto. Como
los instrumentos de medida de diferencia de potencial tienen una resistencia elctrica
muy grande, la intensidad de corriente que circula al realizar la medida es sumamente
pequea (idealmente cero). La diferencia de potencial entre los electrodos de una pila,
medida en condiciones de corriente nula se denomina fuerza electromotriz (FEM) de
la pila. La fuerza electromotriz mide la tendencia de la reaccin a producirse, es decir,
mide las tendencias relativas con que se producen los distintos procesos
(andfico y catdico) de xido-reduccin.
Para deducir una expresin cuantitativa para las tendencias relativas a reaccionar,
recordemos la expresin de la variacin de energa libre en una reaccin qumica
(aA + bB = cC + dD) a temperatura y presin constante:
[C]c [D]d
G
G0 RT ln
(1),
[ A ]a [B]b
donde G es la variacin de energa libre en condiciones estndar para dicho
proceso. Si la reaccin en cuestin es una reaccin redox, por ejemplo:
aA
b Bn+ + n ea A + b Bn+
c Cn+ + n edD
d Dn+ + c C
Entonces la variacin de energa libre ser igual al trabajo elctrico (carga
transferida x diferencia de potencial a travs del cual se transfiere) cambiado de signo.
Cuando a moles de A y b moles de Bn+ se transforman en productos, la carga
transferida es n Faradays y el potencial es la FEM de la pila (E), por lo tanto:
G
nF E .
En condiciones estndar,
G0
nF E 0 ;
donde E es la diferencia de potencial entre los electrodos de la pila cuando se
mide a 298 K y concentraciones 1 M (condiciones estndar).
Sustituyendo en (1),
[C]c [D]d
nF E
nF E 0 RT ln
, y dividiendo ambos miembros por -nF:
[ A ]a [B]b
E
E0
RT [C]c [D]d
ln
nF [ A ]a [B]b
ECUACIN DE NERNST
Considerando que ln (a) = 2,303 log (a), R= 8,31 Joule/K mol, F= 96500 coulomb, y
a la temperatura de 298 K, la ecuacin queda simplificada a:
E
E0
0,059
[C]c [D]d
log
n
[ A ]a [B]b
(Vlida slo a 298 K)
La diferencia de potencial (o abreviadamente, el potencial) que se mide
experimentalmente en una pila se debe a un potencial andico y a un potencial
catdico. As, sabiendo el potencial de uno de los electrodos, y con el valor medido de
90
Gua de Trabajos Prcticos de Qumica General Edicin 2012
la diferencia de potencial de la pila, se puede conocer el potencial del electrodo
restante. Sin embargo, es imposible medir el potencial de un electrodo solo, pues para
que el circuito se complete requiere la presencia de los dos electrodos. Es preciso
entonces asignar a uno de los electrodos un valor arbitrario y a partir de l hallar el
valor del otro. Convencionalmente se atribuye el valor cero al potencial de un
conductor de platino en contacto con una solucin 1 M de iones H + a 298K y a 1 atm
de presin de gas H2. Este electrodo se denomina electrodo estndar de hidrgeno o
electrodo normal de hidrgeno, se simboliza ENH, y la reaccin que se produce es:
2 H+ + 2 e -
H2
E = 0.0000 V
As, la medida de la diferencia de potencial entre cualquier electrodo (tambin
llamado hemipila) y el electrodo normal de hidrgeno (electrodo de referencia), es una
medida del potencial de dicho electrodo. Una tabla que contenga esta informacin,
medida en condiciones estndar (es decir: concentraciones de los electrolitos 1 M y
presiones de los gases 1 atm) se llama serie electromotriz de potenciales normales de
electrodo. Al lado del valor del potencial se escribe la hemi-reaccin correspondiente
a la reduccin. Por ejemplo, si se arma una pila (en condiciones estndar) en la que
ocurra espontneamente la reaccin:
H2
Cu2+ + 2 eH2 + Cu2+
2 H+ + 2 eCu
2 H+ + Cu
y se mide la diferencia de potencial, el voltmetro marcar 0,34 V. (note que la
diferencia de potencial de una pila cuyas reacciones ocurren espontneamente debe
ser positivo, ya que la variacin de energa libre para un proceso espontneo debe ser
negativa). Dado que al electrodo de hidrgeno se le ha asignado el valor cero, el
potencial medido corresponde al potencial normal de reduccin del electrodo Cu 2+/Cu,
pues, tal como se encontr en el T.P. de Redox, la tendencia a reducirse del cobre es
mayor que la del hidrgeno, por lo tanto:
E0
donde E H0
/ H2
E 0catodo E 0anodo
E 0Cu 2
EH0
/ Cu
/ H2
0,34 V
0 V (Referencia).
Consideremos la reaccin:
H2
Zn2+ + 2 eH2 + Zn2+
2 H+ + 2 eZn
2 H+ + Zn
[1]
Esta no es una reaccin espontnea. La reaccin espontnea es aquella en la que
el Zn se oxida y el in hidrgeno se reduce, es decir que si realmente armamos una
pila con estos electrodos la reaccin que ocurrir ser:
2 H+ + 2 eZn
2 H+ + Zn
H2
Zn2+ + 2 eH2 + Zn2+
El potencial (normal) medido experimentalmente ser 0,76 V, es decir:
E0
con lo cual E 0Zn2
/ Zn
E 0catodo
E 0anodo
E H0
/ H2
E 0Zn2
/ Zn
0,76 V
0,76 V .
Como G es una funcin de estado, si G es la variacin de energa libre de una
91
Gua de Trabajos Prcticos de Qumica General Edicin 2012
reaccin cualquiera (Reactivos Productos), el G de la reaccin inversa (Productos
Reactivos) ser -G. De la misma manera (puesto que E = -nFE), si se invierte el
sentido de una reaccin redox, la FEM cambia de signo. Si la pila de Zn e H 2
funcionara en el sentido que se indica en [1], el E de dicha pila sera -0,76 V, pues el
electrodo de Zn debera actuar como ctodo. Una FEM negativa implica que el
proceso es no espontneo ( G>0).
En la tabla I se dan valores de potenciales de reduccin normales, referidos al
electrodo normal de hidrgeno. El potencial de cualquier electrodo medido respecto
del ENH se denomina potencial normal respecto al electrodo normal de hidrgeno o de
la serie normal de hidrgeno.
Potenciales de electrodos normales a 25 0C
Hemi-reaccin
E (voltios)
Li+ + e Li
-3,045
+
Na + e Na
-2,714
Mg2+ + 2 e Mg
-2,37
Al3+ + 3 e Al
-1,66
Mn2+ + 2 e Mn
-1,18
Zn2+ + 2 e Zn
-0,763
Cr3+ + 3 e Cr
-0,74
2+
Fe + 2 e Fe
-0,44
Ni2+ + 2 e Ni
-0,25
Sn2+ + 2 e Sn
-0,136
Pb2+ + 2 e Pb
-0,126
2 H+ + 2 e H2
0,000
Cu2+ + 2 e Cu
0,34
I2 + 2 e 2 I
0,536
Fe3+ + e Fe2+
0,771
Ag+ + e Ag
0,799
Cr2O72- + 14 H+ + 6 e 2 Cr3+ + 7 H2O
1,33
Cl2 + 2 e 2 Cl1,36
MnO4- + 8 H+ + 5e Mn2+ + 4 H2O
1,51
F2 + 2 e 2 F
2,65
Tabla 1
Se convino que al potencial de reduccin de cualquier reaccin de electrodo se lo
llamar simplemente el potencial. Esta designacin tiene la ventaja de que el signo del
potencial corresponde al del polo de la pila; as el Zn, por ejemplo, tiene un potencial
de reduccin negativo (-0,763 V) y es tambin el polo negativo de una pila galvnica
en la cual el otro electrodo es el normal de hidrgeno.
Una pila se representa esquemticamente de la siguiente manera:
Zn / ZnSO4 (x M) // CuSO4 (y M) / Cu
es decir, primero se coloca el metal del nodo, luego la barra, que indica la
interfase metal/solucin, luego el electrolito y su concentracin entre parntesis, la
doble barra que indica puente salino , el electrolito del ctodo y luego el metal del
ctodo, separados stos por una barra.
Pilas de concentracin.
Para que se genere una diferencia de potencial elctrico entre los electrodos de
una pila, no es necesario que los mismos sean de diferente naturaleza. Si se observa
la ecuacin de Nernst se concluir que existir una diferencia de potencial entre dos
electrodos constituidos por las mismas sustancias en los que los electrolitos tengan
distinta concentracin. Si, por ejemplo, en uno de los compartimentos se sumerge una
barra de cobre en una solucin de CuSO 4 diluida y se conecta a otro compartimento
92
Gua de Trabajos Prcticos de Qumica General Edicin 2012
similar en el que una barra de cobre est sumergida en una solucin concentrada de
CuSO4, el electrodo en contacto con la solucin diluida actuar como nodo, y se
disolver, en tanto que en el otro se producir un depsito de Cu (ctodo). La reaccin
que ocurre en la pila tiende a que ambas soluciones alcancen igual concentracin de
la sal, en cuyo caso la FEM se har cero.
Electrodos de referencia.
Ya se ha referido que el potencial de los electrodos se toma con referencia al
electrodo de hidrgeno, al cual se le asigna convencionalmente el valor cero. Existen
otros electrodos que se caracterizan por poseer un valor relativamente fijo de potencial
en cualquier medio que se lo utilice, llamados electrodos o hemi-pilas de referencia. El
ms comnmente usado en el laboratorio es el llamado electrodo de calomel, que
consiste en Hg en contacto con Hg 2Cl2 (cloruro mercurioso o calomel, slido
prcticamente insoluble) y con una solucin de cierta concentracin de KCl.
Esquemticamente, el electrodo puede representarse como:
Hg | Hg2Cl2 (slido) | KCl (concentracin)
La hemi-reaccin del electrodo de calomel es:
Hg2Cl2 + 2 e
2 Hg + 2 ClE = 0,241 V (KCl sat.)
El electrodo de calomel se construye con Hg puro cubriendo un alambre de Pt
sellado en el fondo de un tubo de vidrio; el Hg se cubre con Hg 2Cl2 slido y sobre ste
se coloca solucin de KCl en la que el Hg 22+ es ligeramente soluble (de acuerdo a su
Kps). El potencial del electrodo de calomel ser distinto de acuerdo a las distintas
concentraciones de la solucin de KCl que se utilicen (generalmente se usa una
solucin saturada). Otro electrodo de referencia similar utilizado es el de Ag | AgCl | Cl.
Parte Experimental
I. Determinacin de potenciales de electrodo de distintos metales, utilizando el
electrodo de Pb como referencia
Se armarn las pilas
Cu | CuSO4 (0,1 M) || Pb(NO3)2 (0,1 M) | Pb
Zn | ZnSO4 (0,1 M) || Pb(NO3)2 (0,1 M) | Pb
Ni | NiCl2 (0,1 M) || Pb(NO3)2 (0,1 M) | Pb
Sn | SnCl2 (0,1 M) || Pb(NO3)2 (0,1 M) | Pb
Se conecta cada uno de los electrodos al voltmetro de modo de medir un potencial
positivo. El electrodo conectado al polo positivo del voltmetro es el que acta como
ctodo (no olvidar anotar esta informacin!). Una vez realizadas las medidas, se le
asigna al electrodo de Pb un valor arbitrario, preferentemente distinto de cero y se
calculan los potenciales de electrodo de cada una de las semipilas restantes. Con
estos datos se construye una serie electromotriz.
II. Clculo del potencial de las pilas que se pueden armar con los pares anteriores
Predecir tericamente, en base a los resultados anteriores, la FEM de las distintas
pilas que es posible construir. Comprobarlo experimentalmente, armando algunas de
esas pilas.
III. Determinacin del potencial normal de las semipilas utilizadas
Se medir el potencial de la semipila de Pb con respecto al electrodo de calomel.
Conociendo el valor del potencial normal de este ltimo electrodo, se calcularn los
potenciales normales de los otros pares.
IV. Pilas de concentracin
Se armarn las pilas:
Cu | CuSO4 (0,001 M) || CuSO4 (0,1 M) | Cu
93
Gua de Trabajos Prcticos de Qumica General Edicin 2012
Cu | CuSO4 (0,0001 M) || CuSO4 (1 M) | Cu
y se medir el potencial de cada una de ellas.
IMPORTANTE.
ANTES DE USAR LOS ELECTRODOS DEBEN PULIRSE Y ENJUAGARSE CON AGUA DESTILADA.
LOS PUENTES SALINOS DEBEN ENJUAGARSE CON AGUA DESTILADA LUEGO DE CADA MEDIDA.
DEBEN GUARDARSE SUMERGIDOS EN SOLUCIN SATURADA DE KCl.
LAS PILAS NO DEBEN DEJARSE FUNCIONAR DURANTE MUCHO TIEMPO.
PROBLEMAS COMPLEMENTARIOS
Estos problemas deben resolverse durante el trabajo prctico en la medida que
el trabajo experimental lo permita.
1. Calcule la FEM normal de una pila formada entre los pares Cu 2+/Cu y Ni2+/Ni
sabiendo que los potenciales normales son 0,34 V y -0,25 V. Cunto vale la
constante de equilibrio de la reaccin?
2. Calcule la FEM de la pila anterior cuando las concentraciones de Cu 2+ y de Ni2+
son respectivamente 0,025 M y 0,019 M.
3. Por qu se puede elegir cualquier hemipila como referencia?
4. En el laboratorio se miden las FEM de las siguientes pilas
Al / Al3+ (0,045M) // Cu2+(0,025M) / Cu
FEM = 1,97 V
Pb / Pb2+(0,075M) // Ag+(0,015M) / Ag
FEM = 0,84 V
Pb / Pb2+(0,075M) // Cu2+(0,025M) / Cu
FEM = 0,44 V
Zn / Zn2+(0,010M) // Cu2+(0,050 M) / Cu
FEM = 1,08 V
Obtenga una tabla de potenciales normales para todos los pares redox anteriores.
5. Calcule la tendencia a reducirse (referida a la hemipila de hidrgeno) de soluciones
de Cu2+ de concentracin 1,0 M; 0,10 M y 0,010M.
6. Calcule las FEM de las siguientes pilas de concentracin:
a) Cu / Cu2+(0,010M) // Cu2+(1,0M) / Cu
b) Pt /Fe2+(0,10M),Fe3+(0,050M) // Fe3+(0,080M),Fe2+(0,015M) / Pt
7. Cul es la condicin de equilibrio de una pila de concentracin?
8. Se deja funcionar la pila indicada en el ejercicio 2 hasta que la concentracin de
uno de los iones alcanza el valor 0,018 M. Cul es la concentracin del otro ion?
Calcule la cantidad de electricidad que ha circulado en c y en F si las hemipilas
contenan 100 mL de solucin.
9. Se deja funcionar la pila Al / Al3+(1,0M) // Zn2+(0,85M) / Zn hasta que han circulado
0,0050 A durante 3 horas. Calcule la FEM original y la nueva FEM si cada hemipila
contena 100 mL de solucin. Los potenciales de oxidacin normales del Al y del
Zn son 1,67 V y 0,76 V.
10. Calcule el potencial de reduccin de una hemipila Ag/AgCl (con KCl 1,0 M) y el
habitualmente llamado potencial normal de la misma sabiendo que el potencial de
reduccin normal de Ag+ es 0,80 V y que el Kps del AgCl es 1,7x10-10. Relacione
esta hemipila con la de calomel. Por qu se utilizan?
11. Indique si las siguientes aseveraciones son verdaderas o falsas, justificando su
respuesta:
- La fuerza electromotriz (FEM) de una pila depende de la temperatura.
- El potencial de un electrodo aislado puede determinarse en forma absoluta.
- La FEM standard de una pila nos permite calcular la constante de equilibrio de
la reaccin que en ella se produce.
- El potencial de un electrodo Me +n/Me depende de la concentracin del in
metlico Me+n
- La FEM de una pila no permite predecir el sentido de la reaccin que en ella se
94
Gua de Trabajos Prcticos de Qumica General Edicin 2012
produce.
12. Calcule el potencial en condiciones de presin y temperatura estndar de un
electrodo de Ag sumergido en solucin de AgNO 3 0,010 M. Eo(Ag+/Ago)=0,799 V.
13. Utilizando los potenciales de electrodo estndar que figuran en la tabla I de la gua
de TP, prediga el sentido en que se produciran las siguientes reacciones y calcule
la magnitud de la FEM. (Suponer todas las presiones y concentraciones unitarias).
a) Zno + Mg+2
Zn+2 + Mgo
o
b) Fe + Cl2(g)
Fe+2 + 2 Cl+2
c) 2 Fe + Cl2(g)
2 Fe+3 + 2 Cld) 2 Cl- + Cr2O7-2
2 Cr+3 + Cl2
e) 2 Cl + MnO4
Mn+2 + Cl2
14. Calcule la FEM de las siguientes pilas a 25C.
Mg / Mg+2(0,10 M) // Zn+2(1,0 M) / Zn
Cu / Cu+2 (0,010 M) // Ag+ (0,50 M) / Ag
Cu / Cu+2 (0,00010 M) // Cu+2 (0,10 M) / Cu
15. Una pila que utiliza la reaccin:
Pbo + 2 Ag+ Pb+2 + 2 Ag
tiene, en un instante dado, una FEM de 0,89 V. Si la concentracin, de Pb 2+ es 1,0
M, Cul ser la concentracin de Ag + ?
16. Calcule el potencial de la reaccin MnO 4-(0,10 M)/Mn+2(0,10 M) cuando: a) el pH es
1; b) el pH es 3; el pH es 5.
17. En base al resultado, indique si el MnO 4- es mejor oxidante a bajos o a altos
valores de pH.
18. Escriba la ecuacin redox de la reaccin de oxidacin del Cl - a Cl2 por medio de
Cr2O7-2. Escriba la ecuacin de Nerst correspondiente a dicha reaccin.
Suponiendo que todas las especies de las que depende la FEM de dicha reaccin,
excepto el H+, tienen concentraciones (o presiones, en el caso del H 2) iguales a la
unidad, calcule el pH mximo a partir del cual el Cr2O7-2 es capaz de oxidar al Cl-.
19. Si una pila formada por un electrodo de hidrogeno ([H +] desconocida) y un
electrodo de calomel ([KCl] = 0,10 N, E = 0,337 V), tiene una FEM de 0,5562 V a
25C, calcule el pH de la solucin.
20. Si los potenciales normales de los electrodos Zn +2/Zno y Cu+2/Cuo, son -0,761 y
0,340 V respectivamente, calcule la relacin de equilibrio entre las concentraciones
de los iones Zn+2 y Cu2+, luego de agregar Zn metlico a una solucin dluda de
CuSO4.
21. Calcular la constante de equilibrio para cada una de las siguientes reacciones:
a) Cu+2 + Zn
Cu + Zn+2
b) Fe + 3 H2O
Fe(OH)3 (s) + 3/2 H2
+3
c) Fe + 2 Fe
3 Fe+2
22. Dados los potenciales estndar (E ) de las siguientes hemirreacciones:
i) M+2 + 2eM
E = 0,80 V
+3
ii) M
+ 3e
M
E = 0,70 V
iii) MO+2 + 2 H+ + eM+3 + H2O
E = 0,30 V
Calcular el potencial de la hemirreaccin en la cual MO+2 es reducido a M+2.
95
You might also like
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSFrom EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSRating: 4.5 out of 5 stars4.5/5 (7)
- Práctica 03. Cuestionario Previo P.de Vapor y Entalpía de Vap. Del AguaDocument3 pagesPráctica 03. Cuestionario Previo P.de Vapor y Entalpía de Vap. Del AguaFelipe Barajas100% (1)
- Ecuaciones de Estado para Gases RealesDocument25 pagesEcuaciones de Estado para Gases RealesKEVIN ARNOLDO PEREZ RIVASNo ratings yet
- Amortiguador de Pulsaciones (Descripcion, Mantenimiento y Calculo)Document9 pagesAmortiguador de Pulsaciones (Descripcion, Mantenimiento y Calculo)Andres Hernandez Bernal100% (1)
- Que Es Una Ley de La Naturaleza - Erwin SchrodingerDocument146 pagesQue Es Una Ley de La Naturaleza - Erwin SchrodingerNatacha Díaz0% (1)
- GUIA DE FÍSICA UNAM CURSODocument7 pagesGUIA DE FÍSICA UNAM CURSOAbraham GomezNo ratings yet
- Abigail Correa - Examen Parcial de Las Prácticas 3 y 4Document3 pagesAbigail Correa - Examen Parcial de Las Prácticas 3 y 4Abi CorreaNo ratings yet
- Fundamentos turbINAS ADocument32 pagesFundamentos turbINAS ACarlos J Alvarado MNo ratings yet
- 004 Plan de Trabajo en Espacios ConfinadosDocument10 pages004 Plan de Trabajo en Espacios ConfinadosRoly Chukichanpi WarayaNo ratings yet
- 4 - Durman Gas MT-GIDocument10 pages4 - Durman Gas MT-GIAlan Hernández100% (1)
- Laboratorio 3 de Termodinamica OficialDocument15 pagesLaboratorio 3 de Termodinamica OficialLuisUsseglioNo ratings yet
- Presión de vapor y entalpía de vaporización del aguaDocument4 pagesPresión de vapor y entalpía de vaporización del aguaYokari Godinez Loyola100% (1)
- Informe de Laboratorio de Fisicoquimica 01 GasesDocument10 pagesInforme de Laboratorio de Fisicoquimica 01 GasesJean Lopez JesusNo ratings yet
- Seminarios Primera Parte-2015 PDFDocument44 pagesSeminarios Primera Parte-2015 PDFVane CarranzaNo ratings yet
- Relaciones Termodinamicas Parte 2Document22 pagesRelaciones Termodinamicas Parte 2Maria caballeroNo ratings yet
- Practica #7-2Document19 pagesPractica #7-2Cynntia Barbara MendozaNo ratings yet
- Modelos TermodinamicosDocument21 pagesModelos TermodinamicosMariana Suárez SosaNo ratings yet
- Problemario - Unidad - 5 Quimica AplicadaDocument16 pagesProblemario - Unidad - 5 Quimica AplicadauzieNo ratings yet
- Trabajo Previo - Practica 3Document5 pagesTrabajo Previo - Practica 3Elizabeth GuerraNo ratings yet
- Universidad Nacional Autonoma de Mexico Practica 10Document12 pagesUniversidad Nacional Autonoma de Mexico Practica 10Pablo Vazquez Orta0% (1)
- Propiedades Empíricas de Los Gase1Document8 pagesPropiedades Empíricas de Los Gase1juan alberto gareca guerreroNo ratings yet
- Gases Ideales - David M.himmelblauDocument15 pagesGases Ideales - David M.himmelblauAriel CristóbalNo ratings yet
- Ingeneria Quimica ComputacionalDocument18 pagesIngeneria Quimica ComputacionalMirellea AndurayNo ratings yet
- Gases ideales y reales: representación de curvas de procesosDocument18 pagesGases ideales y reales: representación de curvas de procesosAraceli Fernandez MendozaNo ratings yet
- Practico 3 - Sustancias Puras - Elias BarzonDocument6 pagesPractico 3 - Sustancias Puras - Elias BarzonLuz Valentina Crispin MolloNo ratings yet
- Gas RealDocument23 pagesGas RealAlejandra Adrian TejadaNo ratings yet
- Guia Virtual Noveno Quimica Iii PeriodoDocument9 pagesGuia Virtual Noveno Quimica Iii PeriodoLauraNo ratings yet
- Termodinamica II Tarea 1Document6 pagesTermodinamica II Tarea 1Alvaro Wara SuárezNo ratings yet
- CompendioLectura TQDocument30 pagesCompendioLectura TQricardoNo ratings yet
- Cuestionarios Practica 5Document8 pagesCuestionarios Practica 5jopisteck01No ratings yet
- Taller de Gases-QuimicaDocument14 pagesTaller de Gases-QuimicaYera CastroNo ratings yet
- Ley Combinada de Los GasesDocument8 pagesLey Combinada de Los GasesAdrianaEdithGonzalezNo ratings yet
- Fenomeno Crit - Grupo 5Document24 pagesFenomeno Crit - Grupo 5Marcelo TorresNo ratings yet
- Practica 7 Propiedades de Los GasesDocument11 pagesPractica 7 Propiedades de Los Gasesluis angel ruiz osorioNo ratings yet
- Previo 1Document3 pagesPrevio 1Angélica Sixtos100% (2)
- Quimica General IDocument18 pagesQuimica General ISofía Alvarez HernandezNo ratings yet
- Densidad y Peso Molecular AparenteDocument9 pagesDensidad y Peso Molecular AparenteRios Rios100% (2)
- Informe Peso Molecular de Un Liquido VaporizableDocument10 pagesInforme Peso Molecular de Un Liquido VaporizableAbi Abiantun DiazNo ratings yet
- Equilibrio y CinéticaDocument4 pagesEquilibrio y CinéticaDiego SanchezNo ratings yet
- Unidad 1 EstudiantesDocument117 pagesUnidad 1 EstudiantesFernanda Raymundo Gamboa0% (1)
- LABORATORIO Nro 1 FISICOQUIMICA DETERMINACION DE LA RELACION PRESION-VOLUMEN A TEMPERATURA CONSTANTE (LEY DE BOYLE)Document7 pagesLABORATORIO Nro 1 FISICOQUIMICA DETERMINACION DE LA RELACION PRESION-VOLUMEN A TEMPERATURA CONSTANTE (LEY DE BOYLE)jimy lopez sednaoNo ratings yet
- Practica 2 Balance de Energia en Estado Inestable Mezclado No Ideal Intermitente de SolucionDocument6 pagesPractica 2 Balance de Energia en Estado Inestable Mezclado No Ideal Intermitente de SolucionSusette Diaz0% (1)
- Ecuacion de Van Der WaalsDocument3 pagesEcuacion de Van Der WaalsviridianaNo ratings yet
- Influencia de La Temperatura en La Presion de Vapor 1Document13 pagesInfluencia de La Temperatura en La Presion de Vapor 1Sandy Vanessa CardenasNo ratings yet
- Guia de Lab - Ley de CharlesDocument7 pagesGuia de Lab - Ley de CharlesMaria JoseNo ratings yet
- Reporte Práctica 1 Termodinámica Sara Natalia Rodríguez PérezDocument10 pagesReporte Práctica 1 Termodinámica Sara Natalia Rodríguez Pérezsrodriguez90No ratings yet
- Tpn3 GasesDocument6 pagesTpn3 GasesFeryi RudoNo ratings yet
- Previo P3 Vázquez Domínguez NataliaDocument5 pagesPrevio P3 Vázquez Domínguez NataliaNatalia VázquezNo ratings yet
- GasesDocument6 pagesGasesJose Chavez TobarNo ratings yet
- Unidad 8 Quimica GasesDocument10 pagesUnidad 8 Quimica GasesTobyKNo ratings yet
- Tema 2 GasesDocument8 pagesTema 2 GasesLuisa Gallo Martínez100% (2)
- Ecuaciones gases realesDocument13 pagesEcuaciones gases realesCristian Ccaso MamaniNo ratings yet
- Gases Ideales VirtuallIIIDocument11 pagesGases Ideales VirtuallIIIZaida SuniNo ratings yet
- Cuestiones y Problemas Complementarios PDFDocument4 pagesCuestiones y Problemas Complementarios PDFsërgî_cörlèónëNo ratings yet
- Informe Quimica 7Document8 pagesInforme Quimica 7Camila Fernanda Leon HurtadoNo ratings yet
- Práctica 1Document5 pagesPráctica 1Paulina NoriegaNo ratings yet
- Sesión 4 Gases Ideales y RealesDocument8 pagesSesión 4 Gases Ideales y RealesPaola Stefania Villarreal VeraNo ratings yet
- Informe #01 (Fisico Quimica y Operaciones Unitarias)Document37 pagesInforme #01 (Fisico Quimica y Operaciones Unitarias)Anonymous TXTsNZO0K8No ratings yet
- Seminarios FisicoquimicaDocument41 pagesSeminarios FisicoquimicaAgustin GonzálezNo ratings yet
- Tema 2 UnlockedDocument18 pagesTema 2 UnlockedSaruman ElpuretaNo ratings yet
- Mezcla de GasesDocument35 pagesMezcla de GasesDIEGO FERNANDO CHECA INTINo ratings yet
- PresiónVaporLíquidoDocument7 pagesPresiónVaporLíquidoGISELLA SOFIA LEAL PERTUZNo ratings yet
- Trabajo Gases Ideales y RealesDocument18 pagesTrabajo Gases Ideales y RealesyolijimNo ratings yet
- Cap 7 Gases Ideales 19 Mayo 2013 PDFDocument14 pagesCap 7 Gases Ideales 19 Mayo 2013 PDFKriiztal GodinezNo ratings yet
- Ecuación de RedLich-KwongDocument10 pagesEcuación de RedLich-KwongDomingo A. Aldana NoelNo ratings yet
- Fisicoquimica P2Document13 pagesFisicoquimica P2Paul Silva GalvezNo ratings yet
- Yacimientos 1Document45 pagesYacimientos 1Jose ReyesNo ratings yet
- PVD técnicas deposición películas delgadasDocument11 pagesPVD técnicas deposición películas delgadasCarlos Soto ValleNo ratings yet
- Trabajo No.2 - Química InorgánicaDocument8 pagesTrabajo No.2 - Química InorgánicaLinita Rios FernandezNo ratings yet
- Taller 1 - Masa y VolumenDocument254 pagesTaller 1 - Masa y VolumenRufina Tamayo0% (1)
- Estática de Fluidos: Principios y AplicacionesDocument36 pagesEstática de Fluidos: Principios y AplicacionesNANCY HENDES CARREÑONo ratings yet
- QUIMICADocument5 pagesQUIMICABerlysNo ratings yet
- TP2 Fisicoquimica Estados de La MateriaDocument12 pagesTP2 Fisicoquimica Estados de La MateriaPrograma EncuentroNo ratings yet
- 9.info TEC. FARMACEUTICA P#9Document8 pages9.info TEC. FARMACEUTICA P#9Lucero Carhuas IncheNo ratings yet
- Reporte P2 - Lab - TermodinamicaDocument15 pagesReporte P2 - Lab - TermodinamicaAnnel AquinoNo ratings yet
- Curso Barriles V1Document30 pagesCurso Barriles V1Gustavo FalcoNo ratings yet
- Procedimiento Prueba - Anh PDFDocument6 pagesProcedimiento Prueba - Anh PDFV Gissell UY100% (1)
- EtequiometriaDocument7 pagesEtequiometriaJuliana CastañedaNo ratings yet
- Propueesta Titulacion NitrogenoDocument11 pagesPropueesta Titulacion NitrogenoRF CCNo ratings yet
- Energia Producida (Final I)Document122 pagesEnergia Producida (Final I)Antonio Vasquez AragonNo ratings yet
- Sist hidráulico mesa elevadoraDocument17 pagesSist hidráulico mesa elevadoraAlex H. De la Cruz100% (1)
- 1 Ejercicios Balances de Mada y EnergíaDocument3 pages1 Ejercicios Balances de Mada y EnergíaEmily Yessenia Cherrez MonteroNo ratings yet
- Practica 3 Laboratorio FisicoquimicaDocument19 pagesPractica 3 Laboratorio FisicoquimicaItledf Del Águila DFNo ratings yet
- Tabla Difusividad GasesDocument3 pagesTabla Difusividad GasesCamilo Andres Picon PradaNo ratings yet
- 1-Sistemas MulticompuestosDocument128 pages1-Sistemas MulticompuestosGerman Orlando Salcedo SarmientoNo ratings yet
- Resortes de gas MontcadaDocument31 pagesResortes de gas MontcadaEmanuelNo ratings yet
- TQI-G1-C Relaciones PVT para GasesDocument20 pagesTQI-G1-C Relaciones PVT para GasesDelmy GonzálezNo ratings yet
- Tema 4. Gases IdealesDocument17 pagesTema 4. Gases IdealesBrisman Ricardo Palacin VargasNo ratings yet
- Presentación - Unidad 05 G de V ComponentesDocument49 pagesPresentación - Unidad 05 G de V ComponentesLeandroNo ratings yet
- Transferencia de MasaDocument39 pagesTransferencia de MasaJuan CantizianoNo ratings yet