Professional Documents
Culture Documents
PH, Acidez, Alcalinidad y Dureza
Uploaded by
Nicolás Duque GardeazábalOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
PH, Acidez, Alcalinidad y Dureza
Uploaded by
Nicolás Duque GardeazábalCopyright:
Available Formats
1
DETERMINACIN DE pH, ACEIDEZ, ALCALINIDAD, Y DUREZA EN
MUESTRAS DE AGUA.
Nicols Duque, Cdigo: 214796
nduqueg@unal.edu.co
Manuel Alejandro Montero, Cdigo: 244655
mamonteros@unal.edu.co
Andrea Vergara Villada, Cdigo: 215189
ayvergarav@unal.edu.co
1. INTRODUCCIN
El control de la calidad del agua implica el establecimiento de criterios de calidad para
definir los lineamientos y normas o requisitos mnimos que debe satisfacer un agua para
que sea apropiada para un uso determinado. La medicin de pH, acidez, alcalinidad y
dureza en las muestras, es hoy en da una de las medidas analticas ms importantes en
el control de calidad de las mismas. La acidez y alcalinidad son utilizados como
indicadores de la productividad de cuerpos de agua naturales; adems, estas medidas (de
alcalinidad especialmente) son utilizados en la interpretacin y control del tratamiento de
aguas claras y aguas residuales. Por ejemplo, las aguas residuales crudas de
origen domstico tienen una alcalinidad menor de o ligeramente mayor que el
suministro de agua potable. Otro parmetro utilizado con gran frecuencia es la dureza, y
esta es definida como la suma de las concentraciones de calcio y magnesio, expresadas
como CaCO3 en mg/L. El rango de dureza vara entre 0 y cientos de mg/L, dependiendo
de la fuente de agua y el tratamiento a que haya sido sometida. A continuacin se
presenta un estudio de calidad de 6 muestras diferentes, mediante la determinacin de la
dureza, pH, alcalinidad y acidez de cada una de ellas, con su anlisis respectivo.
2. OBJETIVOS
Determinar la calidad del agua a travs de los parmetros posibles de obtener por
mtodos volumtricos.
Calcular la dureza total, clcica y magnesica de las muestras de agua dadas a
partir de datos experimentales.
Emplear un medidor de pH para la caracterizacin y anlisis inicial de las muestras
de agua.
Utilizar el diagrama de distribucin de especies como instrumento inicial de la
caracterizacin de la muestra de agua.
Determinar la acidez debida a sales hidrolizables y/o minerales de las muestras
problema de agua.
2
Determinar la alcalinidad debida a hidrxidos, bicarbonatos y/o carbonatos de las
muestras de agua dadas.
3. DATOS
A partir de mtodos volumtricos, se obtuvieron los resultados experimentales de la tabla
1. La muestra 4-32177 presentaba olores fuertes imposibilitando el anlisis qumico.
Tabla 1: Datos experimentales obtenidos en laboratorio.
Muestra pH
Alcalinidad Acidez
Dureza
Clcica
Dureza
Total
Mixto (Verde
Bromocresol/Rojo
de Metilo)
Naranja
de Metilo
Total
Naranja
de Metilo
Fenolftalena Total
ml H2SO4 (0,02N) ml NaOH (0,02N) ml EDTA (0,02N)
1-32179 7,83 0 12,5 12,5 0 2,4 2,4 4,4 5,1
2-32151 10,55 6,6 6,4 13,0 0 0 0 0,8 2,1
3-32156 11,32 5,5 2,6 8,1 0 0 0 1,4 2,1
4-32177 8,35 - - - - - - - -
5-32104 5,65 0 0,2 0,2 0 9,8 9,8 1,3 5
Para el clculo de los diferentes parmetros se tomaron los valores experimentales y se
determin caractersticas fisicoqumicas de cada muestra.
4. RESULTADOS Y DISCUSIN
ALCALINIDAD
Muestra 1 32179
Debido a que el volumen gastado de H
2
SO
4
para el viraje del indicador mixto es igual a
cero y el volumen total gastado de H
2
SO
4
, es solo debida al viraje por naranja de metilo,
segn las heursticas y el diagrama de distribucin de especies, se tiene alcalinidad
debida a bicarbonatos, donde el volumen para el clculo es igual al volumen total.
Muestra 2 32151
3
Debido a que el volumen gastado de H
2
SO
4
para el viraje del indicador mixto es mayor a
del volumen total gastado de H
2
SO
4
, segn las heursticas y el diagrama de distribucin
de especies, se tiene alcalinidad debida a hidrxidos y a carbonatos, donde el volumen
para el clculo debida hidrxidos es igual 2F-T y la alcalinidad debida a carbonatos es
igual a 2NM o 2(T-F). (F = Volumen a Fenolftalena, T = Volumen Total, NM =Volumen a
naranja de metilo).
Muestra 3 - 32156
Al igual que la muestra anterior, segn las heursticas y el diagrama de distribucin, se
tiene alcalinidad debida a hidrxidos y a carbonatos.
Muestra 5 32104
Debido a que el volumen gastado de H
2
SO
4
para el viraje del indicador mixto es igual a
cero y el volumen total gastado de H
2
SO
4
, es solo debida al viraje por naranja de metilo,
segn las heursticas y el diagrama de distribucin de especies, se tiene alcalinidad
4
debida a una leve concentracin de bicarbonatos, donde el volumen para el clculo es
igual al volumen total.
ACIDEZ
Muestra 1 32179
En este caso al tener un pH entre 4,5 y 8,5 solo se tiene acidez debida a sales
hidrolizables y a CO
2
, por lo cual la acidez total es igual a este tipo de acidez.
Muestra 2 32151
Debido a que el pH es mayor al punto de viraje de la fenolftalena se tiene un valor de
acidez igual a cero.
Muestra 3 32156
Al igual que la muestra anterior, el pH de la muestra es mayor al punto de viraje de la
fenolftalena, por consiguiente la acidez ser igual a cero.
Muestra 5 32104
En este caso al tener un pH entre 4,5 y 8,5 solo se tiene acidez debida a sales
hidrolizables y a CO
2
, por lo cual la acidez total es igual a este tipo de acidez.
DUREZA TOTAL (DT), CALCICA Y MAGNESICA
Para el clculo de la dureza total se tiene en cuenta el volumen gastado de EDTA para el
cambio de viraje con el indicador NET (Negro de eriocromo T). Para la dureza clcica se
tiene en cuenta el volumen gastado de EDTA para el cambio de viraje con Murexide, y la
dureza por magnesio es determinada por la diferencia entre ambas durezas.
Muestra 1 32179
Muestra 2 32151
Muestra 3 32156
6
Muestra 5 32104
DUREZA CARBONACEA (DC) Y NO CARBONACEA (DNC)
Muestra 1 32179
Para el clculo se debe tener en cuenta la Dureza total (DT) es
y la
alcalinidad total (AT) que es 250
, para lo cual tenemos
Con la anterior relacin se determina:
Muestra 2 32151
Para el clculo se debe tener en cuenta la Dureza total (DT) que es
y la
alcalinidad total (AT) que es
, para lo cual tenemos
7
Con la anterior relacin se determina:
Muestra 3 32156
Para el clculo se debe tener en cuenta la Dureza total (DT) que es
y la
alcalinidad total (AT) que es
, para lo cual tenemos
Con la anterior relacin se determina:
Muestra 5 32104
Para el clculo se debe tener en cuenta la Dureza total (DT) es
y la
alcalinidad total (AT) que es 20
, para lo cual tenemos
Con la anterior relacin se determina:
En la tabla 2, se presenta los resultados finales de acidez, alcalinidad, pH y dureza para
las diversas muestras problema.
Tabla 2: Resultados a partir de los datos experimentales obtenidos en laboratorio.
Alcalinidad (mg CaCO
3
/L) Acidez(mg CaCO
3
/L) Dureza(mg
CaCO
3
/L)
(mg
CaCO
3
/L)
(mg
CaCO
3
/L)
Muestra pH Total HCO
3
-
CO
3
-
OH
-
Total SyCO
2
Mineral DT Dca DMg DC DNC
32179 7,83 250 250 0 0 240 240 0 510 440 70 250 260
32151 10,55 260 0 256 4 0 0 0 210 80 130 210 0
32156 11,32 810 0 520 290 0 0 0 210 140 70 210 0
32104 5,65 20 20 0 0 196 196 0 500 130 370 20 480
32185 7,69
8
Los valores de alcalinidad presentados para las muestras 32179, 32151 y 32156 tienen un
alto valor, lo cual se considera que es una solucin muy amortiguadora y no solo esto, si
no que hace parte importante para el desarrollo de diversas especies porque es til como
reserva de CO2 necesario para el proceso de la fotosntesis; para la muestra 32104 se
tiene un pH bajo y la alcalinidad presentada es igual a 20 mg CaCO
3
/L indicando que
debe ser agua tomada de un vertimiento o de una fuente contaminada debido a que los
valores tpicos en diferentes cuerpos de agua son superiores a 20mg CaCO
3
/L. De igual
manera si se requiere un tratamiento posterior como la coagulacin-floculacin es
importante que el agua contenga algn grado de alcalinidad ya que al realizar este
proceso se consume especies responsables de la basicidad y en el caso de las muestras
32179 y 32104 el pH esta entre 5 y 9 posibilitando las operaciones de tratamiento para el
vertimiento de estas aguas a los cuerpos de agua. En las muestras 32156 y 32151 es
necesario hacer un ajuste del pH ya que estn en un valor muy alcalino.
Para las muestras 32151 y 32156 no se presentan valores de acidez, debido a que el pH
es superior a 8.3, lo cual indica que no existen contaminacin ya sea natural o antrpica
por minerales, y de igual manera indica que no existen sales hidrolizables, la muestra
32179 contiene tanto acidez como alcalinidad, dado por el pH intermedio que presenta, la
acidez de esta muestra se debe a algunas sales hidrolizables y la alcalinidad es debido
ms que todo a iones bicarbonatos, mientras que para la muestra 32104 se tiene una
acidez relativamente alta con un valor de 196 mg CaCO3/L, y debido al pH que tiene
puede indicar que esta cantidad se encuentra ms relacionado con la presencia de sales
hidrolizables, la muestra est por encima de un pH de 4,5 lo que conlleva la presencia de
una alcalinidad mnima de 20 mg CaCO
3
/L generada por iones bicarbonato este valor de
acidez se presenta posiblemente por accin humana indicando un vertimiento aguas
arribas de actividades no reguladas que podran ser de inters para los organismos de
vigilancia, control y del debido cumplimiento del decreto 3930 de 2010.
Ninguna de las muestras analizadas presentaron acides por compuestos minerales, ya
que todas tienen un pH superior a 4,5. Por lo anterior la acidez presente en las muestras
se deben a cidos dbiles con poco poder de disociacin, en la mayora de casos por
sales hidrolizables. Para dos muestras analizadas el pH es muy alcalino que a su vez
tiene relacin con los resultados obtenidos de dureza.
Para la determinacin de la dureza se utiliz un mtodo volumtrico por titulacin con
EDTA e indicadores orgnicos en donde se determin las dureza debida a iones de calcio
y magnesio, as mismo se calcul la dureza total que tiene en cuenta otros iones
polivalentes de menor importancia y cantidad.
Todas las muestras analizadas en el presente escrito, tienen valores de durezas elevadas
superiores a 200 mg CaCO
3
/L, lo cual clasifica a estas como agua dura, siendo necesario
una operacin en el tratamiento de agua que remueva los iones calcio y magnesio
responsables de la dureza, como el uso de zeolitas o resinas de intercambio inico, esta
dureza afectara los equipos domsticos e industriales como calderas, chaquetas de
reactores, intercambiadores de calor entre otros.
9
Las muestras 32151 y 32156 tienen un pH alcalino generado por la presencia de iones
carbonatos, hidrxidos y trazas de bicarbonatos, por esto ltimo la dureza carbonacea en
estas dos muestras es relativamente baja a comparacion de las otras dos muestras, ya
que no presenta alta cantidad de bicarbonato. La Dureza de estas dos muestras es menor
a las muestras 32104 y 32179 porque estas dos ltimas adems de presentar contenidos
altos de bicarbonato expresadas en el valor de dureza carbonacea, contienen valores
altos de dureza no carbonacea traducidas en aniones de la muestra.
5. CUESTIONARIO
1. Cul es el pH aproximado de una solucin 2,0 N de HCl?
El pH de una solucin se calcula de la siguiente manera.
[
]
HClH
+
+ Cl
-
La concentracin de cido clorhdrico es de 2.0 N, por ser una molecular con un solo ion
hidronio, esta concentracin normal, ser la misma molar. Por lo anterior, la concentracin
de este acido ser de 2 mol/L.
El cido clorhdrico es un cido fuerte que se disocia completamente en ion hidronio y ion
cloruro, por consiguiente la concentracin del ion hidronio es de 2 mol/L.
Entonces el pH ser:
[ ]
Matemticamente el pH de esta solucin de cido clorhdrico es incoherente ya que la
escala de pH esta entre 0 y 14. Para soluciones muy concentradas como este caso, el pH
se aproxima a 0, ya que para un pH igual a cero de una solucin de cido clorhdrico, la
concentracin de esta debe ser de 1 N.
2. Cul es el pH aproximado de una solucin 0,02 N de NaOH?
Para calcular el pH de una solucin acuosa bsica es necesario utilizar la siguiente
formula.
[
]
Por ser una base, es necesario hacer uso la ecuacin que involucra la constante de
ionizacin de 10
-14
.
[
][
10
El hidrxido de sodio es una base fuerte, por consiguiente presenta una ionizacin
completa
NaOHNa
+
+ OH
-
Adems de lo anterior, esta base presenta solamente una unidad formula del ion hidroxilo,
lo que permite igualar las concentraciones en normalidad a molaridad, por consiguiente, la
concentracin de iones hidroxilo del hidrxido de sodio es de 0,02 mol/L.
[
][]
]
Para soluciones con alta concentracin de base, el pH se acercara a 14.
3. Cul es la concentracin del ion hidrxido si la concentracin del ion
hidrogeno es 3,0x10
-2
mol/L?
A partir de la constante de ionizacin se puede realizar el clculo de iones hidronio o
hidroxilo a partir del otro par conocido.
[
][
][
4. Una muestra de agua recolectada en el campo tena pH de 6,8. En el
momento de la llegada de la muestra al laboratorio para el anlisis, el pH
haba aumentado a 7,5. De una posible explicacin a este cambio.
Si la muestra de agua pertenece a una fuente en la cual los contenidos de dixido de
carbono son elevados, puede presentarse el incremento del pH en un tiempo
determinado, ya que este oxido acido puede reaccionar con los iones hidronio del agua; si
las condiciones de presin y temperatura son diferentes de un lugar a otro, puede
aumentar la velocidad de reaccin del CO
2
, convirtindose paulatinamente en
bicarbonatos o carbonatos, dependiendo del tiempo que dure la muestra si analizar, y
cambios de temperatura y presin, generando un aumento del pH.
5. Se observ que un abastecimiento de agua tena una concentracin de ion
bicarbonato de 50 mg/L y un contenido de CO
2
de 30 mg/L. Calcule el pH
aproximado del agua (temperatura de 25C)
El pH de una solucin en equilibrio de bicarbonato y dixido de carbono se calcula a partir
de la frmula de Henderson-Hasselbach.
11
[
]
[
]
El pK para el sistema bicarbonato/dixido de carbono a 25 C es de 6,3; adems de esto
las unidades de concentracin para aplicar en la formula anterior deben estar en mol/L.
) (
)
) (
)
]
[
]
El pH de la muestra de agua con los contenidos de dixido de carbono y bicarbonato
descritos anteriormente es de 6,4.
Si el contenido de CO
2
del agua anterior se redujera a 3 mg/L por aireacin
Cul sera entonces el pH?
[
]
[
) (
)
]
[
]
El pH para una muestra con solamente 3 mg/L de dixido de carbono y 50 mg/L de
bicarbonato es de 7,4; la diferencia con la muestra con 30 mg/L de CO
2
, es que al
remover el dixido de carbono por aireacin se elimina la posibilidad de generacin de
cido carbnico que pueda disminuir el pH.
6. Al realizar un anlisis en una serie de muestras, se encontraron los
siguientes valores de pH: 5,5; 3,0; 11,2; 8,5; 7,4; 9,0; Qu concluye usted
con respecto a la posible presencia de una alcalinidad considerable de
bicarbonato, carbonato e hidrxido en cada muestra?
La alcalinidad que presenta una muestra de agua por la presencia de ion bicarbonato,
carbonato e hidrxidos, se analiza de una mejor manera con el diagrama de distribucin
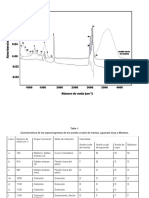
de especies del dixido de carbono que se presenta en la figura 1.
12
Figura 1: Formas de carbono inorgnico a diferente pH.
Para una muestra de agua de pH 5,5 la especie predominante ser el dixido de carbono
que a su vez reaccionara con el agua del medio para producir cido carbnico sin
disociarse, por consiguiente el pH ser de carcter acido.
La muestra con pH 3,0 no presentara alcalinidad debido a que la nica especie en
solucin ser el dixido de carbono que reaccionara para producir acido carbnico, as
que el medio es totalmente acido.
La muestra de pH 11,2 ser de carcter bsico con presencia de carbonatos e hidrxidos
con trazas de ion bicarbonato, segn el diagrama de distribucin de especies, se puede
apreciar que a este pH el porcentaje de ion carbonato se aproxima al 80%, en este caso,
no habr presencia de dixido de carbono que pueda generar la conversin de cido
carbnico, es por esto que la muestra es totalmente alcalina.
A un pH de 8,5 la especie predominante son los iones bicarbonatos, en el diagrama de
distribucin de la figura 1, se puede apreciar que aproximadamente el 98% es ion
bicarbonato y el restante har parte de leves contenidos de dixido de carbono que le
dar la tenue acidez, y el ion carbonato que promueve la alcalinidad de la muestra.
Un pH de 7,4 expresa una acidez ms elevada que la muestra anterior, esto se debe a
que los porcentajes de ion bicarbonato se reduce a 85% y el resto es dixido de carbono
que promueve la formacin de cido carbnico.
En la muestra de pH 9, se promueve la alcalinidad debido a la presencia de iones
carbonatos en casi un 10% segn el diagrama de distribucin de especies, contrario a la
muestra con pH 7,4.
7. Suponiendo que el efecto de las sales disueltas sobre la actividad inica es
insignificante y que la temperatura de la muestra de agua es de 25 C:
a. Calcule la concentracin del ion bicarbonato (en mg/L como HCO
3
-
) si
el pH de la muestra es 10,3 y si la concentracin de carbonato es 120
mg/L (como CO
3
-2
)
EL clculo de la concentracin de ion bicarbonato a partir del contenido de carbonato ser
realiza a partir de la reaccin reversible de disociacin del bicarbonato.
13
HCO
3
-
CO
3
-2
+ H
+
Partiendo de la ecuacin de Henderson-Hasselbach, con una constante pK=10.33 a 25C,
se encuentra el valor de la siguiente manera.
[
]
[
)(
)
[]
[
]
Entonces
[
(
) (
)
La concentracin de bicarbonato en la solucin descrita es de 128 mg/L.
b. Calcule las alcalinidades por hidrxido, carbonato, bicarbonato y total
de la solucin anterior.
(
) (
)
(
) (
)
La alcalinidad de la muestra por bicarbonatos es de 210 mg CaCO
3
/L y por carbonatos de
200 mg CaCO
3
/L. Esto quiere decir que el porcentaje de bicarbonato es 49% y 51% para
carbonatos, y analizando el diagrama de distribucin de especies, el pH de esta solucin
ser aproximadamente 10.3.
8. CONCLUSIONES
Para las muestras 32151 y 32156 con altos valores de alcalinidad, es
importante conocer la fuente de las muestras y su turbiedad, ya que debe ser
necesario un tratamiento de coagulacin-floculacin y esta alcalinidad favorece
el proceso; posteriormente es de importancia neutralizar los vertimientos para
no causar daos al medio ambiente.
14
La muestra 32104 presenta una alta acidez debida a sales hidrolizables lo cual
facilita el tratamiento con bases dbiles para la neutralizacin de las aguas.
Ninguna de las aguas puede ser utilizada para uso industrial, debido a su alto
contenido de iones calcio y magnesio representados en la dureza total. Es
necesario hacer un tratamiento con resinas de intercambio inico o tierras
adsorbentes.
El tratamiento de la muestra 32179 y 32104, cuya dureza es no carbonacea,
debe ser diseado de forma distinta a las otras dos muestras que presentan
solo dureza carbonacea de acuerdo al uso final que se le piense dar al agua de
dicha fuente
La muestra 32179 tiene un pH de 7.83 estable para ser vertida en cuerpos de
agua, pero es necesario hacer un tratamiento que remueva la dureza clcica.
9. BIBLIOGRAFA
- Biblioteca virtual de desarrollo sostenible y salud ambiental. Control de calidad del
agua y anlisis de las normas. Documento disponible en lnea. Consultado
27/09/14.
http://www.bvsde.paho.org/bvsacd/scan2/031275/031275.pdf
- Fisicanet. Determinacin de la dureza en aguas mediante volumetra
complejomtrica. Documento disponible en lnea. Consultado 27/09/14.
http://www.fisicanet.com.ar/quimica/aguas/lb01_agua_dureza.php
- Recinto Universitario de Mayaguez, Puerto Rico. Manual de Ecologa. Documento
disponible en lnea. Consultado 27/09/14.
http://www.uprm.edu/biology/profs/massol/manual/p2-alcalinidad.pdf
You might also like
- Determinacion de Acidez-BROMATOLOGIADocument3 pagesDeterminacion de Acidez-BROMATOLOGIASofía Ochoa AstudilloNo ratings yet
- Traduccion Organica Practica 1Document11 pagesTraduccion Organica Practica 1Juliana Silva MejiaNo ratings yet
- 2532 CondimentosDocument10 pages2532 CondimentosCarlosEstevezLucasNo ratings yet
- Practica. Pardeamiento No EnzimaticoDocument6 pagesPractica. Pardeamiento No EnzimaticotocacorazonesNo ratings yet
- Guia TP 2 Quimica II 2010Document6 pagesGuia TP 2 Quimica II 2010NathalieAsselbornNo ratings yet
- Actividades EspectrofotometríaDocument12 pagesActividades EspectrofotometríaEva SotoNo ratings yet
- Determinación de La Densidad Relativa para Grasas y Aceites Líquidos A 25°CDocument4 pagesDeterminación de La Densidad Relativa para Grasas y Aceites Líquidos A 25°Cjesus guzmanNo ratings yet
- Separacion de Dicromato Permanganato Usando Una Columna de AlúminaDocument6 pagesSeparacion de Dicromato Permanganato Usando Una Columna de AlúminaSamuel Fernando DelgadoNo ratings yet
- Informe de Instrumental Vit CDocument8 pagesInforme de Instrumental Vit CCristian HernándezNo ratings yet
- Control de CalidadDocument6 pagesControl de CalidadErick CastañoNo ratings yet
- Informe-Evaluacion Del Policloruro de Aluminio PAC - 2017Document9 pagesInforme-Evaluacion Del Policloruro de Aluminio PAC - 2017nelly giovanna quequejana condoriNo ratings yet
- Informe Cromatografía de GasesDocument13 pagesInforme Cromatografía de GasesMariana MontoyaNo ratings yet
- Practica N 02 Ucsm Analisis 1 2021Document10 pagesPractica N 02 Ucsm Analisis 1 2021dante bianchiNo ratings yet
- Informe Curva de CalibraciónDocument4 pagesInforme Curva de CalibraciónDaniel Felipe Narvaez RodriguezNo ratings yet
- Análisis Del Proceso Usando Las Graficas de Control-IrwinDocument8 pagesAnálisis Del Proceso Usando Las Graficas de Control-IrwinIrwin Barrera MioNo ratings yet
- Articulo Infrarrojo Con Ejemplo Ir Aceite Soja UsadoDocument10 pagesArticulo Infrarrojo Con Ejemplo Ir Aceite Soja UsadoJorge EsquerreNo ratings yet
- Pract. #2 Extracción de ADNDocument5 pagesPract. #2 Extracción de ADNSandy BernalNo ratings yet
- Pruebas de PlataformaDocument7 pagesPruebas de PlataformaYOHNNY ALEXÁNDER YEPES CATAÑONo ratings yet
- Separación e Identificación de Ác. Grasos Por CCFDocument6 pagesSeparación e Identificación de Ác. Grasos Por CCFMaría José100% (2)
- Determinación de Ácido Ascórbico Por Cromatografía Líquida de Alta Eficiencia (HPLC)Document10 pagesDeterminación de Ácido Ascórbico Por Cromatografía Líquida de Alta Eficiencia (HPLC)Calidad LassNo ratings yet
- Informe ArgentometriaDocument5 pagesInforme ArgentometriaPaola JosefaNo ratings yet
- Determinación Bromatológica de La Malta de CebadaDocument14 pagesDeterminación Bromatológica de La Malta de CebadaCristhianNo ratings yet
- Determinación de Vitamina C en Pimiento Capsicum Annuum Por Voltametría de Barrido LinealDocument6 pagesDeterminación de Vitamina C en Pimiento Capsicum Annuum Por Voltametría de Barrido LinealSaritaGrisalesNo ratings yet
- Aislamiento de Trans-Anetol de Anís Estrellado Por HidrodestilaciónDocument4 pagesAislamiento de Trans-Anetol de Anís Estrellado Por HidrodestilaciónJuan Sebastian CeballosNo ratings yet
- Informe 4 Analisis Regresion LinealDocument12 pagesInforme 4 Analisis Regresion Linealjose david perez navarroNo ratings yet
- Informe-Complejometria y Dureza Del AguaDocument4 pagesInforme-Complejometria y Dureza Del AguaCarlos Morales CocolitoNo ratings yet
- Agar TsaDocument4 pagesAgar TsaRaylan Bhfiach AirgidNo ratings yet
- Cuestionario 8Document5 pagesCuestionario 8jansNo ratings yet
- Reporte Análisis No.5Document8 pagesReporte Análisis No.5andrea munguiaNo ratings yet
- Guía No 2. Determinación de Algunos Parámetros de La Calidad Del Agua - 2018 2sDocument8 pagesGuía No 2. Determinación de Algunos Parámetros de La Calidad Del Agua - 2018 2sDiana GarciaNo ratings yet
- Practica de Metabolitos SecundariosDocument5 pagesPractica de Metabolitos SecundariosPersephone Obscure QueenNo ratings yet
- Informe EmbutidosDocument4 pagesInforme EmbutidosSamanta GonzálezNo ratings yet
- Análisis Químico Cuantitativo (3a. Ed.) - (1. Medidas) PDFDocument13 pagesAnálisis Químico Cuantitativo (3a. Ed.) - (1. Medidas) PDFvickyNo ratings yet
- Índice de Refracción de Grasa en Mantequilla y MargarinaDocument2 pagesÍndice de Refracción de Grasa en Mantequilla y MargarinaLuis Barrionuevo QuintanaNo ratings yet
- Cuestionario Bioquimica Clinica WraDocument10 pagesCuestionario Bioquimica Clinica WraWara OrellanaNo ratings yet
- Informe Análisis Microscópico y Adulteraciones 2022-1Document14 pagesInforme Análisis Microscópico y Adulteraciones 2022-1Angélica María González SánchezNo ratings yet
- Informe 10 Instrumental.1Document8 pagesInforme 10 Instrumental.1Maria Jose Huayamave RosadoNo ratings yet
- Tema 3 ValoracionesacidobaseDocument21 pagesTema 3 ValoracionesacidobaseKeittyn JimenezNo ratings yet
- Vocabulario U4 - Díaz Pibaque SaraiDocument3 pagesVocabulario U4 - Díaz Pibaque SaraiSarai DP0% (1)
- Filtración Por GravedadDocument2 pagesFiltración Por GravedadLuis de la CruzNo ratings yet
- Determinación de Acidez y AlcalinidadDocument2 pagesDeterminación de Acidez y AlcalinidadCabrera FrancoNo ratings yet
- Analisis de Galleta y FideosDocument7 pagesAnalisis de Galleta y Fideosuriel pumaNo ratings yet
- Procedimiento de Viscosímetro de Oswald - DinalDocument23 pagesProcedimiento de Viscosímetro de Oswald - DinalJhefry Othmad Manrique VasquezNo ratings yet
- Colorimetria y Curva de Calibracion 1A PDFDocument6 pagesColorimetria y Curva de Calibracion 1A PDFjulieth cNo ratings yet
- Hidrólisis Enzimática Del Gluten de Trigo Por Proteasas y Propiedades de Los Hidrolizados Resultantes - ScienceDirectDocument12 pagesHidrólisis Enzimática Del Gluten de Trigo Por Proteasas y Propiedades de Los Hidrolizados Resultantes - ScienceDirectKatherine Rocio Obeid ManjarrezNo ratings yet
- Deterinacion de Azucares Reductores en Leche CondensadaDocument3 pagesDeterinacion de Azucares Reductores en Leche CondensadaCarolina Tasayco YncaNo ratings yet
- Infografias - BPLDocument1 pageInfografias - BPLAlex MontoyaNo ratings yet
- Practica 3Document9 pagesPractica 3Gunnar DieGo0% (1)
- Extracción Acido Base Por Formación de SalesDocument3 pagesExtracción Acido Base Por Formación de SalesyeseniaNo ratings yet
- Los AlcaloidesDocument2 pagesLos AlcaloidesJean camilo PorrasNo ratings yet
- Determinacion de Acidez y Alcalinidad en Muestras Específicas de AguaDocument4 pagesDeterminacion de Acidez y Alcalinidad en Muestras Específicas de AguaYesika AlmanzaNo ratings yet
- Informe HPLC AcetaminofenDocument7 pagesInforme HPLC AcetaminofenPatricia MunozNo ratings yet
- Titulacion ArgentometricasDocument7 pagesTitulacion ArgentometricasLaura SofiaNo ratings yet
- Ooooorganica de AlquilosDocument1 pageOoooorganica de AlquilosElizabeth AngaritaNo ratings yet
- Determinación de Etanol en Bebidas Alcoholicas Zavala 5Document12 pagesDeterminación de Etanol en Bebidas Alcoholicas Zavala 5Sandra Hg100% (2)
- SESION 01 Soluciones y DilucionesDocument43 pagesSESION 01 Soluciones y Dilucionesmarco antoniNo ratings yet
- Información General Acerca de Los Tamices Analíticos WS TylerDocument4 pagesInformación General Acerca de Los Tamices Analíticos WS TylerBruno CintraNo ratings yet
- Volumetria Redox - PermanganometriaDocument9 pagesVolumetria Redox - PermanganometriaDaniel GiraldoNo ratings yet
- Dureza y AlcalinidadDocument17 pagesDureza y AlcalinidadSergio Murillo BlondelNo ratings yet
- Ácido - Base y ComplejometríaDocument12 pagesÁcido - Base y Complejometría5 ntenidoNo ratings yet
- IHACRES PayandeDocument5 pagesIHACRES PayandeNicolás Duque GardeazábalNo ratings yet
- Canal de Derivacion BocatomaDocument27 pagesCanal de Derivacion BocatomaNicolás Duque GardeazábalNo ratings yet
- ResultadosFinales Carrera Atlética UNAL2013Document42 pagesResultadosFinales Carrera Atlética UNAL2013Nicolás Duque Gardeazábal0% (1)
- Practica (2) Transito 2012Document5 pagesPractica (2) Transito 2012Nicolás Duque GardeazábalNo ratings yet
- SuperpoblacionDocument4 pagesSuperpoblacionNicolás Duque GardeazábalNo ratings yet
- SO Manual de Prácticas PDFDocument31 pagesSO Manual de Prácticas PDFNicolle GarcíaNo ratings yet
- Determinacion de Calcio y FosforoDocument7 pagesDeterminacion de Calcio y FosforoSebastianNo ratings yet
- Determinación Del Contenido de Sal en Un Crudo Por El Método Del PotenciómetroDocument14 pagesDeterminación Del Contenido de Sal en Un Crudo Por El Método Del PotenciómetroJesus Coqueco100% (2)
- Reacciones QuímicasDocument10 pagesReacciones QuímicasJordannyLiranzoJacksonNo ratings yet
- CorrosivosDocument2 pagesCorrosivosCristopher AlcivarNo ratings yet
- Explicación - Práctica 9 Ácidos y Fuertes y Débiles 2020Document8 pagesExplicación - Práctica 9 Ácidos y Fuertes y Débiles 2020Daniel BVNo ratings yet
- Practica Com 18Document47 pagesPractica Com 18kaesar66No ratings yet
- Descomposición de Muestras Por Vía HumedaDocument14 pagesDescomposición de Muestras Por Vía HumedaGonzalez Daniel100% (1)
- Nitritos en AguaDocument11 pagesNitritos en AguaCarolina SpathNo ratings yet
- Informe de Laboratorio 2Document10 pagesInforme de Laboratorio 2MOISES DAVID HUAMAN TORRESNo ratings yet
- ACTIVIDAD FORMATIVA 1-IND.1 y 2-NOMENCLATURA, Estados oxidación-GREEN CHEMDocument2 pagesACTIVIDAD FORMATIVA 1-IND.1 y 2-NOMENCLATURA, Estados oxidación-GREEN CHEMGreicol BalmacedaNo ratings yet
- 2.5 Ejercicios de Cálculos Estequiométricos-Disoluciones Con RtaDocument5 pages2.5 Ejercicios de Cálculos Estequiométricos-Disoluciones Con RtaEugenia BogarinNo ratings yet
- Informe 4 Grupo 3 - Química InorgánicaDocument20 pagesInforme 4 Grupo 3 - Química InorgánicaRossy Mendoza HuertaNo ratings yet
- Confidor Forte 200 SLDocument7 pagesConfidor Forte 200 SLFrancisca Alejandra Avila CancinoNo ratings yet
- Observación Científica y Descripción: Práctica 1Document107 pagesObservación Científica y Descripción: Práctica 1Reynoso ferdgfNo ratings yet
- Quimica LaboratorioDocument7 pagesQuimica LaboratorioJoel Sanchez vasquezNo ratings yet
- P2-E1 - LQS R-Angel Mauricio Barreto Agundiz REPORTE FINAL CorregidoDocument34 pagesP2-E1 - LQS R-Angel Mauricio Barreto Agundiz REPORTE FINAL CorregidoLupita VazquezNo ratings yet
- QMC Anal Cual QMC106 (Cap V) Corvid19-1 PDFDocument43 pagesQMC Anal Cual QMC106 (Cap V) Corvid19-1 PDFMiguel Angel100% (1)
- Titulacion Acido Base y Determinacion de PH de Una Muestra ComercialDocument13 pagesTitulacion Acido Base y Determinacion de PH de Una Muestra ComercialFelipe VilchesNo ratings yet
- Informe Agroquímica - Acidez Titulable e IntercambiableDocument15 pagesInforme Agroquímica - Acidez Titulable e IntercambiableninachevliakovaNo ratings yet
- PRACTICA No 1 REACCIONES QUIMICASDocument2 pagesPRACTICA No 1 REACCIONES QUIMICASDiana Carolina Burbano RuanoNo ratings yet
- Zummer Caqp 1 A 3 para PDFDocument35 pagesZummer Caqp 1 A 3 para PDFDaniela Magalí SotoNo ratings yet
- El Lauril Éter Sulfato de SodioDocument2 pagesEl Lauril Éter Sulfato de SodioSoledad ColmenarezNo ratings yet
- Informe BioquimicaDocument9 pagesInforme BioquimicaYuli Alejandra Torres RequinivaNo ratings yet
- Practica n4Document3 pagesPractica n4Yomar GuillenNo ratings yet
- Quimica Aplicada en Procesos IndustrialesDocument108 pagesQuimica Aplicada en Procesos IndustrialesDiegoLiSaavedraNo ratings yet
- Guia GravimetríaDocument4 pagesGuia GravimetríaPablo PaillalíNo ratings yet
- ANALÍTICA CLASES Química Analítica2007 IER SEMESTREDocument68 pagesANALÍTICA CLASES Química Analítica2007 IER SEMESTREEMMAZELNo ratings yet
- Rúbrica Laboratorio Escolar - DanielDocument2 pagesRúbrica Laboratorio Escolar - DanieldanNo ratings yet