Professional Documents
Culture Documents
OXIDACIÓN
Uploaded by
Natalia StuartCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
OXIDACIÓN
Uploaded by
Natalia StuartCopyright:
Available Formats
OXIDACIN-REDUCCIN
CONTENIDOS.
1.- Estado de oxidacin.
2.- Concepto de oxidacin y reduccin.
2.1. Oxidantes y reductores.
3.- Ajuste de ecuaciones redoxpor el mtodo del in-electrn.
Estequiometra.
3.1. Reacciones en medio cido.
3.2. Reacciones en medio bsico.
4.- Valoraciones de oxidacin-reduccin.
5.- Pilas electroqumicas (clulas galvnicas).
5.1. Tipos de electrodos.
5.2. Pilas Daniell
5.3. Pilas y bateras comerciales.
6.- Potenciales de reduccin estndar. Escala de potenciales.
6.1. Determinacin del voltaje de una pila electroqumica.
6.2. Electrodo de hidrgeno. Pilas con hidrgeno.
6.3. Espontaneidad de los procesos redox.
7.- Electrlisis.
7.1. Aplicaciones.
7.2. Comparacin de la polaridad de los electrodos en pilas y electrlisis.
7.3. Ecuacin de Faraday.
8.- Aplicaciones industriales de procesos redox:
8.1. Electrlisis del cloruro de sodio.
8.2. Siderurgia y obtencin de metales.
8.3. Corrosin.
8.4. Proteccin catdica.
ESTADO DE OXIDACIN (E.O.) (O NMERO DE OXIDACIN).
Es la carga que tendra un tomo si todos sus enlaces fueran
inicos, es decir, considerando todos los enlaces covalentes polares
como si en vez de tener fracciones de carga tuvieran cargas completas.
En el caso de enlaces covalentes polares habra que suponer que la
pareja de electrones compartidos estn totalmente desplazados hacia el
elemento ms electronegativo.
El E.O. no tiene porqu ser la carga real que tiene un tomo, aunque
a veces coincide.
Principales estados de oxidacin.
Todos los elementos en estado neutro tienen E.O. = 0.
El oxgeno (O) en xidos, cidos y sales oxcidas tiene E.O. = 2.
El hidrgeno (H) tiene E.O. = 1 en los hidruros metlicos y +1 en
el resto de los casos que son la mayora.
Los metales formando parte de molculas tienen E.O. positivos.
Ejemplos
CO
2
: el tomo de C forma dos enlaces covalentes con dos tomos
de O ms electronegativo que l. Comparte los 4e
, pero para saber
cuales son los E.O. hay que suponer que el C los pierde, y que el O los
gana, con lo cual la carga que tendra el C sera +4 y la del O
2 E.O. (C) = +4; E.O. (O) = 2.
El S tiene estados de oxidacin +2, +4 y +6 segn comparta 2, 4 o
los 6 electrones de valencia con un elemento ms electronegativo (por
ejemplo O).
Clculo de estado de oxidacin (E.O.).
La suma de los E.O. de una molcula neutra es siempre 0 y de un
ion es igual a su carga elctrica.
Ejemplo de clculo de estados de oxidacin (E.O.).
Calcular el E.O. del S en ZnSO
4
E.O.(Zn) = +2; E.O.(O) = 2;
+2 + E.O.(S) + 4 (2) = 0 E.O.(S) = +6
Si se trata de un ion monoatmico es igual a su carga.
DEFINICIN DE OXIDACIN Y REDUCCIN.
El trmino OXIDACIN comenz a usarse para indicar que un
compuesto incrementaba la proporcin de tomos de Oxgeno.
Igualmente, se utiliz el termino de REDUCCIN para indicar una
disminucin en la proporcin de oxgeno.
Actualmente, ambos conceptos no van ligados a la mayor o menor
presencia de Oxgeno. Se utilizan las siguientes definiciones:
OXIDACIN: Prdida de electrones (o aumento en el nmero de
oxidacin).
REDUCCIN: Ganancia de electrones (o disminucin en el
nmero de oxidacin).
Siempre que se produce una oxidacin debe
producirse simultneamente una reduccin. Cada una de estas
reacciones se
denomina semirreaccin.
Ejemplos:
a) Si introducimos un electrodo de
cobre en una disolucin de AgNO
3
, de
manera espontnea el cobre se oxidar
pasando a la disolucin como Cu
2+
,
mientras que la Ag
+
de la misma se
reducir pasando a ser plata metlica:
a) Cu Cu
2+
+ 2e
(oxidacin); b) Ag
+
+ 1e
Ag (reduccin).
b) Igualmente, al introducir una lmina de cinc en una disolucin de
Pb(NO
3
)
2
, sta se recubre de una capa de plomo:
Zn Zn
2+
+ 2e
(oxidacin); Pb
2+
+ 2e
Pb (reduccin).
c) Al aadir HCl(ac) sobre Zn(s) se produce
ZnCl
2
y se desprende H
2
(g)que, al ser un gas
inflamable, produce una pequea explosin al
acercarle un cerilla encendida.
Ver vdeo (mpeg) (8,1 Mb) (wmv) (188 Kb)
Ejemplo:
Comprobar que la reaccin de formacin de hierro: Fe
2
O
3
+ 3 CO 2 Fe
+ 3 CO
2
es una reaccin redox. Indicar los E.O. de todos los elementos
antes y despus de la reaccin.
Reduccin: El Fe disminuye su E.O. de +3 a 0 luego se reduce
(cada tomo de Fe captura 3 electrones).
Oxidacin: El C aumenta su E.O. de +2 a +4 luego se oxida (en
este caso pasa de compartir 2e
con el O a compartir los 4 electrones).
OXIDANTES Y REDUCTORES
OXIDANTE: Es la sustancia capaz de oxidar a otra, con lo que
sta se reduce.
REDUCTOR: Es la sustancia capaz de reducir a otra, con lo que
sta se oxida.
Ejemplo:
Reaccin: Zn + 2 Ag
+
Zn
2+
+ 2Ag
Oxidacin: Zn (reductor) Zn
2+
+ 2e
Reduccin: Ag
+
(oxidante) + 1e
Ag
Ejercicio A (Selectividad. Madrid Previo 1998):
Formule, complete y ajuste las siguientes reacciones, justificando de que
tipo son: a) Cloruro de hidrgeno ms amoniaco. b) Carbonato
clcico ms calor. c) Cloro ms sodio. d) cido sulfrico ms zinc
metal.
AJUSTE DE REACCIONES REDOX (MTODO DEL ION-
ELECTRN)
Se basa en la conservacin tanto de la masa como de la carga (los
electrones que se pierden en la oxidacin son los mismos que los que se
ganan en la reduccin).
Se trata de escribir las dos semirreacciones que tienen lugar y
despus igualar el n de e
de ambas, para que al sumarlas los
electrones desaparezcan.
Etapas en el ajuste redox
Ejemplo:
Zn + AgNO
3
Zn(NO
3
)
2
+ Ag
Primera: Identificar los tomos que cambian su E.O.
Zn(0) Zn(+2); Ag (+1) Ag (0)
Segunda: Escribir semirreacciones con molculas o iones que existan
realmente en disolucin ajustando el n de tomos: (Zn, Ag
+
, NO
3
,
Zn
2+
, Ag)
Oxidacin: Zn Zn
2+
+ 2e
Reduccin: Ag
+
+ 1e
Ag
Tercera: Ajustar el n de electrones de forma que al sumar las dos
semirreacciones, stos desaparezcan.
En el ejemplo se consigue multiplicando la segunda semirreaccin
por 2.
Oxidacin: Zn Zn
2+
+ 2e
Reduccin: 2Ag
+
+ 2e
2Ag
R. global: Zn + 2Ag
+
+ 2e
Zn
2+
+ 2Ag + 2e
Cuarta: Escribir la reaccin qumica completa utilizando los coeficientes
hallados y aadiendo las molculas o iones que no intervienen
directamente en la reaccin redox (en el el ejemplo, el ion NO
3
) y
comprobando que toda la reaccin queda ajustada:
Zn + 2 AgNO
3
Zn(NO
3
)
2
+ 2 Ag
Si la reaccin se produce en disolucin acuosa, aparecen iones
poliatmicos con O (ej SO
4
2
), y el ajuste se complica pues
aparecen tambin iones H
+
, OH
as como molculas de
H
2
O.
Ajuste redox en medio cido.
En medio cido los tomos de O que se pierdan en la reduccin van
a parar al agua (los que se ganen en la oxidacin provienen del agua).
Los tomos de H provienen del cido.
Ejemplo:
KMnO
4
+ H
2
SO
4
+ KI MnSO
4
+ I
2
+ K
2
SO
4
+ H
2
O.
+1+7 2 +1+6 2 +11 +2 +6 2 0 +1 +6
2 +1 2
KMnO
4
+ H
2
SO
4
+ KI MnSO
4
+ I
2
+ K
2
SO
4
+
H
2
O
Primera: Identificar los tomos que cambian su E.O.:
Molculas o iones existentes en la disolucin:
KMnO
4
K
+
+ MnO
4
H
2
SO
4
2 H
+
+ SO
4
2
KI K
+
+I
MnSO
4
Mn
2+
+ SO
4
2
K
2
SO
4
2K
+
+ SO
4
2
I
2
y H
2
O estn sin disociar.
Segunda: Escribir semirreacciones con molculas o iones que existan
realmente en disolucin ajustando el n de tomos:
Oxidacin: 2 I
I
2
+ 2e
Reduccin: MnO
4
+ 8 H
+
+ 5e
Mn
2+
+ 4 H
2
O
Los 4 tomos de O del MnO
4
han ido a parar al H
2
O, pero para
formar sta se han necesitado adems 8 H
+
.
Tercera: Ajustar el n de electrones de forma que al sumar las dos
semirreacciones, stos desaparezcan:
Oxidacin: 5 x (2 I
I
2
+ 2e
)
Reduccin: 2 x (MnO
4
+ 8 H
+
+ 5e
Mn
2+
+ 4 H
2
O
Reac. global: 10 I
+ 2 MnO
4
+ 16 H
+
5 I
2
+ 2 Mn
2+
+ 8 H
2
O
Cuarta: Escribir la reaccin qumica completa utilizando los coeficientes
hallados y aadiendo las molculas o iones que no intervienen
directamente en la reaccin redox:
2 KMnO
4
+ 8 H
2
SO
4
+10 KI 2 MnSO
4
+ 5 I
2
+ 6 K
2
SO
4
+ 8 H
2
O
La 6 molculas de K
2
SO
4
(sustancia que no interviene en la reaccin
redox) se obtienen por tanteo.
Ejercicio B (Selectividad. Madrid Previo 1998):
a) Ajuste la siguiente reaccin escribiendo las semirreacciones de oxido-
reduccin que se producen HClO + NaCl NaClO + H
2
O +
Cl
2
;
b) Calcule el volumen de disolucin de cido hipocloroso 0,1 M que
sera necesario utilizar para obtener 10 gramos de cloro. Datos:
Masas atmicas: Cl=35,5 ; Na=23 ; 0=16 y H=1
Ajuste redox en medio bsico
En medio bsico los tomos de O que se ganan en la oxidacin (o
pierden en la reduccin) provienen de los OH
(en doble
nmero),
formndose o necesitndose tantas molculas de H
2
O como
tomos de oxgeno se ganen o pierdan, respectivamente.
Ejemplo:
Cr
2
(SO
4
)
3
+ KClO
3
+ KOH K
2
CrO
4
+ KCl
+ K
2
SO
4
+ H
2
O
+3 +6 2 +1+5 2 +12+1 +1 +6 2 +1 1 +1 +6
2 +1 2
Cr
2
(SO
4
)
3
+ KClO
3
+ KOH K
2
CrO
4
+ KCl
+
K
2
SO
4
+ H
2
O
Primera: Identificar los tomos que cambian su E.O.:
Molculas o iones existentes en la disolucin:
Cr
2
(SO
4
)
3
2Cr
3+
+ 3 SO
4
2
KOH
K
+
+ OH
KClO
3
K
+
+ClO
3
K
2
CrO
4
2 K
+
+ CrO
4
2
KCl K
+
+ Cl
K
2
SO
4
2K
+
+ SO
4
2
H
2
O est sin disociar.
Segunda: Escribir semirreacciones con molculas o iones que existan
realmente en disolucin ajustando el n de tomos:
Oxidacin: Cr
3+
+ 8 OH
CrO
4
2
+ 4 H
2
O + 3e
.
Los 4 tomos de O que se precisan para formar el CrO
4
provienen
de los OH
existentes en el medio bsico. Se necesitan el doble pues la
mitad de stos van a parar al H
2
O junto con todos los tomos de H.
Reduccin: ClO
3
+ 3 H
2
O + 6e
Cl
+ 6 OH
.
Se precisan tantas molculas de H
2
O como tomos de O se pierdan.
As habr el mismo n de O e H.
Tercera: Ajustar el n de electrones de forma que al sumar las dos
semirreacciones, stos desaparezcan:
Oxidacin: 2 x (Cr
3+
+ 8 OH
CrO
4
2
+ 4 H
2
O + 3e
)
Reduccin: ClO
3
+ 3 H
2
O + 6e
Cl
+ 6 OH
Reac. global: 2 Cr
3+
+ 16 OH
+ ClO
3
+ 3 H
2
O 2 CrO
4
2
+ 8 H
2
O
+ Cl
+ 6 OH
Eliminando 6 OH
de ambos miembros:
2 Cr
3+
+ 10 OH
+ ClO
3
2 CrO
4
2
+ 5 H
2
O + Cl
Cuarta: Escribir la reaccin qumica completa utilizando los coeficientes
hallados y aadiendo las molculas o iones que no intervienen
directamente en la reaccin redox:
1 Cr
2
(SO
4
)
3
+ 1 KClO
3
+ 10 KOH 2 K
2
CrO
4
+ 5 H
2
O + 1 KCl
+ 3 K
2
SO
4
Las 3 molculas de K
2
SO
4
(sustancia que no interviene en la
reaccin redox) se obtienen por tanteo.
VALORACIN REDOX
Es similar a la valoracin cido base. Hay que determinar el nmero
de moles de especie oxidante y reductora que reaccionan entre s. Para
ello, si a es el n de electrones que captura la especie oxidante y b los
que pierde la especie reductora, sin necesidad de ajustar la ecuacin
completa, sabremos que a moles de especie reductora reaccionan con
b moles de especie oxidante. Lgicamente, es necesario conocer qu
especies qumicas son los productos de la reaccin y no slo conocer los
reactivos.
Se cumple la siguiente expresin:
Esto se comprueba fcilmente en el siguiente:
Ejemplo:
Se valoran 50 ml de una disolucin de FeSO
4
acidulada con H
2
SO
4
con
30 ml de KMnO
4
0,25 M.Cul ser la concentracin del FeSO
4
si el
MnO
4
pasa a Mn
2+
?
Reduccin: MnO
4
+ 8 H
+
+ 5 e
Mn
2+
+ 4 H
2
O
Oxidacin: Fe
2+
Fe
3+
+ 1 e
Como el MnO
4
precisa de 5 e
para reducirse y el Fe
2+
pierde 1 e
,
sabemos que 5 moles de
FeSO
4
(reductor) reaccionan por cada mol de
KMnO
4
(oxidante).
En general y en el caso de disoluciones: n = V x Molaridad
As, aplicando la proporcin estequiomtrica:
En general, si a = n e
ganados en la reduccin (coincide con el
nmero de moles de reductor que reaccionan) y b = n e
perdidos en la
oxidacin (coincide con el nmero de moles de oxidante que reaccionan),
se tendr:
O lo que es lo mismo:
Todava puede verse, al igual que en cido-base, el concepto de
masa equivalente, y el de normalidad. Para calcular la masa equivalente
de una sustancia oxidante o reductora hay que dividir su masa molecular
por el n de e
ganados o perdidos:
; y
De esta manera: n
eq
(oxidante
) = n
eq
(reductora)
Es decir: V (ox.) x N (ox.) =V (red.) x N (red.)
Para saber cual es la masa equivalente, adems de saber de qu
sustancia se trata, es necesario conocer en qu sustancia se transforma
(semirreaccin).
En el ejemplo: N (KMnO
4
) = 0,25 M x 5 = 1,25 N
Ejercicio C (Selectividad. Madrid Reserva 1998):
Cuando se hace reaccionar permanganato de potasio con cido
clorhdrico se obtienen, entre otros productos, cloruro de manganeso (II)
y cloro molecular. a) Ajuste y complete la reaccin. Calcule los pesos
equivalentes del oxidante y del reductor. b) Calcule el volumen de cloro,
medido en condiciones normales, que se obtendr al hacer reaccionar
100 g de permanganato de potasio con exceso de cido clorhdrico.
Masas atmicas: K=39,1; Mn=54,9; O=16,0; Cl=35,5; H= 1,0. R = 0,082
atm L K
-1
mol
-1
.
TIPOS DE REACCIONES REDOX (SEGN SU ESPONTANEIDAD).
Reacciones espontneas: Se produce energa elctrica a partir
de la energa liberada en una reaccin qumica): Pilas
voltaicas
Reacciones no espontneas: Se producen sustancias qumicas
a partir de energa elctrica suministrada): Electrlisis
PILAS VOLTAICAS (CLULAS GALVNICAS).
Si se introduce una barra de Zn en una disolucin de CuSO
4
(Cu
2+
+
SO
4
2
) se producir espontneamente la siguiente reaccin:
Cu
2+
(aq) + Zn (s) Cu (s) + Zn
2+
(aq)
El Zn se oxida (pierde electrones) y el Cu
2+
se reduce (los gana).
Si hacemos que las reacciones de oxidacin y reduccin se
produzcan en recipientes separados (semiceldas), y las conectamos ente
s para que los electrones perdidos en la oxidacin del Zn circulen por el
exterior y sean los que producen la reduccin del Cu
2+
a Cu, tendremos
una pila, puesto que la circulacin e electrones es precisamente la
corriente elctrica.
Tipos de electrodos.
Se llama as a cada barra metlica sumergida en una disolucin del
mismo metal. En una pila hay dos electrodos:
nodo: Se lleva a cabo la oxidacin (all van los aniones). En el
ejemplo anterior sera el electrodo de Zn.
Ctodo: Se lleva a cabo la reduccin (all van los cationes). En
el ejemplo anterior sera el electrodo de Cu.
Pila Daniell.
Consta de dos semiceldas, una con un electrodo de Cu en una
disolucin de CuSO
4
y otra con un electrodo de Zn en una disolucin de
ZnSO
4
.
Estn unidas por un puente salino que evita que se acumulen cargas
del mismo signo en cada semicelda.
Entre los dos electrodos se genera una diferencia de potencial que
se puede medir con un voltmetro.
Representacin esquemtica de una pila
La pila anterior se representara:
nodo Puente salino Ctodo
Zn (s) | ZnSO
4
(aq) || CuSO
4
(aq) | Cu (s)
Pilas comerciales.
Hay varios tipos conocidos:
Salinas (suelen ser de Zn/C)
Alcalinas(suelen ser de Zn/Mn)
Recargables (suelen ser de Cd/Ni)
De Mercurio o de botn (suelen ser de Zn/Hg)
POTENCIAL DE
REDUCCIN. ESCALA
DE POTENCIALES.
Algunos potenciales normales de reduccin (25 C)
Sistema Semirreaccin E (V)
Li
+
/ Li Li
+
1 e
Li 3,04
K
+
/ K K
+
+ 1 e
K 2,92
Ca
2+
/Ca Ca
2+
+ 2 e
Ca 2,87
Na
+
/ Na Na
+
+ 1 e
Na 2,71
Mg
2+
/ Mg Mg
2+
+ 2 e
Mg 2,37
Las pilas producen
una diferencia de potencial
(E
pila
) que puede
considerarse como la
diferencia entre los
potenciales de reduccin
de los dos electrodos que
la conforman:
Consideraremos que cada
semirreaccin de reduccin
viene dada por un
potencial de reduccin.
Como en el ctodo se produce la reduccin, en todas las pilas E
catodo
>
E
nodo
.
Cada pareja de sustancia oxidante-reductora tendr una mayor o
menor tendencia a estar en su forma oxidada o reducida.
El que se encuentre en una u otra forma depender de la otra pareja
de sustancia oxidante-reductora.
Qu especie se reducir? Sencillamente, la que tenga un mayor
potencial de reduccin.
Electrodo de hidrgeno. Pilas con hidrgeno.
Al potencial de reduccin del electrodo de hidrgeno se le asigna por
convenio un potencial de 0,0 V.
Reaccin de reduccin: 2 H
+
+ 2 e
H
2
Un electrodo de hidrgeno es una lmina de platino sobre el que se
burbujea H
2
a una presin de 1atm a travs de una disolucin 1 M de H
+
.
aadir
Toda pareja oxidante-reductora que tenga ms tendencia a
reducirse que los H
+
tendrn un potencial de reduccin E > 0.
Igualmente, toda pareja oxidante-reductora que tenga menos tendencia a
reducirse que los H
+
tendrn un potencial de reduccin E < 0.
Al
3+
/ Al Al
3+
+ 3 e
Al 1,66
Mn
2+
/ Mn Mn
2+
+ 2 e
Mn 1,18
Zn
2+
/ Zn Zn
2+
+ 2 e
Zn 0,76
Cr
3+
/ Cr Cr
3+
+ 3 e
Cr 0,74
Fe
2+
/ Fe Fe
2+
+ 2 e
Fe 0,41
Cd
2+
/ Cd Cd
2+
+ 2 e
Cd 0,40
Ni
2+
/ Ni Ni
2+
+ 2 e
Ni 0,25
Sn
2+
/ Sn Sn
2+
+ 2 e
Sn 0,14
Pb
2+
/ Pb Pb
2+
+ 2 e
Pb 0,13
H
+
/ H
2
2 H
+
+ 2 e
H
2
0,00
Cu
2+
/ Cu Cu
2+
+ 2 e
Cu 0,34
I
2
/ I
I
2
+ 2 e
2 I
0,53
MnO
4
/MnO
2
MnO
4
`
+ 2 H
2
O + 3 e
MnO
2
+ 4 OH
0,53
Hg
2+
/ Hg Hg
2+
+ 2 e
2 Hg 0,79
Ag
+
/ Ag Ag
+
+ 1 e
Ag 0,80
Br
2
/ Br
Br
2
+ 2 e
2 Br
1,07
Cl
2
/ Cl
Cl
2
+ 2 e
2 Cl
1,36
Au
3+
/ Au Au
3+
+ 3 e
Au 1,500
MnO
4
/ Mn
2+
MnO
4
`
+ 8 H
+
+ 5 e
Mn
2+
+ 2 H
2
O 1,51
En la tabla adjunta se muestran muchos de los potenciales de
reduccin. Si quieres ver ms ve a la
pgina: http://www.shodor.org/unchem/advanced/redox/redoxcalc.html.
Segn sea el potencial de reduccin del metal menor o mayor que 0
reaccionar o no reaccionar con los cidos para [H
+
] = 1 M.
Ejemplos:
Comportamiento de metales (Zn y Cu) frente a cidos.
Zn + 2 H
+
Zn
2+
+ H
2
Cu + 2 H
+
no reacciona
Decir si ser espontnea la siguiente reaccin redox: Cl
2
(g) + 2 I
(aq) 2Cl
(aq) + I
2
(s)
La reaccin dada es la suma de las siguientes semirreacciones:
Red. (ctodo): Cl
2
(g) + 2e
2Cl
(aq)
Oxid. (nodo): 2 I
(aq) I
2
(s) + 2e
Para que la reaccin sea espontnea tiene que cumplirse
que Epila > 0:
E
pila
= E
catodo
E
nodo
= +1,36 V 0,54 V = +0,72 V > 0
luego es espontnea (las molculas de Cl
2
tienen ms tendencia a
reducirse que las de I
2
).
Ejercicio D:
Una pila consta de un electrodo de Mg introducido en una disolucin 1 M
de Mg(NO
3
)
2
y un electrodo de Ag en una disolucin 1 M de AgNO
3
.
Qu electrodo actuar de ctodo y de nodo y cul ser el voltaje de la
pila correspondiente?
Ejercicio E (Selectividad. Madrid Junio1998):
Dada la siguiente tabla de potenciales normales
expresados en voltios: a) Escriba el nombre de: I)-La
forma reducida del oxidante ms fuerte; II) Un catin
que pueda ser oxidante y reductor; III) La especie ms
reductora; IV) Un anin que pueda ser oxidante y
reductor. b) Escriba y ajuste dos reacciones que
sean espontneas entre especies de la tabla que
correspondan a: I) Una oxidacin de un catin por un
anin; II) Una reduccin de un catin por un anin.
ELECTRLISIS
Cuando la reaccin redox no es espontnea en un sentido, podr
suceder si desde el exterior se suministran los electrones. En el ejercicio
Par redox E
0
(V)
Cl
2
/ Cl
1,35
ClO
4
/ClO
3
1,19
ClO
3
/ClO
2
1,16
Cu
2+
/Cu 0,35
SO
3
2
/ S
2
0,23
SO
4
2
/ S
2
0,15
Sn
4+
/Sn
2+
0,15
Sn
2+
/ Sn -0,14
D anterior en el que el electrodo de Magnesio haca de nodo (se
oxidaba) frente al de plata que haca de ctodo formando una pila de
f.e.m = 3,17 V, se puede forzar la formacin de Mg(s) (reduccin) si
desde el exterior se suministran los 3,17 V que se necesitan vencer (por
ejemplo, usando una pila que proporcione mayor voltaje).
Aplicaciones de la electrlisis.
La electrlisis se utiliza industrialmente para obtener metales a partir
de sales de dichos metales, utilizando la electricidad como fuente de
energa.
Se llama galvanoplastia al proceso de recubrir un objeto metlico
con una capa fina de otro metal:
Ejemplo:
Zn
2+
+ 2 e
Zn (cincado) (en este caso los e
los suministra la
corriente elctrica).
Comparacin de la polaridad de los electrodos en pilas y
electrlisis.
Ecuacin de Faraday.
La carga de un electrn es de 1,6x10
19
C y la de 1 mol de
electrones (6,02x10
23
) es el producto de ambos nmeros: 96500 C,
conocido normalmente como 1 F (Faraday).
Con un mol de electrones se es capaz de reducir 1 mol de metal
monovalente, mientras que se precisarn 2 moles de e
para reducir un
mol de metal divalente, etc En general, si a es la carga del catin, se
precisarn a moles de e
para reducir un mol del citado metal:
M
a+
(aq) + a e
M(s)
Si se precisan 96500 C para generar 1 mol de e
, se precisarn para
generar a moles de e
, necesarios para formar 1 mol de metal reducido.
Aplicando una sencilla proporcin, obtendremos que con Q culombios
se formarn n moles de metal. Sustituyendo Q por I x t (ms fciles
de medir) y despejando m se obtiene:
Todava se sigue usando el concepto de Masa equivalente definido
como:
de manera que la frmula queda tambin como:
Ejemplo:
Se realiza la electrlisis de un disolucin de tricloruro de hierro, haciendo
pasar una corriente de 10 A durante 3 horas. Calcula la cantidad de
hierro depositado en el ctodo.
El tricloruro en disolucin estar disociado: FeCl
3
3 Cl
+ Fe
3+
La reduccin ser: Fe
3+
+ 3 e
Fe
Ejercicio F (Selectividad. Madrid Junio 1998):
Una corriente de 4 amperios circula durante 1 hora y 10 minutos a travs
de dos clulas electrolticas que contienen, respectivamente, sulfato de
cobre (II) y cloruro de aluminio, a) Escriba las reacciones que se
producen en el ctodo de ambas clulas electrolticas. b) Calcule los
gramos de cobre y aluminio metlicos que se habrn
depositado. Datos: Masas atmicas: Cu = 63,5 y Al = 27,0. Constante de
Faraday: F = 96500 Ceq
-1
Ejercicio G (Selectividad.
Madrid Reserva 1998):
La figura adjunta
representa una celda para
la obtencin de cloro
mediante electrlisis.
Conteste a las
siguientes
cuestiones: a) Escriba las
reacciones que tienen lugar
en el nodo y en el ctodo. b) Seale cul es la de oxidacin y cul la de
reduccin. c) La disolucin inicial de cloruro sdico tiene un pH = 7. Se
produce modificacin del pH durante la electrlisis? Por qu? d) Por
qu se obtiene hidrgeno en lugar de sodiometlico?
APLICACIONES INDUSTRIALES DE PROCESOS REDOX.
Electrlisis del NaCl
La reaccin: 2 Na +
Cl
2
2 NaCl es una reaccin
espontnea puesto que
E(Cl
2
/2Cl
) > E(Na
+
/Na)
Lgicamente, la reaccin
contraria ser no
espontnea:
2 NaCl
2 Na + Cl
2
Red. (ct,): 2 Na
+
(aq) + 2e
2 Na (s) Oxid. (nodo):2Cl
(aq) Cl
2
(g)
+ 2e
E
pila
= E
catodo
E
nodo
= 2,71 V 1,36 V = 4,07V
El valor negativo de E
pila
reafirma que la reaccin no es espontnea.
Pero suministrando un voltaje superior a 4,07 V se podr descomponer el
NaCl en sus elementos: Na y Cl
2
.
Corrosin
Un problema muy importante es la corrosin
de los metales; por ejemplo, el hierro:
Oxid. (nodo): Fe (s) Fe
2+
(aq) + 2e
Red. (ctodo): O
2
(g) + 4 H
+
(aq) + 4e
2 H
2
O(l)
En una segunda fase el Fe
2+
se oxida a
Fe
3+
:
4 Fe
2+
(aq) + O
2
(g) + 4 H
2
O(l) 2
Fe
2
O
3
(s) + 8 H
+
(aq)
Proteccin catdica.
Para prevenir la corrosin se
lleva a cabo la proteccin catdica
que consiste en soldar a la tubera de hierro a un nodo de Mg que forma
una pila con el Fe y evita que ste se oxide, ya que quien se oxida
es el Mg.
You might also like
- Tipos de Soluciones y Sus ClasificacionesDocument29 pagesTipos de Soluciones y Sus ClasificacionesNatalia StuartNo ratings yet
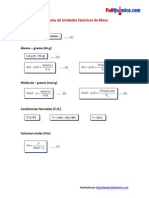
- Fórmulas de Unidades Químicas de Masa v2.0Document1 pageFórmulas de Unidades Químicas de Masa v2.0fullquimicaNo ratings yet
- Teoria de REDOXDocument41 pagesTeoria de REDOXEduardo Fernando Bernahola Portugal100% (2)
- 2 Unidad1 Regiones y CavidadesDocument12 pages2 Unidad1 Regiones y Cavidadesapi-3735753100% (11)
- Elc 110220Document18 pagesElc 110220ericbastyNo ratings yet
- PDF Lista de Piezas Orbitrol DLDocument4 pagesPDF Lista de Piezas Orbitrol DLESTACIÓN DE JUEGONo ratings yet
- Levantamiento ViviendaDocument12 pagesLevantamiento ViviendaKaren RojasNo ratings yet
- Cálculo de gasto y velocidad en tubo de Vénturi con ecuaciones de continuidad y BernoulliDocument8 pagesCálculo de gasto y velocidad en tubo de Vénturi con ecuaciones de continuidad y BernoulliMarco Anderson Oyola SilvaNo ratings yet
- 2 Ccss 3Document8 pages2 Ccss 3MARCELA SANDOVALNo ratings yet
- INTA 200 SuelosDocument361 pagesINTA 200 SuelosDavid IriartNo ratings yet
- Proyecto Formativo 1443678Document91 pagesProyecto Formativo 1443678Nelson PayaresNo ratings yet
- Algebra Lineal UCE Seguimiento SílaboDocument2 pagesAlgebra Lineal UCE Seguimiento SílaboEsteban RivadeneiraNo ratings yet
- Tejón de MielDocument2 pagesTejón de MielJulio Cesar EncarnacionNo ratings yet
- Preguntas de Cultura GeneralDocument17 pagesPreguntas de Cultura GeneralAlejandro Cepeda67% (3)
- Equipo3 RES 341 S2 TE2Document5 pagesEquipo3 RES 341 S2 TE2conde2007No ratings yet
- IA ReporteFINALDocument6 pagesIA ReporteFINALZeero' Sioux PageNo ratings yet
- Potencial de la piscicultura en BoliviaDocument29 pagesPotencial de la piscicultura en BoliviaNen EcoNo ratings yet
- Ma-113 Matematicas IDocument2 pagesMa-113 Matematicas ICesar ColoradoNo ratings yet
- Departamento de CajamarcaDocument3 pagesDepartamento de CajamarcaRoggert CrodovaNo ratings yet
- IntructivoProcesos Gerenciales IngetecDocument95 pagesIntructivoProcesos Gerenciales Ingetecnathalia giraldoNo ratings yet
- Practica 3 NectarDocument6 pagesPractica 3 NectarLuz MariaNo ratings yet
- Sin Título 1Document40 pagesSin Título 1David BanerNo ratings yet
- Dichos Con Bichos PDFDocument98 pagesDichos Con Bichos PDFducadeliaNo ratings yet
- Concepto de GimnasiaDocument15 pagesConcepto de GimnasiaDavixito André Gálvez Flores0% (1)
- Gammapatías monoclonales y Mieloma MúltipleDocument37 pagesGammapatías monoclonales y Mieloma MúltipleOscar ValerNo ratings yet
- Método de La AutoobservaciónDocument4 pagesMétodo de La AutoobservaciónRodrigo Vargas PérezNo ratings yet
- Cómo las ciudades se vuelven más inteligentes con Big DataDocument3 pagesCómo las ciudades se vuelven más inteligentes con Big DataJuan Pablo Paredes HernaniNo ratings yet
- Proyecto OlmosDocument5 pagesProyecto OlmosFrancisco Montoya RiosNo ratings yet
- Angulos VerticalesDocument2 pagesAngulos VerticalesMiriam OrmeñoNo ratings yet
- IBM Guardium - SPA - ShortDocument18 pagesIBM Guardium - SPA - ShortElmer Ronald Vargas CartagenaNo ratings yet
- NootrópicosDocument13 pagesNootrópicosOsukaru Kuro Neko100% (1)
- Un bosque para una admiradora de la luna-vivienda bambúDocument3 pagesUn bosque para una admiradora de la luna-vivienda bambúJonathan Dueñas SánchezNo ratings yet
- Apuntes Diseño de CanalesDocument1 pageApuntes Diseño de CanalesErick GiovaniNo ratings yet
- DC-3 Invalida10Document2 pagesDC-3 Invalida10Fabiola JuárezNo ratings yet