Professional Documents
Culture Documents
Fundamento Teórico de Lqiuidos
Uploaded by
michael152011Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Fundamento Teórico de Lqiuidos
Uploaded by
michael152011Copyright:
Available Formats
FUNDAMENTO TERICO
Lquidos
Un lquido es un estado de la materia con una densidad y volumen definidos,
pero sin una forma particular puede cambiar fcilmente si es sometido a una
fuerza. Las cantidades de lquidos se miden en unidades de volumen,
principalmente en metros cbicos y sus divisiones, particularmente el decmetro,
conocido como litro. El volumen de un lquido est fijado por su temperatura y su
presin.
La forma de los lquidos es esfrica si sobre ellos no acta ninguna fuerza externa.
Al ser sujeto a la fuerza de la gravedad, la forma de un lquido queda definido por
el recipiente que lo contiene.
Propiedades de los lquidos
Tensin superficial:
La tensin superficial es la fuerza con que son atradas las molculas de la
superficie de un lquido para llevarlas al interior y as disminuir el rea superficial.
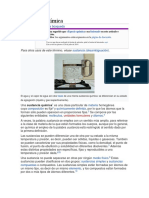
Como se puede observar en la imagen del lado derecho, una molcula en la
superficie de un lquido, es atrada hacia el interior del mismo, debido a las fuerzas
de atraccin intermoleculares que ejercen slo las molculas que la rodean por
debajo de ella y las que se encuentran a su alrededor en el mismo plano, por
debajo de la superficie.
A diferencia de una molcula que se encuentra en el cuerpo del lquido, la cual es
atrada por las fuerzas intermoleculares que ejercen todas las molculas que la
rodean, en todos los sentidos. A mayor fuerza intermolecular, mayor tensin
superficial.
En la siguiente tabla presentamos el valor de la tensin superficial de algunos
lquidos, expresados en dinas/cm y medidos a 20 C:
sustancia tensin superficial sustancia tensin superficial
mercurio 465,0 acetona 23,7
agua 72,75 etanol 22,75
benceno 28,85 metanol 22,61
tolueno 28,50 n-hexano 18,43
tetracloruro de carbono 26,95 ter etlico 17,01
sustancia tensin superficial sustancia tensin superficial
acetato de etilo 23,90
Capilaridad:
La capilaridad es una propiedad de los lquidos que depende de su tensin
superficial. Las fuerzas entre las molculas de un lquido se llaman fuerzas de
cohesin y, aquellas entre las molculas del lquido y las de la superficie de un
slido, se denominan fuerzas de adhesin, lo que les permite ascender por un
tubo capilar (de dimetro muy pequeo).
Cuando un lquido sube por un tubo capilar, es debido a que la fuerza
de cohesin es menor a la adhesin del lquido con el material del tubo. El lquido
sigue subiendo hasta que la tensin superficial es equilibrada por el peso del
lquido que llena el tubo. ste es el caso del agua y, sta propiedad es la que
regula parcialmente su ascenso dentro de las plantas, sin gastar energa para
vencer la gravedad.
Sin embargo, cuando la cohesin entre las molculas de un lquido es ms
potente que la adhesin al capilar (como el caso del mercurio), la tensin
superficial hace que el lquido descienda a un nivel inferior y su superficie es
convexa.
Viscosidad:
Se define como la resistencia al flujo. La viscosidad de un lquido depende de las
fuerzas intermoleculares:
Cuanto mayor son las fuerzas intermoleculares de un lquido, sus molculas
tienen mayor dificultad de desplazarse entre s, por lo tanto la sustancia
es ms viscosa.
Los lquidos que estn formados por molculas largas y flexibles que
pueden doblarse y enredarse entre s, son ms viscosos.
La viscosidad aumenta a medida que aumentan las fuerzas intermoleculares.
Presin de vapor:
Sabemos que las molculas pueden escapar de la superficie de un lquido, hacia
la fase gaseosa, por vaporizacin o evaporacin y adems, que hay sustancias
que se evaporan ms rpidamente que otras, de qu depende esta diferencia?
La explicacin est en las fuerzas intermoleculares:
si las molculas del lquido poseen una mayor intensidad de fuerza
intermolecular, entonces quedarn atrapadas en el lquido y tendrn menor
facilidad para pasar a la fase gaseosa.
por el contrario a menor intensidad de fuerza intermolecular, entonces las
molculas podrn escapar ms fcilmente al estado gaseoso.
Este anlisis nos permite definir:
Volatilidad, una sustancia ser ms voltil cuando se evapore ms
fcilmente, es decir cuando posea menores fuerzas intermoleculares.
Cuando la velocidad de las molculas que abandonan la superficie del lquido
(evaporacin) es igual a la velocidad de las molculas que regresan al lquido
(condensacin), se establece un equilibrio dinmico. En este momento ya no se
modifica la cantidad de molculas en el estado vapor.
El vapor ejerce entonces una presin constante conocida como presin de vapor
del lquido.
La presin de vapor de un lquido depende de la temperatura: a mayor T,mayor es
la P
vapor
.
La presin de vapor depende de:
las fuerzas intermoleculares en el lquido
la temperatura
La presin de vapor es independiente de:
el volumen del lquido o el vapor
el rea de la superficie del lquido
A continuacin presentamos las curvas de presin de vapor de algunas
sustancias:
Punto de ebullicin:
Es la temperatura a la cual su presin de vapor es igual a la presin externa. Un
lquido puede hervir o ebullir a cualquier temperatura, pues solo depende de la
presin externa. Cuando la vaporizacin ocurre en la superficie lquida se llama
evaporacin y si ocurre en toda la masa lquida se llama ebullicin. El punto de
ebullicin normal es la temperatura a la cual la presin de vapor del lquido es
exactamente a una atmsfera (760 mmHg).La presin de vapor de agua es de
760 mmHg a 100C, siendo esta temperatura su punto de ebullicin normal.
You might also like
- ADocument2 pagesAmichael152011No ratings yet
- KJDocument1 pageKJmichael152011No ratings yet
- PresionDocument3 pagesPresionmichael152011No ratings yet
- CalorDocument1 pageCalormichael152011No ratings yet
- FsdfsdfsDocument1 pageFsdfsdfsmichael152011No ratings yet
- El ParacaidistaDocument1 pageEl Paracaidistamichael152011No ratings yet
- FacultadesDocument1 pageFacultadesmichael152011No ratings yet
- LedDocument2 pagesLedmichael152011No ratings yet
- LaboDocument3 pagesLabomichael152011No ratings yet
- LecturamotivimacionDocument1 pageLecturamotivimacionmichael152011No ratings yet
- LecturasDocument1 pageLecturasmichael152011No ratings yet
- YyyDocument1 pageYyymichael152011No ratings yet
- EscDocument2 pagesEscmichael152011No ratings yet
- MemorizacionDocument1 pageMemorizacionmichael152011No ratings yet
- Conquista Tus SueñosDocument10 pagesConquista Tus SueñosTerry RobinsonNo ratings yet
- La Única Fuerza Que Actúa Es El Peso Que Se Puede Descomponer en Su Componente Normal yDocument1 pageLa Única Fuerza Que Actúa Es El Peso Que Se Puede Descomponer en Su Componente Normal ymichael152011No ratings yet
- Nadine Partido NacionalistaDocument1 pageNadine Partido Nacionalistamichael152011No ratings yet
- GDFGFDGDDocument1 pageGDFGFDGDmichael152011No ratings yet
- GGGDocument1 pageGGGmichael152011No ratings yet
- Ingredient EsDocument1 pageIngredient Esmichael152011No ratings yet
- LLLDocument1 pageLLLmichael152011No ratings yet
- MatricesDocument1 pageMatricesmichael152011No ratings yet
- LibreDocument3 pagesLibremichael152011No ratings yet
- Lect UraaaDocument1 pageLect Uraaamichael152011No ratings yet
- LecutraDocument1 pageLecutramichael152011No ratings yet
- ReflecionDocument1 pageReflecionmichael152011No ratings yet
- Conclusion EsDocument1 pageConclusion Esmichael152011No ratings yet
- Segunda Ley de NewtonDocument2 pagesSegunda Ley de Newtonmichael152011No ratings yet
- Medici OnesDocument1 pageMedici Onesmichael152011No ratings yet
- Trata Mien ToDocument1 pageTrata Mien Tomichael152011No ratings yet
- 2da PracticaDocument2 pages2da PracticaYeff 14No ratings yet
- 2 Parcial Termodinamica G1Document3 pages2 Parcial Termodinamica G1Daniz DaniNo ratings yet
- Ley de DaltonDocument5 pagesLey de Daltondiego isaac burgos mirandaNo ratings yet
- FQDocument13 pagesFQBri MartinezNo ratings yet
- Calcular número de vueltas de serpentín para mantener temperatura de néctarDocument12 pagesCalcular número de vueltas de serpentín para mantener temperatura de néctaryenifferprietoNo ratings yet
- MC Practica 7Document8 pagesMC Practica 7Tachy Lunita0% (1)
- Tabla-Periódica S10Document9 pagesTabla-Periódica S10Andy RodriguezNo ratings yet
- Sintesis de AspirinaDocument12 pagesSintesis de AspirinaRubén Gonzalo UsnayoNo ratings yet
- Reducción Del Óxido de Cobre: Fácil 2 10 Minutos 10 MinutosDocument12 pagesReducción Del Óxido de Cobre: Fácil 2 10 Minutos 10 MinutosSHARON MISHEL CONDORI PANIGUARANo ratings yet
- Curso Diseño y Calculo de CompresoresDocument39 pagesCurso Diseño y Calculo de CompresoresHeber FloresNo ratings yet
- Sustancia Química 1Document4 pagesSustancia Química 1wil lopNo ratings yet
- ALQUINOSDocument19 pagesALQUINOSElvis Leonel Temoche SandovalNo ratings yet
- Calor cedido por barra de plataDocument9 pagesCalor cedido por barra de plataJA JashiNo ratings yet
- Manual Enero 2019 PDFDocument151 pagesManual Enero 2019 PDFbenjamin zavaletaNo ratings yet
- Propiedades Fisicas y Quimicas Del Gas NaturalDocument3 pagesPropiedades Fisicas y Quimicas Del Gas NaturalEriledesma0% (1)
- Incendios Forestales. Primera ParteDocument9 pagesIncendios Forestales. Primera ParteChino GonzalezNo ratings yet
- Problemario2yadocx PDFDocument52 pagesProblemario2yadocx PDFDiegoNo ratings yet
- Aletas Transferencia de CalorDocument24 pagesAletas Transferencia de CalorAlfonso Ramirez100% (1)
- ΔH de neutralización de NaOH: comprobación de la ley de HessDocument10 pagesΔH de neutralización de NaOH: comprobación de la ley de HessLuis CorderoNo ratings yet
- 3.atmosfera 2Document17 pages3.atmosfera 2hubert0782No ratings yet
- Propiedades Del Aire PDFDocument1 pagePropiedades Del Aire PDFpatricioNo ratings yet
- TP de JubitsaDocument7 pagesTP de JubitsaRodrigo ManzanedaNo ratings yet
- Practica 2 Diagrama P TDocument11 pagesPractica 2 Diagrama P TRaúl CastilloNo ratings yet
- Presentación FenomenosDocument14 pagesPresentación FenomenosAna Sofia Molina OrtegaNo ratings yet
- Trabajo de Investigacion Intercambiadores de CalorDocument10 pagesTrabajo de Investigacion Intercambiadores de Calorjoan limonNo ratings yet
- Tema 4.1 Maquinado No Tradicional PDFDocument15 pagesTema 4.1 Maquinado No Tradicional PDFMarwin BenavidesNo ratings yet
- Prueba de Química, 1º Medio, 14-Mayo.Document3 pagesPrueba de Química, 1º Medio, 14-Mayo.Alejandro Rubio OrtizNo ratings yet
- Formas de transferencia de calor: conducción, convección y radiaciónDocument5 pagesFormas de transferencia de calor: conducción, convección y radiaciónFanyta FanytaNo ratings yet
- Fisica 5to - Calorimetria IIDocument3 pagesFisica 5to - Calorimetria IIFranky Tello BuitrónNo ratings yet
- Diseño de Un Sistema de Acondicionamiento de AireDocument342 pagesDiseño de Un Sistema de Acondicionamiento de Airebernardo escorciaNo ratings yet