Professional Documents
Culture Documents
Preparación de Soluciones Uso y Manejo de Micropipetas
Uploaded by
Linda Linda CortezCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Preparación de Soluciones Uso y Manejo de Micropipetas
Uploaded by
Linda Linda CortezCopyright:
Available Formats
PREPARACIN DE SOLUCIONES USO Y MANEJO DE MICROPIPETAS
OBJETIVOS
Preparar soluciones porcentuales, stock, simples y seriadas
Determinar las condiciones de exactitud y reproducibilidad de las micropipetas
MARCO TEORICO
2.1 PREPARACION DE SOLUCIONES
Las soluciones en qumica, son mezclas homogneas de sustancias en iguales o distintos estados
de agregacin. La concentracin de una solucin constituye una de sus principales caractersticas.
Bastantes propiedades de las soluciones dependen exclusivamente de la concentracin. Su estudio
resulta de inters tanto para la fsica como para la qumica. Algunos ejemplos de soluciones son:
agua salada, oxgeno y nitrgeno del aire, el gas carbnico en los refrescos y todas las
propiedades: color, sabor, densidad, punto de fusin y ebullicin dependen de las cantidades que
pongamos de las diferentes sustancias.
La sustancia presente en mayor cantidad suele recibir el nombre de solvente, y a la de menor
cantidad se le llama soluto y es la sustancia disuelta.
Al momento de preparar soluciones hay que tomar en cuenta varios aspectos, en el anlisis
qumico son de particular importancia las "unidades" de concentracin, y en particular dos de
ellas: la molaridad y la normalidad. Tambin punto de equivalencia, fraccin molar, la
concentracin decimal, entre otros.
2.2 CALCULO Y EXPRESIN DE DILUCIONES
Disoluciones Una disolucin es una mezcla homognea (los componentes no se pueden distinguir
a simple vista) de dos o ms sustancias en proporciones variables. Debemos distinguir entre:
Soluto: sustancia que se disuelve. Disolvente: sustancia en la que se disuelve el soluto.
Disolucin: conjunto formado por el disolvente y el soluto. Si hay dudas sobre quin es el soluto y
quin el disolvente, se consideradisolvente al componente que est en mayor
proporcin.Disolucin Molecular: partculas de soluto son molculas (azcar en H2O)Disolucin
Inica: las partculas de soluto son iones (NaCl en H2O)
y del disolvente:
(Recordar que la disolucin, suele presentar el mismo estado fsico que el estado disolvente).
Estado fsico Soluto Disolvente Disolucin Ejemplos Slido Slido Aleaciones metlicas (acero)
Lquido Slido Lquido Amalgama (Hg ms metal) Gas Slido Hidrgeno ocludo (Pd y Pt) Slido
Lquido Azcar en agua Lquido Lquido Lquido Alcohol en agua Gas Lquido Amoniaco en agua
Slido Gas Suspensiones (Humo) Lquido Gas Gas Suspensiones (aerosoles) Gas Gas Aire
Segn sea la proporcin de soluto respecto a la de disolvente:
Saturada: la disolucin no admite ms soluto, depositndose el exceso en el fondo del
recipiente.
Diluida: La cantidad de soluto es muy pequea respecto a la de disolvente.
Concentrada: la proporcin de soluto respecto a la del disolvente es grande. Slo son posibles si
el soluto es muy soluble. Solubilidad Mxima cantidad de soluto disuelto en una cantidad dada de
disolvente, a una temperatura fija. Depende de varios factores:
Naturaleza del soluto y del disolvente
Temperatura del proceso (por lo general, la solubilidad aumenta con la T)
Agitacin
Concentracin de disoluciones Cantidad de soluto Concentracin Cantidad de disolucin (o
disolvente)
Expresa la relacin o cociente entre la cantidad de soluto y la cantidadde disolucin o disolvente.
Existen varias formas de expresar la concentracin, segn sean lasunidades empleadas para
Concentracin en g L L disoluci
disolucin
Ejemplos:Una disolucin 1 M de HCl cede 1 H+, por lo tanto, es una disolucin 1 N.Una disolucin
1 M de Ca (OH)2 cede 2 OH, por lo tanto, es una disolucin 2 N.NORMALIDAD ACIDO-
BASEDonde:N es la normalidad de la disolucin.M es la molaridad de la disolucin.H+ es la
cantidad de protonescedidos por una molcula del cido.OH es la cantidad de hidroxilos cedidos
por una molcula de la base.
ALGUNOS EJEMPLOS DE SOLUCIONES SON:Agua salada, oxgeno y nitrgeno del aire, el gas
carbnico en los refrescos y todas las propiedades: color, sabor, densidad, punto de fusin y
ebullicin dependen de las cantidades que pongamos de las diferentes sustancias.
2.3 USO CORRECTO DE LAS MICROPIPETAS
Colocar el pulgar sobre el mando o mbolo de pipeteado. Oprimir el mbolo. Cuando el mbolo se
presiona sentir un punto de resistencia. ste es el primer alto o "tope". Si contina presionando
encontrar un punto donde el mbolo ya no se mueve hacia abajo, este corresponde al segundo
alto o "tope".
Oprimir el mbolo hasta el primer tope y colocar la punta dentro del lquido hasta una
profundidad de 2 a 3 mm. De una manera lenta y controlada, disminuya la presin del mbolo
para permitir que se desplace hacia arriba. No suelte el mbolo abruptamente, al permitirlo
causar que el lquido pueda salpicar dentro de la punta produciendo volmenes inexactos y
generando contaminacin de la pipeta. Una vez el mbolo se haya desplazado hasta arriba
mantenga la micropipeta en el lquido durante un segundo, esto evita que se aspire aire en la
parte final.
Expulsin de la muestra
Llevar la micropipeta al envase en el cul quiere aadir el lquido. Se apoya la punta en la pared del
recipiente sin evitar la salida de la muestra. Oprima el mbolo hasta el primer tope y luego hasta
el segundo tope. Haga este procedimiento a una velocidad moderada, hacerlo muy rpido har
que queden gotas de muestra en la punta. Si observa cuidadosamente, entonces notar que al
oprimir hasta el segundo alto se expele todo el lquido de la punta.
Lo anterior es cierto para la mayora de soluciones acuosas, excepto para las soluciones de alta
viscosidad. Para solventes orgnicos o para soluciones conteniendo grandes cantidades de
protena (plasma y suero), es difcil sacar todo el lquido de la punta. En estos casos, es mejor
pipetear una vez la solucin expelindola y luego llevando hacia arriba el lquido a medir en un
segundo tiempo. Para soluciones de alta viscosidad el llenado y la expulsin deben ser ms lentas
MATERIALES
Balanza analtica, pH metro, probetas, beakers, fiolas, micropipetas p10 p20 p200 p1000, puntas
azules y amarillas
PROCEDIMIENTO PARA PREPARAR LAS SOLUCIONES
Se preparo las soluciones: Tris-HCl pH 7.6 (1M) , MgCl2( 5mM), Ma-EDTA(1M),
Ma2EDTA(500Mm), NaCl(5M), SDS 20%, Isopropanol a 4 oC Etanol a 7% ,Buffer TE 10%
NH4Cl 1M.
PROCEDIMIENTO PARA EL AMEJO DE MICROPIPETAS
Para absorber el liquido se presiono el piston hasta una primera posicin, se puso el tip en
contacto con el liquido y luego lentamente se permiti que el piston vuelva a su posicin
original. Este paso permiti el llenado del tip con el volumen correspondiente. Se
describieron las instrucciones especificas para los modelos de micropipetas.
Se selecciono una micropipeta segun el volumen a dispensar, se aplicaron las reglas que se
utilizan para el manejo de pipetas
Se localizo el indicador de volumen compuesto de tres dgitos que se deben leer de arriba
hacia abajo, se ajusto el volumen de la pipeta con el tornillo botn pulsador por encima
del valor deseado
Se selecciono la punta o tip de plstico apropiado para la micropipeta, la punta de debi
ajustar al cono de la micropipeta, al insertar la punta de aplico una fuerte presin con un
movimiento giratorio para hermetizar
Se apret el botn pulsador hasta el primer toque para su absorcin, con la pipeta en
posicin vertical se sumergi entre 1mm y 3 mm en la muestra
Se aspiro lentamente el liquido cuando re relajo la presin del dedo sobre el boton
pulsador, se espero un segundo y se retiro la punta del liquido
Se coloco la parte inferior de la punta contra la pared interior del recipiente donde se
deposito el liquido,
Se apret el botn pulsador suavemente hasta el primer toque y se espero un segundo, se
apret el botn pulsador hasta el segunto toque y se vacio el resto del liquido
Se mantuvo apretado el botn pulsador en el segundo tope y se retiro la pipeta, se solto
luego el botn pulsador
Se expulso la punta apretando el botn pulsador
CONTROL GRAVIMETRICO DE LAS MICROPIPETAS
se atempero la pipeta y los materiales
se mantuvo la pipeta con sus accesorios por lo menos 1 hora en la sala de ensayo
se determino y anoto la temperatura del agua de ensayo
se ajusto el volumen nominal de la pipeta al mayor volumen
se coloco un beaker limpio sobre la balanza y se taro a cero
se coloco un tip nuevo sobre la punta de la pipeta a calibrar
se oprimi el pulsador hasta el primer toque
se sumergi la punta del tip en el embase con el agua destilada
se dejo retroceder el pulsador lentamente y de manera uniforme
se evito secar el exterior de la punta del tip
se expulso el agua en el interior del beaker a pesar
se apunto el valor obtenido en el display
se volvi a la balanza y se volvi a repetir hasta obtener 10 lecturas para valor
nominal
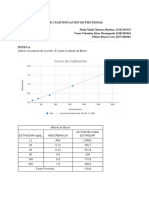
CALCULO DE LA EXACTITUD (E%) Y DEL DOEFICIENTE DE VARIACION (CV%)
comparar los resultados de los valores reales y los valores nominales
Nro de pesadas Volumen nominal al
100%
Volumen nominal al
50%
Volumen nominal al
35%
X1
X2
X3
X4
X5
X6
X7
X8
X9
X10
Valoracin del control gravimtrico
Valor Volumen nominal
100%
Volumen nominal al
50%
Volumen nominal 35%
E%
CV%
Comparar los resultados de los valores reales y los valores nominales
Nro de pesadas Volumen nominal al
100%
Volumen nominal al
50%
Volumen nominal al
35%
X1
X2
X3
X4
X5
X6
X7
X8
X9
X10
Valoracin del control gravimtrico
Valor Volumen nominal
100%
Volumen nominal al
50%
Volumen nominal 35%
E%
CV%
BIBLIOGRAFIA
http://www.slideshare.net/ginadamaris26/preparacin-de-soluciones
http://jorge-contreras.webs.com/guia-El%20uso%20de%20micropipeta-BM.pdf
file:///C:/Users/HP/Downloads/Uso%20correcto%20micropipetas.pdf
http://www.slideshare.net/ginadamaris26/preparacin-de-soluciones
http://es.scribd.com/doc/51194898/Preparacion-de-Soluciones
http://www.monografias.com/trabajos87/bioseguridad-laboratorio/bioseguridad-
laboratorio.shtml
http://www.cientificasenna.com/index.php?modulo=catalogo&accion=articulo&id=956
http://www.cientificasenna.com/index.php?modulo=catalogo&accion=articulo&id=1187
http://www.prolab.com.mx/home/index.php?option=com_content&view=article&id=959:termoci
clador-gradiente-touch&catid=19:termociclador&Itemid=6
http://www.clinicalascondes.cl/INFORMACION-AL-PACIENTE/Examenes-y-
procedimientos/Laboratorio/Biologia-Molecular.aspx
http://en.wikipedia.org/wiki/Shaker_(laboratory)
You might also like
- Meditacion Con Los CristalesDocument37 pagesMeditacion Con Los CristalesLUIS100% (1)
- Informe de Espontaneidad y EquilibrioDocument6 pagesInforme de Espontaneidad y EquilibrioHERNAN ENRIQUE NORIEGA BARROSNo ratings yet
- Metanfetamina InfografíaDocument1 pageMetanfetamina InfografíaRita Ricci100% (1)
- Procedimiento de Quejas y ReclamosDocument3 pagesProcedimiento de Quejas y ReclamosAngie OcampoNo ratings yet
- Ventajas y Desventajas de Ser VegetarianoDocument10 pagesVentajas y Desventajas de Ser VegetarianoLinda Linda Cortez100% (1)
- Problemas en CatacaosDocument5 pagesProblemas en CatacaosAlice Fiorella Pacheco Miñan0% (1)
- Ejercicios Enterobacterias PDFDocument6 pagesEjercicios Enterobacterias PDFXuxek Martinez100% (1)
- Resultado Cultivo de Secrecion Pcte Miranda Arevalo Nathaly PDFDocument1 pageResultado Cultivo de Secrecion Pcte Miranda Arevalo Nathaly PDFyeivethNo ratings yet
- Macromoléculas de La LevaduraDocument1 pageMacromoléculas de La Levaduravalentina grajalesNo ratings yet
- ESPECTROFOTOMETRÍADocument6 pagesESPECTROFOTOMETRÍANataliaNo ratings yet
- TermodinamicaDocument6 pagesTermodinamicaMoHe HernandezNo ratings yet
- Problemas EnzimasDocument5 pagesProblemas EnzimasKevin O. BallardoNo ratings yet
- Curva de Crecimiento para Hongos No Filamentosos FungusDocument5 pagesCurva de Crecimiento para Hongos No Filamentosos Fungusluz lopezNo ratings yet
- Experimento 8 Lisozima 06-04Document20 pagesExperimento 8 Lisozima 06-04rominagriseldaNo ratings yet
- Extracción Acido Base Por Formación de SalesDocument3 pagesExtracción Acido Base Por Formación de SalesyeseniaNo ratings yet
- PRACTICA NO1 Descripcion de Material de LaboratorioDocument12 pagesPRACTICA NO1 Descripcion de Material de LaboratorioYolanda Jael Rizo FonsecaNo ratings yet
- Acción Enzimatica de La Alfa AmilasaDocument9 pagesAcción Enzimatica de La Alfa AmilasaFabiola Del Pilar CuroNo ratings yet
- Fosfatasa Ácida-ProstáticaDocument12 pagesFosfatasa Ácida-ProstáticaFrancisco Baca DejoNo ratings yet
- Metodologia de Manejo de Pipetas AutomaticasDocument1 pageMetodologia de Manejo de Pipetas AutomaticasTahyri ShicayNo ratings yet
- PracticasDocument16 pagesPracticasNayletNo ratings yet
- Informe Practica de VolumetriaDocument5 pagesInforme Practica de Volumetriajose perezNo ratings yet
- GravimetriaDocument3 pagesGravimetriaPaula EmeryNo ratings yet
- Seminario IV AminasDocument22 pagesSeminario IV AminasMonserrat VilaNo ratings yet
- Bioquimica Inf 4Document8 pagesBioquimica Inf 4PedroNo ratings yet
- Práctica No. 6 Eliminación Renal de AAS en HumanosDocument15 pagesPráctica No. 6 Eliminación Renal de AAS en HumanosAlis BretANo ratings yet
- Determinación Espectrofotometrica de AdffDocument10 pagesDeterminación Espectrofotometrica de AdffJ Mora GañanNo ratings yet
- Farma 1 Practica 8Document6 pagesFarma 1 Practica 8Roxana HernandezNo ratings yet
- METODO DE REDUCCION DEL AZUL DE METILENO Practica BioquimicaDocument6 pagesMETODO DE REDUCCION DEL AZUL DE METILENO Practica BioquimicaRay Rodriguez HuamanNo ratings yet
- Informe - Determinación Del Porcentaje de Acidez Titulable de Una FrutaDocument6 pagesInforme - Determinación Del Porcentaje de Acidez Titulable de Una FrutaFrias Alfonso SandraNo ratings yet
- PRQ 301 L Cuantificación de M.ODocument46 pagesPRQ 301 L Cuantificación de M.OCesar AlvarezNo ratings yet
- DIAGRAMA DE FLUJOS PRÁCTICA N°2 Lab. FisicoquimicaDocument3 pagesDIAGRAMA DE FLUJOS PRÁCTICA N°2 Lab. FisicoquimicaJOSELIN BELTRÁN PÉREZNo ratings yet
- Generalidades FEUMDocument1 pageGeneralidades FEUMcarlosNo ratings yet
- Practica 11Document3 pagesPractica 11Adriana MarinNo ratings yet
- Informe de Bioquimica AminoacidosDocument12 pagesInforme de Bioquimica AminoacidosCECILIO BRICEÑONo ratings yet
- Fundamentos para Manejo Del PotenciometroDocument10 pagesFundamentos para Manejo Del PotenciometroMisael Serrano HernandezNo ratings yet
- Ejercicios Cinética 2Document3 pagesEjercicios Cinética 2Mayra MoralesNo ratings yet
- PREPARACIÓN DE BUFFER DE PH CONOCIDO A PARTIR DE DISOLUCIONES DE FOSFATOSDocument9 pagesPREPARACIÓN DE BUFFER DE PH CONOCIDO A PARTIR DE DISOLUCIONES DE FOSFATOSXochitlNo ratings yet
- Taller 1 - Soluciones Amortiguadoras. BioQm TeoriaDocument9 pagesTaller 1 - Soluciones Amortiguadoras. BioQm TeoriaBrandon CaballeroNo ratings yet
- Adsorción y Difusión en La Tinción de BacteriasDocument21 pagesAdsorción y Difusión en La Tinción de BacteriassekaiNo ratings yet
- Protones en LevaduraDocument7 pagesProtones en Levaduralauraj5No ratings yet
- Purificacion de SolidosDocument23 pagesPurificacion de SolidosBetsabe M MejiaNo ratings yet
- OrganohalurosDocument13 pagesOrganohalurosYarely AlvarezNo ratings yet
- Cuantificacion de Proteinas PDFDocument6 pagesCuantificacion de Proteinas PDFNataly JimenezNo ratings yet
- TALLER-3-jau-jau FinalDocument8 pagesTALLER-3-jau-jau Finalsebastian floresNo ratings yet
- Cálculo de Glucosa en EspectrofotómetroDocument2 pagesCálculo de Glucosa en EspectrofotómetroJean Carlos ZambranoNo ratings yet
- Enantiomeros GlucosaDocument2 pagesEnantiomeros GlucosaJorge Rgz100% (2)
- Informe Soluciones IdealesDocument5 pagesInforme Soluciones IdealesJonat ChNo ratings yet
- 6.informe PCRDocument7 pages6.informe PCRdavid espinoza avendañoNo ratings yet
- PrácticaDocument7 pagesPrácticaDulce Mariah MárquezNo ratings yet
- Benemérita Universidad Autónoma de Puebla Practica 3Document10 pagesBenemérita Universidad Autónoma de Puebla Practica 3Diego Armando Frias VazquezNo ratings yet
- Regulación Genética en El Operón Lac Corregido 1Document4 pagesRegulación Genética en El Operón Lac Corregido 1Miguel RivasNo ratings yet
- Laboratorio BioquímicaDocument30 pagesLaboratorio BioquímicaGladys Alba Baquero VizcainoNo ratings yet
- Organica 2Document11 pagesOrganica 2Diego Padilla SantosNo ratings yet
- Farmacologia - Practica 4Document3 pagesFarmacologia - Practica 4Roy InquisdorNo ratings yet
- Mga007 CotDocument2 pagesMga007 Cotvioleta xNo ratings yet
- Práctica Semana 14 - EstequiometríaDocument5 pagesPráctica Semana 14 - EstequiometríaCamila MartínezNo ratings yet
- Informe #5-Electroforesis de Proteinas Del Suero HumanoDocument8 pagesInforme #5-Electroforesis de Proteinas Del Suero HumanoJULIA ESQUIVELNo ratings yet
- Test EmbarazoDocument2 pagesTest EmbarazoNicol FialloNo ratings yet
- Practica 6 AlcoholesDocument18 pagesPractica 6 AlcoholesANNIENo ratings yet
- Informe EntalpiaDocument16 pagesInforme EntalpiaMary_Coll03No ratings yet
- Previo 2 - Electroforesis de ProteinasDocument6 pagesPrevio 2 - Electroforesis de ProteinasMelissa GalanNo ratings yet
- Practica 2 QuimicaDocument11 pagesPractica 2 Quimicahector2lopez22No ratings yet
- Guia de Laboratorio de Quimica IndustrialDocument73 pagesGuia de Laboratorio de Quimica IndustrialJorge Alvites CardenasNo ratings yet
- 100000ni22-Guia N°2-Labquimi01-Propi - ColigativasDocument11 pages100000ni22-Guia N°2-Labquimi01-Propi - ColigativastiseaNo ratings yet
- Quimica-Semana 07 MD3N5Document14 pagesQuimica-Semana 07 MD3N5Piero TorresNo ratings yet
- Historia Del MicroscopioDocument6 pagesHistoria Del MicroscopioLinda Linda CortezNo ratings yet
- Analisis y Control de MielDocument7 pagesAnalisis y Control de MielLinda Linda CortezNo ratings yet
- Farmacos AntineoplasicosDocument12 pagesFarmacos AntineoplasicosLinda Linda CortezNo ratings yet
- Sekaiichi Hatsukoi Yoshino Chiaki No BaaiDocument67 pagesSekaiichi Hatsukoi Yoshino Chiaki No BaaiLinda Linda Cortez50% (2)
- Buscando Un DestinoDocument2 pagesBuscando Un DestinoLaura HuancaNo ratings yet
- Consolidado Gran Consumo Dic 2020Document6 pagesConsolidado Gran Consumo Dic 2020ximenaNo ratings yet
- Rocas Metamorficas de Presion, Dirigido o Dinamico (Expo)Document26 pagesRocas Metamorficas de Presion, Dirigido o Dinamico (Expo)Jonny Steyver Arroyo QuirogaNo ratings yet
- Lista de Cotejo para Trabajar Equidad de GéneroDocument2 pagesLista de Cotejo para Trabajar Equidad de GéneroRolando Villanueva Pariona40% (5)
- Morfologia Cacao y PapayaDocument4 pagesMorfologia Cacao y PapayaDiego MartinezNo ratings yet
- Sistematizacion de DiagnosticoDocument16 pagesSistematizacion de DiagnosticoFabricio Alejandro CevallosNo ratings yet
- Tarea Sesión 5 EmocionesDocument2 pagesTarea Sesión 5 EmocionesPele Valencia TolaNo ratings yet
- Gravitational Torsion Balance Manual AP 8215A EsDocument22 pagesGravitational Torsion Balance Manual AP 8215A EsCube Head VNo ratings yet
- TESIS Jose - Ardito@upn - Edu.peDocument5 pagesTESIS Jose - Ardito@upn - Edu.peClinton Huamán ChávezNo ratings yet
- Difusiòn de Los Derechos Humanos de Los Pacientes y Su Familia-1Document21 pagesDifusiòn de Los Derechos Humanos de Los Pacientes y Su Familia-1Mayra Reyes MaldonadoNo ratings yet
- Full Skin QuitoDocument31 pagesFull Skin QuitoVeronica RolandelliNo ratings yet
- Violencia y Paz. LJADocument3 pagesViolencia y Paz. LJAMahia RosarioNo ratings yet
- Prevención y Tratamiento de La Caries Dental Con Productos Sin Mercurio y Una Intervención MínimaDocument28 pagesPrevención y Tratamiento de La Caries Dental Con Productos Sin Mercurio y Una Intervención Mínimabere laraNo ratings yet
- Drenaje Agrícola - EcuRedDocument3 pagesDrenaje Agrícola - EcuRedGerardo Revelo SanchezNo ratings yet
- Valvula Duplex OrinalDocument2 pagesValvula Duplex OrinalAndres Felipe SánchezNo ratings yet
- Ensayo Evolucion Psicologia EducativaDocument6 pagesEnsayo Evolucion Psicologia EducativaTejada YelitzaNo ratings yet
- Ruedas de La Vida AutocoachingDocument29 pagesRuedas de La Vida AutocoachingHernanNo ratings yet
- HPLCDocument75 pagesHPLClchemistry10No ratings yet
- Estimulacion Multisensorial Fisio PediatricoDocument11 pagesEstimulacion Multisensorial Fisio PediatricoJenny Andrea Rodriguez Quintero100% (1)
- Desafío en El Consumo de Frutas y VerdurasDocument21 pagesDesafío en El Consumo de Frutas y VerdurasAdriana SosaNo ratings yet
- Metodos Anticonceptivos Prac-2 3b Nu 6 EquipoDocument10 pagesMetodos Anticonceptivos Prac-2 3b Nu 6 EquipoGuadalupe Segovia MontejoNo ratings yet
- MarianDocument2 pagesMarianGua PixelNo ratings yet
- Incubadora NeonatalDocument47 pagesIncubadora NeonatalMartin UruNo ratings yet
- Gastronomia Del Perú Por RegionesDocument4 pagesGastronomia Del Perú Por RegionesLaura DannielaNo ratings yet
- Informe 4Document3 pagesInforme 4Jhon FlorezNo ratings yet
- Annotated-Informe Evidencias Prácticas PreprofesionalesDocument68 pagesAnnotated-Informe Evidencias Prácticas Preprofesionalesmarycis.2000No ratings yet