Professional Documents
Culture Documents
Microbiologie Medicala Imagini
Uploaded by
Adrian Cosmin RebosapcaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Microbiologie Medicala Imagini
Uploaded by
Adrian Cosmin RebosapcaCopyright:
Available Formats
A
r
a
n
j
a
r
e
P
o
w
e
r
P
o
i
n
t
:
A
n
t
o
n
e
l
-
A
u
r
e
l
I
l
i
e
!
LISTA COLABORATORILOR
Catedra de Microbiologie, U.M.F. Gr. T. Popa Ia#i
DANIELA BOSNEA $ef de lucr%ri universitar, doctor medic
DUMITRU BUIUC Profesor universitar, doctor medic
GABRIELA COMAN Profesor universitar, doctor medic
MARIA DAN Preparator universitar, medic
OLIVIA DORNEANU $ef de lucr%ri universitar, doctor medic
ROXANA FILIP $ef de lucr%ri universitar, doctor medic
DRAGO! FLOREA Asistent universitar, medic
LUMINI"A SMARANDA IANCU Conferen&iar universitar, doctor medic
CARMEN PNZARU Conferen&iar universitar, doctor medic
IRINA POPOVICI Preparator universitar, medic
ANA VORNICU Preparator universitar, medic
Fig. 2-1:
Colora#ia Gram
Principiu: Dup% colorare cu violet de metil #i mordan&are cu
solu&ie iodo-iodurat% (Lugol) unele bacterii rezist% la
decolorarea cu alcool #i r%mn violete (sunt grampozitive),
altele se decoloreaz% #i le putem recolora n ro#u cu fucsin%
(sunt gramnegative). Comportamentul diferit al bacteriilor n
colora&ia Gram l numim afinitate tinctorial%.
Indica#ii: aspectul morfotinctorial al bacteriilor n colora&ia
diferen&ial% Gram este caracter taxonomic primar util pentru
clasificarea preliminar% a bacteriilor urm%ri&i partea dreapt% a
figurii).
Procedura (urm%ri&i partea stng% a figurii):
A. Colorare un minut cu solu&ie 0,2% violet de metil. Sp%lare cu
ap% de robinet.
B. Mordan&are 2 minute cu solu&ie Lugol.
C. Decolorarea cu alcool-aceton% este timpul cheie al colora&iei.
Alcoolul decoloreaz% rapid. Adaosul de aceton% n propor&ie de
1/3 face reactivul mai u#or de manipulat #i permite
decolorarea (diferen&ierea) optim% n 5 secunde pentru
frotiurile sub&iri (e.g. din culturi) #i 10-15 secunde pentru cele
mai groase (e.g. din prelevate patologice).
D. Recolorare cu fucsin% fenicat% Ziehl diluat% 1/10.
Fig. 2-2:
Controlul de calitate
al colora#iei Gram
Utiliz%m un frotiu efectuat
dintr-o suspensie cu densi-
tatea 3 Mc Farland din
cultura peste noapte pe
agar nutritiv a Escherichia
coli ATCC 25922 #i Bacillus
megaterium.
a. Frotiu martor corect diferen&iat: bacilli gram-negativi #i gram-pozitivi.
b. Frotiu martor insuficient diferen&iat: numai bacilli gram-pozitivi (subdecolorat).
c. Frotiu martor supradecolorat: numai bacili gramnegativi.
d. Frotiu din produs patologic corect diferen&iat: leucocite ro#ii #i coci gram-pozitivi.
Fig. 2-3: Colora#ia Ziehl-Neelsen
Principiu: bacilii al c%ror perete are asociat peptido-
glicanului acizi micolici cu caten% lung% #i micozide se
coloreaz% numai n condi&ii speciale (la cald cu solu&ie
concentrat% de fucsin% fenicat%) #i rezist% la decolorarea cu
solu&ii de acizi minerali #i alcool. Ca atare, i numim bacilli
acido-alcoolo-rezisten&i (baar).
Indica#ii: diferen&ierea baar de bacteriile neacido-rezisten-
te (urm%ri&i partea dreapt% a figurii).
Procedura (urm%ri&i partea stng% a figurii).
A. Colorare cu fucsin% fenicat% Ziehl, la cald. La sfr#itul
acestui timp toate bacteriile apar colorate n ro#u.
B. Diferen&ierea cu solu&ie 3% acid clorhidric n alcool de
96
0
, eviden&iaz% bacilii acido-alcoolo-rezisten&i, care
r%mn colora&i n ro#u. Bacteriile neacido-alcoolo-
rezistente nu rezist% la decolorarea cu acest amestec
acid-alcool.
C. Recolorarea cu albastru de metilen eviden&iaz% bacte-
riile neacido-alcoolo-rezistente.
La sfr#itul acestui timp, bacilii acido-alcoolo-rezisten&i
apar colora&i n ro#u, iar celelalte bacterii #i celulele n
albastru.
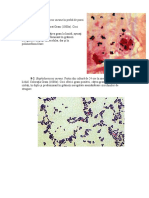
Fig. 3-1: Haemophilus influenzae: colonii satelite striului de Staphylococcus aureus pe
agar snge (2x). H. influenzae formeaz% colonii transparente de aproximativ 2 mm
lng% stria de stafilococ #i din ce n ce mai mici pn% la punctiforme pe m%sur% ce se
distan&eaz% de S. aureus care sintetizeaz% factor V.
Haemophilus infuenzae
Controlul de calitate
Pentru controlul de calitate al
steriliz%rii la autoclav folosim un
test bilogic.
Fiole cu spori de Bacillus stearo-
termophilus, n concentra&ie de
10
6
/ml bulion nutritiv glucozat #i
cu un indicator de pH, sunt folosite
n ambalajele de la diferite nivele
ale incintei de sterilizare. Dup%
sterilizare, fiolele sunt incubate 48
ore la 57
0
C.
Dac% sterilizarea a fost eficient%
sporii sunt omor&i. Fiola cu mediul
virat n galben semnific% steri-
lizarea ineficient%, sporii r%mn
viabili, germineaz% #i genereaz% o
cultur% care fermenteaz% glucoza,
acidific% #i vireaz% mediul de
cultur% n galben.
Fig. 7-1
Fig. 7-2: Detectarea rapid% a beta-lactamazelor prin testul cromogen cu
nitrocefin: rondelele impregnate cu nitrocefin (cefalosporin% colorat% n
galben) #i modific% culoarea n ro#u dac% tulpina testat% este produc%toare de
enzim%.
Testul cromogen cu nitrocefn
Fig. 8-1: Staphylococcus aureus - n prob% de puroi
de la un copil cu osteomielit%. Frotiu colorat Gram
(1000x).
Coci sferici gram-pozitivi (0,5-1,0 micrometri),
c&iva gram la limit%, a#eza&i izola&i, n perechi #i
predominant n gr%mezi neregulate, dispu#i
extracelular, dar #i n polimorfonucleare.
Staphylococcus aureus
Fig. 8-2: Staphylococcus aureus.
Frotiu din cultur% de 24 ore n me-
diu lichid. Colora&ia Gram (1000x).
Coci sferici gram-pozitivi, c&iva
gram la limit%, a#eza&i izola&i, n
diplo #i predominant n gr%mezi
neregulate asem%n%toare ciorchi-
nilor de strugure.
Staflococi
Fig. 8-3: Stafilococi n cultur% de 24 ore pe agar cu 5% snge de berbec (2x).
Coloniile mari netede, cremoase, pigmentate n galben citrin #i '-hemolitice
apar&in Staphylococcus aureus; coloniile pitice, opace, nepigmentate,
nehemolitice apar&in Staphylococcus epidermidis.
Fig. 8-4:
Furuncul al cefei.
Fig. 8-5: Sindromul pielii op%rite (Ritter). Epidermoliz% necrotic%.
Rash-ul tegumentar generalizat #i descuamarea pe zone ntinse realizeaz%
aspectul de "piele op%rit%".
Sindromul Ritter
Fig. 9-1: Cultur% de 24 ore pe agar cu 5% snge de berbec a unei tulpini de streptococ
' -hemolitic, Streptococcus pyogenes (1/1). Acest coc gram-pozitiv formeaz%
colonii mici cu diametrul de 1 mm, nepigmentate, opace, nconjurate de o zon% larg%
de hemoliz% clar%, complet%.
Fig. 9-1bis: Streptococcus
pyogenes - tipurile de colonii:
a. Tulpinile capsulate
formeaz% colonii mucoide cu
tendin&% la confluare.
b. Prin liza acidului hialuronic
capsular coloniile ncep s% se
turteasc%.
c. Colonii turtite, cu
suprafa&a mamelonat%, contur
neregulat (matt).
d. Tulpinile necapsulate
formeaz% colonii mici,
rotunde, opace (glossy).
Fig. 9-2: Cultura pe agar cu
5% snge de berbec (1/1) a
unui streptococ (-hemolitic:
streptococ viridans ce culti-
v% sub forma coloniilor mici
(aprox. 1mm), nepigmenta-
te, opace, nconjurate de o
zon% de liz% par&ial% a he-
mat i i l or ce det er mi n%
"nverzirea" mediului ((-
hemoliz%).
Fig. 9-3: Frotiu din cultura de
24 ore n bulion glucozat a
unei tulpini de Streptococcus
pyogenes. Colora&ia Gram:
coci sferi ci gram-pozi ti vi
a#eza&i n lan&uri lungi.
Fig. 9-4: Impetigo contagiosa.
Fa&a este unul din sediile de
elec&ie.
La acest copil observ%m prezen&a
leziunilor multiple aflate n diferite
stadii evolutive: vezicule, pustule,
cruste galbene,"melicerice".
Denumirea popular% a bolii este
aceea de "bube dulci".
Fig. 9-5: Streptococcus pyogenes. Frotiu din puroi ob&inut dup%
deta#area unei cruste melicerice. Colora&ia Gram (1000x). Sunt prezente
celule inflamatorii #i coci sferici gram-pozitivi ce formeaz% o pereche #i
trei lan&uri.
Fig. 9-6: Testul sensibilit%&ii la
bacitracin% #i sulfametoxazol-
trimetoprim: tulpina de strep-
tococ '-hemolitic prezentat%
este sensibil% la bacitracin%
(B) #i rezistent% la sulfame-
toxazol-trimetoprim (SXT),
deci este streptococ de grup
A.
Fig. 9-7: Testul sensibilit%&ii la
bacitracin% #i sulfametoxazol-
trimetopriml: tulpina de strep-
tococ '-hemolitic testat% este
rezistent% la bacitracin% #i
sensibil% la sulfametoxazol-
trimetoprim. Este un strepto-
coc beta-hemolitic non-grup A.
Fig. 9-8: Testul CAMP pentru identificarea prezumtiv% a streptococului de grup B,
Streptococcus agalactiae. Activitatea '-hemolizinei produs% de Staphylococcus
aureus este poten&at% de proteina extracelular% (factor CAMP) produs% de
streptococul de grup B. Aceast% zon% este u#or observat% pe agar cu 5% snge de
berbec, dup% incubare peste noapte (aspect n "vrf de s%geat%").
Fig. 9-9: Streptococcus
pneumoniae, cultur% pe
agar cu 5% snge de berbec
(1/1): (-hemoliz% dup% 24
ore de incubare n atmosfer%
cu 5% bioxid de carbon.
Coloniile sunt gri-opace,
foarte mici (0,5 mm), alfa-
hemolitice cu deprimare
central%.
Fig. 9-10: Streptococcus pneumoniae, cultur% pe agar snge cu
5% snge de berbec, dup% 24 ore de incubare n atmosfer% cu 5%
bioxid de carbon (3x).
n aceast% imagine de detaliu observ%m foarte bine aspectul
caracteristic al coloniei de pneumococ, respectiv de colonie
crateriform% datorit% autolizei enzimatice.
Fig. 9-11: Frotiu din sput$. Colora&ia Gram (100x).
Observ%m foarte numeroase polimorfonucleare, fibrin% #i dou% celule
bron#ice tinere. Scorul Q de calitate pentru aceast% prob% este +3.
Fig. 9-12: Frotiu din sputa aceluia#i bolnav cu pneumonie pneumococic%.
Colora&ie Gram (1000x). Observ%m c% singurele bacterii prezente, numero#i
diplococi ovali gram-pozitivi (mai mult de 10 perechi/cmp), sunt asociate cu
polimorfonucleare #i fibrin%, "mesagerii leziunii". Sputocultura cantitativ% a
izolat, n concentra&ie de peste 10
6
UFC/ml, o tulpin% de Streptococcus
pneumoniae.
Fig. 9-13: Frotiu din sputa unui pacient cu pneumonie.
Colora&ie Gram (100x).
Observ%m numeroase celule epiteliale scuamoase (mai mult de 25)
#i polimorfonucleare (mai mult de 25), absen&a fibrinei. Scorul Q
de calitate este zero.
Fig. 9-14: Prob$ de sput$ incorect prelevat$. Colora&ie Gram (1000x).
Scorul Q de calitate mai mic dect unu. Observa&i foarte numero#i coci
gram-pozitivi n lan&uri #i perechi asocia&i unei celule epiteliale scuamoase.
Sunt bacterii de contaminare orofaringian%.
Fig. 9-15: Streptococcus
pneumoniae, testul sensibili-
t%&ii la optochin.
Sensibilitatea la etilhidro-
cuprein% (optochin) diferen-
&iaz% pneumococul de al&i
streptococi viridans. Prezen&a
unei zone de inhibi&ie mai mari
sau egal% cu 14 mm n jurul
discului cu 5 micrograme de
optochin identific% prezumtiv
pneumococul.
Fig. 9-16: Streptococcus pneumoniae, depistarea polizaharidului
capsular prin latexaglutinare n LCR: proba pozitiv% (stnga), proba negativ%
(dreapta).
Fig. 10-1: Frotiu din puroi uretral. Colora&ia cu albastru de
metilen (1000x). Gonococi: coci de 0,6-1micrometri dispu#i n
perechi cu fe&ele adiacente aplatizate ("boabe de cafea"), situa&i
intra #i extracelular.
Fig. 10-2: Frotiu din sedimentul unui LCR. Colora&ia
Gram(1000x). Meningococi: coci gram-negativi a#eza&i n diplo cu
aspectul "boabelor de cafea" asocia&i polimorfonuclearelor.
Fig. 10-3: Copil, n vrst$ de 1 an %i 2 luni cu meningit$ meningococic$,
aflat n a 12-a zi de boal%. Stare general% grav%; observ%m privirea "n apus de
soare". Sunt vizibile arii largi de necroz% #i gangren%, ct #i leziuni mici pete#iale.
Fig. 10-4: Meningococcemie cu meningit$ la un copil de 8 ani.
Erup&ie hemoragic% generalizat%.
Fig. 11-1: Enterobacteriaceae. Frotiu din cultur% colorat Gram (1000x).
Bacili gram-negativi drep&i, cu capete rotunjite, f%r% a#ezare caracteristic%.
Fig. 11-2: Klebsiella pneumoniae. Frotiu din amprenta splinei unui
#oarece injectat experimental. Colora&ia Gram (1000x).
Printre celulele splenice sunt prezen&i bacili gram-negativi capsula&i.
Fig. 11-3: Aspectul mucoid
al culturii de Klebsiella
pneumoniae pe mediul
MacConkey.
Fig. 11-4: Aspectul invaziv al unei culturi de Proteus mirabilis. Inocul depus n
centrul pl%cii Petri. Observa&i v%lurile concentrice de invadare a suprafe&ei
mediului de cultur%.
Fig. 11-5: Aspectul diferen&iat al
coloniilor de bacili gram-negativi
pe mediul diferen&ial MacConkey:
coloniile lactozo-pozitive apar
colorate n rozro#u, coloniile
lactozo-negative apar necolorate.
Fig. 11-6: Coprocultur$ pe mediul
Hektoen: coloniile lactozo-pozitive
(coliformi) sunt inhibate la locul de
depunere a produsului; coloniile
lactozo-negative, favorizate n
dezvoltare, se diferen&iaz% n
produc%toare sau neproduc%toare
de hidrogen sulfurat (respectiv cu
sau f%r% centru de culoare neagr%).
Fig. 11-7: Tipul diferen&iat de adezivitate pe culturi de celule HEp-2 a trei
patotipuri diareigene de Escherichia coli. Aderen&a de tip localizat la tulpinile
ECEP.
Fig. 11-8: Tipul diferen&iat de adezivitate pe culturi de celule HEp-2 a
trei patotipuri diareigene de Escherichia coli. Aderen&a de tip
agregativ la tulpinile ECEAg.
Fig. 11-9: Tipul diferen&iat de adezivitate pe culturi de celule
HEp-2 a trei patotipuri diareigene de Escherichia coli. Aderen&a
de tip difuz la tulpinile ECAD.
Fig. 11-10: Bubon pestos: ganglioni inghinali m%ri&i de volum.
Fig. 11-11: Yersinia pestis.
Colora&ia Leishman (cu albastru de
toluidin%) (1000x). Aspirat din
bubon. Numero#i bacili colora&i
caracteristic bipolar, ceea ce i
face u#or de confundat cu un bacil
sporulat, al%turi de numeroase
limfocite.
Fig. 11-11bis: Yersinia pestis. Colora&ia Gram
(x1250). Aspirat din bubon. Numero#i bacili gram-
negativi, pleomorfi, de 0,5-0,8 microni/1-3 microni #i
colora&i bipolar #i limfocite.
Fig. 11-12: Fenomenul Dienes
folosit n studii epidemiologice:
prezen&a unei delimit%ri lineare
n cazul unor tulpini diferite de
Proteus mirabilis cu cre#tere
invaziv%.
Urm%ri&i s%ge&ile.
Fig. 12-1: Campylobacter jejuni, frotiu din scaun diareic colorat cu
albastru de metilen: polimorfonucleare, c&iva coci, bacili mici palid
colora&i n albastru, n form% de virgul% #i sub forma "aripilor de
pesc%ru# n zbor".
Fig. 12-2: Helicobacter pylori n fragment de biopsie gastric%.
Colora&ia Gram (1000x). Aspect caracteristic de bacterie spiralat%.
Fig. 12-3: Testul ureazei. Detectarea prezen&ei ureazei produs% de Helicobacter
pylori prin plasarea fragmentului biopsic ntr-un mediu tamponat cu 2% uree #i ro#u
fenol drept indicator de pH. Test pozitiv (stnga): ureaza scindeaz% ureea cu
producere de ioni de amoniu care alcalinizeaz% mediul. Ro#ul fenol n mediu alcalin
vireaz% n roz-ro#u. Test negativ dreapta, culoarea mediului neschimbat% (galben).
Fig. 13-1: Pseudomonas aeruginosa,
frotiu din cultura de 24 ore pe agar
snge. Colora&ia Gram (1000x). Bacili
gram-negativi fini (0,3 - 0,5micrometrii/
1,5 - 3 micrometri) dispu#i izola&i sau n
perechi.
Fig. 13-2: Pseudomonas aeruginosa:
cultura de 48 ore pe agar nutritiv (1/1)
eviden&iaz% pigmentogeneza, respectiv
el i berarea de pi gmen&i di fuzi bi l i ,
piocianina #i pioverdina ce dau culturii #i
progresi v medi ul ui cul oarea verde
str%lucitoare.
Pseudomonas aeruginosa
Fig. 13-3: Pseudomonas
aeruginosa, cultura de 24
ore pe agar cu 5% snge de
berbec (1/1). Colonii mari cu
diametrul de 3 mm, rotunde,
netede #i hemolitice.
14-1: Frotiu din sputa unui pacient cu pneumonie. Colora&ia Gram
(1000x). Haemophilus influenzae: cocobacili #i bacili gram-negativi
fini, scur&i, drep&i asocia&i semnificativ cu polimorfonucleare.
Fig. 14-2: Frotiu din sput% (n caset%
1000x). Haemophilus influenzae.
Celule inflamatorii, fibrin%, cocobacili
numero#i cu tendin&a de a se a#eza "n
bancuri de pe#ti".
Fig. 16-1: Corynebacterium diphtheriae. Frotiu de cultur% de 24 ore
pe mediul L)effler. Colora&ia Gram, cu prelungirea decolor%rii (1000x).
Bacili gram-pozitivi la limit%, cu incluzii de volutin% dispuse bipolar, violete
pe fondul ro#u al citoplasmei bacilului; dispu#i n litere chineze#ti #i
palisade.
Fig. 16-2: Corynebacterium diphtheriae, cultur% de 48 ore pe mediul Tinsdale
(1/1): colonii mici, negru-cenu#ii, cu halou cafeniu bine delimitat. Acest mediu
selectiv care con&ine telurit de potasiu #i cistin%, diferen&iaz% grupul Corynebacterium
diphtheriae de alte specii ale genului care sunt inhibate cantitativ sau dac% apar, sunt
lipsite de halou.
Fig. 16-3: Difterie. Aspectul faringelui: fals% membran% la
nivelul amigdalelor congestive.
Fig. 16-4: Producerea crupului difteric:
falsele membrane coboar% de la nivelul
faringelui pn% la laringe.
Fig. 16-5: Difterie: edem masiv al gtului (gt proconsular)
#i scurgere nasal% sero-sanguinolent%.
Fig. 16-6: Listeria monocytogenes. Frotiu din cultur% de 24 ore n bulion
tripticaz% soia. Colora&ie Gram (1000x). Se observ% bacilii gram-pozitivi
(0,4-0,8 micrometri/0,5 -2 micrometri) scur&i, drep&i, cu capetele rotunjite,
dispu#i izola&i, n litere unghiulare #i n palisade.
16-7: Listeria monocytogenes:
cultur% de 72 ore pe agar cu 5%
snge de berbec (1/1): colonii mici
de 1 mm, rotunde, transparente,
cu aspectul pic%turilor de rou%,
nconjurate de '-hemoliz% difuz%.
Fig. 16-8: Lsteria monocytogenes. Cultur% de 72 ore pe agar
cu 5% snge de berbec (x3). n aceast% imagine de detaliu
observ%m mai bine caracterul difuz al zonei nguste de beta-
hemoliz%.
Fig. 16-9: Listeria monocytogenes. Cultur% de 24 ore pe mediul
selectiv PALCAM (1/1). Selectivitatea este dat% de polimixin%,
acroflavin%, clorur% de litiu, ceftazidim, esculin%, manitol. Coloniile
sunt negre sau cenu#ii inconjurate de un halou brun-nchis.
Fig. 17-1: Bacillus anthracis. Frotiu din amprenta de splin% a #oarecelui
decedat dup% 48 ore de la inocularea suspensiei bacteriene. Colora&ie cu
albastru de metilen policrom (1000x). Bacillus anthracis #i celulele splenice
apar colora&i n albastru, iar capsula colorat% metacromatic n roz.
Fig. 17-2: Bacillus anthracis. Frotiu din cultura de 48 ore pe agar
nutritiv. colora&ie Gram (1000x). Bacili gram-pozitivi mari (0,9
micrometri/3-8micrometri) a#eza&i n lan&uri arcuite, sporula&i, cu
spor oval situat central #i care nu deformeaz% corpul bacteriei.
Fig. 17-3: Bacillus anthracis.
Cultur% de 24 ore pe agar nutritiv
(1/1): colonii mari de 3 mm,
aplatizate, de tip R.
Fig. 17-4: Bacillus anthracis, detaliu al unei
culturi de 24 ore pe agar nutritiv (x3). Aspectul de
"cap de meduz%": periferia coloniei examinat% cu
lupa apare nconjurat% de prelungiri laterale
ondulate precum #uvi&ele de p%r.
Fig. 17-5: Cultur% de 24 ore pe
agar cu 5% snge de berbec(1/1).
Coloniile mari, rugoase, alb-
cenu#ii, turtite, nehemolitice
apar&in Bacillus anthracis (jos);
coloniile cu morfologie asem%n%-
toare, dar nconjurate de o zon%
larg% de beta-hemoliz% apar&in
Bacillus cereus (sus).
Fig. 17-6: Bacillus anthracis - cultur% de 24 ore pe agar cu 5%
snge de berbec (x3). n aceast% imagine de detaliu observ%m
coloniile mari cu diametrul de 5 mm, alb-cenu#ii, rugoase, cu aspect
de "sticl% pisat%".
Fig. 17-7: C$rbune cutanat: forma buloas%.
Fig. 17-8: C$rbune cutanat: n regiunea cervico-
lateral% pe o zon% congestiv% #i edema&iat% este
prezent% o leziune necrotic% acoperit% de o crust%
neagr%.
Antraxul
Fig. 17-9: Bacillus cereus. Cultura de 24 ore pe mediul
Nagler. Sub ac&iunea lecitinazei produs% de Bacillus cereus
mediul cu g%lbenu# de ou (lecitovitelina) este opacifiat.
Fig. 17-10: Clostridium spp. Frotiu
din cultura de 96 ore n bulion VF.
Colora&ia Gram (1000x): bacili gram-
pozitivi cu dimensiunea de 0,5 micro-
metri / 1,3 micrometri cu spor oval
subterminal #i care deformeaz% corpul
bacteriei.
Fig. 17-11: Clostridium tetani.
Frotiu din cultura de 96 ore n mediul
VF. Colora&ia Gram (1000x): bacili
gram-pozitivi (la limit%) cu dimensiuni
de 1,5 micrometri/2 micrometri, sporu-
la&i, cu sporul sferic situat terminal.
Fig. 17-12: Clostridium perfringens.
Frotiu din cultura de 24 ore pe mediul
VF. Colora&ia Gram (1000x). Bacili gram
pozitivi mari (5 micrometri/1 microme-
tru), drep&i, cu capete rotunjite #i care
nu sporuleaz% pe mediile #i n condi&iile
uzuale de laborator.
Fig. 17-13: Clostridium tetani - cultura de 72 ore
pe agar cu 5% snge de berbec (x3): colonii rizoide,
turtite, cenu#iu-transparente, margini neregulate cu
tendin&% invaziv%.
Fig. 17-14: Clostridium perfringens. Cultura de 48 ore pe agar cu 5% snge de
berbec (1/1). Observ%m colonii rotunde cu margini regulate, nconjurate de o zon%
intern% de hemoliz% complet% datorat% *-toxinei #i o zon% extern% mai larg% de
hemoliz% incomplet% datorat% (-toxinei.
Fig. 17-15: Coloan% de geloz% moale n tuburi
Weinberg cu eviden&ierea unei clostridii mobile ce
formeaz% colonii cu aspect pufos #i a unei clostridii
imobile (Clostridium perfringens) ce formeaz%
colonii lenticulare (urm%ri&i s%ge&ile).
Fi g. 17-16: Cl ostri di um
perfri ngens - testul de
neutralizare a (-toxinei.
Utiliz%m agar nutritiv cu 5%
g%lbenu# de ou. Linia albastr%
divide placa n 2 sectoare: n
jum%tatea dreapt% epuiz%m
antitoxina Clostridium perfrin-
gens. Depunem n 2 striuri
martorul pozitiv #i tulpina de
testat. Observ%m c% n jum%-
tatea dreapt% pentru ambele
tulpini, (-toxina a fost neutra-
lizat%.
Fig. 18-1: Actinomicoz$: "granule de sulf" prezente n lichidul pleural
ntr-un caz de actinomicoz% pulmonar%". Puroi fluid cu grunji galbeni
de 0,2/1mm, ce reprezint% colonii ale actinomicetului infectant.
Fig. 18-2: Actynomices. Frotiu din cultura n anaerobioz% a unor
"granule de sulf". Colora&ie Gram (x1000). Observ%m bacilii gram-
pozitivi ramifica&i ce se fragmenteaz% n forme cocoide #i bacilare.
Fig. 18-3: Cultur% de 5 zile pe mediul Wilkins-Chalgren cu 5%
snge de berbec (4x): Prevotella intermedia colonia neagr%,
Bacteroides ureolyticus cooloniile g%lbui, Fusobacterium
nucleatum coloniile alb-cenu#ii opalescente.
Fig. 18-4: Asocia&ia fuso-spirochetozic%.
Angina Vincent. Colora&ia Gram (1000x):
numero#i baciligram-negativi fusiformi
(Fusobacterium), spirochete (Treponema
vincenti) #i polinucleare.
Mycobacterium tuberculosis
Fig. 19-1: Mycobacterium tuberculosis - frotiu din prob% de sput% concentrat% #i
decontaminat%. Colora&ia Ziehl-Neelsen (1000x): bacili fini (0,2 - 0,6/1 10
micrometri), drep&i sau u#or ncurba&i, cu aspect de litere unghiulare, colora&i n
ro#u. Celulele inflamatorii #i bacteriile neacido-rezistente sunt colorate n
albastru.
Mycobacterium tuberculosis
Fig. 19-2: Frotiu din cultura de Mycobacterium tuberculosis n mediul lichid
(Middlebrooke). Colora&ia Ziehl-Neelsen (1000x): observ%m dispozi&ia bacilului
acido-rezistent n corzi flexuoase datorat% cordfactorului.
Mycobacterium tuberculosis
Fig. 19-3: Mycobacterium tuberculosis, cultur% de 4 s%pt%mni pe mediul
L)westein-Jensen: cre#tere eugonic%, colonii rugoase uscate, conopidiforme,
de culoare bej.
Micobacterii atipice
Fig. 19-4: Micobacterii fotocromogene,
de la stnga la dreapta:
M. marinum;
M. kansasii;
M. simiae.
Cultura de 3 s%pt%mni pe mediul
L)westei n-Jensen: colonii g%lbui ,
rotunde, "S", cu tendin&% la cre#tere
rugoas% (centru).
Micobacterii atipice
Fig. 19-5: Micobacterii scotocromogene (M.
gordonae, M. flavescens).
Cultura de 14 zile pe mediul L)westein-
Jensen: colonii galben-portocalii, "S", cu
aspect untos n eprubeta stng% (M.
gordonae).
Micobacterii atipice
Fig. 19-6: Micobaterii cu cre#tere rapid%,
cultur% pe mediul L)westein-Jensen.
Primele colonii observate dup% 6 zile.
Fotografiile culturilor n vrst% de 8 zile:
Mycobacterium chelonae (stnga)
colonii "R" g%lbui, cre#tere luxuriant% n
subcultur%;
Mycobacterium fortuitum (dreapta)
colonii "S" g%lbui #i cre#tere eugonic% n
subcultur%.
Mycobacterium leprae
Fig. 19-7: n partea stng% desen: Mycobacterium leprae, bacil acido-rezistent
dispus n aglomer%ri compacte de bacili alinia&i paralel #i cap la cap, numite
"globi".
n dreapta: frotiu din raclatul unei leziuni ulcerate de lepr% lepromatoas%;
colora&ia Ziehl-Neelsen modificat% (1000x): bacili acido-rezisten&i intra #i extra
celulari dispu#i n "globi lepro#i".
Mycobacterium leprae
Fig. 19-8: Lepra tuberculoid%:
stnga: macul% la nivelul obrazului stng;
dreapta: zone depigmentate la nivelul toracelui.
n aceste zone, s%race n bacili, neulcerate #i pu&in contagioase, sunt prezente
tulbur%ri de tip nevritic (anestezii).
Mycobacterium leprae
Fig. 19-9: Lepra lepromatoas%:
leziuni granulomatoase distructive
ce invadeaz% tegumentul.
Fig. 19-9bis: Lepra lepromatoas%: facies
leonin.
Fig. 20-1: Treponema pallidum. Examen microscopic pe fond negru din
exsudatul unui #ancru sifilitic (x1000). Sunt prezente n cmp #ase
treponeme delicate, hematii #i n partea dreapta jos un leucocit.
Treponema pallidum
Fig. 20-2: $ancru sifilitic al penisului: ulcera&ie delimitat% net, cu
suprafa&a lucioas% #i baza indurat% (#ancru tare).
ancru siflitic
Fig. 20-3: Leziuni eruptive ale sifilisului secundar.
Siflis secundar
Fif. 20-4: Sifilis ter#iar: gome sifilitice.
Fig. 20-5: Pian: #ancru de inoculare.
Fig. 20-6: Borrelia recurrentis pe frotiu din
snge n cursul unui puseu febril la un
pacient cu febr% recurent%. Printre
hematii, al%turi de un limfocit, observ%m 3
spirochete groase (diametrul 0,2-0,5
micrometri #i 8-30 micrometri lungime) cu
3-10 spire laxe. Celelalte specii ale genului
prezint% aceea#i morfologie.
Fig. 20-7: Leptospira icterrohae-
morrhagiae: examenul microscopic
pe fond negru al preparatului
efectuat din mediul Stuart eviden-
&iaz% o spirochet% fin% cu diametrul
de 0,1microni #i lungimea 15
microni, cu spire regulate, strnse #i
capete n crlig.
Fig. 21-1: Mycoplasma pneumoniae.
Electronomicrografie: mucoasa bron-
#ic% #i corpi de forma unei rachete de
tenis ce au por&iunea terminal%
asem%n%toare unei trompe, care
reprezint% un bacil eloctronodens. O
micoplasm% ce ader% la suprafa&a
mucoasei.
Fig. 21-1bis: Mycoplasma pneumoniae,
proteina P1 #i func&ia de adezin%.
Electronomicrofotografie:
Mycoplasma pneumoniae ader% la
suprafa&a unei celule epiteliale
(136.000x).
Mycoplasma pneumoniae
Fig. 28-1: Aspectul erup&iei n
rujeol%. Observa&i erup&ia maculo-
papular% generalizat% #i aspectul
faciesului plng%re&.
Rujeol
Fig. 32-1: Herpes labial n stadiul
eruptiv veziculos: vezicule situate
peribucal pe o zon% de eritem
cutanat, unel e agl omerate n
buchet.
Herpes labial
Fig. 32-2: Herpes genital. Observa&i la
veziculele situate pe prepu&, pe un pat
eritematos.
Herpes genital
Fig. 32-3: Aspectul erup&iei n
varicel%. Copil n a 3-a zi de la
debut , aspect polimorf, cu ele-
mentele eruptive n diferite stadii
evol uti ve: papul e, vezi cul e
(pic%turi de rou%), cruste.
Varicela
Fig. 32-4: Herpes zoster; erup&ia vezicular% pe
fond eritematos corespunde unui dermatom.
n imagine dermatomul unui nerv spinal.
Herpes zoster
Variol
Fig. 33-1: Aspectul erup&iei n variol%.
Observa&i dispozi&ia centrifug% a ele-
mentelor eruptive aflate n stadiul de
pustul%. n cavitatea bucal%, la nivelul
bol&ii palatine observ%m 3 pustule.
Fig. 40-1: Hemocultur$ n mediu difazic.
Urm%ri&i panta agarizat% la nivelul c%reia sunt
prezente numeroase colonii #i liza hematiilor n
mediu lichid, semn al multiplic%rii bacteriene.
You might also like
- Microbiologie Medicala ImaginiDocument99 pagesMicrobiologie Medicala ImaginiCarmeliaNo ratings yet
- Familia NeisseriaceaeDocument7 pagesFamilia Neisseriaceae22194No ratings yet
- Imuno CorecteDocument19 pagesImuno CorecteToca DianaNo ratings yet
- Imunologie, Anul II, Sem II, 2010-2011.unlockedDocument307 pagesImunologie, Anul II, Sem II, 2010-2011.unlockedDeea Kissu100% (4)
- Test Evaluare Microbiologie 1 Sem 2015Document1 pageTest Evaluare Microbiologie 1 Sem 2015Maria GrecuNo ratings yet
- Boli InfectioaseDocument11 pagesBoli InfectioaseVeronika NikaNo ratings yet
- BacteriofagulDocument13 pagesBacteriofagulAlice LisztNo ratings yet
- Reactiile Serologice-1532Document77 pagesReactiile Serologice-1532Maximciuc CorneliuNo ratings yet
- Morfopatologie 2Document29 pagesMorfopatologie 2Mirww MiruNo ratings yet
- Documents - Tips Curs 7a Testarea Sensibilitatii La Antibiotice Si ChimioterapiceDocument9 pagesDocuments - Tips Curs 7a Testarea Sensibilitatii La Antibiotice Si ChimioterapiceTecu RalucaNo ratings yet
- Anticorpi MonoclonaliDocument22 pagesAnticorpi Monoclonalibvl78No ratings yet
- Microbiologie T1 3Document548 pagesMicrobiologie T1 3Victor DobrovolschiNo ratings yet
- Caiet IDocument33 pagesCaiet ILiliana MorariNo ratings yet
- Morfopatologie TesteDocument28 pagesMorfopatologie TesteDaniela BotnaruNo ratings yet
- Reactii Ag AcDocument12 pagesReactii Ag Acunicorn_XNo ratings yet
- Anemia Din Bolile CroniceDocument1 pageAnemia Din Bolile CroniceciobdanaNo ratings yet
- 15.diagnosticul de Laborator Al Infectiilor StafilocociceDocument7 pages15.diagnosticul de Laborator Al Infectiilor StafilococicedutulescumNo ratings yet
- ElisaDocument24 pagesElisaMadalin George DanilaNo ratings yet
- TEMATICA Pentru Examenul de Medic Specialist Specialitatea MEDICINA de LABORATORDocument6 pagesTEMATICA Pentru Examenul de Medic Specialist Specialitatea MEDICINA de LABORATORcami_4No ratings yet
- MorfopatologieDocument9 pagesMorfopatologieIrina VizureanuNo ratings yet
- Prezentare Elisa PCRDocument17 pagesPrezentare Elisa PCRZamfir Bianca100% (1)
- Aero Micro FloraDocument10 pagesAero Micro FloraIosif MirtNo ratings yet
- Supravegherea Epidemiologica Varianta 2Document91 pagesSupravegherea Epidemiologica Varianta 2Elena Madalina HozoiNo ratings yet
- Igiena GrileDocument135 pagesIgiena GrileVlad PopaNo ratings yet
- InfectiileDocument13 pagesInfectiileAdriana EllenaNo ratings yet
- Subiecte Parazitologie Examen +colocviuDocument5 pagesSubiecte Parazitologie Examen +colocviuCodrut EliasNo ratings yet
- 2016 - Taus - Teste de Toxicologie ClinicaDocument229 pages2016 - Taus - Teste de Toxicologie ClinicaAnonymous IOrWuyVQS1No ratings yet
- Familia TogaviridaeDocument3 pagesFamilia TogaviridaeAriela SăvuţNo ratings yet
- Examen MicrobiologieDocument146 pagesExamen MicrobiologieДарьяNo ratings yet
- Tot 3Document37 pagesTot 3vartic8ianaNo ratings yet
- Imunologie SubiecteDocument34 pagesImunologie SubiecteBalu Deak67% (3)
- Curs 2-Etiopatogenia Bolilor InfectioaseDocument37 pagesCurs 2-Etiopatogenia Bolilor InfectioaseGhiorghita Oana-AdinaNo ratings yet
- Familia AdenoviridaeDocument3 pagesFamilia AdenoviridaeAriela SăvuţNo ratings yet
- Seruri, Imunoglobuline, VaccinuriDocument97 pagesSeruri, Imunoglobuline, VaccinuriAndreea-Alexandra LupuNo ratings yet
- Ex Abs Microb SPDocument47 pagesEx Abs Microb SPAlex MdaNo ratings yet
- Caz Clinic MicrobiologieDocument4 pagesCaz Clinic MicrobiologieTheodor MoldoveanuNo ratings yet
- MicrobDocument18 pagesMicrobSolonaru LarisaNo ratings yet
- IMUNOTERAPIADocument4 pagesIMUNOTERAPIACezara OprescuNo ratings yet
- Fiziologie BacterianaDocument18 pagesFiziologie BacterianaDaniela VaduvaNo ratings yet
- Subiecte Rezolvate Imunologie (Sem1) DAVILADocument38 pagesSubiecte Rezolvate Imunologie (Sem1) DAVILARazvan DerihaciNo ratings yet
- Curs 6 Mitache STAFILOCOCDocument29 pagesCurs 6 Mitache STAFILOCOCdaniela_piNo ratings yet
- 04 Medii CC CbioDocument13 pages04 Medii CC CbioPintilie NicoletaNo ratings yet
- Apss SubDocument19 pagesApss SubAlice AugustinNo ratings yet
- Microbiologie Medicala ImaginiDocument99 pagesMicrobiologie Medicala ImaginiConstantin Pricop100% (1)
- Microbiologie-Medicala-Imagini Buiuc PDFDocument99 pagesMicrobiologie-Medicala-Imagini Buiuc PDFDikruger DiNo ratings yet
- Entero 1 2015Document56 pagesEntero 1 2015Alexandru AdrianNo ratings yet
- archivetempLP - 3 - Microscopie (Bact + Parazit) 2018Document4 pagesarchivetempLP - 3 - Microscopie (Bact + Parazit) 2018Abigail BurgheleaNo ratings yet
- Metode Utilizate in MicrobiologieDocument7 pagesMetode Utilizate in MicrobiologieAndreea Nicoleta HocaNo ratings yet
- LP 3 - Examenul Microscopic - 2022-2023Document3 pagesLP 3 - Examenul Microscopic - 2022-2023Silvia UngureanuNo ratings yet
- LPMD 6Document3 pagesLPMD 6Saad AlfathNo ratings yet
- L 3. Examenul Microscopic in Diagnosticul Bacteriologic - Coloratii Utilizate in BacteriologieDocument6 pagesL 3. Examenul Microscopic in Diagnosticul Bacteriologic - Coloratii Utilizate in BacteriologieSuruianu FlorinaNo ratings yet
- 3 Preparate MicroscopiceDocument15 pages3 Preparate MicroscopiceIonut ChicinasNo ratings yet
- Informatii-Culturi in VitroDocument18 pagesInformatii-Culturi in Vitroanastasya357No ratings yet
- Bacteriologie!!!Document12 pagesBacteriologie!!!LiliLili100% (1)
- Frotiu - Examenul MicroscopicDocument23 pagesFrotiu - Examenul MicroscopicIliescu Malina DianaNo ratings yet
- LP Bactemed III 9-14Document21 pagesLP Bactemed III 9-14Ramona MükNo ratings yet
- Examenul Microbiologic Al SputeiDocument5 pagesExamenul Microbiologic Al SputeiNASTASE IOANANo ratings yet
- Lp3 MicrobiologieDocument5 pagesLp3 MicrobiologieAna GhitunNo ratings yet
- Metodele Microbiologice de DiagnosticDocument62 pagesMetodele Microbiologice de DiagnosticDan Septelici100% (1)
- Subiecte Rezolvate Midscrobiologie LPDocument14 pagesSubiecte Rezolvate Midscrobiologie LPTudor AlinNo ratings yet
- Carte Preventie Barlean Alb NegruDocument161 pagesCarte Preventie Barlean Alb NegruAndra AgheorghieseiNo ratings yet
- Carte Final Monica Scutariu PDFDocument274 pagesCarte Final Monica Scutariu PDFMiruna Banu67% (3)
- AdeziuneDocument138 pagesAdeziuneAndrei FetcoNo ratings yet
- Curs 01 Tesutul Epitelial IDocument19 pagesCurs 01 Tesutul Epitelial IAdrian Cosmin RebosapcaNo ratings yet
- Intrebarea 27Document8 pagesIntrebarea 27Adrian Cosmin RebosapcaNo ratings yet
- 23.7 F O NeurologieDocument15 pages23.7 F O NeurologieMihaela AndreiNo ratings yet
- Carte Final IordacheDocument286 pagesCarte Final IordacheAdrian Cosmin RebosapcaNo ratings yet
- Curs 1-2 2015-2016Document79 pagesCurs 1-2 2015-2016Adrian Cosmin RebosapcaNo ratings yet
- Curs 5 Somitele Si Saptamana 4Document4 pagesCurs 5 Somitele Si Saptamana 4Adrian Cosmin RebosapcaNo ratings yet
- Curs 2 Ovogeneza PDFDocument2 pagesCurs 2 Ovogeneza PDFAdrian Cosmin RebosapcaNo ratings yet
- PASTORALA Subiecte Licenta 2015Document3 pagesPASTORALA Subiecte Licenta 2015Adrian Cosmin RebosapcaNo ratings yet
- Curs 1 Sistem DigestivDocument9 pagesCurs 1 Sistem DigestivIonuţ FocşăneanuNo ratings yet
- Vasile Cel Mare - Cuvant Catre TineriDocument68 pagesVasile Cel Mare - Cuvant Catre TineriCasiana Velimirovici100% (1)
- Cursmaster - An IDocument172 pagesCursmaster - An IthemarianestNo ratings yet
- Vocaţia Şi Responsabilitatea Slujirii Preoţeşti În Epoca ModernăDocument236 pagesVocaţia Şi Responsabilitatea Slujirii Preoţeşti În Epoca ModernăIonascu Petre100% (5)
- Misiologie Si Ecumenism - An 3 Past., Sem. 1Document2 pagesMisiologie Si Ecumenism - An 3 Past., Sem. 1Adrian Cosmin RebosapcaNo ratings yet
- 2012iansf. Grigorie de NazianzDocument18 pages2012iansf. Grigorie de NazianzNica IonutNo ratings yet
- Texte Pentru Cursul 7Document8 pagesTexte Pentru Cursul 7Adrian Cosmin RebosapcaNo ratings yet
- Catavasiile Nasterii DomnuluiDocument5 pagesCatavasiile Nasterii Domnuluipr_irinel5205100% (1)
- Vasile Cel Mare - Cuvant Catre TineriDocument68 pagesVasile Cel Mare - Cuvant Catre TineriCasiana Velimirovici100% (1)
- Despre Preotie - SF - Ioan Gura de AurDocument156 pagesDespre Preotie - SF - Ioan Gura de AurAndrei A.100% (6)
- Elemente de Public SpeakingDocument7 pagesElemente de Public SpeakingPînzari EmanuelNo ratings yet
- Curs Teologie Ortodoxa Pastorala Iasi 1Document53 pagesCurs Teologie Ortodoxa Pastorala Iasi 1Dimitriu Sirghie Daniel100% (1)
- Misiologie Si Ecumenism - An 3 Past., Sem. 1Document2 pagesMisiologie Si Ecumenism - An 3 Past., Sem. 1Adrian Cosmin RebosapcaNo ratings yet
- Despre Isihasm AstaziDocument11 pagesDespre Isihasm AstaziAdrian Cosmin RebosapcaNo ratings yet
- Arta SacraDocument3 pagesArta SacraAdrian Cosmin RebosapcaNo ratings yet
- Catavasiile Nasterii DomnuluiDocument5 pagesCatavasiile Nasterii Domnuluipr_irinel5205100% (1)
- Arta SacraDocument3 pagesArta SacraAdrian Cosmin RebosapcaNo ratings yet