Professional Documents
Culture Documents
Hibridación de Orbitales Atómicos en El Carbono
Uploaded by
Cristian RmzCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Hibridación de Orbitales Atómicos en El Carbono
Uploaded by
Cristian RmzCopyright:
Available Formats
Hibridacin de orbitales atmicos en el carbono
sp
3
(Cuatro regiones de densidad electrnica alrededor del C)
Un carbono unido a cuatro tomos siempre tendr hibridacin sp
3
y una estructura
tetradrica. As son los alcanos, haluros de alquilo, alcoholes, teres y aminas, entre otros.
Todos estos compuestos tienen estabilidad suficiente (1) como para poder ser almacenados
sin problemas especiales.
Un carbono unido a menos de cuatro tomos tambin puede tener hibridacin sp
3
pero la
estructura variar dependiendo del nmero de sustituyentes:
Estructura
Tipo de compuesto Carbaniones Carbenos
Geometra Piramidal Angular
Los carbaniones y carbenos son especies altamente reactivas (intermedios de reaccin)
y en general tienen un tiempo de vida muy corto.
sp
2
(Tres regiones de densidad electrnica alrededor del C)
Un carbono unido a tres tomos, que mantiene un doble enlace con uno de ellos,
siempre tendr hibridacin sp
2
y una geometra trigonal plana. As son compuestos estables
(1) tales como olefinas, hidrocarburos aromticos, aldehdos, cetonas y cidos carboxlcos y
derivados, entre otros.
Existen otras situaciones donde un tomo de carbono unido a tres tomos tambin posee
hibridacin sp
2
:
Estructura
Tipo de compuesto
Carbocatin
(ion carbenio)
Radical
Geometra Trigonal plana Trigonal plana
Carbocationes y radicales son especies altamente reactivas (intermedios de reaccin) y
en general tienen un tiempo de vida muy corto.
sp
(Dos regiones de densidad electrnica alrededor del C)
Un carbono unido a dos tomos, que mantiene un triple enlace con uno de ellos,
siempre tendr una hibridacin sp y una estructura lineal.
Existen otras posibilidades:
Estructura
Tipo de compuesto Aleno Acetiluro
Geometra Lineal Lineal
Los alenos son compuestos estables(1). Los acetiluros son especies reactivas
(intermedios de reaccin).
Electronegatividad del carbono en funcin de su hibridacin
El carbono tiene mayor electronegatividad a medida que aumenta el carcter s de
la hibridacin. Por tanto los carbonos del etano (sp
3
) son menos electronegativos
que los del eteno (sp
2
) y stos a su vez menos electronegativos que los del etino
(sp). El clculo de las densidades electrnicas en estos tres compuestos refleja
claramente este hecho:
(azul +, rojo -)
Etano Eteno Etino
Los hidrgenos tienen una coloracin azul ms acusada desde el etano al etino,
prueba de su menor densidad electrnica como consecuencia de la
electronegatividad creciente del carbono.
Hibridacin de orbitales atmicos en nitrgeno y oxgeno
sp
3
Nitrgeno
Oxgeno
Estructura
Tipo Aminas Sales de amonio
Alcoholes
teres
Alcxidos
Geometra Piramidal Tetradrica Angular -
Las aminas, sales de amonio, alcoholes y teres son especies estables(1). Los
alcxidos son especies muy reactivas (intermedios de reaccin).
sp
2
Nitrgeno
Oxgeno
Estructura
Tipo Iminas Sales de imonio Carbonilos
Geometra Trigonal plana Trigonal plana Trigonal plana
Los tres tipos de compuestos tienen en general estabilidad suficiente como
para poder almacenarse sin problemas especiales(1). Los compuestos con grupos
carbonilo son muy variados: pueden ser aldehdos, cetonas, cidos carboxlicos,
haluros de cido, anhdridos, steres y amidas, entre otros.
sp
Nitrgeno
Estructura
Tipo Nitrilos
Geometra Lineal
Los nitrilos son compuestos estables(1).
Parmetros de enlace
Enlace
Longitud
tpica (A)
Momento
dipolar (D)
Energa de
disociacin
(kcal/mol)
C-H 1.07 0.40 99
X-H
1.01(N)
0.96(O)
1.31(N)
1.51(O)
93(N)
111(O)
C-C 1.54 0 83
C=C 1.33 0 146
CC
1.20 0 200
C-N 1.47 0.22 73
C=N 1.30 1.90 147
CN
1.16 3.50 213
C-O 1.43 0.74 86
C=O 1.23 2.30 184
C-Cl 1.78 1.46 81
C-Br 1.93 1.38 68
C-I 2.14 1.19 51
Consideraciones generales
La fortaleza de los enlaces C-C es muy elevada. El diamante es una red
tetradrica de carbono (sp
3
) y es el mineral ms duro que se conoce. El
grafito es una red bidimensional de carbono (sp
2
) y su poder lubricante
para mquinas es excepcional debido a la fortaleza de las capas de
carbonos que pueden resbalar unas sobre otras.
El carbono da enlaces muy fuertes con otros elementos, tanto
electronegativos como electropositivos (H, halgenos, O, N, P, S,
B, Li, etc.). La variedad de hidruros de carbono (hidrocarburos)
es enorme y todos ellos son muy estables al aire y agua, a diferencia
de lo que ocurre con el resto de los elementos del sistema peridico
(SP).
La posicin del carbono en el SP es nica: pequeo tamao y cuatro
electrones de valencia. Hace que sus posibilidades de perder los
electrones o de ganar otros cuatro, para conseguir la configuracin
de gas noble, sean remotas y que, por tanto, compartaelectrones
para formar enlaces. De esta manera la repulsin entre los
electrones compartidos se compensa con la atraccin que los
ncleos unidos al carbono ejercen sobre ellos.
La qumica de los compuestos de carbono es principalmente la
qumica del enlace covalente. Las diferencias en propiedades fsicas
y qumicas entre los compuestos orgnicos vendrn dadas por la
naturaleza y disposicin de los otros elementos unidos al carbono.
Estos pueden agruparse en grupos funcionales.
http://www.uam.es/departamentos/ciencias/qorg/docencia_red/qo/l1/const.html
HIBRIDACIN DE NITRGENO Y DE OXGENO
Al igual que el tomo de carbono, el N tambin puede formar orbitales hbridos. El N posee tres
enlaces en las molculas orgnicas y un par de electrones no enlazantes. La forma de hibridar es
idntica a la del C con la nica diferencia que uno de los orbitales hbridos contiene un par de
electrones no enlazantes, mientras que los otros forman los enlaces. El nitrgeno puede formar
hbridos sp3 en las aminas, sp2 en la iminas y sp en los nitrilos.
HIBRIDACIN DEL NITRGENO
En el caso del amoniaco, el N forma tres enlaces del tipo Nsp3H1s y el par de electrones no
enlazantes se encuentra en un orbital hbrido sp3. El ngulo de enlace es un poco menor (107)
que el del metano debido a la mayor repulsin del orbital sp3con los dos electrones no enlazantes
y los enlaces simples N-H. La geometra del amoniaco en este caso no es tetradrica sino que
piramidal (pirmide de base trigonal). Por su parte, el tomo de oxgeno tambin tiene la
capacidad de hibridar sus orbitales. Sin embargo, slo puede formar orbitales hbridos sp3 en los
alcoholes y el agua y sp2 en los compuestos carbonlicos. Los dos pares de electrones
no enlazantes del oxgeno se ubican en los dos hbridos mientras que con los otros forma los
enlaces sigma ().
HIBRIDACIN DEL OXGENO
En el caso del agua, el oxgeno forma dos enlaces del tipo sp3 1s, mientras que los dos pares
de electrones no enlazantes estn en los dos hbridos sp3 restantes. El ngulo de enlace en el agua
es menor (105) que en el caso del amoniaco y del metano debido a las mayores repulsiones de
los dos pares de electrones no enlazantes con los enlaces simples O-H. La geometra de la
molcula del agua es angular y no tetradrica.
Hibridacin de orbitales atmicos en nitrgeno y oxgeno
1. sp3
sp3
Nitrgeno
Oxgeno
Estructura
Tipo Aminas Sales de amonio Alcoholes Alcxidos
teres
Geometra Piramidal Tetradrica Angular -
Las aminas, sales de amonio, alcoholes y teres son especies estables(1). Los
alcxidos son especies muy reactivas (intermedios de reaccin).
2. sp2
sp2
Nitrgeno
Oxgeno
Estructura
Tipo Iminas Sales de imonio Carbonilos
Geometra Trigonal plana Trigonal plana Trigonal plana
Los tres tipos de compuestos tienen en general estabilidad suficiente como para
poder almacenarse sin problemas especiales(1). Los compuestos con grupos
carbonilo son muy variados: pueden ser aldehdos, cetonas, cidos carboxlicos,
haluros de cido, anhdridos, steres y amidas, entre otros.
3. sp
sp
Nitrgeno
Estructura
Tipo Nitrilos
Geometra Lineal
Los nitrilos son compuestos estables(1)
http://orbequimica.tripod.com/quimica/hibridacion.html
You might also like
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaFrom EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaRating: 5 out of 5 stars5/5 (1)
- Estructura de Los Compuestos OrgánicosDocument14 pagesEstructura de Los Compuestos OrgánicosSusana Herrera Németh80% (15)
- 1 Métodos de Exploración Directos e IndirectosDocument3 pages1 Métodos de Exploración Directos e IndirectosAmalia RebecaNo ratings yet
- S1 - El Atomo de CarbonoDocument30 pagesS1 - El Atomo de CarbonoGamerS14 XDNo ratings yet
- Una Planta Requiere Que 15 KGDocument13 pagesUna Planta Requiere Que 15 KGlola50% (2)
- Andrea Palladio, arquitecto clave del RenacimientoDocument5 pagesAndrea Palladio, arquitecto clave del RenacimientoDarianna Jimenez100% (1)
- MC - Muro Contencion-InclinadoDocument24 pagesMC - Muro Contencion-InclinadowillyNo ratings yet
- Unidad Dental QL2028, Dental Unit, Fengdan, CATALOGO PDFDocument7 pagesUnidad Dental QL2028, Dental Unit, Fengdan, CATALOGO PDFAnibal PeñaNo ratings yet
- Lista de Chequeo para Vehiculos de CargaDocument2 pagesLista de Chequeo para Vehiculos de CargaMaryorieNo ratings yet
- III. Química OrgánicaDocument208 pagesIII. Química OrgánicaPaulina Diaz JimenezNo ratings yet
- Psicología de Lo MasculinoDocument158 pagesPsicología de Lo MasculinoMaría Soyla solano ramosNo ratings yet
- Geometria de Los Compuestos OrganicosDocument11 pagesGeometria de Los Compuestos OrganicosDanny Paredes LayzaNo ratings yet
- Grafito CarbonoDocument14 pagesGrafito CarbonoUchiha JuanNo ratings yet
- Modelos MolecularesDocument11 pagesModelos MolecularesVictor AnDre'z CastilloNo ratings yet
- Átomo de CarbonoDocument5 pagesÁtomo de CarbonoNancy BerdugoNo ratings yet
- Hibridacion Del Nitrógeno y Oxígeno en Los Compuestos OrganicosDocument3 pagesHibridacion Del Nitrógeno y Oxígeno en Los Compuestos OrganicosMariana Guerrero50% (2)
- Atomo Del CarbonoDocument13 pagesAtomo Del CarbonoRoger D. PérezNo ratings yet
- Guia#1 La Quimica Del CarbonoDocument6 pagesGuia#1 La Quimica Del CarbonoProf Marotta100% (2)
- Introducción a la nomenclatura y isomería orgánicaDocument32 pagesIntroducción a la nomenclatura y isomería orgánicaAgustín IslaNo ratings yet
- UNIVERSIDAD PRIVADA ANTENOR ORREGODocument13 pagesUNIVERSIDAD PRIVADA ANTENOR ORREGOHUGO EDUARDO PEÑA LABANNo ratings yet
- Clase No. 2 (13-07-23)Document13 pagesClase No. 2 (13-07-23)Edwin VasquezNo ratings yet
- Taller de Quìmica OrgànicaDocument32 pagesTaller de Quìmica OrgànicaCARLOS ALBERTO CAICEDO MOREIRANo ratings yet
- Química OrganicaDocument23 pagesQuímica OrganicaRonaldo MonterrozaNo ratings yet
- El átomo de carbono y sus tiposDocument8 pagesEl átomo de carbono y sus tiposDianne BrigitteNo ratings yet
- Química Orgánica: Reconocimiento General del CursoDocument16 pagesQuímica Orgánica: Reconocimiento General del CursoAngelo Sivaris López HerreraNo ratings yet
- Resumen Capítulo 17Document4 pagesResumen Capítulo 17Kristel Alfaro MadrigalNo ratings yet
- Química de Los Compuestos OrgánicosDocument7 pagesQuímica de Los Compuestos OrgánicosHola Como estasNo ratings yet
- Carbono: Estructura, Enlaces y PropiedadesDocument2 pagesCarbono: Estructura, Enlaces y PropiedadesEliseo HuamanNo ratings yet
- Propidades Fisicoquimicas Bases NitrogenadasDocument3 pagesPropidades Fisicoquimicas Bases NitrogenadasCarlos Paul González MéndezNo ratings yet
- Átomo de Carbono Definición, Hibridaciones y CaracterísticasDocument1 pageÁtomo de Carbono Definición, Hibridaciones y CaracterísticasOSCAR DE JESUS SANCHEZ SALAZARNo ratings yet
- El Atomo de CarbonoDocument27 pagesEl Atomo de CarbonoLehandro Vega Rojas50% (2)
- Carbono y sus propiedades químicasDocument21 pagesCarbono y sus propiedades químicasfelipe jaraNo ratings yet
- GUIA QUIMICA ORGANICA 40CDocument10 pagesGUIA QUIMICA ORGANICA 40CCarlita DanielaNo ratings yet
- Alcanos Tema Ii.1Document75 pagesAlcanos Tema Ii.1Esteban CallejaNo ratings yet
- Medio AmbienteDocument5 pagesMedio Ambienteantonileon118No ratings yet
- Química OrgánicaDocument31 pagesQuímica Orgánicatatiana suarezNo ratings yet
- CARBONODocument8 pagesCARBONOSonia MBNo ratings yet
- UreaDocument8 pagesUreaCRESPONo ratings yet
- Geometría MolecularDocument53 pagesGeometría MolecularLee Sang MiNo ratings yet
- PD 3Document4 pagesPD 3Analy BcNo ratings yet
- Estructura y NomenclaturaDocument47 pagesEstructura y NomenclaturaJovanhy Aparicio0% (2)
- Hibridacion Del CarbonoDocument19 pagesHibridacion Del CarbonoDeysi Cabrera100% (1)
- Sem 01Document27 pagesSem 01Isaac Guevara TelloNo ratings yet
- Química orgánica: Propiedades del átomo de carbonoDocument47 pagesQuímica orgánica: Propiedades del átomo de carbonoFabian FloresNo ratings yet
- S1 - El Átomo de CarbonoDocument25 pagesS1 - El Átomo de Carbonojeyson100% (1)
- 7 Alquenos EstructuraDocument35 pages7 Alquenos EstructuraGisa FNNo ratings yet
- Unidad Iii Alquenos Nomenclatura PDFDocument28 pagesUnidad Iii Alquenos Nomenclatura PDFSivert GutsolNo ratings yet
- Ayudantía N°1 Química OrgánicaDocument9 pagesAyudantía N°1 Química OrgánicasorayiniNo ratings yet
- QUÍMICA 3° CURSO-PLAN COMÚN-Átomo Del CarbonoDocument10 pagesQUÍMICA 3° CURSO-PLAN COMÚN-Átomo Del CarbonopoazaqueNo ratings yet
- Apunte Grupo 14Document17 pagesApunte Grupo 14Mercedes Garcia CozziNo ratings yet
- Alcanos, Alquenos y AlquinosDocument24 pagesAlcanos, Alquenos y Alquinosluca_nfNo ratings yet
- Química Orgánica I Propiedades Del Carbono e HidrocarburosDocument22 pagesQuímica Orgánica I Propiedades Del Carbono e HidrocarburosJuan TobarNo ratings yet
- NÚCLEO TEMÁTICO EstructuraDocument17 pagesNÚCLEO TEMÁTICO EstructuraKarla Aimeé Benitez HernándezNo ratings yet
- Átomo de CarbonoDocument12 pagesÁtomo de CarbonoRaspadillaNo ratings yet
- Acidez y BasicidadDocument40 pagesAcidez y BasicidadrosaNo ratings yet
- Co ValenciaDocument4 pagesCo ValenciaJorge Cconocc FloresNo ratings yet
- Tema Semana 7. El CarbonoDocument10 pagesTema Semana 7. El CarbonoRichy Escobar PNo ratings yet
- 01.01-Adjunto-00-QCA ORG y BIOLOGICA ISFD9-002 Unidad 1Document9 pages01.01-Adjunto-00-QCA ORG y BIOLOGICA ISFD9-002 Unidad 1Nicole de la RosaNo ratings yet
- Guia de Quimica Organica 2º MedioDocument12 pagesGuia de Quimica Organica 2º MedioKatherine SanchezNo ratings yet
- Ingeniería de procesos siderúrgicos: La experiencia de AHMSAFrom EverandIngeniería de procesos siderúrgicos: La experiencia de AHMSANo ratings yet
- Explicacic3b3n Del Programa Del Mc3a9todo de Biseccic3b3nDocument12 pagesExplicacic3b3n Del Programa Del Mc3a9todo de Biseccic3b3nJuan RomeroNo ratings yet
- Dispositivos de flujo estacionarioDocument5 pagesDispositivos de flujo estacionarioCristian RmzNo ratings yet
- Ortografía WordDocument8 pagesOrtografía WordCristian RmzNo ratings yet
- Reglas Básicas para Escribir El CurrículumDocument11 pagesReglas Básicas para Escribir El CurrículumCristian RmzNo ratings yet
- SIGNOSDocument11 pagesSIGNOSyhooniNo ratings yet
- Tecnic Basicas Coliformes en Placa 6528Document6 pagesTecnic Basicas Coliformes en Placa 6528hamaradilupeuNo ratings yet
- Códigos plásticos botellas guía reciclaje 7 tipos identificaciónDocument2 pagesCódigos plásticos botellas guía reciclaje 7 tipos identificaciónCristian RmzNo ratings yet
- Leyes de MendelDocument5 pagesLeyes de MendelCristian RmzNo ratings yet
- Que Es Un DLLDocument7 pagesQue Es Un DLLCristian RmzNo ratings yet
- Abreviaturas de Comandos de Autocad en EspanolDocument8 pagesAbreviaturas de Comandos de Autocad en EspanolBenjamin Collantes Tenorio88% (17)
- Frutas, Verduras, CerealesDocument21 pagesFrutas, Verduras, CerealesCristian RmzNo ratings yet
- La Danza y El BaileDocument11 pagesLa Danza y El BaileCristian RmzNo ratings yet
- Combustión Del Alcohol EtílicoDocument14 pagesCombustión Del Alcohol EtílicoDanyta Jimenez VergaraNo ratings yet
- Informe Tecnico AmbevDocument159 pagesInforme Tecnico AmbevRobert BendezúNo ratings yet
- PresupuestoConstrucciónViviendaDocument18 pagesPresupuestoConstrucciónViviendaAldair PJNo ratings yet
- Tarea Extra Clase No. 1 - Normas de Ensayo AstmDocument89 pagesTarea Extra Clase No. 1 - Normas de Ensayo AstmThaily Arias MayNo ratings yet
- Problemas Planteados de Electricidad FÍSICA GENERALDocument35 pagesProblemas Planteados de Electricidad FÍSICA GENERALKelvinJhoniCarranzaHerreraNo ratings yet
- 00.03 SeparadoresDocument21 pages00.03 SeparadoresEsaú VerásteguiNo ratings yet
- 2022 Resueltos ParcialDocument24 pages2022 Resueltos ParcialSonia GautoNo ratings yet
- Triptico 3 Jose TigaciDocument2 pagesTriptico 3 Jose TigaciJose TigaciNo ratings yet
- Aparato MisteriosoDocument3 pagesAparato MisteriosoDionicio Abraham Ponce RomeroNo ratings yet
- Instantáneas estancas mixtas Themaclassic F 24 EDocument20 pagesInstantáneas estancas mixtas Themaclassic F 24 EManuel Fernandez MoraNo ratings yet
- Ejercicios TermodinamicaDocument5 pagesEjercicios TermodinamicaDavid NaviaNo ratings yet
- El Anfiteatro FlavioDocument20 pagesEl Anfiteatro FlavioMariluz Pilar Figueroa RoblesNo ratings yet
- Medición de Energía Eléctrica en Circuitos MonofásicosDocument32 pagesMedición de Energía Eléctrica en Circuitos MonofásicosPercy Melendez LarreatigueNo ratings yet
- Unidad Habitacional de Marsella: Los 5 principios de Le CorbusierDocument21 pagesUnidad Habitacional de Marsella: Los 5 principios de Le CorbusierFabiola Cariapaza0% (2)
- OGUCDocument147 pagesOGUCGuillermo RamirezNo ratings yet
- Interconexion Guatemala Mexico 400kVDocument34 pagesInterconexion Guatemala Mexico 400kVcastillejosNo ratings yet
- Requisitos calidad fragmentos roca mamposteríaDocument5 pagesRequisitos calidad fragmentos roca mamposteríaangelof10No ratings yet
- Presentacion de Cañeria Guia-LodosDocument24 pagesPresentacion de Cañeria Guia-LodosLucia MoyanoNo ratings yet
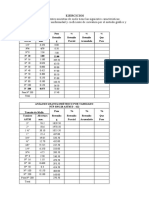
- Materia: Carreteras I EXAMEN 1er. PARCIAL (87,5%) : 1. - (25%) Además de La Información Dada en La Figura, Se ConoceDocument2 pagesMateria: Carreteras I EXAMEN 1er. PARCIAL (87,5%) : 1. - (25%) Además de La Información Dada en La Figura, Se ConoceTorres JhossephNo ratings yet
- 3528 File PRAC07-GEOGRAFIADocument2 pages3528 File PRAC07-GEOGRAFIAItsel AlfaroNo ratings yet
- Circuito Elemental UNAMDocument5 pagesCircuito Elemental UNAMAlejandro González RuvalcabaNo ratings yet
- EJERCICIOS de GRANULOMETRIADocument4 pagesEJERCICIOS de GRANULOMETRIAevelin espinoza mamaniNo ratings yet
- Tipos de ApartarrayosDocument5 pagesTipos de ApartarrayosKikiaraujoNo ratings yet
- Flujo Gradualmente VariadoDocument35 pagesFlujo Gradualmente Variadotango juliNo ratings yet