Professional Documents
Culture Documents
Manual Practica Sobre La Utilización Del Google Earth
Uploaded by
Estrella Medina0 ratings0% found this document useful (0 votes)
29 views8 pagesOriginal Title
MANUAL PRACTICA SOBRE LA UTILIZACIÓN DEL GOOGLE EARTH (1)
Copyright
© © All Rights Reserved
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
29 views8 pagesManual Practica Sobre La Utilización Del Google Earth
Uploaded by
Estrella MedinaCopyright:
© All Rights Reserved
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 8
POTENCIAL DE OXIDACIN
Todos los elementos qumicos en funcin de su configuracin electrnica
pueden ceder electrones y quedar con carga positiva o ganar electrones y
cargarse negativamente. De esta norma se excluyen los gases nobles que
responden a una configuracin electrnica perfecta. Cuando un elemento
cede un electrn se dice que se oxida mientras que cuando lo gana se dice
que se reduce. Para que un elemento pueda oxidarse es necesario que exista
un aceptor de ese electrn, otro elemento que se reduce.
Los elementos que presentan gran facilidad para ceder electrones y oxidarse
se les conoce como reductores, cuyo patrn es el hidrgeno. Los elementos
proclives a ganar electrones y reducirse se les conoce como oxidantes, cuyo
prototipo es el oxgeno de donde se deriva el nombre del proceso.
El conjunto de un oxidante y un reductor es lo que se conoce como un
sistema redox. Entre ambos elementos existe una transferencia de
electrones que genera una corriente elctrica, marcada por una diferencia de
potencial entre ambos.
Cuando se ponen en contacto dos elementos en solucin, con
presencia de su forma elemental y la forma ionizada correspondiente,
siempre hay uno que se oxida y otro que se reduce, lo que se
manifiesta por el incremento en una de sus formas. El elemento que
se reduce es el que posee una capacidad oxidante mayor. La
capacidad oxidante es lo que se conoce como potencial de oxidacin
(Eh), que cuanto ms alto es, mayor es la capacidad oxidante del
sistema y mayor es la concentracin de la forma reducida.
El potencial de oxidacin se mide en voltios, aunque como su valor
es muy pequeo se expresa usualmente en milivoltios (mV).
Potencial de oxidacin - reduccin
Las condiciones de oxidacin-reduccin del suelo son de gran
importancia para procesos de meteorizacin, formacin de
diversos suelos y procesos biolgicos, tambin estn relacionadas
con la disponibilidad de ciertos elementos nutritivos.
La formulacin qumica de las reacciones de oxidacin-reduccin
es la siguiente:
ESTADO OXIDADO + ELECTRONES <=> ESTADO REDUCIDO
En el suelo existe un equilibrio entre los agentes oxidantes y
reductores. La materia orgnica se encuentra reducida y tiende a
oxidarse, es reductora, ya que al oxidarse tiene que reducir a otro
de los materiales del suelo. Por el contrario el oxgeno es
oxidante. Por otra parte hay muchos elementos qumicos que
funcionan con valencias variables, pudiendo oxidarse o reducirse
segn el ambiente que predomine.
Los procesos de oxidacin reduccin envuelven a elementos que
pueden actuar con diferentes valencias como ser: Fe, Mn, S, N.
Algunos ejemplos de procesos de de oxidacin en el suelo son:
Oxidacin: del Fe
+2
de minerales primarios en Fe
+3
formando
xidos e hidrxidos; la transformacin de Mn+2 en Mn
+4
; la
oxidacin de S
=
, por ejemplo de pirita, en sulfatos; la nitrificacin o
sea la transformacin de NH
4
en nitritos y nitratos.
Por el contrario muchos procesos suceden bajo condiciones
reductoras como la desnitrificacin, la desulfuricacin, la formacin
de compuestos Fe
+2
y Mn
+2
.
En los suelos normales el ambiente es aireado y por tanto la
tendencia general es oxidante. En los suelos hidromorfos la
saturacin en agua tiende a provocar un ambiente reductor .
Los valores de pH y potencial redox (medidas Eh) delimitan los
campos de estabilidad de los materiales del suelo. Los compuestos
de Fe y Mn son muy sensibles a cambios de pH y Eh.
http://edafologia.ugr.es/introeda/tema05/ph.htm
http://edafologia.ugr.es/introeda/tema05/ph.htm
You might also like
- La Libertad Octubre 2015Document23 pagesLa Libertad Octubre 2015Estrella MedinaNo ratings yet
- La Libertad Octubre 2015Document23 pagesLa Libertad Octubre 2015Estrella MedinaNo ratings yet
- 1ver DIA Tibillo - CompressedDocument408 pages1ver DIA Tibillo - CompressedEstrella MedinaNo ratings yet
- El Ave Mas Grande Del MundoDocument13 pagesEl Ave Mas Grande Del MundoEstrella MedinaNo ratings yet
- Manual de Procesos en Fotografías Aéreas EnviDocument14 pagesManual de Procesos en Fotografías Aéreas EnviWaldo PintoNo ratings yet
- Ejemplos de croquis y preguntas sobre ubicación familiarDocument2 pagesEjemplos de croquis y preguntas sobre ubicación familiarEstrella MedinaNo ratings yet
- ACTIVIDAD 4lo Que Soy Capaz de HacerDocument3 pagesACTIVIDAD 4lo Que Soy Capaz de HacerEstrella MedinaNo ratings yet
- Ficha de Actividades Matemática Miércoles 05 de Abril...Document4 pagesFicha de Actividades Matemática Miércoles 05 de Abril...Estrella MedinaNo ratings yet
- Seción Hoy Martes 06 de Abril de MatematicaDocument3 pagesSeción Hoy Martes 06 de Abril de MatematicaEstrella MedinaNo ratings yet
- Sesión 1 S1Document3 pagesSesión 1 S1Estrella MedinaNo ratings yet
- El VIRUS CON CORONADocument5 pagesEl VIRUS CON CORONAEstrella MedinaNo ratings yet
- Ley 27446 Sneia SeiaDocument64 pagesLey 27446 Sneia SeiaJesus CoralNo ratings yet
- MuseoDocument7 pagesMuseoEstrella MedinaNo ratings yet
- Zoológico de HuancayoDocument14 pagesZoológico de HuancayoEstrella MedinaNo ratings yet
- Turismo Como Estrategia de Conservación - SERNANPDocument35 pagesTurismo Como Estrategia de Conservación - SERNANPEstrella MedinaNo ratings yet
- Cultivo HidroponicoDocument95 pagesCultivo HidroponicoEstrella MedinaNo ratings yet
- Diapositivas de InvestigaciónDocument9 pagesDiapositivas de InvestigaciónEstrella MedinaNo ratings yet
- Porosidad Total Del Suelo y Espacio AéreoDocument25 pagesPorosidad Total Del Suelo y Espacio AéreoEstrella Medina50% (2)
- Alzheimer - Historias ClinicasDocument6 pagesAlzheimer - Historias ClinicasEstrella MedinaNo ratings yet
- Diapositivas de InvestigaciónDocument9 pagesDiapositivas de InvestigaciónEstrella MedinaNo ratings yet
- Análisis de métodos para determinar humedad en suelosDocument21 pagesAnálisis de métodos para determinar humedad en suelosEstrella MedinaNo ratings yet
- Planeamiento EstratégicoDocument36 pagesPlaneamiento EstratégicoEstrella MedinaNo ratings yet
- Oxidacion - SueloDocument5 pagesOxidacion - SueloEstrella MedinaNo ratings yet
- Alzheimer PDFDocument10 pagesAlzheimer PDFlithium2203No ratings yet
- Clima Nuestras Manos RESUMENDocument14 pagesClima Nuestras Manos RESUMENJuVe UbNo ratings yet
- Terminos AmbientalesDocument49 pagesTerminos AmbientalespexunitedNo ratings yet
- Sabana de PalmerasDocument9 pagesSabana de PalmerasEstrella Medina0% (1)
- Combinaciones BandasDocument5 pagesCombinaciones BandasJhon Javier67% (3)
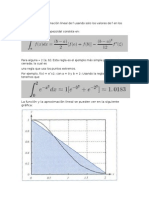
- Regla TrapezoidalDocument3 pagesRegla TrapezoidalEstrella MedinaNo ratings yet
- Capítulo 25 Mankiw - Producción y CrecimientoDocument31 pagesCapítulo 25 Mankiw - Producción y CrecimientoEvi Antuane Sanchez QuispeNo ratings yet
- Adaptación Española Del Environmental Reward Observation Scale (Eros)Document14 pagesAdaptación Española Del Environmental Reward Observation Scale (Eros)Andrés OrizolaNo ratings yet
- Fundamento Filosofico de Los Derechos HumanosDocument3 pagesFundamento Filosofico de Los Derechos HumanosLópez Portillo Vidal JoséNo ratings yet
- Wa0003.Document3 pagesWa0003.Samantha RodriguezNo ratings yet
- Union e InterseccionDocument7 pagesUnion e InterseccionJuan SequeraNo ratings yet
- Oecdtg425 (1) .En - EsDocument27 pagesOecdtg425 (1) .En - EsfabiNo ratings yet
- Rios Rivera, Edgar RaulDocument10 pagesRios Rivera, Edgar RaulEdgar Raul Rios RiveraNo ratings yet
- Herencia MitocondrialDocument19 pagesHerencia MitocondrialAlondra EscuderoNo ratings yet
- Acta de Inicio Contrato 6400017697Document2 pagesActa de Inicio Contrato 6400017697Andrés SierraNo ratings yet
- Práctica No. 10Document9 pagesPráctica No. 10Yennzy BarreraNo ratings yet
- SLADE 3300C Empaque para Válvulas y Bombas: Empaque de Grafito Expandido de Alta PurezaDocument1 pageSLADE 3300C Empaque para Válvulas y Bombas: Empaque de Grafito Expandido de Alta PurezaMontserrat GuijarroNo ratings yet
- Ejercicios Formas CanonicasDocument2 pagesEjercicios Formas CanonicasCésar David RomeroNo ratings yet
- Proyecto de Emprendimiento-Webinar FilosoficoDocument7 pagesProyecto de Emprendimiento-Webinar FilosoficoEmerson Jose Paz ChorresNo ratings yet
- MCD y MCM ProblemasDocument2 pagesMCD y MCM ProblemasCruz Andress100% (1)
- BROCHURE ITIL 4 26 Julio SMART RM CERTIFIED 1Document6 pagesBROCHURE ITIL 4 26 Julio SMART RM CERTIFIED 1Alvaro VargasNo ratings yet
- La Muerte (Científica) de Jesús A Los 33 Años Jesús Fue Azotado y Condenado A MuerteDocument25 pagesLa Muerte (Científica) de Jesús A Los 33 Años Jesús Fue Azotado y Condenado A MuerteJunior Rivadeneyra CarrascoNo ratings yet
- Tesis Sanidad de DiosDocument8 pagesTesis Sanidad de DiosIglesia Cristiana Cielos Abiertos Acevedo100% (1)
- La Constitución Española de 1978: principios, estructura y contenidoDocument22 pagesLa Constitución Española de 1978: principios, estructura y contenidobecha18No ratings yet
- Análisis Externo de La Empresa Local SeleccionadaDocument5 pagesAnálisis Externo de La Empresa Local SeleccionadaFrancini QuezadaNo ratings yet
- Formato de Vinculación Y Solicitud de CréditoDocument12 pagesFormato de Vinculación Y Solicitud de CréditoMike RAMÍREZNo ratings yet
- Sistemas Hidraulicos - InformeDocument21 pagesSistemas Hidraulicos - InformeLUIS ENRIQUE NARCISO RONCALNo ratings yet
- LuisDocument12 pagesLuisFabian DazaNo ratings yet
- La Psicología AplicadaDocument23 pagesLa Psicología Aplicadaangie tolozaNo ratings yet
- Dictamen Con y Sin Salved A DesDocument2 pagesDictamen Con y Sin Salved A DesMayra Alejandra CedeñoNo ratings yet
- Etiquetas Productos Químico EjemploDocument8 pagesEtiquetas Productos Químico EjemplooscarNo ratings yet
- Celebremos en Familia La Semana de La Sana ConvivenciaDocument8 pagesCelebremos en Familia La Semana de La Sana ConvivenciaMarìa Castillo EstradaNo ratings yet
- Práctica 1. Transferencia de Calor en Una Unidad de Acondicionamiento de AireDocument5 pagesPráctica 1. Transferencia de Calor en Una Unidad de Acondicionamiento de AireAdriana CamachoNo ratings yet
- Isaac Newton, la figura más resplendiente del siglo XVIIDocument11 pagesIsaac Newton, la figura más resplendiente del siglo XVIImvlsNo ratings yet
- Seguridad Durante La Construccion Ingeniería Civil UCVDocument11 pagesSeguridad Durante La Construccion Ingeniería Civil UCVterrones_oscar24100% (1)
- Dossier Esperanza y Utopi A 2Document8 pagesDossier Esperanza y Utopi A 2Carmen Muñumer100% (1)