Professional Documents
Culture Documents
Enfermedad de Alzheimer
Uploaded by
Luis BautistaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Enfermedad de Alzheimer
Uploaded by
Luis BautistaCopyright:
Available Formats
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
ENFERMEDAD DE ALZHEIMER
____________________________________
BAUTISTA OROZCO LUIS ANGEL
Primeras descripciones de la Enfermedad Alzheimer (EA) El 13 de Noviembre de 1906, en el 37. Versammhung Sdwestdeutscher Irrenrzte, celebrado en Tbingen, Alois Alzheimer present su comunicacin acerca de una seria enfermedad peculiar del crtex cerebral (ber eine eigenartige Erkrankung der Hirnrinde), se trataba del caso de Auguste Deter quien haba nacido el 16 mayo de 1850, era casada y tena una hija sana hasta que, en los ltimos meses del siglo XIX, inici con problemas para dormir. Sin razn alguna aseveraba con vehemencia que su marido se iba de paseo con una vecina, poco despus tuvo dificultad para recordar cosas. Dos meses ms tarde cometi errores al cocinar, que cada vez eran mayores. Paseaba de manera constante e inmotivada por su casa.
Se despreocup poco a poco de todo, arrastraba las sbanas y gritaba por horas a media noche, aseguraba que un hombre, que iba a su casa, tena la intencin de hacerle algo. Pensaba que las conversaciones que tenan lugar en su entorno hacan siempre referencia a ella.
Figura 2. Auguste Deter
Auguste D. fue evaluada por Alois Alzheimer en 1901, quien le realiz varias preguntas, mismas que repiti tiempo despus durante la entrevista, y la enferma no fue capaz de recordarlas, responda a su nombre pero no recordaba su apellido ni el nombre de su marido. Se le pidi que escribiera su nombre, ella lo intent y al no poder realizarlo repeta constantemente: Ich hab mich verloren (me Figura 1. Doctor Alois Alzheimer
Pgina
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
he perdido); a menudo tena momentos de ansiedad y miedo de estar murindose. Tocaba sin ton ni son las campanillas de entrada de las puertas de sus vecinos. No saba encontrar sus objetos personales en los lugares en que ella los haba guardado. Se comportaba hostil, gritaba frecuentemente y arremeta contra quien quera examinarla, tocaba la cara de los otros enfermos y los golpeaba. Era difcil deducir lo que quera y fue necesario aislarla. Se agreg un trastorno del lenguaje caracterizado por fallas en la comprensin, pobreza de palabras y asintaxis. Al paso del tiempo se torn completamente demente, dej de hablar (mutismo), y era totalmente dependiente.
condujo a la muerte el 8 de abril de1906, en Frankfurt. El cerebro de Auguste Deter fue donado y se traslad a Munich, donde entonces trabajaba el Dr. Alzheimer, quien estudi afanosamente este espcimen. El estudio patolgico del cerebro de esta paciente, evidenci una marcada atrofia de la corteza con el ensanchamiento correspondiente de las cisternas. Los cortes histolgicos que haban sido teidos con tcnicas argnticas (se usan sales de plata) mostraron en el parnquima una abundante y masiva degeneracin en la cual se destacaba dos tipos de estructuras particulares. Una de ella tena forma de mancha por lo que fue nombrada placa senil y la otra se caracterizaba por su forma de flama. Esta lesin fue denominada como ovillo o maraa neurofibrilar. Debido a que este caso fue la primera descripcin detallada y formal de una demencia con posibles causas neurolgicas puesto que haba la grave atrofia cerebral con numerosas lesiones, tuvo como consecuencia que la comunidad mdica de aquellos tiempos empezara a pensar que haba un tipo de demencia que no poda ser explicado slo por el envejecimiento normal, sino que representaba una verdadera entidad neurodegenerativa Unos aos despus se acept, por consenso, el epnimo de enfermedad de Alzheimer para describir el padecimiento de esta mujer. La enfermedad de Alzheimer en la actualidad Resulta difcil dar una definicin concreta de la enfermedad de Alzheimer desde el momento en que se desconoce su etiologa. Eventualmente se la puede definir como un trastorno adquirido y crnico de dos o ms de las funciones cerebrales: memoria, lenguaje, pensamiento y conducta, que lleva a un
Figura 3. Pruebas de escritura de Auguste Deter La ltima fase de su vida se caracteriz por prdida del control de esfnteres vesical y anal. Aparecieron lceras de decbito. Su debilitamiento fsico era cada vez mayor, perdi mucho peso. Como evento final padeci un grave proceso febril que la
Pgina
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
deterioro cognitivo mltiple e invalidante. Es una de las principales causas de demencia.
Clnicamente se caracteriza por la progresiva e irreversible deterioro de la memoria, de las habilidades para realizar hbitos rutinarios, de la orientacin en tiempo y espacio, del lenguaje, del pensamiento abstracto y de la habilidad para aprender y efectuar clculos matemticos. Cada una de las etapas del deterioro de la memoria y la prdida de las funciones mentales superiores de la enfermedad se encuentran bien definidos clnicamente.
insolubles que tienen la conformacin plegada las que definen dos tipos principales de lesiones: las placas neurticas (PNs) y las maraas neurofibrilares (MNFs). El principal componente protenico de fibrillas de las PNs es el pptido amiloide y de las MNFs, la protena tau. En general, cabe sealar que tanto la formacin de las fibrillas del amiloide de la PNs como las de las MNFs (a nivel ultra-estructural, estas lesiones representan densas acumulaciones de polmeros insolubles denominados filamentos helicoidales apareados, FHAs) representan los productos de un transtorno del plegamiento de protenas que se caracterizan por protelisis y cambios conformacionales. Esta serie de eventos moleculares llevan a la formacin de polmeros insolubles de estructura plegada. Placas neurticas (PNs) Las PNs estn formadas de dos componentes principales: un ncleo de amiloide extracelular y un arreglo de terminales nerviosas degeneradas, de formas caprichosas, las neuritas distrficas, que pueden ser de naturaleza intracelular o extracelular dependiendo de su estado de degeneracin.
Figura 4. Comparacin anatmica e histolgica entre un cerebro normal y un cerebro con la EA Histopatologa de la EA El diagnstico definitivo de la EA se basa en el examen del tejido cerebral obtenido por autopsia. A nivel histopatolgico la EA es un proceso neurodegenerativo que se caracteriza por la selectiva y progresiva muerte de las clulas neuronales en reas cerebrales especficas, principalmente de la neocorteza y el hipocampo, lo que se refleja clnicamente por un estado demencial. El cuadro clnico de la demencia tipo Alzheimer se acompaa de la acumulacin masiva de filamentos
Pgina
Figura 5. Placa neurtica con centro amiloide y neuritas distrficas perifricas. Plata metenamina acelerada con MW 100 X
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
Estas neuritas envuelven al ncleo de la placa. Caractersticamente las PNs, estn rodeadas de numerosas clulas gliales las cuales, de cierta forma, las encapsulan. La densidad de las PNs correlaciona con el grado de la EA. En los casos de Alzheimer, as como en los adultos mayores sanos y en ciertos primates, perros y osos, pueden encontrarse en el cerebro depsitos de amiloide pero sin el componente neurtico. A diferencia de las PNs, este tipo de lesin, llamada placa senil, no correlaciona con la EA. Estos hallazgos han hecho sugerir que las placas seniles constituyen un factor de riesgo para el desarrollo de la enfermedad, esto es,
Placas difusas que no tienen en el centro amiloide, pero que contienen a su alrededor una protena estable (A)-inmunorreactiva, posiblemente representa una placa joven. Placa neurtica clsica es una estructura esfrica de 50 a 200 mm de dimetro, la cual contiene una protena A-inmunorreactiva rodeada por neuritas distrficas. Frecuentemente tienen filamentos pareados de manera helicoidal, procesos aliales normales y organelos anormales. La placa habitualmente se encuentra rodeada por astrocitos reactivos y clulas de la microglia. Adems de la protena amiloide, las placas poseen protena Tau, -1-antiquimotripsina, apolipoprotena E (ApoE) y glucosaminoglicanos. Placas terminales (burnt out) que solo contienen un centro amiloide denso y aislado. El amiloide es un pptido de un peso molecular de 4kD y tiene una longitud de 4243 aminocidos. Las dos especies principales del amiloide A40 y A42 se originan como producto de secrecin normal de una protena transmembranal muy grande llamada protena precursora del -amiloide (PPA). Hay por lo menos tres isoformas diferentes del APP, de 695, 751 y 770 residuos de aminocidos, que se generan por un recorte alternativo del ARN mensajero que se deriva de un solo gen localizado en el brazo largo del cromosoma 21. La PPA es un componente celular fisiolgico de todos los animales y participa en diversas funciones de regulacin y de adhesin. Han sido descritos dos procesos de protlisis de la PPA: uno amiloidognico y otro no amiloidognico. En ambos casos el primer paso de la protelisis de la PPA ocurre en su extremo amino por la accin de una secretasa. En el proceso amiolodognico el segundo paso de protelisis implica la accin de la secretasa
Figura 6. Corte de corteza cerebral con tincin argntica donde se observan las placas seniles su presencia es necesaria pero no suficiente para el inicio de la enfermedad. Estudios recientes han sugerido que la participacin del amiloide en la fisiopatognesis de la EA se atribuye ms que al depsito de fibrillas en la PNs, a su depsito en las paredes vasculares cerebrales, lo que conlleva a degeneracin y microhemorragias. El grado de estos hallazgos ha sido correlacionado con la demencia. Se han identificado tres diferentes tipos que, muy probablemente, representen diferentes estadios de un mismo proceso:
Pgina
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
que forma pptidos de varias longitudes de los cuales los ms importantes son 40 y 42 aminocidos. La secretasa participa en la llamada protolisis no amiloidognica de la PPA. Esta enzima corta entre los residuos 16 y 17 de la secuencia del amiloide evitando su formacin. La identidad de las secretasas
amiloide-42, que es muy reactivo y txico. El depsito de A amiloide-42, coloquialmente conocido como amiloide parece ser el elemento central en la cascada de eventos que culminan con la muerte neuronal y es el principal constituyente de las placas neurticas. Maraas neurofibrilares (MNFs) Las MNFs estn constituidas de filamentos helicoidales apareados (FHAs) y la protena tau es su principal componente estructural. La
Figura 7. Protena precursora del amiloide. involucradas en el procesamiento de la PPA ha sido definida para la secretasa la cual corresponde a una asparto-proteasa transmembranal, llamada Asp-2; y la secretasa parece ser la presenilina 1 y la secretasa, una metalo-proteinasa y desintegrina de la familia de las ADAM llamada ADAM10. La protena precursora de amiloide es una protena neuronal transmembranal, que durante su catabolismo se reduce a pptidos con menor nmero de aminocidos; este proceso se realiza por accin de tres enzimas llamadas secretasas , y . La actividad de las tres secretasas da como resultado sustancias proteicas cortas, fcilmente removibles y no txicas. Cuando slo actan las secretasas y originan un producto protenico de 42 aminocidos denominado A Figura 8. Maraas neurofibrilares. Plata metenamina acelerada con MW 40X protena tau es una protena termoestable que forma parte del grupo de las denominadas MAPs, la cual es capaz de asociarse a la tubulina. La funcin especfica de tau, al igual que otros tipos de MAPs, es promover el ensamble y estabilidad de los microtbulos que forman parte del citoesqueleto de las clulas nerviosas. La protena tau presenta 6 diferentes isoformas, con un peso molecular aproximado de 50-64 kD. Las diferentes isoformas de tau presentes en las clulas del sistema nervioso poseen una longitud promedio de 352-441 aminocidos, en funcin de la presencia o ausencia de tres secuencias inserto. El nmero de MNFs
Pgina
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
Figura 9. Maraas neurofibrilares en corteza entorrinal. Plata metenamina acelerada con MW 100X observadas en la histologa post-mortem de los casos de Alzheimer correlaciona con la severidad y duracin de la demencia. Las MNFs pueden ser de dos tipos: intracelulares y extracelulares dependiendo si se encuentran dentro de la neurona o en el espacio extracelular con la muerte de la misma. Existen formas que evolucionan conforme la MNFs pasa de un estado a otro. Cabe aclarar que las neuritas distrficas tambin forman parte de la degeneracin fibrilar de las clulas neuronales. Las neuritas se forman de la acumulacin de filamentos anormales en las terminales de la clula, axones y dendritas. Por otra parte, las MNFs se forman en el cuerpo neuronal, en la regin perinuclear, de ah su forma tpica. Fisiopatologa de la EA En la EA la evolucin de la formacin neurofibrilar en el hipocampo, las MNFs aparecen primero en la zona transicional (transentorrinal) y su adyacente capa II de la corteza entorrinal, que se localizan en la circunvalacin del parahipocampo, en el lbulo temporal. Este dao es crtico para entender la fisiopatologa de la EA, puesto que las clulas neuronales de la capa II de la
Pgina
corteza entorrinal son una zona de relevo donde llegan los axones de las reas asociativas de la neocorteza. Los axones de la capa II llegan al hipocampo, a travs de una va definida llamada va perforante, y entonces hacen sinapsis con las neuronales piramidales del hipocampo. Una vez procesada la informacin, los axones del hipocampo hacen sinapsis de salida con la capa IV de la corteza entorrinal y de ah se enva la informacin hacia toda la neocorteza. En otras palabras, la conexin sinptica de la neocorteza y el hipocampo est limitada a la corteza entorrinal. En la EA, al encontrarse destruidas estas dos capas, desconecta estas dos importantes zonas del cerebro. La concomitante destruccin del hipocampo crea una desconexin completa con las reas asociativas de la neocorteza. Las consecuencias de la excesiva formacin de marneurofibrilares y parlisis supranuclear son trascendentales para el entendimiento de la EA- Los cambios que se describen a continuacin son las alteraciones histolgicas de la enfermedad de Alzheimer y, al mismo tiempo, representan eventos anatmicos y fisiopatolgicos interrelacionados: 1. Perdida de neuronas (vulnerabilidad selectiva) Se asocia con las fallas cognitivas y conductuales del paciente. La prdida neuronal en la EA parece iniciarse en la regin medial del lbulo temporal (corteza entorrinal), con la evolucin de la enfermedad se afectan la corteza del cngulo, la neocorteza, el tlamo, la corteza motora y sensitiva, los ncleos basales, y el cerebelo slo en estadios tardos de la enfermedad. 2. Reduccin de conexiones sinpticas La merma de neuronas se vincula con menoscabo de las sinapsis, especialmente en las regiones con mayores cambios histolgicos. La cuantificacin disminuida de las protenas sinpticas est estrechamente
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
vinculada con la muerte neuronal, la cual es consecuencia de un proceso de muerte retrgada, donde se advierten aberraciones en el citosqueleto, que modifica el flujo axnico y la toxicicdad directa sobre los botones sinpticos. 3. Infiltrado inflamatorio. Es un elemento histolgico consistente. Existen reas enceflicas susceptibles a la respuesta inflamatoria que lleva a la destruccin del neuropilo y coadyuvan a la formacin de placas neurticas. El infiltrado inflamatorio puede rodear a las placas o estar ubicado dentro de ellas. Los reactantes de fase aguda, como la -1-antiquimotripsina y la 2-macroglobulina, estn presentes en las placas neurticas. Es muy probable que la actividad inflamatoria facilite la muerte neuronal en el paciente con EA. 4. Angiopatia amiloide Se trata de un proceso infiltratitivo que afecta a los vasos corticales superficiales (angiopata amiloide cerebral) y los vasos leptomenngeos, no siempre asociada con la formacin de las placas neurticas, aunque, en ocasiones, stas pueden rodear al vaso afectado. Este padecimiento suele estar relacionado con hemorragias lobares recurrentes y demencia en la enfermedad de Dutch. 5. Degeneracin granulovacuolar Es otra anormalidad histolgica encontrada comnmente en pacientes con EA y rara vez en el envejecimiento normal. Suelen afectarse las clulas piramidales hipocampales, en las cuales se observan grandes vacuolas intracitoplasmticas. Estas vacuolas contienen un grnulo denso. Estos grnulos tienen reactividad anti--Alz-50 y anticuerpos antineurofilamentos. Alteraciones genticas detectadas en la EA
Durante la ltima dcada del siglo XX, la descripcin de mutaciones en determinados genes que se relacionan con la aparicin de la EA cre gran expectacin. La mutacin para el gen del precursor de la protena amiloide (PPA), mutaciones en el cromosoma 14 y del cromosoma 1, que codifican protenas similares conocidas como presenilinas 1 y 2 (PS1 y PS2), elevan las concentraciones de A 1-42 en la sangre, el lquido cefalorraqudeos y en el encfalo de los pacientes con EA que probablemente favorezcan la apoptosis neuronal. La bsqueda de afectaciones genticas en la EA mostr la existencia de al menos seis mutaciones missense (cambio de sentido, esto es el cambio de un aminocido por otro). Las mutaciones en el gen de la protena precursora de amiloide son responsables de 2% del total de casos de la EA familiar y, aproximadamente, de 5 a 20% de la EA familiar de comienzo temprano. Mecanismos de muerte neuronal en la EA La muerte de las clulas nerviosas ocurre por dos mecanismos bsicos: inflamacinisquemia y apoptosis, ambas acontecen en la enfermedad de Alzheimer. Inflamacin El infiltrado inflamatorio es un componente constante en la enfermedad de Alzheimer. Entre los criterio histopatolgicos para establecer el diagnstico de EA se insiste que en la corteza cerebral debe haber placas neurticas y maraas neurofibrilares e infiltrado inflamatorio rodeando las placas o estar dentro de ellas. Es probable que la actividad inflamatoria facilite la muerte neuronal en el paciente con EA. Este proceso inflamatorio que circunda, rodea e infiltra las placas neurticas se asocia con la liberacin de sustancias mediadoras de inflamacin como: -1-antiquimotripsina y la
Cuadro 1. Factores genticos y metablicos involucrados en la etiopatogenia de la Enfermedad de Alzheimer
Pgina
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
-2-macroglobulina, la interleucina 1 y la interleucina 6, y el sistema de complemento es activado, lo cual facilita la muerte neuronal en pacientes con EA a travs de una cascada de eventos donde participan de manera central las sustancias derivadas del catabolismo de cido araquidnico. La participacin de elementos neurotxicos, como los radicales libres (producto del estrs oxidativo), y los neurotransmisores excitadores, el calcio y otros, interfiere con las funciones esenciales para supervivencia celular, las cuales posiblemente estn activadas por factores externos, que representan fenmenos bien reconocidos en la patogenia de la EA inician una cascada que culmina en la muerte neuronal. Apoptosis Existen evidencias claras de que la expresin de genes que promueven la muerte neuronal por apoptosis est aumentada en los pacientes con EA. Los factores que intervienen en este hecho no son claros, pero es factible que sea el resultado la conjuncin de una predisposicin individual y factores externos. En qu medida interviene cada uno de ellos y en qu proporcin determina la apoptosis celular es todava un enigma. Lo que s es un hecho es la prdida masiva de neuronas y clulas gliales a travs de este mecanismo de muerte celular en los pacientes con EA. Modificaciones de los neurotransmisores y sus receptores observadas. En la enfermedad de Alzheimer existen fallas en la produccin, metabolismo, recambio de receptores, recaptura y renovacin de neurotransmisores y neuromoduladores en diversas reas del encfalo. Consideraciones sobre la disminucin acetilcolina en EA En el ncleo basal de Meynert se sintetiza la mayor parte de la acetilcolina en el sistema nervioso central. Esta sntesis ocurre por la accin de la
acetilcolinatransferasa. Este ncleo se afecta de manera importante en la EA. La produccin de acetilcolina en la EA disminuye 58 a 90%; este problema se correlaciona directamente con el deterioro cognoscitivo. Los receptores para acetilcolina muscarnicos y nicotnicos son los responsables de las acciones postsinpticas de este neurotransmisor. De los cinco receptores muscarnicos plenamente identificados, los M1 y M2 son los que tienen mayor participacin en la fisiopatologa de la enfermedad. Los M1 se localizan, principalmente, en el hipocampo y la corteza cerebral. Estos suelen conservar su nmero durante la EA; sin embargo, sufren deficiencias funcionales. En tanto que los M2, localizados en el tallo cerebral y en los ncleos basales, se reducen de manera importante durante el curso de la enfermedad. Los receptores nicotnicos tambin se ven sumamente disminuidos. Participacin del glutamato en la EA La neurotoxicidad es un suceso comn en muchos procesos degenerativos que suelen estar mediados por glutamato y sus dos receptores (AMPA y NMDA) En esta contingencia participan muchos factores como: exceso de radicales libres de oxgeno caracterstico de un ambiente con prdida de oxgeno, alteracin en el paso de iones a travs de la membrana. sta es medida por una activacin incesante de ambos receptores, con lo que provoca acumulacin interneuronal de calcio y sodio. Esto significa que la neurona se encuentra continuamente despolarizada e incapaz de codificar un nuevo estmulo. La traduccin clnica es la falla en las funciones mediadas por estos receptores (memoria, aprendizaje, etc.); as mismo, la entrada indiscriminada de sodio, pero particularmente de calcio, promueve la expresin de genes de apoptosis
Pgina
FACULTAD DE CIENCIAS UNIVERSIDAD NACIONAL AUTNOMA DE MXICO
e interrupcin de las funciones metablicas de la clula, que culminan en la muerte neuronal. GABA y otras sustancias neuromoduladoras en la patogenia de la enfermedad de Alzheimer. Los receptores para GABA se encuentran reducidos alrededor de la mitad, para somatostatina entre 40 y 60 % para norepinefrina entre 30 y 70%. Los receptores dopaminrgico estn afectados, especialmente en la demencia por cuerpos de Lewy, en la enfermedad de Alzheimer pueden verse afectados por la administracin de neurolpticos. Conclusiones Aunque mucho se ha avanzado en los estudios de histolgicos, de biologa molecular y genticos, en general, los avances en la bsqueda de las causas de la enfermedad de Alzheimer y los cambios moleculares asociados a la formacin de los FHAs han sido limitados por la ausencia de un modelo adecuado. Con ello, el estudio del cerebro de los casos que fallecen de este mal se presenta como el nico instrumento a que tiene acceso el investigador para poder continuar en esta incesante bsqueda de un tratamiento el control o cura de la enfermedad de Alzheimer. Referencias Bayer T., Paliga K., Weggen S., Weistler, Beyreudther K., Multhaup G. 1997. Amyloid precursor-like protein 1 accumulates in neuritic plaques in Alzheimers disease. Acta Nauropathol. 94: 519-524. Gail V.W. and Hartigan A. J. 1998. Tau protein in normal and Alzheimers disease brain: an update.
Alzheimers disease review 3, 125-141. Grupo Consenso del Sndrome de Deterioro Intelectual y Padecimientos Demenciales. Consensos/Fundsalud. Mxico, D.F. 1996. Kawas Ch. 2003. Clinical practice. Early Alzheimers disease. The New England Journal of Medicine. 349(11): 1056-63. Revesz T., Ghiso J., Lashley T., Plant G., Rostagno A., Frangione B., Holton J. Cerebral amyloid angiopathies: A pathological, biochemical and genetic view. J. Neuropathol. Exp. Neurol. 62:885898, 2003. Ueberham U., Hessel A., Aredt T. 2003. Cyclin C expression is involved in the pathogenesis of Alzheimers disease. Neurobiology of aging. 24: 427-437. Vassar R.,Bennet B.D., Babu-Khan y col. 1999. Beta-secretase cleavage of Alzheimers amiloid precursor protein by the transmembrane aspartic protease bace. Science. 286: 735-741 Wischik C.M., Harrington C.R. y Mena R. Molecular determinants of paired helical filament assembly and the therapeutic implications in Alzheimers disease. Inter. Rev. Psychiatry. 7:299-338, 1995. Wisniewski T., Ghiso J, and Frangione B. 1997. Biology of A amyloid in Alzheimers. Neurobiology of disease. 4:313-328.
Pgina
You might also like
- Plan de Fatiga y SomnolenciaDocument15 pagesPlan de Fatiga y SomnolenciaAriel Araya Gonzalez80% (10)
- Plantilla de Correccion Del MCMI-IIDocument10 pagesPlantilla de Correccion Del MCMI-IINorma ReynaNo ratings yet
- El VIH - SIDA Segun HamerDocument27 pagesEl VIH - SIDA Segun HamerErnesto Rodolfo Guzmán JaraNo ratings yet
- Neurología 2VDocument16 pagesNeurología 2VNells Jesús Olivos LozanoNo ratings yet
- PseudopsicologíasDocument68 pagesPseudopsicologíasFelipe Balaguera100% (1)
- Febrero 1977: Supernovas en Otras GalaxiasDocument124 pagesFebrero 1977: Supernovas en Otras GalaxiasLuis Manara100% (1)
- Disrafismo EspinalDocument44 pagesDisrafismo EspinalGerardo Osorio LeonNo ratings yet
- Coma NeurológicoDocument33 pagesComa NeurológicoSara RojasNo ratings yet
- EEG: Electroencefalograma guía completaDocument38 pagesEEG: Electroencefalograma guía completaMaJo EstrellaNo ratings yet
- Caso Clínico 09 NeurologíaDocument13 pagesCaso Clínico 09 NeurologíaAna Luisa Tacanga RodriguezNo ratings yet
- ELA Actualizacion PDFDocument13 pagesELA Actualizacion PDFR Makir Yanac CotrinaNo ratings yet
- Ee 22-23Document144 pagesEe 22-23juangelboyNo ratings yet
- FisioDocument11 pagesFisioluis alberto saavedra sorianoNo ratings yet
- El Esceptico Nº 17Document83 pagesEl Esceptico Nº 17Rigoberto Muñoz LagosNo ratings yet
- Entrevista Con Los Padres Acerca Del Autismo Versión ClínicaFINALDocument6 pagesEntrevista Con Los Padres Acerca Del Autismo Versión ClínicaFINALCarmenNo ratings yet
- Enfermedades Autoinmunes Sistémicas - EnfermosDocument62 pagesEnfermedades Autoinmunes Sistémicas - EnfermosNorberto Ortego Centeno100% (1)
- El Pediatra Eficiente. 6º EdiciónDocument645 pagesEl Pediatra Eficiente. 6º EdiciónMarce NazzoNo ratings yet
- SEGUNDO I Bimestre y II BimestreDocument66 pagesSEGUNDO I Bimestre y II BimestreGary Quisuruco Gutierrez100% (1)
- Informe-Contaminacion Ambiental en Ingenieria CivilDocument15 pagesInforme-Contaminacion Ambiental en Ingenieria CivilAnaCarolina Ramos MercadoNo ratings yet
- Síndrome de Horner: revisión de su historia y manifestaciones clínicasDocument3 pagesSíndrome de Horner: revisión de su historia y manifestaciones clínicasHugo X. HerreraNo ratings yet
- 00 - Circuitos Electrónicos II - Información GeneralDocument3 pages00 - Circuitos Electrónicos II - Información GeneralalexNo ratings yet
- Lectura 6 Enfermedades Por Expansión de Tripletes PDFDocument9 pagesLectura 6 Enfermedades Por Expansión de Tripletes PDFDiego Enzo Chala GrazaNo ratings yet
- Examen de Neurologia Trim Mayo RecopilaciónDocument32 pagesExamen de Neurologia Trim Mayo RecopilaciónPineapple WeslyNo ratings yet
- Clase6-Sensaciones Somaticas II Cefalea DolorDocument45 pagesClase6-Sensaciones Somaticas II Cefalea DolorDANIEL ALEJANDRONo ratings yet
- SX Oclusión de La Arteria Cerebral Anterior. by Dr. Caleb Rodea Peñaloza UNAMDocument26 pagesSX Oclusión de La Arteria Cerebral Anterior. by Dr. Caleb Rodea Peñaloza UNAMCaleb RodeaNo ratings yet
- Anatomia en El Anfiteatro - Dr. Durand - AbdomenDocument78 pagesAnatomia en El Anfiteatro - Dr. Durand - AbdomenHinO - Arturo100% (2)
- Tronco Ensefalico - ApaDocument18 pagesTronco Ensefalico - ApaFernando AkatsukiNo ratings yet
- ITU Internado USACHDocument30 pagesITU Internado USACHGustavo Belmar SotoNo ratings yet
- Materiales y MetodoDocument1 pageMateriales y MetodoKarla Vale SaldañaNo ratings yet
- Complicaciones de La Hipertensión ArterialDocument134 pagesComplicaciones de La Hipertensión ArterialJuan Diego Siguenza Rojas67% (3)
- Fisiología Coclear Bases Anatómicas, Celulares y ElectrofisiológicasDocument22 pagesFisiología Coclear Bases Anatómicas, Celulares y ElectrofisiológicasSergio FerreiraNo ratings yet
- Clase Neurología - Semiologia de Pares CraneanosDocument8 pagesClase Neurología - Semiologia de Pares CraneanosMatías Norambuena NeiraNo ratings yet
- Simulacro Parte ADocument23 pagesSimulacro Parte AEussk AdyNo ratings yet
- 1) Abordaje Del Paciente en ComaDocument27 pages1) Abordaje Del Paciente en ComaRuby YandúnNo ratings yet
- CASOS CLINICOS GASTROINTESTINAL 2r.Document7 pagesCASOS CLINICOS GASTROINTESTINAL 2r.Claudia Lopez LozaNo ratings yet
- Sistema ExtrapiramidalDocument31 pagesSistema ExtrapiramidalLola CORBAZNo ratings yet
- Neuromielitis OpticaDocument11 pagesNeuromielitis OpticaJorge De Vera AlvaradoNo ratings yet
- Sistema motor: Organización y tipos de movimientoDocument92 pagesSistema motor: Organización y tipos de movimientorusselNo ratings yet
- AlzhaimerDocument44 pagesAlzhaimerambar montesinoNo ratings yet
- El Cráneo StarchildDocument25 pagesEl Cráneo Starchildvituco123No ratings yet
- Diferencias morfológicas entre arañas y garrapatasDocument11 pagesDiferencias morfológicas entre arañas y garrapatasgabcirNo ratings yet
- Alberto Henao VinascoDocument1 pageAlberto Henao Vinascowendy silvaNo ratings yet
- MotoneuronaDocument16 pagesMotoneuronaSilvy FuentesNo ratings yet
- Expoooo Receptores para Antígeno e InmunoglobulinaDocument25 pagesExpoooo Receptores para Antígeno e InmunoglobulinaCdcgs PWinNo ratings yet
- Neuroanatomia I PDFDocument12 pagesNeuroanatomia I PDFMarinaNo ratings yet
- Diatesis HemorragicaDocument9 pagesDiatesis HemorragicaAlexis M-cNo ratings yet
- 9 RM Cerebro UfroDocument193 pages9 RM Cerebro UfroKaren Palma CarrascoNo ratings yet
- Electrofisiologia CardiacaDocument2 pagesElectrofisiologia CardiacaDianaMartinNo ratings yet
- Segundos MensajerosDocument8 pagesSegundos MensajerosMachaca CelesteNo ratings yet
- Electroencefalografía Clínica 2021 5Document20 pagesElectroencefalografía Clínica 2021 5Alfredo Pérez100% (1)
- Exploración abdominalDocument44 pagesExploración abdominalalfredoNo ratings yet
- HISTORIA CLINICA NeurocirugiaDocument9 pagesHISTORIA CLINICA NeurocirugiaTae Shey KimNo ratings yet
- Exploración Física Del Sistema Hematico. Caleb RodeaDocument21 pagesExploración Física Del Sistema Hematico. Caleb RodeaCaleb RodeaNo ratings yet
- ELECTROCARDIOGRAMADocument30 pagesELECTROCARDIOGRAMADavid Siguenza100% (1)
- Clase 2 - Trauma CraneoencefalicoDocument40 pagesClase 2 - Trauma CraneoencefalicoMaryuri100% (1)
- Criptococosis MeningeaDocument15 pagesCriptococosis MeningeaEmmanuel CabreraNo ratings yet
- Caso Clinico Neurosifilis DCLDocument26 pagesCaso Clinico Neurosifilis DCLYESICA YESSENIA QUISPE OCHOANo ratings yet
- ANOMALÍAS CEREBRALES FETALESDocument17 pagesANOMALÍAS CEREBRALES FETALESLiliAna CoRaniNo ratings yet
- Examen EUNACOM 5 - Grupo CTODocument34 pagesExamen EUNACOM 5 - Grupo CTOcaros manzanresNo ratings yet
- Respiratorio Guevara PDFDocument46 pagesRespiratorio Guevara PDFprincesavarasNo ratings yet
- Demencia Tipo AlzheimerDocument9 pagesDemencia Tipo Alzheimeririana mozoNo ratings yet
- Enfermedad de Alzheimer.Document9 pagesEnfermedad de Alzheimer.Dennis LanuzaNo ratings yet
- AlzheimerDocument12 pagesAlzheimerDulce RodriguezNo ratings yet
- Alzheimer PDFDocument20 pagesAlzheimer PDFLuis Porras MendozaNo ratings yet
- AlzheimerDocument8 pagesAlzheimerLiz LeonNo ratings yet
- Dialnet EnfermedadDeAlzheimerActualizacion 6143768Document15 pagesDialnet EnfermedadDeAlzheimerActualizacion 6143768Flavia Ozuna SalinasNo ratings yet
- Reporte LaminillasDocument2 pagesReporte LaminillasLuis BautistaNo ratings yet
- Clasificación de Las AngiospermasDocument3 pagesClasificación de Las AngiospermasLuis BautistaNo ratings yet
- AntibioticosDocument7 pagesAntibioticosLuis BautistaNo ratings yet
- AntibioticosDocument7 pagesAntibioticosLuis BautistaNo ratings yet
- Acción de Los Antioxidantes Sobre Los Radicales LibresDocument3 pagesAcción de Los Antioxidantes Sobre Los Radicales LibresLuis BautistaNo ratings yet
- Cartel HIDocument1 pageCartel HILuis BautistaNo ratings yet
- Introduccion Al Estudio de Los Sistemas de OrganosDocument38 pagesIntroduccion Al Estudio de Los Sistemas de OrganosEmmanuel V Garcia BNo ratings yet
- Inerv e Irrig de La Cara CBMF VIDocument36 pagesInerv e Irrig de La Cara CBMF VIsheyla caceresNo ratings yet
- Reto A La Protección Manufacturera PDFDocument17 pagesReto A La Protección Manufacturera PDFalvasquezt73% (41)
- Cancer de PeneDocument39 pagesCancer de PeneGissellAracelyNaviaArnezNo ratings yet
- Técnico Paramédico GinecologíaDocument5 pagesTécnico Paramédico GinecologíaMariela VelizNo ratings yet
- Foro ¿Cómo Decidir Entre Texto, Gráficas y Tablas para Presentar Sus ResultadosDocument10 pagesForo ¿Cómo Decidir Entre Texto, Gráficas y Tablas para Presentar Sus ResultadosJhos Gregory Castillo Mendoza50% (2)
- Caso SalamDocument4 pagesCaso SalamDrJoseloNo ratings yet
- Respuesta Sexual HumanaDocument38 pagesRespuesta Sexual Humanacarmen100% (2)
- Memoria operativa: modelo, componentes y funciones según BaddeleyDocument8 pagesMemoria operativa: modelo, componentes y funciones según BaddeleyVianney MorontaNo ratings yet
- Acidosis MetabolicaDocument10 pagesAcidosis MetabolicaEdgard Eduardo Capristan RojasNo ratings yet
- La Oligofrenia y Su CriminalidadDocument4 pagesLa Oligofrenia y Su CriminalidadGiovanna VsNo ratings yet
- Analisis de Casos Clinicos Ictericia y PDocument20 pagesAnalisis de Casos Clinicos Ictericia y PEvelyn Cast rejónNo ratings yet
- Tolerancia y AutoinmunidadDocument8 pagesTolerancia y AutoinmunidadLuis Alberto de la Fuente García PeñaNo ratings yet
- Family Central Broward County Childcare Handbook - SpanishDocument15 pagesFamily Central Broward County Childcare Handbook - SpanishfamilycentralNo ratings yet
- VACUNA HAEMOPHILUS INFLUENZAE TIPO B (Hib)Document11 pagesVACUNA HAEMOPHILUS INFLUENZAE TIPO B (Hib)Manuel Benjamín Gonzáles Nanfuñay100% (1)
- C) Plan Detallado MazamariDocument19 pagesC) Plan Detallado MazamariYessica Lucero Huaman PonceNo ratings yet
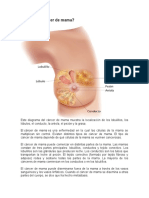
- Cáncer mama: causas, síntomas y tiposDocument16 pagesCáncer mama: causas, síntomas y tiposEdilson VázquezNo ratings yet
- Sífilis GestacionalDocument10 pagesSífilis GestacionalColBrosNo ratings yet
- Equipo 5 Exposicion 2Document33 pagesEquipo 5 Exposicion 2MAYRA GISSELY CRUZ PANTINo ratings yet
- Proyecto de Dieta MonorrenoDocument4 pagesProyecto de Dieta MonorrenoAdriana Latouche MartinezNo ratings yet
- CARNITINADocument3 pagesCARNITINAmemoaranedaNo ratings yet
- Valoración Neurológica LesionesDocument43 pagesValoración Neurológica LesioneshectormicheaNo ratings yet
- Los ParásitosDocument8 pagesLos ParásitosStuart LejaNo ratings yet
- Higiene Bronquial Mecanica en NMDocument78 pagesHigiene Bronquial Mecanica en NMGabriela Enciso100% (1)
- Fichas MedicamentosDocument18 pagesFichas MedicamentosVivy Ortega MoreiraNo ratings yet