Professional Documents
Culture Documents
Tabla Difusividad Gases
Uploaded by
Camilo Andres Picon PradaOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Tabla Difusividad Gases
Uploaded by
Camilo Andres Picon PradaCopyright:
Available Formats
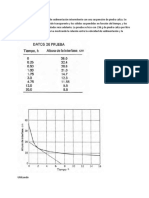
DIFUSIN MOLECULAR EN FLUIDOS 35
Tabla 2.1
Sistema
Difusividad de gases a presin atmosfrica esthndar, 101.3 kN/m*
Temp, C 0 0 0 0 0 25.9 59.0 0 25.9
59.0
Difusividad, m2/s x 1O5 6.25t 1.81 1.85 1.39 1.98 2.58 3.05 1.02
0.87
Ref. 3 3 3 3 26 1
1
Hz-CH, 0,-b co-o* co,-o* Aire-NH, Aire-H,0 Aire-etanol Aire-n-butano1 Aire-acetato de etilo Aire-anilina Aire-clorobenceno Aire-tolueno
14
1
1.04
0.87
1
1
25.9
59.0
1.06
0.74 0.90 0.74 0.90 0.86 0.92
1
7 7 7 7 1 7
25.9
59.0
25.9
59.0
25.9
59.0
t Por ejemplo, DHzpCH,
= 6.25 x
10V5 m2/s.
MA, MB = peso molecular de A y B, respectivamente, kg/kmol pt = presin absoluta, N/m2 AB = separacin molecular durante el choque, - nm- = (rA + rB)/2 & A B = energa de la atraccin molecular = ,//G~ 8, k = constante de Boltzmann f(kT/E,,) = funcin de choque dada por la figura 2.5 Los valores de r y e, como los listados en la tabla 2.2, pueden calcularse a partir de otras propiedades de los gases, como la viscosidad. Si es necesario, pueden calcularse empricamente para cada componenteI r = 1.18~~ & - = 1.2lT, k (2.38) (2.39)
en donde v = volumen mola1 del lquido en el punto de ebullicibn normal, rM/kmol (calculado de la tabla 2.3), y Tb = punto de ebullicin normal, K. Al utilizar la tabla 2.3, se suman las diferentes contribuciones de los tomos componentes. As, parael tolueno, CTHs, v = 7(0.0148) + 8(0.0037) - 0.015 = 0.1182. _
36
OPERACIONES
DE
0.2, 0.1
a2
0.4 0.6
1.0
&T 7
10
20
40 60
100
200
400
Figura 2.5 Funcin de choque para la difusibn .
La difusin a travks del aire, cuando los componentes del aire permanecen en proporciones fijas, se maneja como si el aire fuese una nica sustancia.
Ejemplo 2.3 Calcular la difusividad del vapor de etanol, C*HsOH (A), a travs del airea 1 atm de presin, OoC.
Tabla 2.2 Constantes de fuerza de gases determinadas a partir de .datos de viscosidad
Gas Aire CC14 CH,OH CH, co co* CJH, W,
C6H6
e/L, K 78.6 322.7 481.8 148.6 91.7 195.2 467 215.7 237.1 412.3 316
r> nm 0.3711 0.5947 0.3626 0.3758 0.3690 0.3941 0.4483 0.4443 0.5118 0.5349 0.4217
Gas HCI He HZ W
H2S
NH, NO
N2 N2O 4 so2
CI2
344.7 10.22 59.7 809.1 301.1 558.3 116.7 71.4 232.4 106.7 335.4
0.33-39 0.255 1 0327 0.2641 0.3623 0.2900 0.3492 0.3798 0.3828 0.3467 0.4112
t Tomado de: R.A. Svehla; NASA Tech. Rept. R-132, Lewis Research Center, Cleveland, Ohio, 1962.
DIFUSIN MOLECULAR EN FLUIDOS
37
Tabla 2.3
Volmenes atmicos y moleculares
Volumen molecular, m3/kmol x l@ HZ 4 NZ Aire co co2 so2 NO 14.3 25.6 31.2 29.9 30.7 34.0 44.8 23.6 36.4 Volumen atmico. m3/1000 Btomos x ld Volumen molecular m/kmol x ld
Volumen atmico, m3/1000 tomos X ld Carbn Hidr6geno Cloro Bromo Iodo Azfre Nitr6geno Nitrgeno en aminas primarias Nitrgeno en aminas secundarias 14.8 3.1 24.6 27.0 37.0 25.6 15.6 10.5 12.0
1.4 Oxgeno Oxgeno en esteres metlicos 9.1 Oxgeno es Meres superiores 11.0 Oxigeno en bcidos 12.0 9.9 Oxgeno en steres metlicos Oxgeno en esteres superiores II.0 Anillo benchico: restar 15 Anillo naftalnico: restar 30
NH,
H20 H2S
cos
cl,
Br2 12
25.8 18.9 32.9 51.5 48.4 53.2 71.5
SOLUCIN T = 273 K,p, = 101.3 kN/m, MA = 46.07, Ma = 29. De la tabla 2.2, para aire se tiene, EB/k = 78.6, ra = 0.3711 nm. Los valores para el etanol pueden calcularse mediante las ecuaciones (2.38) y (2.39). De l;a tabla 2.3, v,+ = 2(0.0148) + 6(0.0037) + 0.0074 = 0.0592, = 0.46 nm. El punto de ebullicin normal es Tb, A = 3.51.4 K mientras que rA = 1.18(0.0592) y&,/k = 1.21(351.4) = 425. ,
0.46 + 0.3711 = o 416 2 kT 273 -=- = 1.599 170.7 &AB r.4, = Figura 2.5 = 0.595 Ecuacin (2.37) D AB =
y-m - 170.7
= 0.237
10-4[ 1.084 - 0.249(0.237)](27332)(0.237) (101.3 x ld)(0.416)2(0.595)
= 1.05 X lOe5 m2/s El valor observado (tabla 2.1) es 1.02(10-) m2/s.
La ecucin (2.37) muestra que D vara como T32 (aun cuando se puede obtener una variacin ms correcta de la temperatura considerando tambin la funcin de choque de la figura 2.5) e inversamente con la. presibn, lo que sirve para presiones mayores de 1 500 kN/m2 (15 atm)tr9r. El coeficiente de autodifusion, o D, para un gas que se est difundiendo a travs de si mismo, ~610 puede determinarse experimentalmente mediante txxricas muy especiales que requieren, por ejemplo, de marcadores radiactivos. Puede ser calculado mediante la ecuacin (2.37), haciendo A = B.
You might also like
- Difusión de Etanol en AireDocument12 pagesDifusión de Etanol en AireFabiola Del Pilar CuroNo ratings yet
- Difusividad LiquidosDocument24 pagesDifusividad LiquidosChristian Cesar Alcantara Juarez100% (1)
- Conductividad Termica y Mecanismo de Transporte de EnergíaDocument4 pagesConductividad Termica y Mecanismo de Transporte de Energíamarizita1850% (2)
- Practica Difusividad Del EtanolDocument7 pagesPractica Difusividad Del Etanolbilly jack altamirano alayoNo ratings yet
- Contradifusion EquimolarDocument18 pagesContradifusion EquimolarjasminNo ratings yet
- DifusividadDocument4 pagesDifusividadMisaelEspinozaGarciaNo ratings yet
- 33, 34, 35Document29 pages33, 34, 35Adrian Vergara100% (1)
- Problema MasaDocument10 pagesProblema Masabetyor129100% (1)
- Practica 3 Caucho VulcanizadoDocument31 pagesPractica 3 Caucho VulcanizadoCamilo Andres Picon Prada100% (2)
- Fisica Cap 15 GiancoliDocument14 pagesFisica Cap 15 GiancoliPedro QuesadaNo ratings yet
- Ejercicio 2 - Chapman EnskogDocument3 pagesEjercicio 2 - Chapman EnskogJOSE ERAZO0% (1)
- 3a Difusividad Másica TablasDocument11 pages3a Difusividad Másica TablasBlas NoeNo ratings yet
- Tablas para Difusividades en Gases PDFDocument2 pagesTablas para Difusividades en Gases PDFArmando Aguilar100% (1)
- Transderencia de Masa .Ins .SilvDocument4 pagesTransderencia de Masa .Ins .Silvchelys88No ratings yet
- TP-2: "Empalmes Arco-Arco Usando Modos de Referencia A Entidades"Document19 pagesTP-2: "Empalmes Arco-Arco Usando Modos de Referencia A Entidades"lucio RNo ratings yet
- Volatilidad Cloroformo. AcetonaDocument3 pagesVolatilidad Cloroformo. AcetonaRaymundo Garcia GaliciaNo ratings yet
- Problemas de Transferencia de Materia y Aplicaciones de BalanceDocument44 pagesProblemas de Transferencia de Materia y Aplicaciones de BalanceVictor RuanaNo ratings yet
- Informe - Coeficiente de DifusividadDocument7 pagesInforme - Coeficiente de Difusividadsheilapd100% (1)
- Ejemplos de Fases Separadas Por Una MembranaDocument33 pagesEjemplos de Fases Separadas Por Una MembranaBrittNiveloNo ratings yet
- Contradifusion Equimolar PDFDocument8 pagesContradifusion Equimolar PDFKevin M. MoyaNo ratings yet
- Establecer El Perfil de ConcentracionesDocument6 pagesEstablecer El Perfil de ConcentracionesHernandezLuzNo ratings yet
- Practica Transferencia de Calor Conn AletasDocument13 pagesPractica Transferencia de Calor Conn AletasazucenaNo ratings yet
- Problemas DifusionDocument8 pagesProblemas DifusionJean Carlos Quispe SNo ratings yet
- Tarea IvDocument5 pagesTarea IvJULINHO CASTILLO BACONNo ratings yet
- 3 Difusividad MasicaDocument12 pages3 Difusividad MasicaJhonatan Huamani Ramos80% (5)
- IAII - 6 Ejercicios Difusion Molecular en LiquidosDocument6 pagesIAII - 6 Ejercicios Difusion Molecular en LiquidosJulio Tirado100% (1)
- Problemas DecantadoresDocument23 pagesProblemas DecantadoresJulio Castro50% (2)
- Ejercicios Transferencia de MasaDocument7 pagesEjercicios Transferencia de MasaAlexandre NavarreteNo ratings yet
- Aplicación Del Método de MickleyDocument7 pagesAplicación Del Método de MickleyAngy Milena Leira OrtizNo ratings yet
- Difusividad (Nuestro)Document15 pagesDifusividad (Nuestro)Nicolas Aristizabal HernandezNo ratings yet
- Equipo 1 y 4Document6 pagesEquipo 1 y 4Arturo Ortiz OlascoagaNo ratings yet
- Fenomenos de Transporte - Ley de Fourier - TCDocument9 pagesFenomenos de Transporte - Ley de Fourier - TCChristian Diaz100% (2)
- Transferencia de Calor Tablas de H y KDocument2 pagesTransferencia de Calor Tablas de H y KHenry Giovanny ProañoNo ratings yet
- Problemas Propuestos - Clase 09 - Conducción Paredes CompuestasDocument2 pagesProblemas Propuestos - Clase 09 - Conducción Paredes CompuestasJHOAN FERNANDEZNo ratings yet
- 6 TC Superficies Con Aletas (Corregido)Document4 pages6 TC Superficies Con Aletas (Corregido)Andres OrellanaNo ratings yet
- Lou Derrame de Líquidos - Lab08Document10 pagesLou Derrame de Líquidos - Lab08Evangeline Darius VanzzetiNo ratings yet
- 22.5 FoustDocument2 pages22.5 FoustMarco ChangNo ratings yet
- Difusión Transitoria de MasaDocument3 pagesDifusión Transitoria de MasaGerman Ruiz PortalNo ratings yet
- Problemario de ComsolDocument16 pagesProblemario de ComsolDiego_Segoviano19No ratings yet
- Difusividad Del Alcohol en AireDocument8 pagesDifusividad Del Alcohol en Aireliztdy100% (5)
- Tarea 2-OPU315Document4 pagesTarea 2-OPU315Mónica SolórzanoNo ratings yet
- INFORME Nº9 Difusividad de GasesDocument27 pagesINFORME Nº9 Difusividad de GasesTHALIA TAQUIA PORRAS100% (1)
- Teoría de La PelículaDocument2 pagesTeoría de La PelículaRose Roses100% (1)
- Intercambiador de Calor de Doble Tubo (GRUPO B) OficialDocument36 pagesIntercambiador de Calor de Doble Tubo (GRUPO B) OficialMIJAEL ROMANI TERBULLINONo ratings yet
- Desti Laci On Multi CompDocument6 pagesDesti Laci On Multi CompAdrianRodriguez0% (1)
- Apuntes Clases Transferencia MasaDocument55 pagesApuntes Clases Transferencia MasaCarolina TolozaNo ratings yet
- Examen IiDocument2 pagesExamen IiMayeli Vasquez RivasNo ratings yet
- Ecuación de Chapman-EnskogDocument6 pagesEcuación de Chapman-EnskogRuben DmgNo ratings yet
- Tabla Difusividad LiquidosDocument1 pageTabla Difusividad LiquidosJenifer NiñoNo ratings yet
- Tamiz Afnor FrancesaDocument1 pageTamiz Afnor FrancesaRAFAEL OCTAVIO SANCHEZNo ratings yet
- Coeficiente de DifusividadDocument11 pagesCoeficiente de DifusividadpattylopezlunaNo ratings yet
- Formulario SedimentacionDocument4 pagesFormulario SedimentacionKelly Evelyn TejadaNo ratings yet
- Fenómenos II - Taller de ClaseDocument3 pagesFenómenos II - Taller de ClaseDavid BaronNo ratings yet
- Ejercicio de Destilacion MulticomponenteDocument8 pagesEjercicio de Destilacion MulticomponenteJose Maria Flores Fernandez100% (1)
- Control de La Temperatura en Un CSTRDocument14 pagesControl de La Temperatura en Un CSTRClaudiaPalominoZelayaNo ratings yet
- Practica - DifusionDocument11 pagesPractica - DifusionTaurorex100% (1)
- 15 - Transporte de Masa en InterfaseDocument41 pages15 - Transporte de Masa en InterfaseMartina SolarNo ratings yet
- Tablas DifusividadDocument8 pagesTablas Difusividadedwar.quiintero11100% (1)
- ViscosidadDocument6 pagesViscosidadJS LuisNo ratings yet
- Tablas para Gases Ideales (Libro de Cengel) PDFDocument17 pagesTablas para Gases Ideales (Libro de Cengel) PDFPilar MayaNo ratings yet
- Cálculo EnergíaDocument26 pagesCálculo Energíaabel silvestre100% (2)
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Preinforme CauchoDocument7 pagesPreinforme CauchoCamilo Andres Picon PradaNo ratings yet
- Taller EstequiometriaDocument4 pagesTaller EstequiometriaCamilo Andres Picon PradaNo ratings yet
- Taller Razones y ProporcionesDocument3 pagesTaller Razones y ProporcionesCamilo Andres Picon PradaNo ratings yet
- Resumen Animales PonzoñososDocument6 pagesResumen Animales PonzoñososCamilo Andres Picon Prada100% (1)
- Alianzas ClaveDocument2 pagesAlianzas ClaveCamilo Andres Picon PradaNo ratings yet
- Exposicion DesarenadoresDocument28 pagesExposicion DesarenadoresCamilo Andres Picon PradaNo ratings yet
- Taller Numero y Masa AtomicaDocument3 pagesTaller Numero y Masa AtomicaCamilo Andres Picon PradaNo ratings yet
- Lazo Control PDFDocument362 pagesLazo Control PDFCamilo Andres Picon PradaNo ratings yet
- Física NuclearDocument4 pagesFísica NuclearFisi-k UnpNo ratings yet
- Aportes de Niels Bohr FernandoDocument5 pagesAportes de Niels Bohr FernandoElkin CastroNo ratings yet
- 3 Quimica 011Document40 pages3 Quimica 011Freddy Quispe CorahuaNo ratings yet
- Ejercicios de Hidrostática-Contreras Guerra, Rodrigo.Document5 pagesEjercicios de Hidrostática-Contreras Guerra, Rodrigo.Rodrigo GuerraNo ratings yet
- Montaña RusaDocument13 pagesMontaña RusaBrianVelezBlacioNo ratings yet
- CondensaciónDocument4 pagesCondensaciónOlgaRiosTiznadoNo ratings yet
- Tema Minería, Energía e IndustriaDocument17 pagesTema Minería, Energía e Industriarosi60% (5)
- Centro de MasasDocument10 pagesCentro de Masasbryamdv23No ratings yet
- El MovimientoDocument8 pagesEl MovimientoDiana GarcíaNo ratings yet
- Propuesta SolarDocument6 pagesPropuesta SolarJuanManuelOrtizNo ratings yet
- Teoria Atomica InformeDocument12 pagesTeoria Atomica InformeAlex Gerson Perez RojasNo ratings yet
- Calculo y Correccion Del Factor de PotenciaDocument4 pagesCalculo y Correccion Del Factor de PotenciaEisuke-Sama FujimaroNo ratings yet
- Campo Gravitatorio EjerciciosDocument2 pagesCampo Gravitatorio EjerciciosAna Belen GrañaNo ratings yet
- Capitulo v. Cinetica de Una Partícula. Trabajo - EnergiaDocument57 pagesCapitulo v. Cinetica de Una Partícula. Trabajo - EnergiaPariapaza Cuarite DarwinNo ratings yet
- Informe Gas PobreDocument18 pagesInforme Gas PobreCarlos CabanillasNo ratings yet
- Ley de Coulomb Ejercicios ResueltosDocument18 pagesLey de Coulomb Ejercicios ResueltosChechu TraboniNo ratings yet
- Tabla NuclidosDocument52 pagesTabla Nuclidosvear4040No ratings yet
- Energía EólicaDocument10 pagesEnergía EólicaNarda Cecilia Acosta HdzNo ratings yet
- Eficiencia Energética para Mejorar El Control de Uniformidad Del Pellet en La Extrusión de Alimentos AcuícolasDocument5 pagesEficiencia Energética para Mejorar El Control de Uniformidad Del Pellet en La Extrusión de Alimentos AcuícolasInternational AquafeedNo ratings yet
- Practica SecadoDocument13 pagesPractica SecadoEzbe PeñaNo ratings yet
- Fisicoquimica Problemas ResueltosDocument4 pagesFisicoquimica Problemas ResueltosCARLOSNo ratings yet
- Informe Del Sol - FrancoDocument11 pagesInforme Del Sol - FrancoCarlos IbarraNo ratings yet
- 3) Ejercicios Fisica - 1er - ByF - Daniel BDocument19 pages3) Ejercicios Fisica - 1er - ByF - Daniel BJhonatan CarriónNo ratings yet
- Primera Ley de La Termodinamica.Document12 pagesPrimera Ley de La Termodinamica.Rufo C MtzNo ratings yet
- Cantidad de Movimiento LinealDocument36 pagesCantidad de Movimiento LinealDilio Manuel Mendez NovoaNo ratings yet
- Cero Combustibles Fósiles para Las Islas Galápagos - V01 - Rev SEREE - 020616Document9 pagesCero Combustibles Fósiles para Las Islas Galápagos - V01 - Rev SEREE - 020616Jorge Guachimboza DávalosNo ratings yet
- Triptico de QuimicaDocument2 pagesTriptico de Quimicadaniel enrique inchicaqui gonzalesNo ratings yet
- Presentación Paneles Solares TecnologíaDocument8 pagesPresentación Paneles Solares Tecnologíacanoclara11No ratings yet