Professional Documents
Culture Documents
Estequiometria en Reacciones Quimicas y Compuestos Quimicos Hidratados
Uploaded by
Nelson StosOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Estequiometria en Reacciones Quimicas y Compuestos Quimicos Hidratados
Uploaded by
Nelson StosCopyright:
Available Formats
ESTEQUIOMETRIA EN REACCIONES QUIMICAS Y COMPUESTOS QUIMICOS HIDRATADOS
1. INTRODUCCIN El agua contenida en una gran diversidad de sales no solamente en agua en forma de humedad producto de una fenmeno de adsorcin superficial, sino que forma parte de su retculo, cristalino, o sea durante el proceso de obtencin o formacin de las mismas el agua participo activamente formando parte de su estructura qumica. 2. OBJETIVOS Que el alumno de determinar el nmero de moles de agua que contiene un mol de las sales estudiadas y establece la estructura qumica de las sales y relacionar sus caractersticas con los conocimientos tericos de la bibliografa. 3. MARCO TEORICO Una sal hidratada es tambin llamada hidrato y es en definitiva una combinacin de un compuesto y agua, una red cbica (cristal), en cuyo interior se encuentra una molcula de agua. Esta es liberada cuando el hidrato es sometido a alta temperatura, la red se rompe y deja escapar la molcula de agua producindose un cambio visible en el compuesto de la sustancia. En qumica inorgnica, los hidratos contienen molculas de agua que o bien estn ligadas a un ncleo metlico o estn cristalizadas con el complejo metlico. Tales hidratos se dice que poseen "agua de cristalizacin" o "agua de hidratacin. El mtodo ms general para determinar el agua de hidratacin de una sal es la separacin de dicha agua de hidratacin por evaporacin
DETERMINACIN DE LA FRMULA DE UNA SAL HIDRATADA:
Muchas sales cristalizadas procedentes de una solucin acuosa aparecen como perfectamente secas, aun cuando al ser calentadas producen grandes cantidades de agua. Los cristales cambian de forma, e incluso algunas veces, de color al quitarles el agua, indicando que el agua estaba presente como una parte integrante de la estructura cristalina. Tales compuestos se denominan hidratos. El nmero de moles de agua presentes por cada mol de sal anhidra es, generalmente, un nmero sencillo. En este experimento se encontrara el peso de agua perdido por calentamiento y la Cantidad de sal anhidra que queda. La razn ms simple entre los moles de sal anhidra y de agua se halla dividiendo los resultados anteriores entre la cantidad menor de estos valores. Con este valor se denomina la frmula del hidrato propuesto MATERIALES Y MTODOS: Materiales y equipos: Balanza analtica Mechero de bunsen Capsula de porcelana
Rejilla de amianto Tenaza Desecador
Reactivos: Sulfato de cobre Cloruro de bario Acetato de plomo Sulfato ferroso
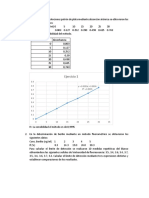
2g SO4Cu.H2O SO4Cu 2g--------------> 100% 1.245g--------->x% X=62.295%--> 100%-62.295%=37.705% de H2O se pierde al exponerlo al calor
Cu(NO3)2H2O Cu(NO3) 2g--------------> 100% 1.29g--------->x% X=62%--> 100%-62%=38% de H2O se pierde al exponerlo al calor
SO4Fe.H2O SO4Fe 2g--------------> 100% 1.83g--------->x% X=91.5%--> 100%-91.5%=8.5% de H2O se pierde al exponerlo al calor (CH3-COO)2 Pb + 2IK I2Pb + 2(CH3-COO)K Peso del acetato de plomo 325,2 gr Peso del I2Pb Peso Peso tubo seco 461,9 gr 5.4640gr 5.2148gr 0.2292gr
CUESTIONARIO
1. Por qu el crisol en varias ocasiones de la experiencia se coloca en el desecador y no se pesa directamente? Porque para tener un conteo exacto de la muestra a pesar se tiene que retirar toda la humedad existente por mnima que sea 2. Por qu se deben calentar las muestras con una lama de combustin completa?
De esa forma se utiliza el calor ms efectivamente 3. es adecuada la cantidad de muestra pesada o es ms adecuado utilizar 1g de muestra y economizar el resto? Justifique. Es ms adecuado utilizar los decimales en el pesado de una muestra porque as se obtiene un conteo ms exacto. 4. Qu utilidad tiene la experiencia desarrollada? Esta clase nos ha permitido aprender cmo se determina la cantidad proporcionada de un elemento, radical o compuesto presente en una muestra, eliminando todas las sustancias que interfieren y convirtiendo el constituyente o componente deseado en un compuesto de composicin definida, que sea susceptible de pesarse. La gravimetra es un mtodo analtico cuantitativo, es decir, que determina la cantidad de sustancia, midiendo el peso de la misma con una balanza analtica. 5. Cules son las fuentes de errores ms probables en esta experiencia? Los errores ms frecuentes en esta prctica son olvidarse de que los elementos a pesar posean las siguientes propiedades: Baja solubilidad Alta pureza al precipitar Alta filtrabilidad Composicin qumica definida al precipitar
You might also like
- Determinacion Del Porcentaje de Hidratacion de Un CompuestoDocument7 pagesDeterminacion Del Porcentaje de Hidratacion de Un CompuestoDaniel DazaNo ratings yet
- Conduccion Superficie MultipleDocument3 pagesConduccion Superficie MultipleJosselineNo ratings yet
- EJERCICIOS EXAMEN QUÍMICA INORGÁNICA 1ER PARCIAL - Revisión Del IntentoDocument8 pagesEJERCICIOS EXAMEN QUÍMICA INORGÁNICA 1ER PARCIAL - Revisión Del IntentoAdonny GeovannyNo ratings yet
- Informe III Preparacion de Metano Por Reduccion de CloroformoDocument3 pagesInforme III Preparacion de Metano Por Reduccion de CloroformoValentina Sanín RestrepoNo ratings yet
- Lab OrgánicaDocument10 pagesLab OrgánicaLPNo ratings yet
- Ejercicios de Equilibrio Químico en FisicoquímicaDocument3 pagesEjercicios de Equilibrio Químico en FisicoquímicaAnonymous 3WfZOPNo ratings yet
- EXAMEN QUÍMICA INORGÁNICA 1ER PARCIAL 27 Enero 2022 - Revisión Del IntentoDocument9 pagesEXAMEN QUÍMICA INORGÁNICA 1ER PARCIAL 27 Enero 2022 - Revisión Del IntentoAdonny GeovannyNo ratings yet
- Práctica 1. Preparación de SolucionesDocument5 pagesPráctica 1. Preparación de SolucionesCely RamirezNo ratings yet
- GD Soluciones (Resuelta)Document8 pagesGD Soluciones (Resuelta)Agustin Albeño100% (1)
- Taller 3Document8 pagesTaller 3Diana Marcela MartinezNo ratings yet
- Practica 5 Propiedades Coligativas 1Document7 pagesPractica 5 Propiedades Coligativas 1ampavase88% (8)
- Determinacion Gravimetrica de Cloro en Un Cloruro SolubleDocument6 pagesDeterminacion Gravimetrica de Cloro en Un Cloruro SolubleJuan GranadosNo ratings yet
- Gasto y Ecuación de ContinuidadDocument1 pageGasto y Ecuación de ContinuidadMario ManzoNo ratings yet
- Determinacion Del Porcentaje de Hidratacion de Un CompuestoDocument4 pagesDeterminacion Del Porcentaje de Hidratacion de Un Compuestoluis pino0% (2)
- Nitracion Triple DirectaDocument6 pagesNitracion Triple DirectaIsra De SegoviaNo ratings yet
- So Luci OnesDocument17 pagesSo Luci Oneselsaunachi100% (2)
- Guia de Ejercicios Propuestos para Segundo ParcialDocument3 pagesGuia de Ejercicios Propuestos para Segundo ParcialIsela Menjivar GuevaraNo ratings yet
- VOLUMETRIA DE NEUTRALIZACIÓN - Estudiantes PDFDocument8 pagesVOLUMETRIA DE NEUTRALIZACIÓN - Estudiantes PDFNNNNo ratings yet
- Taller #4 - 2020Document5 pagesTaller #4 - 2020Ana Arias Torres100% (1)
- Informe Reglas Del Laboratorio de Quimica AnaliticaDocument4 pagesInforme Reglas Del Laboratorio de Quimica AnaliticaAlicia AtupañaNo ratings yet
- Práctica N°5 Halogenación de ParafinasDocument14 pagesPráctica N°5 Halogenación de ParafinasDilan LeónNo ratings yet
- Ejercicio 1y 2 de CurvasDocument2 pagesEjercicio 1y 2 de CurvasNatasha VargasNo ratings yet
- Clase 5. INQ-111Document5 pagesClase 5. INQ-111Elvin V. MesaNo ratings yet
- Ejercicios Fisica-QuimicaDocument65 pagesEjercicios Fisica-QuimicaJenny EstrellaNo ratings yet
- Actividad 22Document7 pagesActividad 22Xavier VillonNo ratings yet
- Reporte de Practica DestilacionDocument8 pagesReporte de Practica DestilacionheberNo ratings yet
- Ejercicio 5Document5 pagesEjercicio 5David Vp KydNo ratings yet
- Aldehído-Cetona - 2,4-DNFH - NH2OH - Nitroprusiato NaDocument21 pagesAldehído-Cetona - 2,4-DNFH - NH2OH - Nitroprusiato NaBrenda MurilloNo ratings yet
- Nitracion de La AcetanilidaDocument13 pagesNitracion de La AcetanilidazanniazorzaNo ratings yet
- Taller 1 FisicaDocument4 pagesTaller 1 FisicaSofia DuranNo ratings yet
- Informe de Oxidacion de Aluminio Con Sulfato de CobreDocument16 pagesInforme de Oxidacion de Aluminio Con Sulfato de CobreCamilo JosueNo ratings yet
- Iq-Fisico QuimicaDocument9 pagesIq-Fisico QuimicaJordanFloresNo ratings yet
- Derivadas SucesivasDocument4 pagesDerivadas SucesivasGerardo Upqroo100% (1)
- Apellidos Nombrespractica 2Document7 pagesApellidos Nombrespractica 2PamelaNo ratings yet
- Tarea 2 Mezclas BinariasDocument3 pagesTarea 2 Mezclas BinariasElena C100% (1)
- Ejercicios Resueltos SolucionesDocument15 pagesEjercicios Resueltos Solucioneslos sabiosNo ratings yet
- Preguntas Practica 4Document3 pagesPreguntas Practica 4juan angel100% (1)
- Practica 1 QMC108Document2 pagesPractica 1 QMC108Jorge NavarroNo ratings yet
- Reporte 3. AnalíticaDocument8 pagesReporte 3. AnalíticaALAM DANIEL- HERNμNDEZ MALDONADONo ratings yet
- Taller de FQ-Amb-GasesDocument4 pagesTaller de FQ-Amb-GasesmaiNo ratings yet
- EJERCICIOSDocument22 pagesEJERCICIOSYORDI ALDAIR LAVADO FLORESNo ratings yet
- Taller # 1 - QA - UdeA - 02-2019Document7 pagesTaller # 1 - QA - UdeA - 02-2019CATALINA BUITRAGO OROZCONo ratings yet
- Equipo1 Practica2difusvidadliquidaDocument17 pagesEquipo1 Practica2difusvidadliquidaVaaLe GarciiaNo ratings yet
- 5.8.-Análisis de Textos Utilizando La Lectura Especificas Relacionadas Con Su EntornoDocument4 pages5.8.-Análisis de Textos Utilizando La Lectura Especificas Relacionadas Con Su EntornoValeria Escobar HernandezNo ratings yet
- Teoria y Cuestionario Laboratorio de Química Organica 2 Parte 1Document1 pageTeoria y Cuestionario Laboratorio de Química Organica 2 Parte 1Gerardo Rivera Espinioza100% (1)
- Marco Teorico de Peso ConstanteDocument2 pagesMarco Teorico de Peso ConstanteUlises GarciaNo ratings yet
- Expocicion de CircuitoDocument39 pagesExpocicion de CircuitoElihud li Palomino AroniNo ratings yet
- Informe Experimento #12 Equilibrio Sólido-LíquidoDocument8 pagesInforme Experimento #12 Equilibrio Sólido-LíquidoKatherineGarciaRiveraNo ratings yet
- Normas de Seguridad InformeDocument6 pagesNormas de Seguridad InformeFranyer MadariagaNo ratings yet
- Prcaticas de Laboratorio de QuimicaDocument5 pagesPrcaticas de Laboratorio de QuimicaClaudia ParisiNo ratings yet
- Determinación de SulfatosDocument3 pagesDeterminación de SulfatosBerenice PérezNo ratings yet
- Reporte de Lab - Práctica 4 - Brig 2 - Equipo 7 - IamDocument25 pagesReporte de Lab - Práctica 4 - Brig 2 - Equipo 7 - IamXimena RubioNo ratings yet
- Informe HidratosDocument11 pagesInforme HidratosJaneth Rosario Mamani Rivera100% (1)
- DETERMINACION DE LA FORMULA SAL HIDRATADA AwdadaiwdiuahdiuaDocument10 pagesDETERMINACION DE LA FORMULA SAL HIDRATADA Awdadaiwdiuahdiualuchitoman10No ratings yet
- Lab 4 AqDocument28 pagesLab 4 AqLeonel Ore CochacheNo ratings yet
- CristalizacionDocument15 pagesCristalizacionJoel Machaca GNo ratings yet
- Quimica LB4Document11 pagesQuimica LB4Sugawara KoshiNo ratings yet
- Calidad del agua para estudiantes de ciencias ambientalesFrom EverandCalidad del agua para estudiantes de ciencias ambientalesNo ratings yet
- Check BoxDocument31 pagesCheck BoxNelson StosNo ratings yet
- Repartija - ProyectosDocument1 pageRepartija - ProyectosNelson StosNo ratings yet
- 7.4 Control Del CostoDocument2 pages7.4 Control Del CostoNelson StosNo ratings yet
- Resultado de ObjetivosDocument2 pagesResultado de ObjetivosNelson StosNo ratings yet
- Cap 20002Document2 pagesCap 20002Nelson StosNo ratings yet
- 01 - Formas SocietariasDocument18 pages01 - Formas SocietariasNelson StosNo ratings yet
- Formato Pardo 1Document10 pagesFormato Pardo 1luisNo ratings yet
- 2016-II Desarrollo Caso PraìcticoDocument6 pages2016-II Desarrollo Caso PraìcticoNelson StosNo ratings yet
- 2016-II Praìctica EnunciadoDocument1 page2016-II Praìctica EnunciadoNelson StosNo ratings yet
- Estrategias para La Implantación de Tecnologías de La Informática EfectivasDocument2 pagesEstrategias para La Implantación de Tecnologías de La Informática EfectivasNelson StosNo ratings yet
- 2016-II Praìctica EnunciadoDocument1 page2016-II Praìctica EnunciadoNelson StosNo ratings yet
- Integracion 4.1-4.2Document3 pagesIntegracion 4.1-4.2Nelson StosNo ratings yet
- Lista de RequerimientosDocument1 pageLista de RequerimientosNelson StosNo ratings yet
- Informaciojbjbn FinancieraDocument10 pagesInformaciojbjbn FinancieraNelson StosNo ratings yet
- Silabo Final 2014-II Is - Vii CicloDocument37 pagesSilabo Final 2014-II Is - Vii CicloNelson StosNo ratings yet
- El Agua - Ionizacion Clase 2 - 2016-IDocument39 pagesEl Agua - Ionizacion Clase 2 - 2016-INelson StosNo ratings yet
- CU Buscar ClienteDocument5 pagesCU Buscar ClienteNelson StosNo ratings yet
- CU Emitir BoletaDocument5 pagesCU Emitir BoletaNelson StosNo ratings yet
- Modelo para FinalDocument2 pagesModelo para FinalNelson StosNo ratings yet
- Pre ParcialhvhvDocument4 pagesPre ParcialhvhvNelson StosNo ratings yet
- MatrizDocument3 pagesMatrizNelson StosNo ratings yet
- Horarios Ing. Sistemas 2015-IDocument146 pagesHorarios Ing. Sistemas 2015-INelson StosNo ratings yet
- Examenes OptiDocument7 pagesExamenes OptiNelson StosNo ratings yet
- Lab. 01 IsisDocument11 pagesLab. 01 IsisNelson StosNo ratings yet
- Pert CPMDocument23 pagesPert CPMclawdioNo ratings yet
- Importante Antes de InstalarDocument1 pageImportante Antes de InstalarCivil IngenieriaNo ratings yet
- Trabajo de Investigacion de Administracion 1Document2 pagesTrabajo de Investigacion de Administracion 1Nelson StosNo ratings yet
- Examenes OptiDocument7 pagesExamenes OptiNelson StosNo ratings yet
- FisicaDocument3 pagesFisicaNelson StosNo ratings yet
- Sintomas RelevantesDocument1 pageSintomas RelevantesNelson StosNo ratings yet
- FotoconductividadDocument4 pagesFotoconductividadMarlon A RamosNo ratings yet
- Liquido RefrigeranteDocument41 pagesLiquido RefrigeranteCristher DavidNo ratings yet
- Informe-PRÁCTICA 05-ReprogramadaDocument7 pagesInforme-PRÁCTICA 05-Reprogramadamarcelo pereyra ruizNo ratings yet
- Moldeo Por InyecciónDocument13 pagesMoldeo Por Inyecciónlduran_63No ratings yet
- Separata de Química GeneralDocument131 pagesSeparata de Química Generalesiooca100% (2)
- Soldadura OxiacetilénicaDocument12 pagesSoldadura OxiacetilénicaHipolito GarciaNo ratings yet
- Sesion 02 - FACTORES EXTERNOS QUE INFLUYEN EN EL CRECIMIENTO DE LAS PLANTASDocument20 pagesSesion 02 - FACTORES EXTERNOS QUE INFLUYEN EN EL CRECIMIENTO DE LAS PLANTASomar.cubas.123No ratings yet
- Materiales Radiográficos. 2.Document8 pagesMateriales Radiográficos. 2.Mishell CevallosNo ratings yet
- Condensadores Helicoidales ResumenDocument11 pagesCondensadores Helicoidales ResumenSantiago Xavier100% (1)
- PT-OPCN-04 Rev-2 Carguío y TronaduraDocument11 pagesPT-OPCN-04 Rev-2 Carguío y TronaduraJavierCruzNo ratings yet
- TRABAJO PRÁCTICO Diagrama de FasesDocument9 pagesTRABAJO PRÁCTICO Diagrama de FasesRodriguezAnibalAdrianNo ratings yet
- Semana 12 - Concentracion Por FlotacionDocument33 pagesSemana 12 - Concentracion Por FlotacionLarry Mamani LinaresNo ratings yet
- Tecnologia de Los JetsDocument27 pagesTecnologia de Los JetsGlaysmar RamosNo ratings yet
- Tarea 3Document11 pagesTarea 3karenNo ratings yet
- Briones - Taller BusquedaDocument2 pagesBriones - Taller BusquedaArelly BrionesNo ratings yet
- Gramaje Recetario - Radhíka RodríguezDocument3 pagesGramaje Recetario - Radhíka RodríguezRadhika RodriguezNo ratings yet
- VÍAS DE PENETRACIÓN 08 - 03 - 2017. FORMAS TÓPICAS Piel ASPECTOS BIOFARMACÉUTICOSDocument11 pagesVÍAS DE PENETRACIÓN 08 - 03 - 2017. FORMAS TÓPICAS Piel ASPECTOS BIOFARMACÉUTICOSFlor MartinezNo ratings yet
- LAB.N°01 Tension SuperficialDocument18 pagesLAB.N°01 Tension SuperficialLeidy Angelica MenaNo ratings yet
- Operación UnitariaDocument2 pagesOperación UnitariaStefany FlorezNo ratings yet
- Absorción de Vitaminas Hidrosolubles.Document21 pagesAbsorción de Vitaminas Hidrosolubles.Marissa AlvarezNo ratings yet
- NFPA 15 Exposicion - Oscar HerediaDocument26 pagesNFPA 15 Exposicion - Oscar HerediaIan As100% (1)
- T2.PEÑA - LEONARDO, Elect - LeyFarad.Document5 pagesT2.PEÑA - LEONARDO, Elect - LeyFarad.Leonardo Peña FabilaNo ratings yet
- Informe 4 de Laboratorio de Fisica 2Document17 pagesInforme 4 de Laboratorio de Fisica 2Cristhian OrdoñezNo ratings yet
- 2 Practica Calificada de PrototipoDocument4 pages2 Practica Calificada de PrototipoAnthonyJulcaVeraNo ratings yet
- Tabla de Productos QuimicosDocument3 pagesTabla de Productos Quimicosbriggith rubioNo ratings yet
- Norma Técnica NTP 205.038 Peruana 1975 (Revisada El 2016) : 2016-07-21 1 EdiciónDocument9 pagesNorma Técnica NTP 205.038 Peruana 1975 (Revisada El 2016) : 2016-07-21 1 EdiciónLorena RafaelNo ratings yet
- Taller Recuperación de Química Noveno.Document2 pagesTaller Recuperación de Química Noveno.Yuli Paola RondonNo ratings yet
- NITRACIONDocument4 pagesNITRACIONCarlos F. López H.No ratings yet
- Informe 11Document18 pagesInforme 11Liz Gutierrez OriundoNo ratings yet
- Nieve Artificial Experimento de QuimicaDocument3 pagesNieve Artificial Experimento de QuimicaJonathan Rocha Ruiz100% (1)