Professional Documents
Culture Documents
PH, Equilibrio Acido Base.
Uploaded by
Gerald D. FrizOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
PH, Equilibrio Acido Base.
Uploaded by
Gerald D. FrizCopyright:
Available Formats
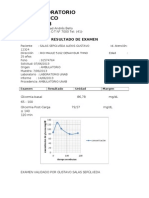
Equilibrio Acido-base, Gases sanguneo *Oxigeno + Metal= Oxido alcalino; Oxigeno + No Metlico= Oxido acido El Gasmetro determina presin
de gases que hay en la sangre, como la del CO2 y O2. Las relaciona con el pH sanguneo. La importancia que tiene la medicin de pH sanguneo y los gases es que podemos tener una visin importante del estado fisiolgico del paciente y porque hay actividades dependientes de enzimas que se realizan a este pH fisiolgico, hay un rango en donde la enzima trabaja bien puesto que con el cambio de pH hay cambios conformacionales que pueden o no afectar el sitio activo de la enzima. Un sistema en equilibrio, cuando es sometido a algn tipo de estrs resultante de un cambio de temperatura, presin o concentracin, y que causa una perturbacin en el equilibrio, ajustar su posicin de equilibrio para liberarse del estrs y reestablecer el equilibrio. Principio de Le Chatelier. *Estamos en equilibrio porque las cargas positivas y las negativas estn en equilibrio *Los valores de referencia de pH vara entre 7.35 7.45. *Rango compatible con la vida: 6.8 7.8 Fuentes generadoras de H cidos voltiles (CO2): 12 20 mil mmol/da cidos fijo (no voltiles): exgena (dieta), metabolismo endgeno cidos inorgnicos cidos orgnicos: cido lctico, en sepsis cuando hay hipoxia importante hay cido lctico. Cuando hay bacteria en sangre la septicemia hay formacin de acido lactico
Manejo de carga cida diaria Tamponamiento qumico (intra y extracelular) Compensacin respiratoria Manejo renal de bicarbonato
Mecanismos que mantienen el pH Buffers qumicos (prot. plasmticas hemoglobina), fosfato, bicarbonato adems de ser buffer quimico podemos regular su concentracin mediante el S.R y el S.R teniendo un sistema abierto de regulacin de bicarbonato) Sistema respiratorio: ventilacin pulmonar (CO2) Rin: Secrecin renal y reabsorcin de bicarbonato
Primera lnea de defensa Es instantneo Minimiza pero no previene cada de pH
Solucin tampn o amortiguador: mezcla de un acido dbil con su base conjugada ( o viceversa). Resiste cambios de pH HCO3 pK: 6.1 presente en grandes cantidades sistema abierto sistema respiratorio y renal actan como sistema de buffers mas importante buffer ECF (fluido extracelular)
La ecuacin de Henderson Hasselbach cido carbnico H + HCO3 Una de las enzimas ms abundantes en el cuerpo es la anhidrasa carbnica y es la que toma el agua con el CO2 para formar este cido carbnico, el cual se disocia rpidamente en protones y bicarbonato. La forma de eliminacin del CO2 del organismo es principalmente en forma de bicarbonato para poder viajar a travs de la sangre y una vez en los pulmones se elimina como CO2 (tambin se libera agua). *pH: pKa + log [HCO3-/H2CO3] = 6.1 + log [HCO3-/H2CO3]. Esta ecuacin proviene de la ecuacin original (arriba). Cationes: Na+, K+, Ca+2, otros. Aniones: Cl-, HCO3-, protenas, aniones orgnicos, sulfato, fosfato, etc.
You might also like
- Puntos Zona 11, 22 y 33Document67 pagesPuntos Zona 11, 22 y 33Gerald D. FrizNo ratings yet
- Ira AltaDocument54 pagesIra AltaGuillermo AbarcaNo ratings yet
- 101 Enfermedades Tratadas Con Acupuntura y MoxibustionDocument245 pages101 Enfermedades Tratadas Con Acupuntura y MoxibustionVictoria Dinata100% (13)
- Puntos Zona 44Document26 pagesPuntos Zona 44Gerald D. FrizNo ratings yet
- Guía HomovegetusDocument76 pagesGuía HomovegetusGerald D. FrizNo ratings yet
- Control de Calidad Interno Resistencia Inducible A ClindamicinaDocument1 pageControl de Calidad Interno Resistencia Inducible A ClindamicinaGerald D. FrizNo ratings yet
- Guiía de Estilo para El Uso de Palabras de Origen ChinoDocument134 pagesGuiía de Estilo para El Uso de Palabras de Origen ChinoGerald D. FrizNo ratings yet
- Zona DT y VTDocument51 pagesZona DT y VTGerald D. FrizNo ratings yet
- basico1和inicial的语法-gramatica de inicial y basico1Document12 pagesbasico1和inicial的语法-gramatica de inicial y basico1Gerald D. FrizNo ratings yet
- Verbo To BeDocument2 pagesVerbo To BeGerald D. FrizNo ratings yet
- Mecanismos de Resistencia en Pseudomonas Aeruginosa PDFDocument8 pagesMecanismos de Resistencia en Pseudomonas Aeruginosa PDFGerald D. FrizNo ratings yet
- 2.2 DistribucionDocument1 page2.2 DistribucionGerald D. FrizNo ratings yet
- The Concept of Image in Chinese MedicineDocument5 pagesThe Concept of Image in Chinese MedicineGerald D. FrizNo ratings yet
- Consentimiento Informado Puntos ComandoDocument2 pagesConsentimiento Informado Puntos ComandoGerald D. FrizNo ratings yet
- Dolor QuemadurasDocument6 pagesDolor QuemadurasGerald D. FrizNo ratings yet
- Poblacion Total Por Genero y Grupo EtarioDocument1 pagePoblacion Total Por Genero y Grupo EtarioGerald D. FrizNo ratings yet
- Propiedades Semilla de ChíaDocument6 pagesPropiedades Semilla de ChíaGerald D. FrizNo ratings yet
- Receptor Farmacologico (Primera Clase PDFDocument9 pagesReceptor Farmacologico (Primera Clase PDFGerald D. Friz0% (1)
- Ex TPGOcurvDocument2 pagesEx TPGOcurvGerald D. FrizNo ratings yet
- Generalidades Del Sistema InmuneDocument3 pagesGeneralidades Del Sistema InmuneGerald D. FrizNo ratings yet
- 3 Biotransformacion y ExcrecionDocument6 pages3 Biotransformacion y ExcrecionGerald D. FrizNo ratings yet
- 2.1 Absorcion y Vias de AdministracionDocument7 pages2.1 Absorcion y Vias de AdministracionGerald D. FrizNo ratings yet
- Generalidades Protozoos y Amebas ComensalesDocument3 pagesGeneralidades Protozoos y Amebas ComensalesGerald D. FrizNo ratings yet
- Genética de Obesidad..Document12 pagesGenética de Obesidad..Gerald D. FrizNo ratings yet
- Teoria de Los 5 ElementosDocument18 pagesTeoria de Los 5 Elementosmsomaza86% (22)
- Teoria de Los 5 ElementosDocument18 pagesTeoria de Los 5 Elementosmsomaza86% (22)
- Dolor de Hombros PuntosDocument1 pageDolor de Hombros PuntosMarco David OrtizNo ratings yet
- Relación de Compresión y CilindradaDocument17 pagesRelación de Compresión y CilindradaCristian Ralph Lizana RiveraNo ratings yet
- Reporte. Práctica 4. Berenice Gómez Rangel.Document2 pagesReporte. Práctica 4. Berenice Gómez Rangel.Berenice Gómez RangelNo ratings yet
- Pruebas PVTDocument2 pagesPruebas PVTDavid J. Montaño SilvaNo ratings yet
- Agitador PDFDocument122 pagesAgitador PDFjoaquin torrano veraNo ratings yet
- Métodos de Análisis de La Calidad de La LecheDocument87 pagesMétodos de Análisis de La Calidad de La Lechejonathan80% (5)
- Unidad 1 Tarea 2 Identificar Peligros EléctricosDocument7 pagesUnidad 1 Tarea 2 Identificar Peligros Eléctricosvalentina lopera betancurNo ratings yet
- FDS Agua para BateríaDocument5 pagesFDS Agua para BateríaAliomar VillabónNo ratings yet
- Determinación experimental de viscosidad y densidadDocument16 pagesDeterminación experimental de viscosidad y densidadbryanNo ratings yet
- Tacito 666Document9 pagesTacito 666Hugo Tapia PandiaNo ratings yet
- 30 Reacciones Químicas de La Vida Cotidiana - LifederDocument9 pages30 Reacciones Químicas de La Vida Cotidiana - LifederMarvin Ramírez Alvarez100% (1)
- Energia Especifica y Resalto HidraulicoDocument11 pagesEnergia Especifica y Resalto Hidraulicodsgonzalez59 dsgonzalez59No ratings yet
- Vida Util TemperaturaDocument336 pagesVida Util TemperaturaOrlandoNo ratings yet
- SOLUCIONARIO Estructuras Del Vehiculo - 2016Document69 pagesSOLUCIONARIO Estructuras Del Vehiculo - 2016Jose de Miguel63% (59)
- Entrega FinalDocument11 pagesEntrega FinalLorena VillotaNo ratings yet
- Taller Respiracion 1Document4 pagesTaller Respiracion 1javier_flores_3No ratings yet
- Componentes de Un AbsorbedorDocument6 pagesComponentes de Un AbsorbedorAnonymous wornYxFqNo ratings yet
- TP Electricidad Fisicoquímica 3Document3 pagesTP Electricidad Fisicoquímica 3Viviana MorettiNo ratings yet
- Libro de Fisica 10ºDocument73 pagesLibro de Fisica 10ºorlandoNo ratings yet
- Aplicaciones Industriales de La Química OrgánicaDocument9 pagesAplicaciones Industriales de La Química OrgánicaMiriam TenecotaNo ratings yet
- Estudio Del Comportamiento Químico de Los Elementos Boro y AluminioDocument10 pagesEstudio Del Comportamiento Químico de Los Elementos Boro y AluminioJorge RosalesNo ratings yet
- Fuerzas Sobre Superficies Planas15Document18 pagesFuerzas Sobre Superficies Planas15JavierSamakNo ratings yet
- Induccion12 PDFDocument4 pagesInduccion12 PDFLuis Carlos ValverdeNo ratings yet
- Cual Es La Diferencia Entre Densidad y Peso Especifico Cuales Son Las Unidades de Mediciòn de EstasDocument4 pagesCual Es La Diferencia Entre Densidad y Peso Especifico Cuales Son Las Unidades de Mediciòn de EstasJose Vilchez Chumo89% (9)
- Efecto Y Consideracion de Pandeo en Diseño: Norma Europea de HºaºDocument13 pagesEfecto Y Consideracion de Pandeo en Diseño: Norma Europea de HºaºFernandaNo ratings yet
- Choques en Dos DimensionesDocument7 pagesChoques en Dos DimensioneskelvinNo ratings yet
- EsIa sdIIDocument76 pagesEsIa sdIIAnonymous pCIauPOGNo ratings yet
- Tema 3. Campo GravitatorioDocument3 pagesTema 3. Campo Gravitatoriopaula alvarezNo ratings yet
- Ramirez Etal 2017 ConsumoAguaCultivo SEBALDocument11 pagesRamirez Etal 2017 ConsumoAguaCultivo SEBALGustavo Cabello VerrugioNo ratings yet
- Cálculos Básicos Cementación TR SDocument7 pagesCálculos Básicos Cementación TR SJuan Antonio MazaNo ratings yet
- Tarea 3Document4 pagesTarea 3Nicolás TensaNo ratings yet