Professional Documents
Culture Documents
Enlace Quimico
Uploaded by
Germán BissónOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Enlace Quimico
Uploaded by
Germán BissónCopyright:
Available Formats
Tema 3
Enlace qumico
Tema 3 Enlace qumico
Concepto de enlace qumico Por qu se unen los tomos? En la naturaleza existen sustancias, como los gases nobles (algunos se encuentran en el aire) y el mercurio, que estn constituidos por tomos aislados. Pero en general, los tomos estn fuertemente ligados unos con otros, y pueden ser del mismo tipo o pertenecer a distintos elementos. Los tomos se unen para buscar una mayor estabilidad o, lo que es lo mismo, un estado de mnima energa, y con esto consiguen que la energa de la molcula formada es menor que las energas de los tomos aislados (la ley del mnimo esfuerzo). La formacin de un enlace qumico siempre va acompaada por un desprendimiento de energa. El enlace qumico es la unin entre tomos, molculas o iones que originan estructuras ms complejas y ms estables que los tomos o molculas de partida, as como las interacciones que mantienen unidos a los tomos para formar una agrupacin ms estable. Estos compuestos se forman o se rompen en las reacciones qumicas. El enlace qumico estudia los distintos tipos de enlace y sus caractersticas, la geometra (forma) de las molculas y las interacciones entre las molculas (fuerzas que unen los tomos). Estas uniones son de naturaleza elctrica: son un conjunto de atracciones y repulsiones entre el ncleo y la corteza de los tomos que interaccionan. Los qumicos descubrieron que el enlace qumico est relacionado con la estructura electrnica de los tomos y en el enlace qumico juega un papel decisivo la configuracin electrnica del nivel ms externo de los tomos, llamado nivel de valencia. o Los gases nobles presentan la configuracin electrnica de mayor estabilidad, pues su nivel de valencia est ocupado por completo por el mayor nmero de electrones posible (tienen 8 electrones en el ltimo nivel). Es por esto, que los gases nobles no se unan con otros tomos. o Los dems elementos tienen su nivel de valencia incompleto y de ah su mayor o menor reactividad (facilidad para unirse a otros tomos). Los tomos tienden a tener la configuracin electrnica del gas noble ms cercano bien, cediendo, captando o compartiendo electrones para que en el ltimo nivel haya 8 electrones. Esta tendencia general se llama regla del octeto. 1
Tema 3
Enlace qumico
Enlace inico: concepto y propiedades
Los elementos situados en la parte izquierda de la tabla peridica (metales) poseen muy pocos electrones en el nivel externo y tienden a cederlos para conseguir una estructura estable (de gas noble).1
Los elementos situados en la parte derecha de la tabla peridica (no metales) tienen casi completo el nivel ms externo y tienden a capturar los electrones que le faltan para conseguir una estructura estable (de gas noble).2
El enlace inico se forma cuando se encuentran un elemento de los ms metlicos (muy electropositivo) con otro de carcter muy no metlico (muy electronegativo), es decir, dos elementos de electronegatividades muy diferentes (uno metlico con uno no metlico). Se forma con un elemento de la parte izquierda de la tabla con uno de la derecha.
Cuando se encuentran dos elementos de electronegatividades muy diferentes, se produce una transferencia de uno o varios electrones del tomo del metal al no metal, con lo que se forman los iones de los respectivos elementos: el positivo o catin y el negativo o anin, quedando unidos por atraccin electrosttica. La sustancia inica caracterstica es la sal comn, NaCl.
Se llama electrovalencia o valencia inica de un elemento al nmero de electrones que suele ganar o perder dicho elemento para formar sus iones.
Los compuestos inicos, no son verdaderas molculas formadas por los iones que la componen, sino que forman una red tridimensional (cristal elctricamente neutro), llamada cristal inico, y a temperatura ambiente son slidos.
Las propiedades de los compuestos inicos son: o Conductividad elctrica: los compuestos inicos tienen una conductividad elctrica nula pues sus iones carecen de dinamismo, pero los compuestos inicos conducen la corriente elctrica cuando se encuentran disueltos, ya que en caso existen iones libres. o Punto de fusin y de ebullicin: los puntos de fusin y de ebullicin son elevados. o Dureza3: para rayar un compuesto inico habr que romper enlaces y como stos son fuertes, los compuestos inicos presentan mucha dureza. En cambio, son muy frgiles.
1 2
Los metales tienen una energa de ionizacin muy baja, por lo que es fcil arrancarles un electrn. Los no metales tienen una afinidad electrnica muy alta, por lo que es muy fcil que capten un electrn. 3 La dureza es la resistencia que presentan los cuerpos a ser rayados.
Tema 3
Enlace qumico
o Solubilidad: los compuestos inicos se disuelven fcilmente en disolventes polares, como el agua (los disolventes polares se llaman as porque sus molculas presentan dos polos elctricos, uno positivo y otro negativo), pero poco solubles en disolventes apolares.
Enlace covalente: concepto y propiedades
El enlace covalente se produce entre tomos de no metales (situados a la derecha del Sistema Peridico) y tambin entre el hidrgeno y los no metales. Este enlace se logra mediante la comparticin de uno o ms pares de electrones del ltimo nivel por cada uno de los tomos que forman la molcula y segn Lewis, comparten tantos pares de electrones hasta alcanzar la estructura de gas noble (regla del octeto). La sustancia covalente ms caracterstica es el agua. Tambin son enlaces covalentes H2, O2 y N2.
Cuando comparten ms de un par de electrones, se llama enlace covalente mltiple y dota a las molculas de una mayor estabilidad que a las del enlace sencillo.
El enlace covalente se representa mediante los diagramas de Lewis. Para realizar este diagrama, se utiliza el smbolo del elemento rodeado de tantos puntos como electrones de valencia posea.
Si los tomos que se unen son iguales, los electrones son compartidos de forma equilibrada y no se crean polos elctricos. El enlace covalente es apolar.
Si los tomos que se unen no son iguales, los electrones pueden no ser compartidos de forma equilibrada y se crean polos elctricos. El enlace covalente es polar. El tomo que ms atrae al par o pares de electrones del enlace queda con un exceso de carga negativa y el tomo que menos atrae a los electrones queda con un defecto de carga negativa. Se crean de esta forma dos polos elctricos, uno con carga positiva y otro con carga negativa y al conjunto as formado se denomina dipolo elctrico.
Tema 3
Enlace qumico
La electronegatividad de cada elemento nos permite predecir si un enlace covalente es polar o apolar. Si los tomos tienen electronegatividades similares, el enlace es apolar; pero si existe una apreciable diferencia de electronegatividad, el enlace es polar.
Los compuestos covalentes pueden presentarse como sustancias moleculares, en la que los tomos estn asociados formando molculas unidas entre s, o cristales covalentes, en la que los tomos se enlazan para formar una red tridimensional.
Las propiedades de los compuestos covalentes son: o Conductividad elctrica: son malos conductores de la electricidad (se utilizan como aislantes). o Temperaturas de fusin y ebullicin : las sustancias moleculares tienen temperaturas de fusin y de ebullicin bajos, pero los cristales covalentes tienen temperaturas de fusin y de ebullicin muy altas, algunas son las ms altas que existen. o Dureza: son muy duros. o Solubilidad: son insolubles tanto en disolventes polares como apolares
Tema 3
Enlace qumico
Fuerzas de interaccin entre molculas. Enlace de hidrgeno
Las fuerzas intermoleculares son las fuerzas que mantienen unidas las molculas de las distintas sustancias. Son de tipo electrosttico y son muy dbiles.
Enlace de hidrgeno o puente de hidrgeno o Son fuerzas intermoleculares muy dbiles de tipo electrosttico que se establece entre el hidrgeno y tomos muy electronegativos (elementos de la parte derecha de la tabla), como son el oxgeno, nitrgeno y flor. o Al estar unido el tomo de hidrgeno con un elemento muy electronegativo, el par de electrones compartido est muy atrado por ste, por lo que queda el hidrgeno casi desposedo de la carga elctrica negativa, por cuya razn puede formar un enlace (puente de hidrgeno) con el tomo muy electronegativo de otra molcula prxima. o Un ejemplo de enlaces por puente de hidrgeno lo constituye el agua; las fuerzas atractivas entre los tomos de hidrgeno y los tomos de oxgeno de las molculas contiguas son las causantes de que se mantengan unidas sus molculas.
Fuerzas de Van der Waals o Son fuerzas intermoleculares, muy dbiles, de tipo electrosttico, cuya accin permite que ciertas sustancias se manifiesten en estado slido o lquido. o En el caso de molculas polares, las atracciones electrostticas entre polos de signos contrarios correspondientes a molculas vecinas permiten que se mantengan unidas. o En el caso de molculas apolares, durante un pequesimo instante, por vibraciones de las masas electrnicas, la distribucin de cargas de la molcula puede variar, transformndose sta en un dipolo instantneo; al instante siguiente estos dipolos dejan de existir, pero por razones anlogas puede formarse otro o producirse un dipolo inducido por una molcula vecina. Al formarse dipolos, ya sean instantneos o inducidos, entre las molculas se estn produciendo atracciones de tipo electrosttico, que las mantiene unidas. o Las fuerzas de Van der Waals entre molculas polares son ms fuertes que entre molculas apolares.
You might also like
- 1 Norma API 6A IntroduccionDocument48 pages1 Norma API 6A IntroduccionCelia AlejandraNo ratings yet
- Capacitacion Gases Msa Altair 5X JP PDFDocument49 pagesCapacitacion Gases Msa Altair 5X JP PDFoscarfonce100% (1)
- Aparicio - Victor - La Caída Del Petróleo - Foro y Entrega.Document4 pagesAparicio - Victor - La Caída Del Petróleo - Foro y Entrega.victor lopez100% (1)
- Manual STRDocument122 pagesManual STRPrensa Local0% (1)
- Pets Fls Mol14mantenimientodezarandavibratoriarev0 180811134200Document29 pagesPets Fls Mol14mantenimientodezarandavibratoriarev0 180811134200Luis SumireNo ratings yet
- Análisis Del Comic y de La Pelicula Sin CityDocument3 pagesAnálisis Del Comic y de La Pelicula Sin CityGermán BissónNo ratings yet
- Obtención de Imágenes A Través de Un TCDocument8 pagesObtención de Imágenes A Través de Un TCGermán BissónNo ratings yet
- Estudios Especiales en RXDocument8 pagesEstudios Especiales en RXOsbaldo SanchezNo ratings yet
- LG l5 II E460 ManualDocument152 pagesLG l5 II E460 ManualGermán BissónNo ratings yet
- Peliculas Radiograficas.-LaboratorioDocument17 pagesPeliculas Radiograficas.-LaboratorioGermán BissónNo ratings yet
- Esta Di SticaDocument1 pageEsta Di SticaGermán BissónNo ratings yet
- RayosxDocument12 pagesRayosxJose PNo ratings yet
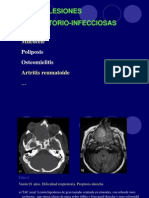
- Clivus. Lesiones InflamatorioinfecciosasDocument5 pagesClivus. Lesiones InflamatorioinfecciosasGermán BissónNo ratings yet
- Las Fuerzas IntermolecularesDocument2 pagesLas Fuerzas IntermolecularesGermán BissónNo ratings yet
- Notacion Exponencial PDFDocument12 pagesNotacion Exponencial PDFDeyvis AlfaroNo ratings yet
- Producción Rayos XDocument7 pagesProducción Rayos XOscar DurangoNo ratings yet
- Serie de Ej. 2 ReactoresDocument9 pagesSerie de Ej. 2 ReactoresIlae RuizNo ratings yet
- Bocatoma La TrancaDocument5 pagesBocatoma La TrancaTiendas Bata TacnaNo ratings yet
- Informe21 Moposita Yanez SanipatinDocument21 pagesInforme21 Moposita Yanez SanipatinLuisRobertoNo ratings yet
- Catastro de Centrales y Proyectos Energeticos 2012 CAP 3Document146 pagesCatastro de Centrales y Proyectos Energeticos 2012 CAP 3sirphantomNo ratings yet
- Peines o EncuelladeroDocument2 pagesPeines o EncuelladeroIngeniero Angeles Miranda BustamanteNo ratings yet
- Normativa y sugerencias bancariasDocument20 pagesNormativa y sugerencias bancariasPÉREZ HERNÁNDEZ XIMENANo ratings yet
- Catálogo Luminarias de Emergencia 2014Document7 pagesCatálogo Luminarias de Emergencia 2014noel antonio RamosNo ratings yet
- Tippens Fisica 7e Diapositivas 38bDocument23 pagesTippens Fisica 7e Diapositivas 38bCENVIM UNSCH CEMROBNo ratings yet
- Inspeccion y Pruebas de Los Sistemas de Rociadores AutomaticosDocument4 pagesInspeccion y Pruebas de Los Sistemas de Rociadores AutomaticosJosé ArgüelloNo ratings yet
- 31060Document108 pages31060María PérezNo ratings yet
- Manualf3s WespañolDocument46 pagesManualf3s WespañolJuan David AriasNo ratings yet
- La Física InútilDocument2 pagesLa Física InútilMarco Antonio Badillo BalderasNo ratings yet
- Selección Fusibles KDocument23 pagesSelección Fusibles KJavier Ramírez VeraNo ratings yet
- Mapas de Riesgos (Antigua) 1.1Document1 pageMapas de Riesgos (Antigua) 1.1Pedro mendozaNo ratings yet
- Plan Estrategico ATUDocument63 pagesPlan Estrategico ATULady ParedesNo ratings yet
- Normas FEDE - Capitulo 6 PDFDocument20 pagesNormas FEDE - Capitulo 6 PDFPablo GutierrezNo ratings yet
- Laboratorio 1 Fisicoquimica - Entalpia de ReaccionDocument15 pagesLaboratorio 1 Fisicoquimica - Entalpia de Reaccionyerson mendoza roblesNo ratings yet
- ENSAYO Expropiacion PetroleraDocument2 pagesENSAYO Expropiacion PetroleraJuan Roman Rodriguez GarciaNo ratings yet
- Ingenieria GeotecnicaDocument35 pagesIngenieria GeotecnicaEmerson SGNo ratings yet
- Medición de caudal y selección de tubería en MCH PisacDocument8 pagesMedición de caudal y selección de tubería en MCH Pisacelvis pedrazaNo ratings yet
- Manual de Usuario Ats Hidro PelletDocument19 pagesManual de Usuario Ats Hidro Pelletproduccion -100% (1)
- Pasos para Embobinar Un MotorDocument5 pagesPasos para Embobinar Un MotorLorenzo TzocNo ratings yet
- 1er Examen de EdafologiaDocument3 pages1er Examen de EdafologiaRaul Garcia Candia100% (1)
- Geologia Del Petroleo 1Document27 pagesGeologia Del Petroleo 1Mauri JaldinNo ratings yet
- Recursos no renovables Vaca MuertaDocument12 pagesRecursos no renovables Vaca MuertaValentina TamboriniNo ratings yet