Professional Documents
Culture Documents
Cinética Enzimática, Reporte
Uploaded by
Heriberto AngelesOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Cinética Enzimática, Reporte
Uploaded by
Heriberto AngelesCopyright:
Available Formats
UNIVERSIDAD NACIONAL AUTNOMA DE MXICO.
FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLAN.
LABORATORIO DE BIOQUMICA ESTRUCTURAL.
INFORME EXPERIMENTAL DE LA CINETICA ENZIMATICA DE LA UREASA.
CARMONA BARAJAS ANGEL. PEREZ ALCALA ESTHER. LOPEZ ARTEAGA FERNANDO. GRUPO: 1603 07 DE NOVIEMBRE DEL 2007.
EQUIPO 1.
Cintica enzimtica de la ureasa. Introduccin. Las enzimas son los catalizadores que determinan el patrn de las transformaciones qumicas en los sistemas biolgicos. Casi todas las enzimas son protenas que median la transformacin de diferentes formas de energa; por ser protenas, son susceptibles a los mismos factores que desnaturalizan a las protenas, como el calor, cidos fuertes, bases fuertes, metales pesados y detergentes. Pueden tener componentes no proteicos, como carbohidratos, fosfatos, lpidos, iones metlicos o pequeas molculas orgnicas. Un sustrato es el compuesto especfico sobre el que acta una enzima afectando la velocidad de la reaccin. La cintica enzimtica se encarga de la velocidad de la reaccin y del modo es que sta cambia en respuesta a cambios en los parmetros experimentales. Un inhibidor es una sustancia que, cuando interacciona con una enzima, provoca una disminucin en la actividad cataltica. La inhibicin enzimtica puede ser: Reversible, si se produce una formacin de un complejo enzimtico inhibidor no covalente. Irreversible, si se forma un complejo covalente enzima-inhibidor. Se combinan con o se destruyen un grupo del enzima que es esencial para su actividad, o aquellos que forman una asociacin no covalente muy estable. Son tiles para estudiar los mecanismos de reaccin. Los aminocidos con funciones catalticas clave en el sitio activo, pueden ser identificados, determinado qu aminocido se ha unido covalentemente a un inhibidor despus de la inactividad del enzima. Los inhibidores suicidas son relativamente poco reactivos hasta que se unen al sitio activo de un enzima especfico. Pasa a travs de los primeros pasos de una reaccin enzimtica normal, a continuacin se convierte en un compuesto muy reactivo que se combina irreversiblemente con el enzima en lugar de ser transformado en el producto normal. La ureasa cataliza la hidrlisis de la urea en amoniaco y bicarbonato, donde el primero se difunde a travs de la capa semipermeabe de acetato butirato de celulosa interpuesta entre el reactivo y las capas de indicador para minimizar la difusin de los iones hidroxilo del colorante. La funcin de la enzima es degradar la urea en amonaco y dixido de carbono. La ureasa se produce a partir de Lactobacillus fermentum. Dicha enzima pertenece al grupo se las ureasas denominadas ureasas cidas. Se activa a pH bajo. L. fermentum se cultiva en medio sinttico. Despus de la fermentacin se filtra el cultivo, se lava con agua y las clulas se matan en alcohol de 50 % vol. La suspensin se seca por liofilizacin o por pulverizacin. La preparacin consiste en un polvo formado por clulas muertas enteras que contienen la enzima. La ureasa no debe contener ni substancias ni microorganismos ni actividades enzimticas colaterales que puedan: - ser perjudiciales para la salud, - ser perjudiciales para la calidad de los productos tratados, - llevar a la formacin de productos indeseables, - ocasionar o facilitar un fraude. La ureasa se presenta bajo forma de polvo cristalino, blanco, inodoro, de un sabor ms bien dulce. Las enzimas tiene un pH ptimo en el que su actividad es mxima; a valores superiores o inferiores de pH la actividad disminuye. Algunas cadenas laterales de aminocidos pueden actuar como cidos o bases dbiles que desarrollan funciones crticas en el sitio activo de la enzima que dependen del
mantenimiento de un cierto estado de ionizacin, mientras que en otras zonas de la protena algunas cadenas laterales ionizadas pueden jugar un papel esencial en las interacciones que mantienen la estructura de la protena. El intervalo de pH n el que cambia la actividad puede proporcionar alguna pista sobre qu aminocido est implicado. En el ambiente compacto de una protena, el pKa de las cadenas laterales de los aminocidos puede cambiar significativamente. Los efectos de la temperatura en las enzimas con muy complejos. Las enzimas funcionan lentamente a grados de congelacin, y sus actividades incrementan al aumentar la temperatura, puede llegar a elevarse lo suficiente como para destruir la actividad enzimtica. La mayora de las enzimas muestran actividad ptima entre 30 y 40 C. Una enzima es ms estable a la temperatura si se encuentra en un tejido intacto o si est en presencia de carbohidratos, pectinas u otros protenas. Los cambios a la temperatura afectan a: a) Estabilidad de las enzimas. b) Cambios en la ionizacin de grupos del sistema. c) pH del medio d) Afinidad de la enzima por el sustrato e) Rapidez de ruptura del complejo E-S f) Grado de asociacin de las enzimas que tienen ms de una subunidad. Las enzimas pueden ser inactivadas por el calor, algunas pueden existir en forma desnaturalizada reversible. Cuando esto pasa, adopta un estado conformacional activo, y se vuelve a observar la actividad enzimtica. Dada la mayor energa (temperatura) de las molculas, se sobrepone a la desnaturalizacin de la enzima debido a su origen proteico. El resultado global de estas dos interacciones da como resultado un perfil con un mximo de velocidad a una temperatura dada, denominada temperatura ptima. La actividad de una enzima se puede estudiar in vitro, bajo condiciones controladas aadindole una enzima a un substrato. S se trabaja con la condicin de que la concentracin del substrato sea saturante, variando entonces la concentracin de enzima, se observa que aumenta el producto de la reaccin, a pH y temperatura constantes. Si se mantiene la concentracin de la enzima constante y variando la concentracin de substrato se obtiene una curva hiperblica. Al principio un aumento de la concentracin de substrato produce un aumento rpido de la velocidad de reaccin, pero si se sigue aumentando la concentracin de substrato, la velocidad de reaccin comienza a disminuir y a muy altas concentraciones de substrato se observa que no cambia la velocidad de reaccin, se dice que los centros activos de la enzima se encuentran saturados. La velocidad de reaccin que se obtiene a esa alta concentracin de substrato se define como la velocidad mxima (V) de la reaccin enzimtica bajo las condiciones especificadas. La concentracin de substrato (S), a la semivelocidad mxima de reaccin (V/2) representa la constante de Michaelis o Km, la cual es una caracterstica para cada enzima. La inversa de Km, o 1/Km, mide aproximadamente la afinidad de la enzima por el substrato. Mientras ms pequeo sea el valor de Km, mayor ser la afinidad de la enzima por el substrato. Si varias enzimas compiten en el metabolismo por el mismo substrato, ste ser transformado preferentemente por la enzima con mayor afinidad. La ecuacin de Michaelis describe la relacin cuantitativa entre la velocidad de reaccin y la concentracin de substrato [S], si se conoce Vmax o Km: v= En donde:
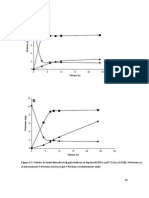
v= es la velocidad de reaccin observada a una concentracin de substrato determinada [S] Km= constante de Michaelis en moles/ltro Vmax= velocidad mxima a concentracin saturante de substrato. Si v= Vmax/2; entonces = Km+[S] = 2[S] Km =[S] De tal forma que podemos concluir que Km es igual a la concentracin de substrato a la semivelocidad mxima de reaccin. Objetivos. A partir de la extraccin de la ureasa del frijol de soya, estudiaremos los factores que alteran a la velocidad de reaccin enzimtica, bajo condiciones ptimas de la ureasa. Resultados. Concentracin. Tubo Blanco Problema 1 0 0.1 2 0.1 0.5 3 0.05 0.8 4 0.1 1 5 0.1 1.6
Concentracin
1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 0 0 1 2 3 4 5 6 Concentracin. Blanco Concentracin. Problema
pH Tubos 1 2
Blanco
Problema 0 0 0.6 2
3 4 5
0.6 2 1.2
2 1.1 0.1
pH
2.5 2 1.5 1 0.5 0 0 1 2 pH Blanco 3 4 pH Problema 5 6
Temperatura C Blanco Problema 0 0.2 0.3 20 0.5 1.3 50 1 2 70 0.4 1.6 90 0.2 0.8
Temperatura
2.5 2 1.5 1 0.5 0 0 20 40 60 80 100 Temperatura Blanco Temperatura Problema
Tiempo Segundos
Blanco
Problema
10 20 30 40
0.1 0.1 0.1 0.1
0.3 0.2 0.1 0.1
Tiempo
0.35 0.3 0.25 0.2 0.15 0.1 0.05 0 0 10 20 Tiempo Blanco 30 Tiempo Problema 40 50
Anlisis de resultados. Conclusin. Bibliografa. VARGAS RODRIGUEZ YOLANDA MARINA, OBAYA VALDIVIA ADOLFO EDUARDO, Clculos de parmetros de rapidez en cintica qupimica y enzimtica, UNAM, Cuautitln, Mxico, 2005. WISEMAN ALAN, Manual de biotecnologa de las enzimas, Acribia, Espaa, 1991. NELSON L. DAVID, COX M. MICHAEL, Lehninger, Principios de bioqumica, 4 edicin, Ediciones Omega, Espaa, 2005.
You might also like
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaFrom EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaRating: 5 out of 5 stars5/5 (1)
- ADSORCIÓN I ESTUDIO DE LA ADSORCION SOLIDO SOLUCION - Watermark PDFDocument11 pagesADSORCIÓN I ESTUDIO DE LA ADSORCION SOLIDO SOLUCION - Watermark PDFHelenNo ratings yet
- Determinacion de Acido BoricoDocument14 pagesDeterminacion de Acido BoricoCésar CastelánNo ratings yet
- Reporte-6 Bioquimica GeneralDocument11 pagesReporte-6 Bioquimica GeneralAlexis Daly Mateos FloresNo ratings yet
- Reporte 1. Efecto de La Concentración Sobre La Rapidez de ReacciónDocument9 pagesReporte 1. Efecto de La Concentración Sobre La Rapidez de Reacciónmarcos613No ratings yet
- Reacciones OscilantesDocument3 pagesReacciones OscilantesHenry OjedaNo ratings yet
- Práctica 5 FSQDocument9 pagesPráctica 5 FSQCristian SaldanaNo ratings yet
- Benzoxazoles Benzotiazoles Bencimidazoles 3FM1Document32 pagesBenzoxazoles Benzotiazoles Bencimidazoles 3FM1Pamela Adkins50% (2)
- Pre-Reporte Práctica No. 8 Cinética de La Reacción de Azul de Metileno Ácido AscórbicoDocument27 pagesPre-Reporte Práctica No. 8 Cinética de La Reacción de Azul de Metileno Ácido Ascórbicogeorge_carrillo_6No ratings yet
- Reporte p2. Valoracion Potenciometrica de Dos Halogenos en MezclaDocument15 pagesReporte p2. Valoracion Potenciometrica de Dos Halogenos en MezclaJorge Adrian Pérez TrejoNo ratings yet
- Reporte de Fisicoquimica FarmaceuticaDocument13 pagesReporte de Fisicoquimica FarmaceuticaAlan U UgaldeNo ratings yet
- Cuantificacion Potenciometrica de Hierro (III) PDFDocument9 pagesCuantificacion Potenciometrica de Hierro (III) PDFJose Emmanuel ChemaNo ratings yet
- Previo 1 Organica IVDocument6 pagesPrevio 1 Organica IVdany_289No ratings yet
- Previo 5 Control de CalidadDocument3 pagesPrevio 5 Control de CalidadbillyNo ratings yet
- Previo 6 ANTIULCEROSOSDocument8 pagesPrevio 6 ANTIULCEROSOSlizNo ratings yet
- P02. Zinc-EDTADocument7 pagesP02. Zinc-EDTAFanny Venado HernandezNo ratings yet
- Obtención de Acetato de Isobutilo Mediante La Síntesis de FischerDocument4 pagesObtención de Acetato de Isobutilo Mediante La Síntesis de FischerSam TorresNo ratings yet
- Reporte. Acido AscorbicoDocument9 pagesReporte. Acido AscorbicoCarlos CastilloNo ratings yet
- Informe 1Document15 pagesInforme 1Oscar Ramirez BermeoNo ratings yet
- Informe No. 2Document9 pagesInforme No. 2JonathanNo ratings yet
- PRÁCTICA #2 MAI "Preparación y Uso de Disoluciones Patrón Complejométricas" FINALDocument17 pagesPRÁCTICA #2 MAI "Preparación y Uso de Disoluciones Patrón Complejométricas" FINALGirard GarciaNo ratings yet
- Solubilidad Aparente Del Ácido Benzoico en Diferentes Concentraciones de Tensioactivo TweenDocument10 pagesSolubilidad Aparente Del Ácido Benzoico en Diferentes Concentraciones de Tensioactivo TweenDaniel BonzaNo ratings yet
- Protócolo Práctica 1. Caracterización de Un Compuesto OrgánicoDocument5 pagesProtócolo Práctica 1. Caracterización de Un Compuesto OrgánicoGerardo CervantesNo ratings yet
- 09 PrevioDocument7 pages09 PrevioRodrigo ColinNo ratings yet
- CineticaDocument9 pagesCineticarubenNo ratings yet
- Problemario FisSisAmb CinéticaDocument1 pageProblemario FisSisAmb CinéticaLucía MargaritaNo ratings yet
- Informe 2. PH y Capacidad ReguladoraDocument9 pagesInforme 2. PH y Capacidad ReguladoraGustav ValenciaNo ratings yet
- Cinetica Enzimatica ReporteDocument6 pagesCinetica Enzimatica ReporteGabriel LVNo ratings yet
- Práctica No 7, 8, 9,10Document15 pagesPráctica No 7, 8, 9,10Luis CVNo ratings yet
- Sistemas ColoidalesDocument2 pagesSistemas ColoidalesLeslie ingrid Venegas100% (1)
- Isotermas de AdsorciónDocument8 pagesIsotermas de AdsorciónAnonymous ExcNQWv7PNo ratings yet
- QA3 p01 PDFDocument14 pagesQA3 p01 PDFdanielNo ratings yet
- Reporte-Extracción Cu y MNDocument11 pagesReporte-Extracción Cu y MNBranNo ratings yet
- Reporte Determinación Gravimétrica de Oxinato de Aluminio (III)Document4 pagesReporte Determinación Gravimétrica de Oxinato de Aluminio (III)JOSE FRANCISCO MONROY PEREZ100% (1)
- Reglas de BaldwinDocument2 pagesReglas de BaldwinMiguelBlanquicettNo ratings yet
- Previo 1. Fico V Cinética de Hidrolisis de Un EsterDocument5 pagesPrevio 1. Fico V Cinética de Hidrolisis de Un EsterEdwin TapiaNo ratings yet
- Grupo5. Determinación de Sulfato de HierroDocument7 pagesGrupo5. Determinación de Sulfato de HierroDaniela RomeroNo ratings yet
- Practica 10Document24 pagesPractica 10Denisse CoortNo ratings yet
- P4 Ana Julia Hernandez Leyva 2501Document6 pagesP4 Ana Julia Hernandez Leyva 2501Ann LeyvaNo ratings yet
- Cuestionario Previo 4 FitofármacosDocument6 pagesCuestionario Previo 4 FitofármacosMadeline RomeroNo ratings yet
- Titulaciones ConductimétricasDocument4 pagesTitulaciones ConductimétricasCarmeny NavaNo ratings yet
- Determinacion Gravimetrica Del AluminioDocument4 pagesDeterminacion Gravimetrica Del AluminioAldo Vicencio Garcia0% (1)
- Reporte #7 - P-NitroanilinaDocument3 pagesReporte #7 - P-NitroanilinaAna Karen Rodríguez ReyesNo ratings yet
- Previo Practica 4 AnestesicosDocument6 pagesPrevio Practica 4 AnestesicosOrlando HernandezNo ratings yet
- Informe LAB 1 y 2Document10 pagesInforme LAB 1 y 2Maria Cecilia MorcilloNo ratings yet
- Reporte 1 O3Document3 pagesReporte 1 O3danielNo ratings yet
- Practica 6Document10 pagesPractica 6Aldair fernandezNo ratings yet
- Práctica 8 FisicoquímicaDocument7 pagesPráctica 8 Fisicoquímicaメデ カナNo ratings yet
- Reporte Practica 3Document5 pagesReporte Practica 3Daniel OlveraNo ratings yet
- Reporte Metahemoglobina TerminadoDocument5 pagesReporte Metahemoglobina TerminadoAndres Polina ZuñigaNo ratings yet
- Preparacion de Disoluciones.Document10 pagesPreparacion de Disoluciones.Unarlis MartinezNo ratings yet
- Separación e Identificación de Una Mezcla OrganicaDocument8 pagesSeparación e Identificación de Una Mezcla OrganicamerryNo ratings yet
- Humedad Exp 1Document3 pagesHumedad Exp 1Leif_Erikson_No ratings yet
- Cuantifiación de Laton Por GravimetriaDocument16 pagesCuantifiación de Laton Por GravimetriaJesus GuillenNo ratings yet
- Practica6Team1 Sintesis de NerolinaDocument14 pagesPractica6Team1 Sintesis de NerolinaHilda Ballin0% (1)
- MetiltrifenilestañoDocument9 pagesMetiltrifenilestañooscarNo ratings yet
- Ejercicios Resuletos Cinetica QuímicaDocument11 pagesEjercicios Resuletos Cinetica QuímicaDomingo Mestra RossoNo ratings yet
- Cinetica LactasaDocument122 pagesCinetica LactasaalvarezriNo ratings yet
- Practica 4Document3 pagesPractica 4CAROLINA HERRERANo ratings yet
- Humedad en Una Muestra Comercial de TalcoDocument3 pagesHumedad en Una Muestra Comercial de TalcoDanahy PraviaNo ratings yet
- Ensayo CalidadDocument3 pagesEnsayo CalidadHeriberto AngelesNo ratings yet
- Previo 1 Introduccion Al MetabolismoDocument7 pagesPrevio 1 Introduccion Al MetabolismoHeriberto AngelesNo ratings yet
- Previo1, Manejo y Cuidado Del MicroscopioDocument4 pagesPrevio1, Manejo y Cuidado Del MicroscopioHeriberto AngelesNo ratings yet
- AMINOÁCIDOSDocument11 pagesAMINOÁCIDOSHeriberto AngelesNo ratings yet
- Extraccion de ADN (Vegetal)Document12 pagesExtraccion de ADN (Vegetal)Ana Julissa GálvezNo ratings yet
- Nutrición Autótrofa y Nutrición HeterótrofaDocument16 pagesNutrición Autótrofa y Nutrición HeterótrofaVimuZzaNo ratings yet
- Ciclo Celular Con MitosisDocument20 pagesCiclo Celular Con Mitosisaguerofiorella794No ratings yet
- Sinapsis y Circuitos NeuronalesDocument52 pagesSinapsis y Circuitos NeuronalesTery Vasquez Hassinger100% (1)
- Catalizadores y NosodesDocument6 pagesCatalizadores y NosodesEdgardo Aguilar Hernandez100% (1)
- De Que Esta Compuesto El Ser HumanoDocument3 pagesDe Que Esta Compuesto El Ser HumanoHenrry CifuentesNo ratings yet
- Biosintesis de La MureinaDocument27 pagesBiosintesis de La MureinaEloy L. EufracioNo ratings yet
- Farmaco GLUCOCORTICOIDESDocument42 pagesFarmaco GLUCOCORTICOIDESluis ortegaNo ratings yet
- Resumen de Rutas Metabólicas BCMDocument52 pagesResumen de Rutas Metabólicas BCMLuana HuertasNo ratings yet
- Diapositivas de TerapiaDocument17 pagesDiapositivas de Terapiaa88432dNo ratings yet
- Fisiologia Del Tejido Adiposo LipidosDocument10 pagesFisiologia Del Tejido Adiposo LipidosStefany TorresNo ratings yet
- Que Es La Ingenieria GeneticaDocument13 pagesQue Es La Ingenieria GeneticapabloituNo ratings yet
- Antioxidantes en Los Alimentos - AgroindustriasDocument30 pagesAntioxidantes en Los Alimentos - AgroindustriasCarito PiedraNo ratings yet
- BIOLOGIA-EXAMEN Junio 2012 PDFDocument4 pagesBIOLOGIA-EXAMEN Junio 2012 PDFnereaabreuNo ratings yet
- Ciclo CelularDocument7 pagesCiclo CelularMahirami MartinezNo ratings yet
- Actividad de Puntos EvaluablesDocument6 pagesActividad de Puntos EvaluablesMery Jazmin Cantor CubillosNo ratings yet
- Fósforo, MagnesioDocument30 pagesFósforo, MagnesioRafael León Ramírez100% (1)
- Guía-Taller de Laboratorio 4 PCR ActualizadaDocument4 pagesGuía-Taller de Laboratorio 4 PCR ActualizadaFrailejon Ernesto PerezNo ratings yet
- ADENOHIPÓFISISDocument1 pageADENOHIPÓFISISDANIELA ALEJANDRA RIVERA GUERRERONo ratings yet
- Encefalopatías ProgresivasDocument15 pagesEncefalopatías ProgresivasGatito Gatito GatunoNo ratings yet
- Metabolismo de NucleotidosDocument46 pagesMetabolismo de NucleotidosErica Susana Avila BecerraNo ratings yet
- Enzimas Mecanismo de AcciónDocument10 pagesEnzimas Mecanismo de AcciónNayeli LasluisaNo ratings yet
- Guía Problemas 2C 2020Document32 pagesGuía Problemas 2C 2020Camila RubinoNo ratings yet
- Introduccion Al Sistema EndocrinoDocument7 pagesIntroduccion Al Sistema Endocrinotheboykrypto soNo ratings yet
- Biotecnología AmbientalDocument6 pagesBiotecnología AmbientalKarla VegaNo ratings yet
- Guia de Aprendizaje Grado 9 Replicacion Del Adn 2020 Insema PDFDocument17 pagesGuia de Aprendizaje Grado 9 Replicacion Del Adn 2020 Insema PDFESNICNo ratings yet
- Beta Oxidación FICHA DE APRENDIZAJEDocument4 pagesBeta Oxidación FICHA DE APRENDIZAJEProf. Víctor M. VitoriaNo ratings yet
- N4 Det. Cho Espectroscopico - Galindo Canchari NinaDocument7 pagesN4 Det. Cho Espectroscopico - Galindo Canchari NinaninaNo ratings yet
- Tema 1 Metabolismo de La GlucosaDocument17 pagesTema 1 Metabolismo de La GlucosaVioleta Lucero BonillaNo ratings yet
- INFORME 1-LipidosDocument9 pagesINFORME 1-LipidosSilvana Reyes SalazarNo ratings yet