Professional Documents
Culture Documents
Biocatalisis Enzimatica
Uploaded by
Benjamin HammondOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Biocatalisis Enzimatica
Uploaded by
Benjamin HammondCopyright:
Available Formats
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS
ENERO DEL 2013 [Escriba el nombre de la compaa] BIOCATALISIS ENZIMATICA
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
BIOCATALISIS ENZIMATICA I. RESUMEN: El presente trabajo tuvo como finalidad determinar las condiciones de operacin para la hidrlisis de sacarosa en lote por la enzima inmovilizada en un reactor, cuantificando la cantidad de azcares reductores liberados, la velocidad inicial de hidrlisis y la hidrlisis a diferentes concentraciones de sustrato y a una temperatura de 45C. El pH fue de 4.7 regulados con buffer acetato.
II. INTRODUCCIN: Como todos los catalizadores, las enzimas disminuyen la energa requerida para conseguir una reaccin comenzada. Debajo se demuestra un diagrama similar con ms detalle para el patrn de la energa para la reaccin catalizada enzima. Primero, la energa se requiere para formar el complejo entre la enzima y el substrato (complejo del E-S) que es un estado de una energa ms alta que la enzima y el substrato/el producto libres.
Figura 01. Diagrama de la energtica de la enzima cataliz la reaccin contra la reaccin no-catalizada.
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
La funcionabilidad biolgica de las enzimas depende de la mantencin de su estructura biolgica de las enzimas depende la mantencin de su estructura proteica nativa que es consecuencia directa de la informacin gentica contenida en el ADN. Su capacidad cataltica reside en su centro activo, que es una estructura formada por un nmero reducido de grupos funcionales (residuos aninoacidicos) que poseen una alta afinidad por el sustrato, con la cual se combina especficamente dando origen a la reaccin:
De forma general, la velocidad de una reaccin catalizada enzimticamente es proporcional a la cantidad de enzima en la mezcla de ensayo, segn:
v=V
max
[S]/(K + [S]) = k'[E ] V
m 0
max
= k [E ]
cat 0
Las enzimas pueden requerir, adems de su estructura proteica de otras molculas esenciales para su actividad denominada cofactores, existiendo cofactores ligados o catalticos y cofactores disociables o estequiometricos. Desde el punto de vista de su utilizacin tecnolgica, las enzimas son catalizadoras del proceso de transformacin de materias primas en producto tiles. El carcter catalico de la enzima permite en teora su indefinido en la conversin de sustratos en productos. En los ltimos aos, la biotecnologa ha experimentado grandes avances y, paralelamente sus aplicaciones industriales en la obtencin de productos qumicos, en la industria alimentaria y farmacutica. Los procesos catalizados por enzimas en la industria son cada da ms numerosos, ya que presentan una serie de ventajas frente a los catalizadores convencionales no biolgicos:
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Presentan una gran actividad cataltica Muestran una gran especificidad de sustrato (incluso estereoselectividad y regioespecificidad) Son muy activos a temperatura ambiente y presin atmosfrica.
A pesar de estas claras ventajas, el empleo de enzimas no se ha generalizado en los procesos qumicos industriales debido a que la mayora de las enzimas no son estables en las condiciones de trabajo. Por otra parte al ser solubles en agua, su separacin de los sustratos y productos es difcil, y por tanto, no se pueden reutilizar. Con la inmovilizacin de las enzimas se han podido superar estos ltimos inconvenientes, permitiendo que el proceso biotecnolgico sea econmicamente rentable.
ACTIVIDAD ENZIMATICA Las enzimas son de naturaleza proteica y, aunque muchas contienen en su estructura otro tipo de molcula, su funcionabilidad biolgica radica siempre en su porcin proteica. La capacidad cataltica de la enzima reside en su sitio activo, que est conformado por un nmero de residuos aminoaciditos que se agrupan en la estructura tridimensional para generar un nicho, donde el substrato es ligado y qumicamente transformado. La presencia de la estructura de este nicho es esencial para la expresin de dicha capacidad cataltica, por lo que la estabilidad configuracional de la estructura `proteica de la enzima resulta fundamental parta su funcionabilidad. Desde el punto de vista termodinmica las enzimas actan rebajando la barrera energtica que presenta la energa de activacin requerida para lograr un complejo de transicin activado que dar origen al producto. Desde el punto de vista cintico, la actividad enzimtica, que corresponde a la capacidad cataltica de la enzima, se traduce en un incremento de la velocidad de la reaccin catalizada y, dado que en ausencia de la enzima la velocidad es generalmente despreciada, la cuantificacin de la actividad enzimtica se basa justamente en la medicin de la velocidad de la reaccin. La actividad enzimtica representa en consecuencia el mximo potencial cataltico de la enzima para un conjunto de condiciones ambientales dadas.
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
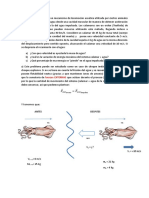
La actividad enzimtica se expresa en trminos de unidades de actividad. La definicin de unidades de actividad ha sido bastante arbitraria lo que dificulta muchas veces el anlisis comparativo de los resultados obtenidos por diversos obtenidos. En general se ha adoptado la definicin propuesta por la UI de bioqumica. Se define la UI como la cantidad de enzima que cataliza la transformacin de un micro mol de sustrato por minuto. Cintica enzimtica: El objeto de la cintica enzimtica es el estudio de las enzimas en su funcionamiento. Se propone, en particular, establecer las relaciones que existen entre la velocidad de la reaccin enzimtica y las concentraciones del substrato (S) y de la enzima, as como la influencia de algunos factores como: pH, temperatura, presencia de efectores y eventualmente actividad del agua. Curiosamente, este mximo no depende del tamao del sustrato o de la enzima. La proporcin de las constantes de especificidad para dos sustratos es una comparacin cuantitativa de la eficiencia de la enzima para convertir en productos dichos sustratos. La pendiente de la ecuacin de Michaelis-Menten a bajas concentraciones de sustrato (cuando [S] << Km) tambin proporciona la constante de especificidad. Como las reacciones catalizadas por enzimas son saturables, la velocidad de catlisis no muestra un comportamiento lineal en una grfica al aumentar la concentracin de sustrato. Si la velocidad inicial de la reaccin se mide a una determinada concentracin de sustrato (representado como [S]), la velocidad de la reaccin (representado como V) aumenta linealmente con el aumento de la [S], como se puede ver en la figura. Sin embargo, cuando aumentamos la [S], la enzima se satura de sustrato y alcanza su velocidad mxima (Vmax), que no sobrepasar en ningn caso, independientemente de la [S].
Mecanismo de unin de nico sustrato para una reaccin enzimtica. k1, k-1 y k2 son las constantes cinticas para cada una de las etapas de la reaccin.
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
El modelo de cintica michaeliana para una reaccin de nico sustrato se puede ver en la figura de la izquierda. Primeramente, tiene lugar una reaccin qumica bimolecular entre la enzima E y el sustrato S, formndose el complejo enzimasustrato ES. Aunque el mecanismo enzimtico para una reaccin unimolecular puede ser bastante complejo, existe una etapa enzimtica limitante que permite que el mecanismo sea simplificado como una etapa cintica nica cuya constante es k2. (Ecuacin 1) k2 tambin llamado kcat o nmero de recambio, hace referencia al mximo nmero de reacciones enzimticas catalizadas por segundo. A bajas concentraciones de sustrato, la enzima permanece en un equilibrio constante entre la forma libre E y el complejo enzima-sustrato ES. Aumentando la [S] tambin aumentamos la [ES] a expensas de la [E], desplazando el equilibrio de la reaccin hacia la derecha. Puesto que la velocidad de reaccin depende de la [ES], la velocidad es sensible a pequeos cambios en la [S]. Sin embargo, a altas [S], la enzima se satura y solo queda la forma unida al sustrato ES. Bajo estas condiciones, la velocidad de la reaccin (v k2[E]tot = Vmax) deja de ser sensible a pequeos cambios en la [S]. En este caso, la concentracin total de enzima ([E]tot) es aproximadamente igual a la concentracin del complejo ES:
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Representacin grfica de la curva de saturacin de una enzima donde se puede observar cmo evoluciona la relacin entre la concentracin de sustrato y la velocidad de la reaccin.
La ecuacin de Michaelis-Menten describe como la velocidad de la reaccin depende del equilibrio entre la [S] y la constante k2. Leonor Michaelis y Maud Menten demostraron que si k2 es mucho menor que k1 (aproximacin del equilibrio) se puede deducir la siguiente ecuacin:
(Ecuacin 2) Esta famosa ecuacin es la base de la mayora de las cinticas enzimticas de sustrato nico. La constante de Michaelis Km se define como la concentracin a la que la velocidad de la reaccin enzimtica es la mitad de la Vmax. Esto puede verificarse sustituyendo la concentracin de sustrato por dicha constante ([S] = Km). Si la etapa limitante de la velocidad de la reaccin es lenta comparada con la disociacin de sustrato (k2 <<< k1), la constante de Michaelis Km ser aproximadamente la constante de disociacin del complejo ES, aunque sea una situacin relativamente rara. La situacin ms comn, donde k2 > k1, es denominada cintica de BriggsHaldane. La ecuacin de Michaelis-Menten an se mantiene bajo estas condiciones ms generales, como puede derivarse de la aproximacin del estado estacionario. Durante el perodo inicial, la velocidad de la reaccin es ms o menos constante, indicando que la [ES] tambin se mantendr constante:
De esta forma, la concentracin de ES viene dada por la siguiente expresin:
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Donde la constante de Michaelis Km se define as:
Con lo cual, despus de operar todos los factores, obtenemos una frmula general para la velocidad de la reaccin que coincide con la ecuacin de MichaelisMenten:
La constante de especificidad kcat / Km mide la eficiencia con la que una enzima convierte un sustrato en producto. Utilizando la definicin de la constante de Michaelis Km, la ecuacin de Michaelis-Menten podra escribirse de la siguiente forma:
donde [E] es la concentracin de enzima libre. As, la constante de especificidad se convierte en una constante bimolecular efectiva de la enzima libre que reacciona con sustrato libre para formar producto. Esta constante viene definida por la frecuencia con la que el sustrato y la enzima se encuentran en una solucin, y ronda aproximadamente un valor de 1010 M-1 s-1 a 25 C. Curiosamente, este mximo no depende del tamao del sustrato o de la enzima. La proporcin de las constantes de especificidad para dos sustratos es una comparacin cuantitativa de la eficiencia de la enzima para convertir en productos dichos sustratos. La pendiente de la ecuacin de Michaelis-Menten a bajas concentraciones de sustrato (cuando [S] << Km) tambin proporciona la constante de especificidad. Cintica de un substrato: Principales hechos experimentales: debemos sealar como un prembulo la necesidad absoluta de que las enzimas sean puras y desprovistas de actividad parasita. Los tres hechos experimentales principales, en que se basan las leyes generales de de la cintica enzimtica son:
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
a) El substrato S, forma con la enzima, E, un complejo intermediario transitorio ES. este complejo resulta de una complementaria de la estructura entre el sitio activo de la enzima y d la molcula del substrato. b) La velocidad de la reaccin en el tiempo t, es decir la velocidad de la desaparicin del substrato, -
dS dP , o de aparicin del producto, que se dt dt
representa por la pendiente de la tangente a la curva, P o S = f(t) no es constante para las concentraciones dadas en enzimas o en substrato (fig. 66), y disminuye en funcin del tiempo debido a la desaparicin del substrato en el curso de desarrollo de la reaccin. Siempre al principio de la reaccin, se puede considerar que la tangente a la curva se confunde con aquella en que la velocidad permanece constante. Los estudios de cintica enzimtica corresponden siempre a esta parte lineal de la curva; lo que implica el trabajar a velocidades inciales. En estas condiciones, al principio de la reaccin, la concentracin en producto es muy dbil; puede despreciarse, as como la reaccin inversa de transformacin del producto en substrato. Entonces se puede escribir:
ES
k1 K3 ES EP k2
c) Por otra parte, para una concentracin dada de substrato, el estudio de las variaciones de la velocidad inicial de reaccin en funcin de la concentracin de enzimas (fig. 6-7) muestra que esta variacin no es lineal. La curva presenta un trazo hiperblico corre3spondiente al hecho de que para una cierta concentracin de enzima, la totalidad del substrato se encuentra bajo la forma de complejo enzima-substrato; de lo que resulta que la velocidad inicial, funcin de la concentracin de este complejo, permanece constante. Para los estudios cinticos, es necesario situarse en las condiciones que corresponden al principio de la curva, donde es lineal, es decir a concentracin bajas de enzimas. En otros trminos, al cantidad de enzima debe ser pequea en comparacin a la concentracin del substrato, de tal manera, que la formacin del complejo enzima substrato, ES, no modifica, o modifica poco la concentracin del substrato.
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Influencia del contenido de agua: Las enzimas son protenas globulosas solubles en agua y las reacciones enzimticas se efectan, en su mayor parte, en medio acuoso. Es comn observar que alimentos han sido protegidos del desarrollo microbiano por aplicacin de diferentes tratamientos de deshidratacin (secado de legumbres, en crudo) sufren sin embargo, a pesar del bajo contenido de agua, degradaciones enzimticas que conducen a la aparicin de olor y sabor desagradables. En estos casos, el papel del disolvente de la enzima que corresponden habitualmente al agua, es del todo secundario y no es indispensable. La lipasa, situada en la interfase aceite-agua, y la lipogenasa que actan en presencia de cantidades de agua, son un buen ejemplo de este tipo de comportamiento. Pero siempre el agua interviene en todas las reacciones de hidrlisis como un segundo substrato. En este caso, el factor a considerar no es en realidad el tenor en agua, si no la actividad del agua en el medio considerado, actividad que cifra su grado de disponibilidad, especialmente para participar en la reaccin de hidrlisis enzimtica. Las curvas de sorcin - desorcin del agua, constituyen el mtodo clsico para determinar la variacin de la actividad del agua en funcin del tenor en agua. Cuando el tenor en agua es dbil, todo factor que aumenta la movilidad de la enzima y la frecuencia de la s colaciones enzima-substrato, acelera el desarrollo de reacciones enzimticas; uno de los ejemplos mejor conocidos es el del amasamiento intensificadito que favorece la accin de las lipoxigenasas. Considerando la existencia de factores limitantes ligados a la movilidad de los reactivos, las cinticas no son michelianas.
Enzimas inmovilizadas: La gran especificidad en la accin de las enzimas y de las condiciones tan suaves en las cuales funcionan les confiere una decidida ventaja sobre los catalizadores qumicos ordinarios. Por ello en numerosos sectores se han desarrollado considerablemente el uso de preparaciones enzimticas. Pero el alto costo de los de los procedimientos de extraccin y de purificacin de las macromolculas
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
enzimticas, su alta inestabilidad cundo estn en solucin, son un obstculo a su recuperacin despus de haber sido utilizado este biocatalizador. En la prctica la mayor parte de las operaciones industriales se realizan de forma discontinua, en lotes, con la renovacin de la enzima al principio de cada ciclo. La inmovilizacin sobre un soporte insoluble, que a menudo se acompaa de un aumento en la estabilidad de la enzima, facilita el desarrollo de reactores en continuo, que funcionan durante periodos largos, sin necesidad de renovar el catalizador. Permiten tambin utilizar preparaciones ms puras, cierto es que ms caras, pero de especificidad en su accin ms estrecha, lo que mejora la calidad de los productos que se obtienen. Para los enzimologos, la fijacin sobre un soporte realiza un modelo cercano a las condiciones de la clula viviente, en donde las enzimas se encuentran con frecuencia asociadas a la membrana o a organelos intracelulares. Desde 1916, Nelson y Griffin haban demostrado que la invertasa absorbida sobre carbn activo, conserva su actividad. Pero de cualquier modo hubo que esperar hasta la dcada de los 50s para que aparecieran las primeras aplicaciones de esta tcnica, en particular con los trabajos de Grub-hofer y Schleith. Despus de 1960, las investigaciones, las investigaciones se han intensificado y bajo al impulso de los equipos de Katchalski en Israel y de Manecke en Alemania, se han multiplicado las utilizaciones potenciales de las enzimas inmovilizadas. En 1969 Chibata y sus colaboradores desarrollaron en Japn el primer reactor industrial con enzima fijada, una L-aminocidos a partir de la correspondiente mezcla racemica. Esta tcnica permitira, segn los autores, disminuir el precio de costo a menos del 40% con relacin al procedimiento convencional. En Francia varios equipos han trabajado activamente en este campo. Citaremos en particular los estudios de Durand y Monsan del instituto nacional de ciencias aplicadas de Toulouse, los de Broun y Thomas de la Universidad de Tecnologa de Compiegne, o el de Engasser del Instituto Nacional Politcnico de Lorraine.
En la actualidad, se han desarrollado numerosos mtodos de fijacin de inters para ms de 100 enzimas, tanto en la etapa de laboratorio como en escala piloto y se ha abierto un campo de experimentacin, despus de algunos aos, para la inmovilizacin de clulas intactas, vivas o muertas. Esta multiplicacin de trabajos ha dado lugar a una abundante literatura cientfica.
10
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Propiedades de las enzimas inmovilizadas: Los efectos de la inmovilizacin sobre la actividad de las enzimas resultan de la interaccin de diferentes factores:
a) Modificaciones de la estructura tridimensional de la enzima, a causa de tensiones durante la fijacin. b) Modificaciones del microambiente: pH local, interacciones electrostticas. c) Fenmenos difusionales en el interior del complejo. d) Impedimentos estricos.
Este conjunto de factores juega un papel determinante en la actividad y estabilidad de la enzima. Medicin de la actividad: Las condiciones ptimas de accin de las enzimas inmovilizadas difieren a menudo de las enzimas en solucin y deben ser perfectamente conocidas para evitar todo riesgo de error de interpretacin. Asi para la ureasa, fijada sobre bentonita, la actividad de ph es de 7.7 no alcanza sino a 75% de la actividad de la enzima libre mientras que es de100% a ph 7,1. Con las reservas antes dichas, parece que la inmovilizacin entraa con frecuencia una prdida de de actividad, muy variable segn sea la naturaleza de la enzima y el modo de fijacin; pero tambin se han sealado algunos casos en los que hay aumento de la actividad. Estas variaciones en un sentido o en otro podran explicarse por una modificacin estrica del sitio activo de la enzima de bajo el efecto de un cambio de conformacin de la cadena polipeptidica.
11
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Influencia de las condiciones de operacin: Si la actividad residual de las enzimas inmovilizadas es ms dbil que de las enzimas nativas, por el contrario, su estabilidad se encuentra generalmente aumentada. La duracin de la vida de los complejos es sin embargo muy variable y las cifras citadas en las diferentes obras cientficas varan de algunas decenas de horas a varios meses y para algunos casos excepcionales, a varios aos, la estabilidad de las preparaciones comerciales es un factor primordial para la explotacin industrial de los reactores de enzimas. Las cantidades de protena retenidas son tambin muy variables (2-400% de la masa de polmero) y depende de la enzima considerada, del soporte que se utiliza y del mtodo de inmovilizacin empleado. No se presentan fenmenos de impedimento estrico, de relacin lineal entre la actividad en relacin a la unidad de masa del complejo y a la cantidad de biocatalizador fijado. La inmovilizacin de la enzima, en presencia del substrato o de u inhibidor competitivo, protege el sitio activo e impide la formacin de enlaces entre el soporte y los cidos aminados que interviene en la catlisis. Para las enzimas con agrupamientos SH, muy sensibles a la oxidacin, es preferible bloquear las funciones tiol antes de la fijacin y de regenerarlas en el momento del empleo. Las condiciones de pH y de temperatura necesarias para la reaccin de inmovilizacin pueden provocar la desnaturalizacin parcial o total de la protena. Peo, una vez que se ha realizado la inmovilizacin, se observa menudo, que las enzimas fijadas resisten mejor las variaciones de pH y a los tratamientos trmicos, que las especies en solucin.
12
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
INVERTASA La -D-fructofuranosidasa fructohidrolasa, comnmente llamada invertasa y tambin conocida como -D-fructofuranosidasa, -fructosidasa, fructosilinvertasa y sacarasa fue descubierta por primera vez por Berthelot en 1860 (Neuman y Lamped, 1967). La reaccin de rompimiento del residuo no reductor L-D-fructofuranosido es catalizada por la invertasa. El sustrato preferido de esta enzima es la sacarosa pero la invertasa tiene la capacidad de catalizar la hidrlisis de rafinosa y estaquiosa (Fiedurek et al., 2000, Belcarz et al., 2002), produciendo una mezcla de fructosa y glucosa, esta mezcla conocida como azcar invertida, tiene mayor poder edulcorante que la sacarosa y es usada en la produccin de chocolate, bombones, jarabe, miel sinttica, mermelada y jaleas. El azcar invertido no es el nico producto de importancia que produce la invertasa. La produccin y aplicacin de fructooligosacridos formados por invertasa obtenida de cepas de A. niger ha ganado tremenda importancia comercial debido a sus propiedades funcionales; stas incluyen: mejora de la microflora intestinal, alivian la constipacin, disminuyen el colesterol y lpidos, promueven el crecimiento animal y son edulcorantes bajos en caloras (Nguyen et al., 1999). Actualmente, la invertasa es una de las enzimas ms utilizadas en la industria de los alimentos, especialmente en la preparacin de dulces, bebidas y en la produccin de cido lctico por fermentacin de melazas (Acosta et al., 2000). La invertasa tambin se utiliza para la hidrlisis de sacarosa en procesos de produccin de etanol; lo que evita la formacin de sorbitol durante el proceso de fermentacin (Lee y Huang, 2000).
13
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Microorganismos productores de invertasa Se ha reportado la presencia de invertasa en bacterias, hongos, plantas superiores y en algunas clulas animales (Belcarz et al., 2002, Mtrai et al., 2000, Luxhoi et al., 2002, Huang et al., 2003). Sin embargo, la mayora de las investigaciones sobre produccin de invertasa se ha realizado con Saccharomyces cerevisiae, el cual es un microorganismo particularmente interesante ya que mientras otras especies de levaduras que consumen sacarosa tienen la habilidad de sintetizar slo una forma de invertasa intra o extracelular, S. cerevisiae sintetiza ambas formas de invertasa. Una es la protena periplasmtica glucosilada y la otra es una protena citoslica no glucosilada (Belcarz et al., 2002) La invertasa es producida de manera comercial principalmente por Saccharomyces cerevisiae y por cepas de hongos del gnero Aspergillus como A. niger, A. oryzae y A. ficcum (Vargas et al., 2004). En estos hongos la invertasa puede ser intra y extracelular. En A. niger se ha observado la prese ncia de mltiples formas de esta enzima y aproximadamente del 40-60% de sta es intracelular (Vargas et al., 2004). Produccin de invertasa Muchos de los trabajos sobre produccin de invertasa se han hecho en fermentacin lquida usando sacarosa y melazas como principal fuente de carbono. Belcarz y col. (2002) observaron que a una concentracin de 1% de sacarosa se induce la sntesisde invertasa por C. utilis. Siendo S. cerevisiae uno de los principales productores a nivel industrial, se ha cultivado en diferentes medios para producir altas cantidades de invertasa. Con hongos filamentosos se han realizado numerosos intentos para incrementar la produccin de invertasa. Se ha reportado (Fiedurek et al., 2000) la seleccin de cepas de A. fumigatus utilizando tcnicas de mutagnesis clsicas, encontrando la mayor actividad de invertasa extracelular e intracelular (5.27 U/ml y 0.44 U/ml) despus de 96 horas de incubacin, el incremento de la actividad de invertasa comparada con la cepa parental fue de dos veces aproximadamente. Mukherjee y colaboradores (2002) reportan la produccin de invertasa por Termitomyces clypeatus cuando el hongo fue cultivado por 5 das en un medio sinttico con 1% de sacarosa. Una opcin para la produccin de invertasa son los procesos de fermentacin en medio slidos. Se han sugerido varias ventajas de la fermentacin slida sobre la fermentacin lquida (Mitchell et al., 2000) entre las que destacan la menor
14
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
represin catablica, la alta productividad de enzimas y la mayor concentracin de enzimas (Romero-Gmez et al., 2000). Montiel-Gonzlez y col. (2002) compararon mutantes haploides de A. niger, previamente caracterizadas como sobreproductoras de enzimas y diploides de A. niger formadas a partir de las mutantes haploides, de esta manera encontraron una mayor produccin de invertasa en FMS en comparacin con el mtodo convencional de fermentacin lquida. Invertasa Inmovilizada La invertasa est catalogada dentro de las enzimas solubles de alta demanda (Huerta-Ochoa, 2004), por lo que se han usado diferentes mtodos para tratar de obtener la mayor produccin de esta enzima a partir de los microorganismos que comercialmente la producen. Sin embargo, se tienen desventajas ya que la enzima est en solucin, lo que puede representar problemas en la purificacin de los productos y generalmente la enzima no se puede recuperar, incrementando el costo del proceso. Para tratar de evitar estos problemas se han diseado mtodos de inmovilizacin de enzimas para favorecer la reaccin y reuso de las enzimas. Las enzimas pueden estar inmovilizadas en geles hidroflicos como agar, agarosa, alginato, carregenina, o en matrices polimricas semipermeables o en celulosa (Huerta-Ochoa, 2004). Las ventajas de usar enzimas inmovilizadas son muchas y algunas tienen especial relevancia en el rea de alimentos (Torres et al., 2002). Sin embargo, la inmovilizacin de clulas con actividad invertasa puede ofrecer ventajas econmicas comparadas con la inmovilizacin de invertasa soluble (Krastanov, 1997). Los materiales para inmovilizar clulas con actividad invertasa son diversos como poliacrilamida (Ghosh y DSouza, 1989), polihidroxietilmetacrilato (Cantarella et al., 1992), alginato (Pira et al., 1991), gelatina (Parascandola et al., 1993) y pectinato de calcio (Polakovic et al., 1993) entre otros, sin embargo, ni uno de los mtodos mencionados rene las caractersticas catalticas necesarias para su aplicacin en procesos industriales de hidrlisis de sacarosa (Krastanov, 1997). Se ha observado que la invertasa inmovilizada en diferentes materiales (Mansfeld et al., 1992,, Monsan y Combes, 1983, Prodanovic et al., 2001, Krastanov 1997, Basha y Palanivelu, 2000), se puede mantener estable por periodos prolongados de tiempo a concentraciones de sacarosa y temperaturas relativamente elevadas.
15
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
III. OBJETIVOS: Objetivos generales: Disear y realizar diferentes experiencias de estudios cinticos de un preparado enzimtico en bruto de invertasa de levadura de panadera (-Dfructofuranosidasa) en sus formas soluble e inmovilizada. Objetivos especficos: Preparar reactivos para obtener curvas de calibrado de DNS y protenas. Obtener el preparado enzimtico en bruto de invertasa de levadura. Determinar el rango de linealidad y actividad enzimtica (actividades volumtrica y especfica) del preparado soluble. Determinar los parmetros cinticos de la invertasa soluble. Inmovilizar invertasa en geles. Montar el sistema mini-reactor con invertasa inmovilizada, para evaluar su comportamiento. IV. MATERIALES: Metodo Bradford 0.1g de azul de coomassie G-250 Reactivo Bradford Etanol al 98% Acido fosfrico al 85% gua destilada Micropipetas Pipetas Tubos de ensayo 500 L Espectrofotmetro Suero de bobino 0.3g/l Matraces
16
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Inmovilizacion de invertasa Alginato de sdio al 2% Solucin de CaCl2 0,1M y 0,05M. Jeringa Matraces Mechero Mini-reactor Bao Maria Cronometro Pipetas Micropipeta Rango de linealidad
Tubos de ensayo con tapa (4) y 2 tubos para blanco Soluciones: Solucion de sustrato (2.9 ml por tubo) Extracto crudo enzimarico (0.25 ml para 4 tubos) Pipetas (3) Bao Maria Cronometro Espectrofotometro UV Agua helada
17
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Determinacion de azucares reductos DNS Ractivo DNS Micropipeta Tubos de ensayo (9) Pipeta Agua destilada Rejilla Mechero Bunsen Agua delada Agitador Maximix Espectrofotometro
V. METODOLOGA EXPERIMENTAL: Consideraciones: Usar soluciones concentradas de sacarosa: 0.2 M 0.6 M Utilizar como soporte Alginato de sodio al 1.5%-2.5% (p/v) Usar un sistema mini-reactor enzimtico por lotes agitado. Definicin: una unidad internacional de Invertasa es aquella cantidad de enzima necesaria, que libera un micromol (1 mol) de azucares reductores por minuto, desde una solucin de 20g/L a 40 C y pH 4.7 (Tampn acetato de sodio 0.05 M)
18
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Elaboracion de preparado enzimatico a) Pesar 1.053 g de Na4P2O7. Hallando peso de Na4P2O7 para 0.066 M PM= 266 g/mol
b) Agregar 60 ml de fosfato de sodio (Na4P2O7) 0.066 M en un recipiente c) Llevar a un pH 8.5 d) Agregar 20 g de levadura a un vaso de precipitacin de 100 ml y cubrir con papel aluminio e) Mantener a 20C y dejar reposar hasta el da siguiente f) Centrifugar, quedndonos con el sobrenadante (centrifugar 2 veces) g) Guardar el sobrenadante (preparado enzimtico) hasta la siguiente semana.
Pesar 1.053 g de fosfato de sodio y agregarle 60 ml de agua para obtener fosfato de sodio 0.066 M
19
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Ajustar el pH a 8.5. Agregar 20 gramos de levadura y dejarlo repposar hasta el siguiente dia.
Determinacion de protenas: Metodo de Bradford Reactivo: Disolver 0.1 g de azul de Coomassie G-250 en 50 ml de etanol al 98%, mas 100 ml de acido fosfrico al 85% y con agua destilada aforar a un litroProcedimiento: a) Agregar a un tubo de ensayo 500 l de muestra convenientemente diluida. b) Aadir 5 ml de reactivo Bradford (a cada muestra) y dejar reaccionar durante 5 minutos. c) Leer la absorbancia a una longitud de onda de 595 nm, contrastndola con un blanco de agua destilada de 500 l. d) La concentracin se obtiene interceptando la medida de absorbancia en la curva de calibrado. La curva de calibrado se obtiene a partir de muestras de concentracin conocida de una solucin estndar de albumina suero de bovino y analizadas segn este procedimiento.
20
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Determinacion del rango de linealidad y actividad de la enzima Las experiencias se realizaron a diferentes diluciones del extacto crudo enzimtico, 1:1, 1:2, 1:4 y 1:6 segn como convino. Se grafico la concentracin de producto contra el tiempo de reaccin y se expreso correctamente los valores de las actividades volumtrica y especifica. El procedimiento fue el siguiente: a) Se prepararon 4 tubos de ensayo con tapa, se agrego a cada uno 2.5 ml de solucin de sustrato a la concentracin definida (concentraciones estndares de sacarosa 20 g/l; rafinosa 15 g/l e inulina achicoria 10 g/l) a pH 5.0 con tampn citrato-fosfato y se calentaron en una bao Maria a 55C durante 2 minutos. b) Se adiciono 0.25 ml de extracto crudo enzimtico a cada uno de los 4 tubos de ensayo y se dejo reaccionar por los tiempos requeridos por el experimento: 5, 10, 15 y minutos, respectivamente. c) La reaccin se detuvo introduciendo cada tubo en bao de agua a 100C por 3 minutos y luego puestos en agua helada. d) Simultaneamente en otros dos tubos se hicieron los blancos para el sustrato y para la enzima. e) Finalmente se hicieron las determinaciones de azucares reductores.
Con una pipeta se cogio 0.25 ml de caldo enzimtico de invertasa
21
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Se extrajo 250 ml de solucin concentrada de sacarosa de concentracion 20 g/l. Y con otra pipeta coger solucin tampn acetato pH 4.7 y mezclarlos.
Se numeran 4 tubos (1,2,3,4) se rotula un tubo para el blanco enzima (BE), se enumera un tubo mas para el blanco sustrato (BS). A los 4 tubos enumerados y el tubo BS se le agrega 2.9 ml de solucin preparada (solucin sacarosa + tampn acetato); y al tubo BE se le agrega 2.9 ml de tampn acetato.
Posteriormente, a los tubos 1,2,3,4,BE se les agrega 0.1 ml de caldo crudo. Se lleva a Bao Maria (45C) a los seis tubos durante 2 minutos.
22
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Con una micropipeta, colocar 1 ml decaldo enzimtico en diferentes tiempos. Al primer tubo se le retira del Bao Maria 5 minutos despus dehaberle agregado el caldo enzimtico, al segundo tubo 10 minutos despus de agregarle la enzima, al tercer tubo a los 15 minutos y al cuarto tubo a los 20 minutos.
Retirado los tubos del Bao Maria, se colocan (cada uno a su respectivo tiempo de salida de agua caliente) en agua hirviendo durante 3 minutos.
23
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Despues del agua a ebullicin, llevar los tubos al agua helada durante 5 minutos aproximadamente y despus se almacena en refrigeracin hasta realizar el anlisis de azucares reductores DNS.
Determinacion de azucares reductores
24
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Realizar todos los pasos de anlisis de azucares reductores por DNS, pero haciendo una dilucin 1:5 (100 l de muestra + 400 l de agua destilada). Luego de hacer todos los pasos, leer Abs en el espectrofotmetro a 540 nm.
Metodo de inmovilizacin de invertada en alginato de sodio a) Prepara una disolucin de alginato de sodio al 2% y calentar a 80C por 15 minutos y luego enfriar a 45C. b) De la disolcuion anterior tomar 5 ml, mezclar con1 ml del preparado invertasa y cargar todo a una jeringa provista de aguja. c) Con la jeringa gotear la mezcla dentro de 30 ml de solucin agitada de CaCl2 0.1 M. d) Los beads esfricos de enzima inmovilizada, dejarlos en reposo en refrigeracin por 3 a 4 horas y luego lavarlos con una solucin de CaCl2 0.05 M. e) Empacar los beads dentro del minireactor.
25
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Prepara una disolucin de alginato de sodio al 2% y calentar a 80C por 15 minutos y luego enfriar a 45C.
De la disolucin anterior tomar 5 mL, mezclar con 1 mL del preparado invertasa y cargar toda una jeringa provista de aguja.
Con la jeringa gotear la mezcla dentro de 30 mL de solucin agitada de CaCl20.1 M.
Los beads esfricos de enzima inmovilizada, dejarlos reposar en refrigeracin por 30 min y luego lavarlos con una solucin de CaCl20.05 M.
26
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Comportamiento de un reactor por lote con enzima inmovilizada a) Preparar 45 ml de sacarosa (20 g/ml) b) Colocarlo en el reactor y dejarlo que alcance 45C. c) Colocar los beads dentro del reactor e inmediatamente sacar la 1 muestra (1 ml con una micropipeta). d) Colocar la muestra en Bao Maria por 3 minutos. e) Llevar a agua helada por 5 minutos, y posteriormente almacenar hasta realizar el anlisis de azucares reductores.
Preparar 45 ml de solucin de sacarosa de concentracin 20g/ml y agregarlos junto con la solucin tampn dentro del mini-reactor.
Mediante un agitador magntico se va removiendo las solucin hasta que alcance una temperatura de 45C. Mientras tanto se lava los beads con solucin tampn hasta eliminar todas las impurezas.
27
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Agregar al mismo tiempo todos los beads, y justo en ese momento se coge la primera muestra de 1 ml con una micropipeta y llevarlo a agua en abullicion por 3 minutos.
Despues del agua a abullicion, colocar los tubos en agua helada por 5 minutos aproximadamente y depsues alamacenarlos en refrigeracin hasta relaizar el anlisis de azucarfes reductores.
28
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Realizar el mismo procedimiento estndar de anlisis de azucares reductores y leer Abs al espectrofotmetro a 540 nm.
29
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Mtodo de inmovilizacin de invertasa en alginato de sodio
Prepara una disolucin de alginato de sodio al 2% y calentar a 80C por 15 minutos y luego enfriar a 45C.
De la disolucin anterior tomar 5 mL, mezclar con 1 mL del
preparado invertasa y cargar toda
una jeringa provista de aguja.
Con la jeringa gotear la mezcla dentro de 30 mL de solucin agitada de CaCl20.1 M.
Los beads esfricos de enzima inmovilizada, dejarlos reposar en refrigeracin por 30 min y luego lavarlos con una solucin de CaCl20.05 M.
30
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Empacar los beads dentro del mini-reactor a 40C, que tiene 20ml de tampon y 25ml std.
Luego tomar 1020ul de muestra cada 30min por 5 horas.
Cada muestra se pone a hervir por 3min, luego se enfra en agua helada y guardar en cada vial.
Luego realizar DNS a las 10 muestras tomadas.
31
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Metodologa de la obtencin de preparado enzimtico de levadura Materiales: Levadura seca Fosfato de sodio a 0.066M Vasos precipitados Probeta Procedimiento:
Se mezclara 43.33gr de levadura desecada con 130ml de fosfato de sodio a 0,066M.
Se tomo 2.28ml de fosfato de sodio para una solucin de 130ml
Ajustar el valor de pHa 8,5.
Dejar reposar toda una noche manteniendo la temperatura a 20C.
Se centrifugara, durante 15 minutos a temperatura ambiente, tomar el sobrenadante y volver a repetir este paso. El sobrenadante mantiene la mayor actividad enzimtica.
El
preparado
enzimtico
obtenido, si no se est usando mejor guardarlo en fro.
32
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Determinacin de azcares reductores mediante el mtodo del DNS Materiales: Reactivo DNS Espectrofotometro Mechero Procedimiento: Agua destilada Micropipeta Matraces
Se aade 1 mL de reactivo DNS a un 1 mL de muestra a analizar.
Se mantiene la mezcla en bao de agua a ebullicin durante 5 minutos para luego enfriar con agua helada.
Se aaden 5 ml de agua destilada, y se deja reposar por 15 minutos,
luego agitar.
Se lee la absorbancia a 540 nm, utilizando agua como blanco. La concentracin se obtiene interceptando la medida de absorbancia en la curva de calibrado. .
33
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
La curva de calibrado para el azcar se obtiene a partir de muestra de concentracin conocida y analizadas segn este procedimiento.
Disear y montar el sistema mini-reactor con invertasa inmovilizada, para determinar los parmetros cinticos de la enzima. La forma usual de usual de determinar los parmetros cinticos es a travs de mediciones de velocidad inicial de reaccin a diferentes concentraciones de sacarosa en un reactor por lote. La manera ms adecuada de obtenerlos es por linealizacin de la ecuacin cintica. Para ello emplearemos el mtodo de los inversos o Lineweaver Burke, para un modelo cintico simple
K s K s
34
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Mtodos de linealizacin para determinar parmetros cinticos Mtodo Eje Y 1/v s/v V Eje X 1/s S v/s Intercepto Eje Y 1/v k/V V Intercepto Eje X -1/k -k v/k Pendiente
Lineweaver Burke Hames Eadie Hofstee
k/V 1/v -k
1/v
KAP/VAP 1/VAP
-1/KAP
1/s
Figura 02: Determinacin de parmetros cinticos mediante mtodo de inversos de Lineweaver Burke
35
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
VI. RESULTADOS A. DETERMINACION DEL RANGO DE LINEALIDAD Y ACTIVIDAD ENZIMATICA
Para la determinacin de la actividad de la enzima, utilizamos preparados enzimaticos con distinta concentracin para evaluar la formacin de producto en el tiempo. En todos los casos se observa que aproximadamente despus de 15 minutos de reaccin, la produccin decae. Las pendientes de las rectas, nos permiten determinar la actividad enzimtica.
GRUPO A-1 DILUCION 1:1
DILUCIN 01:05 01:05 01:10 01:10 B. SUSTRATO B. ENZIMA
ABSORBANCIA 0.481 0.8 0.448 0.368 0.014 0.239
TIEMPO (min) 0 5 10 15 20 BLANCO ENZIMA BLANCO SUSTRATO
CONC. (g/L) 0 5.026153115 8.818354731 9.267712791 7.365668093 0.429862102 -0.10508797
Conc. Ajustada 0 4.596291013 8.38849263 8.837850689 6.935805991 0
36
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
GRUPO A-2 DILUCION 1:2
DILUCIN 01:01 01:02 01:03 01:03
ABSORBANCIA 0.902 0.726 0.773 0.493
TIEMPO (min) 0 5 10 15 20 BLANCO ENZIMA BLANCO SUSTRATO
CONC. (g/L) 0 2.006 3.1754 5.0982 3.1012 0.1 0.033
Conc. Ajustada 0 1.906618165 3.076018165 4.998818165 3.001818165 0.099381835 0
37
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA GRUPO A-3 DILUCION 1:3
DILUCIN 01:03 01:03 01:03 01:03
ABSORBANCIA 0.127 0.337 0.421 0.224
TIEMPO (min) 0 5 10 15 20 BLANCO ENZIMA BLANCO SUSTRATO
CONC. (g/L) 0 0.4914 1.9887 2.5878 1.1826 0.1 0.027
conc. Ajustada 0 0.392018165 1.889318165 2.488418165 1.083218165 0.099381835 0
Las ecuaciones de las rectas halladas son las sgts: Y1= 0.8388X+0.134 Y2= 0.3233X+0.0705 Y3= 0.1793X-0.1519
38
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
METODO DE BRADFORD PARA LA DETERMINACION DE PROTEINAS
Solo consideramos la concentracin de protenas en un rango 0.5-1 para obtener la ecuacin de la recta con R=0.9959, que permite el calculo de concentracin de protenas en las muestras con mayor exactitud.
Concentracin g/l
Abs. 0.577 0.425 0.348 0.239 ABS 0.173 0.103 0
0.8 0.6 0.4 0.2 0 0
1 0.7 0.5 0.3 0.2 0.1 0
CURVA DE CALIBRADO DE PROTEINA Sol. Std. Albmina 1 g/L
y = 0.5514x + 0.0458 R = 0.9817 Series1 Linear (Series1) 0.5 1 1.5
Concentracin
Solo consideramos la concentracin de protenas en un rango 0.5-1 para obtener la ecuacin de la recta con R=0.9959, que permite el calculo de concentracin de protenas en las muestras con mayor exactitud.
39
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
B. DETERMINACION DE VELOCIDAD INICIAL DE REACCION A DISITINTAS CONCENTRACIONES DE SUSTRATOS
Para la determinacin de la velocidad inicial de reaccin Vi o tambin actividad inicial, se prepararon solucions de sacarosa con distinta concentracin como se muestra en la tabla siguiente para medir la efectividad de la enzima en la formacin de producto a travs del tiempo. Solo se tomaron las evaluaron indicadas por motivos de tiempo
Tcnica experimental: (A) (B) (C) Buffer acetato 0.05M, pH= 4.7 Preparado Enzimtico, extracto crudo de invertasa Solucin sustrato de sacarosa So=20gr/L
SOLUCIONES DE SACAROSA A DISTINTA CONCENTRACION
N muestra 1 2 3 4 5 6 7 8 9 10
Solucin A (ml) 26 23 20 18 15 12 9 6 3 0
Solucin B (ml) 1 1 1 1 1 1 1 1 1 1
Solucin C (ml) 3 6 9 11 14 17 20 23 26 29
Sacarosa (g/l) 2 4 6 7.3 9.3 11.3 13.3 15.3 17.3 19.3
40
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA Los resultados de absorbancia obtenidos para cada una de las muestras se muestan a en los cuadros siguientes junto a las concentraciones de producto obtenidos con la ecuacin de la curva de calibrado. Para la determinacin de Vi se utilizaron las rectas obtenidas al relacionar Concentracion vs Tiempo. Las graficas se muestran tambin. DNS/Min 0 2 6 10 15 dilucin 2 0.233 0.397 0.649 0.923 3 0.158 0.298 0.456 0.702 4 0.192 0.401 0.671 0.924 7 0.120 0.201 0.314 0.454 01:04 8 0.105 0.151 0.212 0.266 01:04 10 0.032 0.113 0.232 0.378 01:05
La ecuacin de la curva de calibrado DNS para la determinar la concentracin de producto es:
Abs= x*0.4915 0.0043
DNS/Min 0 2 6 10 15
2 0.482807731 0.816480163 1.329196338 1.886673449
3 0.330213632 0.615055951 0.936520855 1.437029502
4 0.798779247 1.64923703 2.747914547 3.777416073
7 1.011597152 1.670803662 2.590437436 3.729806714
8 0.88952187 1.26388606 1.76032553 2.19979654
10 0.36927772 1.19328586 2.40386572 3.88911495
41
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Las ecuaciones de las rectas obtenidas son las siguientes: Y2= 0.11X+0.2209 Y3= 0.0851X+0.1278 Y4= 0.2329X+0.3218 Y7= 0.2116X+0.5048 Y8= 0.1027X+0.6811 Y10=0.2746X-0.3012
Se puede observar que no hay estabilidad en la variacin de la Vi en relacin a la concentracin inicial de sustrato. Estos fueron los resultados obtenidos por ello se reportan para favorecer la discusin.
42
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Se puede observar que no hay estabilidad en la variacin de la Vi en relacin a la concentracin inicial de sustrato.esto tambin se observa en la pendiente de las curvas mostradas en el grafic siguiente.
43
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
C. DETERMINACION DE LOS PARAMETROS CINETICOS DE LA ENZIMA LIBRE
Para la determinacin de los parmetros cinticos Vmax Y Kmax se utilizan los valores de Vi hallados anteriormente. El modelo utilizado es la ecuacin de Lineawer-Burk. Los valores de los parsmetros utilizados se muestran a continuacin. muestras 2 3 4 7 8 10 s 4 6 9.3 13.3 15.3 19.3 1/s 0.25 0.166666667 0.107526882 0.07518797 0.065359477 0.051813472 Vi 0.11 0.0851 0.2329 0.2116 0.1027 0.2746 1/Vi 9.090909091 11.75088132 4.293688278 4.725897921 9.737098345 3.641660597
As tendremos que: 1/V= (Kmax/Vmax)*(1/S) + (1/Vmax) Y= 24.566 (1/S) + 4.227 RELACIONANDO: (1/Vap)= 4.227 Entonces: Vap= 0.2340
44
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
(Kap/Vap)= 24.566 Entonces: Kap= 5.7493
Concluimos que los parmetros cinticos de la enzima para los clculos del Grupo A
V 0.23403857 K 5.7493915
Para efectos de comparacin de resultados se muestran tambin los parmetros cinticos obtenidos por el Grupo B, cuya linealidad en la grafica de Lneawer-Burk es de R=0.9807. Se muestran los valores de absorbancia y concentracin que permiten determinar los valores de Vi y los clculos posteriores.
sacarosa g/l DNS/Min 0 2 6 10 15 activ(g/l*mi)
1 0.3098678 0.6231943 0.9385554 1.2172940 0.0703
10
0.59267548 0.6889115 1.42950153 1.0103764 1.04699898 1.17660224 0.90050865 2.3491353 2.03173957 2.08870804 1.69338759 2.10498474 2.93102747 3.04089522 2.91475076 2.19593082 3.03682604 3.94832146 4.0785351 3.9768057 0.1233 0.1803 0.1893 0.2368 0.2232
DNS/Min 0 2 6 10 15 Dilucion
1 0.148 0.302 0.457 0.594
3 0.287 0.574 0.828 1.075
5 0.165 0.217 0.513 0.742 01:02
7 0.347 0.573 0.716 0.966 01:02
9 0.244 0.495 0.743 0.998 01:02
10 0.253 0.509 0.712 0.973 01:02
45
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
s (g/l) 2 6 9.3 13.3 17.3 19.3
1/s 0.5 0.16666667 0.10752688 0.07518797 0.05780347 0.05181347
Vi 0.0703 0.1233 0.1803 0.1893 0.2368 0.2232
1/a 14.2247511 8.11030008 5.5463117 5.28262018 4.22297297 4.48028674
46
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA En este caso se determinaron los parmetros cinticos de la misma forma, obtenindose: Vmax= 0.288159 y Kmax= 6.32 En el grafico anterior tambin se observa la relacin lineal entre la formacin de producto y el tiempo en las soluciones de sacarosa.
D. COMPORTAMIENTO DE LA ENZIMA INMOVILIZADA EN UN REACTOR POR LOTES
Para una mejor comprensin de los resultados obtenidos se muestran los clculos de todos los grupos de trabajo. Se muestran los resultados del grupo A-1 y A-2, utilizando los parmetros cinticos del grupo B por indicacin del docente.
Cintica simple:
Como: Vmx = ke Kmx = k ( )
V 0.288159
K 6.32
47
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
GRUPO A2 Dilucion 01:08 01:08 01:08 01:08 01:08 01:08 01:08 01:08 01:08
TIEMPO min 0 30 60 90 120 150 180 210 240
ABS 0.034 0.159 0.315 0.506 0.536 0.645 0.689 0.71 0.724
P(gr/l) 0.33853428 2.70260047 5.65295508 9.26524823 9.83262411 11.8940898 12.7262411 13.1234043 13.3881797
EJE Y valores de X 0.0260411 0.20789234 0.4348427 0.7127114 0.7563557 0.91492999 0.97894163 1.00949264 1.02985997
EJE X (Ke*t)/k 0 1.36784335 2.73568671 4.10353006 5.47137342 6.83921677 8.20706013 9.57490348 10.9427468
48
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
GRUPO A1 Dilucion 01:10 01:10 01:10 01:10 01:10 01:10 01:10
TIEMPO(min 0 60 120 150 180 210 240
ABS 0 0.175 0.37 0.522 0.567 0.663 0.701
P(gr/l) 0 0.33096927 4.94089835 8.53427896 9.59810875 11.8676123 12.7659574
EJE Y valores de X 0 0.01654846 0.24704492 0.42671395 0.47990544 0.59338061 0.63829787
EJE X (Ke*t)/k 0 2.73568671 5.47137342 6.83921677 8.20706013 9.57490348 10.9427468
49
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Utillzando nuestros propios valores de :
V 0.23403857 K 5.7493915
Dilucion 01:10 01:10 01:10 01:10 01:10 01:10 01:10 01:10 01:10
TIEMPO min 0 30 60 90 120 150 180 210 240
ABS 0 0.072 0.175 0.273 0.37 0.522 0.567 0.663 0.701
P(gr/l) 0 0 0.33096927 2.64775414 4.94089835 8.53427896 9.59810875 11.8676123 12.7659574
EJE Y valores de x 0 0 0.01654846 0.13238771 0.24704492 0.42671395 0.47990544 0.59338061 0.63829787
EJE X (Ke*t)/k 0 1.22120003 2.44240007 3.6636001 4.88480013 6.10600016 7.3272002 8.54840023 9.76960026
50
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA Se muestra a continuacin la grafica del comportamiento del reactor por lote con la enzima inmovilizada. Para efectos del calculo no se considero el punto 0.
Comportamiento del reactor por lote A-2 parametros B
1.2 Grado de conversion X 1 0.8 0.6 0.4 0.2 0 0 2 4 6 ke*t/K 8 10 12 Series1 Log. (Series1) y = 0.4193ln(x) + 0.0684 R = 0.9828
Comportamiento del reactor por lote A-1 parametros A
0.7 Grado de conversion X 0.6 0.5 0.4 0.3 0.2 0.1 0 -0.1 0 2 4 6 ke*t/K 8 10 12 Series1 Log. (Series1) y = 0.4733ln(x) - 0.4495 R = 0.9781
51
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
Comportamiento del reactor por lote A-1 parametros B
0.7 Grado de conversion X 0.6 0.5 0.4 0.3 0.2 0.1 0 -0.1 0 2 4 6 ke*t/K 8 10 12 Series1 Log. (Series1) y = 0.4606ln(x) - 0.4738 R = 0.9785
La relacin Si/K que describe el comportamiento del reactor por lote con la enzma inmovilizada se muestra a continuacin.
Grupo A-1 A-1 A-2
Parametro K 5.7493915
6.32366078
Si (g/l) 20 20 13
Si/K 3.4786 3.1627 2.0557
6.32366078
52
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
53
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
VII. DISCUSIONES En la presente practica de laboratorio se realizaron los procedimientos para un caso de biocatalisis enzimtica utilizando invertasa inmovilizada con alginato de sodio y actunado con sacarosa como sustrato. Los procedmientos incluyeron la determinacin del rango de linealidad de la enzima, los parmetros cinticos de la enzima libre y el anlisis del comportamiento de un sistema minireactor por lotes.
En la determinacin del rango de linealidad, se observa que a partir de 10 minutos de reaccin enzimtica, la formacin de producto decae invariablemente en todos los casos analizados, alcanzndose un mayor concentracin de producto cuando el extracto enzimtico esta menos diluido.
La determinacin de la velocidad inicial de reaccin o actividad inicial de la enzima, el anlisis del comportamiento de la enzima a distintas concentraciones de sustrato ( 2-19.3 g/l). en el caso del grupo B, esta actividad aumenta con la concentracin de sustrato inicial, en el caso del grupo A-1 no hay un comportamiento estable susceptible al modelamiento como se describi en los resultados. Es por ello que la ecuacin de Lineawer-Burk utilizada para la determinacin de los parmetros arroja resultados tan disimiles de Vmax ( 0.2340 y 0.288159) y Kmax ( 5.7494 y 6.32) para el grupo A-1 y B respectivamente. Sin embargo en ambos casos, el valor X o grado de conversin de sustrato aumenta en el tiempo. El anlisis del comportamiento del reactor y la relacin Si/K se muestra tambin en los resultados. La invertasa es una enzima que cataliza la hidrlisis de la sacarosa en D-fructosa y Dglucosa. En la levadura comn, dicha enzima se encuentra como un complejo fosfomanano protena localizada en el espacio periplasmtico y su funcin hidrolizar la sacarosa proveniente del medio ya que no est descripta la existencia de transportadores especficos para sacarosa en la membrana plasmtica (UNQ, 2005)
54
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
La variacin en la actividad enzimtica de la invertasa puede deberse a su condicin de inmovilizada.
La cintica de todas las enzimas inmovilizadas es afectada por la carga del soporte, la del sustrato, el dimetro de poro del soporte, las velocidades de difusin y muchos otros parmetros. Adems de estos factores, otros como las velocidades de agitacin y las tasas de flujo desempean tambin un papel importante en la cintica aparente de las enzimas inmovilizadas. A manera de ejemplo se presenta la tabla 1.1, en que se muestran los cambios de KM al inmovilizar la enzima; Weetall informa de un caso muy claro en que el valor de KM depende directamente del flujo del sustrato; encontr que KM disminuye cuando el flujo aumenta, lo que explica que a medida que se incrementa el flujo, la turbulencia tambin aumenta y disminuye la capa esttica del liquido alrededor de cada partcula, lo que lgicamente reduce el efecto de transferencia de masa.
Tabla 1.1 Comparacin de valores de KM de algunas enzimas en solucin e inmovilizadas KM (milimolar) SOLUCIN 0.448 1.85 1.22 10.0 7.70 1.00
ENZIMA SUSTRATO INMOVILIZADA Invertasa Sacarosa 0.448 Arilsulfatasa p-nitrofenilfosfato 1.57 Glucoamilasa Almidn 0.30 Ureasa urea 7.60 Glucosa oxidasa glucosa 6.80 L-amioacido L-leucina 4.00 oxidasa Alcalino fosfatasa p-nitrofenilfosfato 0.10 2.90 * Las enzimas estn inmovilizadas en partculas de vidrio poroso (96% slice)
55
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
La inmovilizacin de enzimas en soportes insolubles puede mejorar la estabilidad enzimtica como tambin permite reciclar la enzima y separarla fcilmente del producto, lo cual tiene beneficios econmicos. Dichas ventajas pueden aplicarse a la produccin de jarabes fructosados a partir de sacarosa si se cuenta con un mtodo para inmovilizar y un soporte barato, que no afecte la especificidad de sustrato y la velocidad de reaccin de la invertasa (-fructofuranosidasa EC: 3.2.1.26). Segn HIDRLISIS DE LA SACAROSA POR INVERTASA INMOVILIZADA EN NYLON-6 EN UN REACTOR CONTINUO.PDF:
Segn INMOBILIZED ENZYMES: THEORY, METHODS OF STUDY AND APPLICATIONS.PDF: A menudo, la inmovilizacin altera significativamente el comportamiento de las enzimas. En primer lugar se producen cambios en su estabilidad, adems de que la enzima inmovilizada es un sistema heterogneo en el cual todos los componentes que intervienen en el proceso cataltico (pH, sustratos, productos, inhibidores, cofactores, activadores, etc.) el cual se encuentran en interface: en el medio de reaccin y en la fase constituida por el soporte con la enzima. Como consecuencia, la actividad enzimtica se ve afectada por efectos de tipo difusional, estrico y del microentorno.
56
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
VIII. CONCLUSIONES Se diseo y realizo una experiencia de estudio cintico con un preparado enzimtico en bruto de invertasa de levadura de panadera en sus formas solubles e inmovilizadas. La actividad de la enzima invertasa diluida 1:1, 1:2 y 1:3 en tampn, mantiene su rango de linealidad hasta por 10 minutos de reaccin con el sustrato. Las velocidades iniciales de reaccin o actividades iniciales obtenidas no tienen relacin con la concentracin de sustrato inicial. Para la experiencia A-1 los parmetros cinticos obtenidos con la ecuacin de Lineawer-Burk fueron de Vmax y Km de 0.2340 mmol/mlmin y 5.7494. La relacin Si/K para nuestra experiencia fue de 3.478.
IX. REFERENCIAS BIBLIOGRAFICAS SCRIBAN RENE; Biotecnologia Segunda Edicion 1985; Editorial El Manual Moderno, S.A., de C.V. ; Mexico, D.F.; pp. 254 315. GACESA P., y HUBBLE J.; Tecnologa de Enzimas 1990; Editorial Acribia S.A; ZARAGOZA ESPAA; cap. 6. Ingeniera Bioqumica, QUINTEROS RAMIREZ Rodolfo, primera edicin. Mxico, edit. Alhomba, 1981. Cintica enzimtica. Profesor Andrs Illanes Frontaura. Escuela de Ingeniera Bioqumica. Universidad Catlica de Valparaso. Reactores Enzimticos. Profesor Agustn Lpez Munguia. Departamento de Biotecnologa. Universidad Nacional Autnoma de Mxico.
57
UNIVERSIDAD NACIONAL DEL SANTA
LABORATORIO DE BIOPROCESOS BIOCATALISIS ENZIMATICA
FUSIN TRADUCCIONAL DE LA INVERTASA ZMINVB DE Zymomonas mobilis A UN DOMNIO DE UNIN A CELULASA.PDF HIDRLISIS DE LA SACAROSA POR INVERTASA INMOVILIZADA EN NYLON-6 EN UN REACTOR CONTINUO.PDF ENZIMAS: QU SON Y PARA QUE SIRVE.PDF Inmobilized enzymes: Theory, methods of study and applications.pdf http://www.bio.mtu.edu/campbell/401lec11p6.html
58
You might also like
- Modelamiento y casos especiales de la cinética química heterogéneaFrom EverandModelamiento y casos especiales de la cinética química heterogéneaRating: 3 out of 5 stars3/5 (1)
- Práctica 4Document11 pagesPráctica 4Mayra Angélica GalvánNo ratings yet
- Bioquimica2Document21 pagesBioquimica2Vero Claros TapiaNo ratings yet
- EnzimasDocument38 pagesEnzimasJason50% (2)
- Enzimas Determinación CuantitativaDocument14 pagesEnzimas Determinación CuantitativaIngeniero PerezNo ratings yet
- Informe de Actividad EnzimaticaaaaaaDocument22 pagesInforme de Actividad Enzimaticaaaaaalizbet perez mezaNo ratings yet
- Taller 7 de EnzimasDocument6 pagesTaller 7 de EnzimasDaniel Felipe CañonNo ratings yet
- BIOQUIMICA2Document21 pagesBIOQUIMICA2Lolhy Burga Hernández100% (1)
- Enzimología Clínica.Document7 pagesEnzimología Clínica.Lara MayoralNo ratings yet
- Clase Tema 5a BiocatalisisDocument86 pagesClase Tema 5a BiocatalisisArianaRiosNo ratings yet
- Aplicaciones-Medicas-De-La-Cinetica-Enzimatica FinalDocument25 pagesAplicaciones-Medicas-De-La-Cinetica-Enzimatica FinalAnonymous gET1JK88% (8)
- Presentación de Cinética EnzimáticaDocument30 pagesPresentación de Cinética EnzimáticaFlorNo ratings yet
- Apuntes EnzimasDocument18 pagesApuntes EnzimasEduardo Peña MelendezNo ratings yet
- EnzimasDocument62 pagesEnzimasyurd leidy100% (4)
- EnzimasDocument16 pagesEnzimasSeoba LeeNo ratings yet
- Cinética EnzimáticaDocument6 pagesCinética EnzimáticaAngie More SolanoNo ratings yet
- Cinética EnzimaticaDocument23 pagesCinética EnzimaticaArturo MoraNo ratings yet
- EnzimasDocument25 pagesEnzimasmichelNo ratings yet
- Conceptos Básicos de Cinética QuímicaDocument8 pagesConceptos Básicos de Cinética QuímicaNicole Del Solar LagosNo ratings yet
- Laboratorio Actividad EnzimaticaDocument8 pagesLaboratorio Actividad EnzimaticaSebastian GaitanNo ratings yet
- Cinética EnzimáticaDocument17 pagesCinética EnzimáticaGianny SRNo ratings yet
- Bioq EnsayoEnzimasDocument13 pagesBioq EnsayoEnzimasAriel TorresNo ratings yet
- Practica BiorreactoresDocument16 pagesPractica Biorreactoresitche3salgado3acostaNo ratings yet
- Guia de BioquímicaDocument8 pagesGuia de BioquímicaEvelynNo ratings yet
- EnzimasDocument22 pagesEnzimasMARIA PAOLA QUINTANA SISANo ratings yet
- Hidrolosis Total Del AlmidonDocument19 pagesHidrolosis Total Del AlmidonJunior GomezNo ratings yet
- Qué Es La Cinética EnzimáticaDocument4 pagesQué Es La Cinética EnzimáticaJesús RGNo ratings yet
- Cuestionario ENZIMASDocument18 pagesCuestionario ENZIMASCristina Russell100% (1)
- Cinetica Enzimatica y MicrobianaDocument29 pagesCinetica Enzimatica y MicrobianaSaul Espinoza HumanNo ratings yet
- TEMA 10 Cinetica EnzimaticaDocument16 pagesTEMA 10 Cinetica EnzimaticaluciaNo ratings yet
- En ZimasDocument71 pagesEn ZimasLeidy ItzelNo ratings yet
- Laboratorio 4 BQDocument13 pagesLaboratorio 4 BQLEONARDO V�CTOR EUGENIO PACHAS QUISPENo ratings yet
- Informe #2Document9 pagesInforme #2Valentina Ordoñez SanchezNo ratings yet
- Clase 6 Cinetica Enzimatica 2023ADocument17 pagesClase 6 Cinetica Enzimatica 2023ASUCAPUCA MARUYAMA DIANA VICTORIA DE ROCIONo ratings yet
- Bbioquimica de Los Alimentos - Enzimas en Panaderia y ConfiteriaDocument33 pagesBbioquimica de Los Alimentos - Enzimas en Panaderia y ConfiteriaHenry Oré Gutiérrez83% (6)
- Cinética EnzimáticaDocument7 pagesCinética EnzimáticaCelisdey CastilloNo ratings yet
- Ev U4 InvestigaciónDocument25 pagesEv U4 Investigacióndaniel santoyoNo ratings yet
- CursoDocument37 pagesCursoMarco Antonio Salazar PalaciosNo ratings yet
- Aporte Tarea 3 BioquimicaDocument15 pagesAporte Tarea 3 BioquimicaSandra PeñaNo ratings yet
- Tarea 2 - Enzimología y BioenergéticaDocument21 pagesTarea 2 - Enzimología y Bioenergéticaliz100% (2)
- EnzimasDocument70 pagesEnzimasLeonardo Galicia CasildoNo ratings yet
- Bioprocesos Preguntas Tipo ExamenDocument4 pagesBioprocesos Preguntas Tipo Examenanthony minho Caballero IparraguirreNo ratings yet
- Enzimas Recombinantes ClaseDocument42 pagesEnzimas Recombinantes ClaseGabriela MejiaNo ratings yet
- Taller de Bioquimica EnzimasDocument15 pagesTaller de Bioquimica EnzimasAlejandra SalcedoNo ratings yet
- Informe Factores Fisico-Quimicos MelyDocument18 pagesInforme Factores Fisico-Quimicos MelyJozzie Melissa L-hNo ratings yet
- Cinetica EnzimaticaDocument112 pagesCinetica EnzimaticaLeirale100% (2)
- Propiedades Fundamentales de Una EnzimaDocument6 pagesPropiedades Fundamentales de Una Enzima•Estella Bemón•No ratings yet
- Enzimas Parte 2Document64 pagesEnzimas Parte 2KAREN ANDREA CACERES HUACARPUMANo ratings yet
- Enzimas y CatálisisDocument42 pagesEnzimas y CatálisissorayakiriachekNo ratings yet
- Bioquimica MicrobianaDocument153 pagesBioquimica MicrobianaMariana LenolNo ratings yet
- Catalisis EnzimaticaDocument14 pagesCatalisis EnzimaticaJessy Rivaz HerreraNo ratings yet
- PRÁCTICA No 3. Enzima Amilasa SalivalDocument15 pagesPRÁCTICA No 3. Enzima Amilasa SalivallpalacioscaNo ratings yet
- Cinética Enzimática y El Efecto de La Concentración de Sustrato y La Temperatura Sobre La Actividad CatalíticaDocument4 pagesCinética Enzimática y El Efecto de La Concentración de Sustrato y La Temperatura Sobre La Actividad CatalíticaCitlalli Damian VertizNo ratings yet
- Marco TeóricoDocument8 pagesMarco TeóricoDaniel Arroyo AedoNo ratings yet
- 34 Article 4Document72 pages34 Article 4Kevin M. MoyaNo ratings yet
- Cinetica EnzimaticaDocument3 pagesCinetica EnzimaticaNIDIA JULISSA ALCALDE CARDENASNo ratings yet
- Qué Es Cinética EnzimáticaDocument21 pagesQué Es Cinética EnzimáticaStefa WupamNo ratings yet
- Practica Nº05 - BioquimicaDocument21 pagesPractica Nº05 - BioquimicaKarin MedinaNo ratings yet
- ENZIMADocument6 pagesENZIMAleticiaNo ratings yet
- Catalisis Enzimatica Equipo No 4Document16 pagesCatalisis Enzimatica Equipo No 4Ilse yuliana GordilloNo ratings yet
- Reparacion Actuador Jeep XJDocument18 pagesReparacion Actuador Jeep XJCesarNo ratings yet
- Ontologia SocialDocument3 pagesOntologia SocialWilmer SuárezNo ratings yet
- S12 Procesos EstocásticosDocument29 pagesS12 Procesos EstocásticosCristianAlarconZarateNo ratings yet
- Metodologia Youdon-DeMarcoDocument3 pagesMetodologia Youdon-DeMarcoFernando ScNo ratings yet
- Instructivo para Pagos de CesantíasDocument13 pagesInstructivo para Pagos de CesantíasDora Maria Cobos VillarragaNo ratings yet
- Clase 19 Con ClavesDocument42 pagesClase 19 Con ClavesMarco Malle MoraNo ratings yet
- Diabetes InformeDocument17 pagesDiabetes InformeDaleshka Herrera ParedesNo ratings yet
- Ideas Claves Unidad 1Document36 pagesIdeas Claves Unidad 1Tatiana Samantha Coello MendozaNo ratings yet
- Cap 1 DesigualdadesDocument14 pagesCap 1 DesigualdadesjuanpalitosNo ratings yet
- Digitalizacion Esp Area II Unam 14 de MayoDocument5 pagesDigitalizacion Esp Area II Unam 14 de MayoVelázquez Martínez Jonathan HazielNo ratings yet
- Preparación Del Terreno AcelgaDocument2 pagesPreparación Del Terreno AcelgaCristopher GarciaNo ratings yet
- Romanos 1 18-32 GAV-80-314 Cuando Dios Abandona A Una NaciónDocument13 pagesRomanos 1 18-32 GAV-80-314 Cuando Dios Abandona A Una NaciónJUANNo ratings yet
- Lenguaje No Verbal NuevoDocument5 pagesLenguaje No Verbal NuevoMOISESNo ratings yet
- Ordenanza Sobre Conservacion Defensa y Mejoramiento Del AmbienteDocument22 pagesOrdenanza Sobre Conservacion Defensa y Mejoramiento Del AmbienteFrancisco Jose DiazNo ratings yet
- La Cultura Desde El Paradigma Del Conflicto SocialDocument3 pagesLa Cultura Desde El Paradigma Del Conflicto SocialYorca Vargas LopezNo ratings yet
- TorresAndrewESM T3Document12 pagesTorresAndrewESM T3ANTONIO ROLDAN MENDOZANo ratings yet
- Teoria 10-Fenómenos Térmicos y TermodinámicaDocument23 pagesTeoria 10-Fenómenos Térmicos y Termodinámicaxa asadNo ratings yet
- La Perestroika Libro (Resumen)Document15 pagesLa Perestroika Libro (Resumen)Mishel BianNo ratings yet
- Giovanni Reale Introduccion A AristotelesDocument212 pagesGiovanni Reale Introduccion A AristotelesIgnacio OtamendiNo ratings yet
- Gomez, Francesc - El Pequeño Libro de Las Redes SocialesDocument161 pagesGomez, Francesc - El Pequeño Libro de Las Redes SocialesLeidy YF100% (1)
- Informe de Gestión Cualitativo y Cuantitativoformato12102020Document6 pagesInforme de Gestión Cualitativo y Cuantitativoformato12102020yeximarNo ratings yet
- Problemas Resueltos de AlgoritmosDocument17 pagesProblemas Resueltos de AlgoritmosDubanNo ratings yet
- Auditoria Preventiva y Procedimientos de Fiscalización Tributaria OkDocument78 pagesAuditoria Preventiva y Procedimientos de Fiscalización Tributaria OkMarcos Noel Campoverde GuerreroNo ratings yet
- Autotrónica IngDocument7 pagesAutotrónica Ingmario gomezNo ratings yet
- Tipos de Texto PDFDocument9 pagesTipos de Texto PDFXamary MurilloNo ratings yet
- Tasas de Los Créditos de Libre Inversión de BancolombiaDocument8 pagesTasas de Los Créditos de Libre Inversión de BancolombiaAnghieNo ratings yet
- Plan de Trabajo Inmunizaciones Huayllasp 2022Document7 pagesPlan de Trabajo Inmunizaciones Huayllasp 2022P.S Huayllaspanca67% (6)
- Lectura Poética Aristóteles 2Document11 pagesLectura Poética Aristóteles 2LIZETH KATERINE CANO ESCOBARNo ratings yet
- Rinne BathtimeDocument39 pagesRinne BathtimeJunior MarcanoNo ratings yet
- Problema Cantidad de Movimiento ResueltoDocument3 pagesProblema Cantidad de Movimiento ResueltoevangelinaNo ratings yet