Professional Documents
Culture Documents
Tecnica Ley de Hess
Uploaded by
Marcos ToscanoCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Tecnica Ley de Hess
Uploaded by
Marcos ToscanoCopyright:
Available Formats
OBJETIVO
- Realizar medidas calorimtricas - Verificar la ley de Hess dentro del margen de error experimental.
MATERIALES
- Calormetro - Termmetro - 3 probetas de 100 y 200 mL - Esptula o cucharilla
SUSTANCIAS
-Hidrxido de sodio solido - Solucin de HCL 0,5M - Solucin de HCL 1,0M -Solucin NaOH 1,0M
TCNICA
Proceso N1: Determinacin del calor de disolucin del hidrxido de sodio 1. Medir 200mL de agua y verterlos en el calormetro 2. Tapar el calormetro e introducir el termmetro. Termosttica agitando suavemente con movimiento circular 3. Medir la temperatura, cuidando que el bulbo del termmetro este dentro del liquido, y registrarla en el cuadro (ti) 4. Medir en la balanza 4,0 g de hidrxido de sodio slido. Nota: El hidrxido de sodio es una sustancia CORROSIVA y DELICUESCENTE, por lo cual deben tomarse precauciones durante su manipulacin. 5. Colocar el hidrxido de sodio en el agua del calormetro y agitar hasta que se disuelva totalmente. 6. Leer la temperatura mxima alcanzada durante el proceso y anotarla en el cuadro de valores (tf) 7. Enjuagar y secar el calormetro y el termmetro Proceso N2: Determinacin del calor de neutralizacin [NaOH(ac) + HCl (ac)] 1. Medir 100mL de solucin de HCl 1,0M y verterlos en el calormetro 2. Tapar el calormetro e introducir el termmetro. Termosttica agitando suavemente con movimiento circular. 3. Medir y anotar la temperatura en el cuadro (ti) 4. Medir 100mL de solucin de NaOH 1,0M y agregarlos al calormetro 5. Agitar suavemente 6. Medir la temperatura mxima alcanzada y anotarla en el cuadro (tf)
Proceso N3: Determinacin del calor de reaccin [NaOH(ac) + HCl (ac)] 1. Proceder en la misma forma que durante el proceso N 1 pero utilizando 200mL de solucin de HCl 0,5M y 4,00g de NaOH solido. 2. Anotar las temperaturas inicial y final del proceso en el cuadro. Aclaracin: Todas las medidas realizadas se registrarn con su error correspondiente. CUADRO DE DATOS
Proceso ti(C) tf (C) t(C) Op (cal) n NaOH(moles) H(cal/mol) N 1 N 2 N 3 16,9 16,9 16,9 21,8 20,2 27,4 4,9 3,3 10,5 979 672,5 2115,7 0,1 0,1 0,1 -20.021 -6.880 -21.652
ACTIVIDADES COMPLEMENTARIAS:
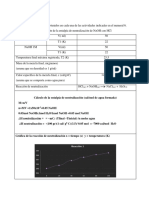
1. Plantear las ecuaciones termoqumicas correspondientes a cada proceso 2. Sumar las ecuaciones correspondientes a los procesos (1) y (2) y comparar el resultado con la ecuacin del proceso (3) 3. Calcular: a) La variacin de temperatura (t) para cada proceso b) El calor absorbido por la solucin en cada proceso (Qp=m.Ce. t) Nota: Para realizar este calcula, tener en cuenta que, como las soluciones son muy diluidas se puede considerar: Que la densidad de las mismas es igual a la del agua pura (1g/mL) y por consiguiente: dado que =m/V msolucin = Vsolucin - Que el calor especifico de las soluciones es igual al calor especifico de H2O pura: 1cal/g.C o 4,18j/g.C c) El numero de moles del hidrxido de sodio que interviene en cada proceso. d) El H por mol de NaOH para cada proceso. Realizar el clculo de error para cada proceso. A partir de los clculos realizados, verificar la ley de Hess teniendo en cuenta los errores correspondientes (H1 + H2 = H3 Analizar las posibles causas de error. Cuestionario: a) Qu es el calor de reaccin? b) En que condiciones experimentales se determina el calor de reaccin? c) Cul es la mayor fuente de error en la determinacin del calor de reaccin? d) Definir entalpia. e) Es la entalpia una funcin de estado? Por qu? f) Enunciar la ley de Hess. g) Es necesario emplear el mismo nmero de moles en los distintos procesos para comprobar la ley de Hess?
4. 5. 6. 7.
You might also like
- 6th Central Pay Commission Salary CalculatorDocument15 pages6th Central Pay Commission Salary Calculatorrakhonde100% (436)
- Informe Capacidad de Intercambio Cationico (Cic) - EdafologiaDocument33 pagesInforme Capacidad de Intercambio Cationico (Cic) - EdafologiaMelpineda100% (1)
- Practica 2 Ley de HessDocument5 pagesPractica 2 Ley de HessOrlando HNo ratings yet
- Calor de Disolución Del Carbonato de Sodio AnhidridoDocument9 pagesCalor de Disolución Del Carbonato de Sodio Anhidridomarisol marinNo ratings yet
- PRÁCTICO CalorimetríaDocument12 pagesPRÁCTICO CalorimetríaCathiiNo ratings yet
- 2023 Ley de Hess HCL NaOHDocument1 page2023 Ley de Hess HCL NaOHbrunomarquez1000No ratings yet
- TermoquimicaDocument12 pagesTermoquimicaGustavo AmaroNo ratings yet
- Ley de Hess 2Document2 pagesLey de Hess 2federico.salvatellaNo ratings yet
- Practica Nº6 Ley de Hess PDFDocument6 pagesPractica Nº6 Ley de Hess PDFJorgeNo ratings yet
- Práctico 5 TermoquímicaDocument3 pagesPráctico 5 TermoquímicaAngélica R.No ratings yet
- CONCLUSIONESDocument13 pagesCONCLUSIONESLucy JonesNo ratings yet
- Entalpia de Descomposicion PDFDocument18 pagesEntalpia de Descomposicion PDFale fgNo ratings yet
- Actividad en El Laboratorio Ley de HessDocument4 pagesActividad en El Laboratorio Ley de HessChristianSilveraNo ratings yet
- PRACTICA N 6 Ley de HessDocument8 pagesPRACTICA N 6 Ley de HessNovito7No ratings yet
- Termodinámica Q.GeneralDocument16 pagesTermodinámica Q.GeneralJorge Jesus Jeri JimenezNo ratings yet
- PRACTICA 2 FisicoquimicaDocument16 pagesPRACTICA 2 FisicoquimicaCarlos Jhair Rodriguez83% (6)
- Practica Nº6 Ley de HessDocument6 pagesPractica Nº6 Ley de HessKiara SalasNo ratings yet
- Lab Termoquimica VirtualDocument4 pagesLab Termoquimica VirtualJose JaimesNo ratings yet
- Informe de Lab.2 - Ciclo 0Document23 pagesInforme de Lab.2 - Ciclo 0Aracelly rojas100% (1)
- Método Titrimétrico A Temperatura AmbienteDocument5 pagesMétodo Titrimétrico A Temperatura AmbienteMaría Díazgranados JiménezNo ratings yet
- Manual Practica Laboratorio IiiDocument7 pagesManual Practica Laboratorio IiiManuel CortesNo ratings yet
- Practica Nº5 Calores de ReaccionDocument10 pagesPractica Nº5 Calores de ReaccionLuis HernandezNo ratings yet
- CALORIMETRÍADocument2 pagesCALORIMETRÍAstdfdn5qpkNo ratings yet
- Determinación de Calor de ReacciónDocument6 pagesDeterminación de Calor de ReacciónOmar JuarezNo ratings yet
- Práctica Fisicoquimica (Ley de Hess)Document5 pagesPráctica Fisicoquimica (Ley de Hess)yazsancer10No ratings yet
- Informe 2 Quimca GeneralDocument11 pagesInforme 2 Quimca GeneralAndrés ToalaNo ratings yet
- Informe 6Document10 pagesInforme 6Alondra Isabel Canchari CuroNo ratings yet
- Calorimetro Mezcla AcidoDocument5 pagesCalorimetro Mezcla AcidoJah MiloNo ratings yet
- Wuolah Free Practica 2 FisicoquimicaDocument13 pagesWuolah Free Practica 2 FisicoquimicahuikiiloNo ratings yet
- Practica 3 TermoquimicaDocument9 pagesPractica 3 TermoquimicaLiNo ratings yet
- FQ Lab 1Document10 pagesFQ Lab 1Aracelly rojasNo ratings yet
- Lab Termoquimica VirtualDocument6 pagesLab Termoquimica VirtualEstefanía ZuluagaNo ratings yet
- Práctica 8 Quim. Fis. Ley de HessDocument8 pagesPráctica 8 Quim. Fis. Ley de HessWilliam AdonNo ratings yet
- Práctica 8 Quim. Fis. Ley de HessDocument8 pagesPráctica 8 Quim. Fis. Ley de HessMlVNo ratings yet
- Práctica de Laboratorio N 6Document15 pagesPráctica de Laboratorio N 6Yonar Shmit Gallo QuispeNo ratings yet
- Practica de Laboratorio TermoquimicaDocument3 pagesPractica de Laboratorio TermoquimicaAngel Gamboa MoralesNo ratings yet
- INFORME-7Document7 pagesINFORME-7AnaisBriggitJacintoChavezNo ratings yet
- Informe Lab 12 QuimicaDocument8 pagesInforme Lab 12 QuimicaRODRIGO MAURO CATACORA ZARABIANo ratings yet
- PRACTICA de Calorimetria IIIDocument6 pagesPRACTICA de Calorimetria IIIalexander ruelas zapata0% (1)
- Informe 3 QG Invierno PDFDocument15 pagesInforme 3 QG Invierno PDFDiana Rita Pomez QuirozNo ratings yet
- Laboratorio Dos. Termoquímica - Ley de HessDocument6 pagesLaboratorio Dos. Termoquímica - Ley de HessSILVIA KATHERIN CANO GUZMANNo ratings yet
- Laboratorio Fisicoquimica 5Document9 pagesLaboratorio Fisicoquimica 5cristian peñarandaNo ratings yet
- Informe de Termoquimica UnmsmDocument17 pagesInforme de Termoquimica UnmsmPier NavarroNo ratings yet
- Informe 7Document15 pagesInforme 7Bruno Alberto Ramirez HerreraNo ratings yet
- Medición de Calor de Una ReacciónDocument3 pagesMedición de Calor de Una ReacciónpoloNo ratings yet
- Informe de TermoquimicaDocument15 pagesInforme de TermoquimicapanachosaurioNo ratings yet
- Ley de HessDocument10 pagesLey de HessMelisa EscorciaNo ratings yet
- Calorimetría y Termoquímica Informe Termo N1 finalPDF PDFDocument13 pagesCalorimetría y Termoquímica Informe Termo N1 finalPDF PDFRous Carolain0% (1)
- III Determinación de Entalpías de Disolución y ReacciónDocument5 pagesIII Determinación de Entalpías de Disolución y ReacciónMalena Zulma Arrieta QuirozNo ratings yet
- Termoquimica2 Laboratorio de Fisicoquimica UNMSMDocument19 pagesTermoquimica2 Laboratorio de Fisicoquimica UNMSMwaldir marcelinoNo ratings yet
- l8 BorraDocument16 pagesl8 BorraErika GarciaNo ratings yet
- Semana5-Guia de LaboratorioDocument5 pagesSemana5-Guia de LaboratorioMARIANO ENRIQUE VARA ALMANZANo ratings yet
- Calorimetria MiaDocument6 pagesCalorimetria MiaEliecer GonzalezNo ratings yet
- Bomba ClorificaDocument8 pagesBomba ClorificaJuanse ParoliNo ratings yet
- Calor de Reaccion (Calorimetro A Presion Constante)Document24 pagesCalor de Reaccion (Calorimetro A Presion Constante)Camilo VanegasNo ratings yet
- Trabajo de Labo #7Document12 pagesTrabajo de Labo #7Veronica ZumaetaNo ratings yet
- Solubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Document10 pagesSolubilidad Del Ácido Benzóico y Determinación de Entalpía de Solución.Oscar Portillo100% (1)
- Laboratorio 1Document3 pagesLaboratorio 1Eric S.CNo ratings yet
- Practica 2 Calor de ReaccionDocument8 pagesPractica 2 Calor de ReaccionAxel Moreno ModestoNo ratings yet
- Qumica Numero 7Document6 pagesQumica Numero 7Sergio SantillanNo ratings yet
- Ingeniería química. Soluciones a los problemas del tomo IFrom EverandIngeniería química. Soluciones a los problemas del tomo INo ratings yet
- Primera ParteeDocument4 pagesPrimera ParteeMarcos ToscanoNo ratings yet
- Masa Molar SerpadaDocument4 pagesMasa Molar SerpadaMarcos ToscanoNo ratings yet
- Quimica SerpadaDocument1 pageQuimica SerpadaMarcos ToscanoNo ratings yet
- Quimica PiolaDocument3 pagesQuimica PiolaMarcos ToscanoNo ratings yet
- Resumen QuimicaDocument1 pageResumen QuimicaMarcos ToscanoNo ratings yet
- Quimica en La CasaDocument1 pageQuimica en La CasaMarcos ToscanoNo ratings yet
- Primera ParteeDocument4 pagesPrimera ParteeMarcos ToscanoNo ratings yet
- NewsletterDocument6 pagesNewsletterMarcos ToscanoNo ratings yet
- Socio Economico en PPDocument11 pagesSocio Economico en PPMarcos ToscanoNo ratings yet
- SwicheeaDocument2 pagesSwicheeaMarcos ToscanoNo ratings yet
- Control QuimicaDocument1 pageControl QuimicaMarcos ToscanoNo ratings yet
- Reactivo de FehlingDocument1 pageReactivo de FehlingMarcos ToscanoNo ratings yet
- Qué Es Un Suplemento AlimenticioDocument1 pageQué Es Un Suplemento AlimenticioMarcos ToscanoNo ratings yet
- Filo SofiaDocument4 pagesFilo SofiaMarcos ToscanoNo ratings yet
- Propiedades Químicas y Fisicoquímicas de Las ProteínasDocument26 pagesPropiedades Químicas y Fisicoquímicas de Las Proteínas.:("*"BLacK BuLLeT"*"):.89% (45)
- FisicaDocument1 pageFisicaMarcos ToscanoNo ratings yet
- Tecnica Ley de HessDocument2 pagesTecnica Ley de HessMarcos ToscanoNo ratings yet
- Quimica PiolaDocument3 pagesQuimica PiolaMarcos ToscanoNo ratings yet
- Practica Glucidos Parte 2Document1 pagePractica Glucidos Parte 2Marcos ToscanoNo ratings yet
- Analisis de Al LectorDocument2 pagesAnalisis de Al LectorMarcos Toscano100% (2)
- R 54248Document6 pagesR 54248Yesenia SanchezNo ratings yet
- R 54248Document6 pagesR 54248Yesenia SanchezNo ratings yet
- P3Document5 pagesP3Marcos ToscanoNo ratings yet
- ControlDocument12 pagesControlMarcos ToscanoNo ratings yet
- Reactivo de FehlingDocument1 pageReactivo de FehlingMarcos ToscanoNo ratings yet
- Cola GenoDocument1 pageCola GenoMarcos ToscanoNo ratings yet
- Aminocadis en ComidasDocument3 pagesAminocadis en ComidasMarcos ToscanoNo ratings yet
- Aminocadis en ComidasDocument3 pagesAminocadis en ComidasMarcos ToscanoNo ratings yet
- Materiales Aglutinantes y El ConcretoDocument46 pagesMateriales Aglutinantes y El ConcretoFabio OtxoaNo ratings yet
- Quimica Ok PDFDocument46 pagesQuimica Ok PDFWalter Quispe ChaucaNo ratings yet
- PRÁCTICA # 2 CALOR DE MEZCLA Chan ChanDocument19 pagesPRÁCTICA # 2 CALOR DE MEZCLA Chan ChanLUAR PADRONNo ratings yet
- Ensayo de Chispa y LimaDocument6 pagesEnsayo de Chispa y LimaJavier CasanovaNo ratings yet
- Peroxisomas, Plastidios y Mitocondrias 1.2Document5 pagesPeroxisomas, Plastidios y Mitocondrias 1.2Cristina Odeht De la cruz TenazoaNo ratings yet
- Infografia Enzima - SacarasaDocument2 pagesInfografia Enzima - SacarasaElizabeth VeraNo ratings yet
- Informe Lab 1 QuimicaDocument22 pagesInforme Lab 1 Quimicajoel noriegaNo ratings yet
- MSDS Cal DolomaxDocument4 pagesMSDS Cal Dolomaxjairo padillaNo ratings yet
- Flujograma 2Document2 pagesFlujograma 2Herbert Martin Colan TorresNo ratings yet
- Estudio de La Integridad y Vida Útil Remanente-Calderas Termozipa-EMGESADocument33 pagesEstudio de La Integridad y Vida Útil Remanente-Calderas Termozipa-EMGESAMarcelino Navarrete Evaristo100% (1)
- ACEITES ESENCIALES Evidencia SENADocument8 pagesACEITES ESENCIALES Evidencia SENAMonica MosserNo ratings yet
- MACROMOLÉCULASDocument3 pagesMACROMOLÉCULASNicole de la RosaNo ratings yet
- 2 DiccionariotecnologianuclearDocument548 pages2 DiccionariotecnologianuclearLa Cerrazón de WansNo ratings yet
- Presentación #2 TabletasDocument40 pagesPresentación #2 TabletasMaria Cecilia MorcilloNo ratings yet
- Tarea3 TermodinamicaDocument4 pagesTarea3 TermodinamicabeatrizNo ratings yet
- Proyecto (Preparación, Caracterización y Discriminación de Nuevos Catalizadores en El Proceso de Síntesis de DME)Document46 pagesProyecto (Preparación, Caracterización y Discriminación de Nuevos Catalizadores en El Proceso de Síntesis de DME)consueloNo ratings yet
- M4 S.4 Biología 3° SDocument4 pagesM4 S.4 Biología 3° SBenji Padilla CamposNo ratings yet
- CALIZADocument9 pagesCALIZAbelen adriana puma vera0% (1)
- Aislantes Térmicos-Instalaciones EspecialesDocument5 pagesAislantes Térmicos-Instalaciones EspecialesRaul Pacco HanccoNo ratings yet
- 425ficha-seguridad-FDS HARDENER HV 998-1 (07-11-2019) .CleanedDocument25 pages425ficha-seguridad-FDS HARDENER HV 998-1 (07-11-2019) .CleanedRossel CruzNo ratings yet
- Indice PeroxidoDocument9 pagesIndice PeroxidoManuel Guillen ParicelaNo ratings yet
- Deformación en FríoDocument9 pagesDeformación en FríoCarlos Cepeda LópezNo ratings yet
- Foro Calor y TemperaturaDocument2 pagesForo Calor y TemperaturaMarco Antonio Tasayco Yataco100% (1)
- Contenido de Agua y Actividad de AguaDocument7 pagesContenido de Agua y Actividad de AguaDenisse VelásquezNo ratings yet
- Extraccion de Aceite Cascara de Mandarina AYUDADocument5 pagesExtraccion de Aceite Cascara de Mandarina AYUDAEstefany María BlancoNo ratings yet
- Determinacion de Cloruros Grupo 5 FinalizadoDocument5 pagesDeterminacion de Cloruros Grupo 5 FinalizadoguillermoNo ratings yet
- Tarea 2Document4 pagesTarea 2Francisco PaulinoNo ratings yet
- Materiales de ConstrucciónDocument24 pagesMateriales de ConstrucciónBelen ErikaNo ratings yet
- Q218 Ejercicio 1.01-1Document1 pageQ218 Ejercicio 1.01-1BarbaraNo ratings yet