Professional Documents
Culture Documents
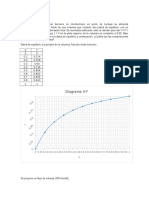
Metodo Ponchon Savarit
Uploaded by
Luz Maritza FloresOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Metodo Ponchon Savarit
Uploaded by
Luz Maritza FloresCopyright:
Available Formats
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
Destilacin
Binaria
Por el Mtodo de
Ponchon-Savarit
Antonio Valiente Barderas
Facultad de Qumica
UNAM, C.U.
Mxico D.F.
2010
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
2
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
3
Amable Lector
Este fascculo ha sido escrito para presentar a los estudiantes profesionales y
personas interesadas en la materia de la destilacin binaria por el mtodo propuesto
por los cientficos Marcel Ponchon y R. Savarit. Este tipo de destilacin es muy
utilizada en la industria petroqumica, vitivincola y qumica para la separacin de
mezclas lquidas miscibles.
Los lectores que empleen este libre deberan estar familiarizados con los
balances de materia y energa, con fisicoqumica, termodinmica y con las
operaciones unitarias de transferencia de momentum, calor y masa que esos
conocimientos son tiles para entender la materia de qu trata este libro.
Es fascculo ha sido diseado para adentrar al lector poco a poco en la
operacin unitaria de destilacin binaria mediante el aprendizaje de conceptos,
habilidades y aplicacin de a la resolucin de problemas. El fascculo forma parte de
una serie de documentos similares en los cuales se abordan distintas operaciones
unitarias y ha sido posible gracias a la dedicacin del Sr. Gustavo Lpez Palacios
quien a travs de su Servicio Social y Tesis me ayudo a poner en limpio mis apuntes
que durante varios aos haba ido reuniendo sobre la materia.
Por ultimo no me queda sino agradecer la atencin y el cuidado que muestren
al utilizar este fascculo y esperar que sean tan amables de indicarme fallas, erratas
y errores que detecten al emplearlo: esto me permitir mejorarlo y presentar un texto
ms acabado en la siguiente edicin.
Gracias
Antonio Valiente Barderas
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
4
Curriculum resumido
Antonio Valiente Barderas naci en Madrid, Espaa en 1941. Al emigrar sus
padres lo trajeron a Mxico en 1950. Desde 1955 tiene la nacionalidad mexicana. Es
ingeniero qumico egresado de la Facultad de Qumica de la UNAM en 1965, casado
y con tres hijos.
Tiene la maestra en Ingeniera Qumica del Tecnolgico de Loughborough
en Inglaterra en 1970 y la Maestra en Administracin Industrial de la Facultad de
Qumica de la UNAM y el Doctorado en Docencia en la Universidad la Salle de
Mxico.
Es profesor universitario desde 1966 y profesor de tiempo completo en la
Facultad de Qumica de la UNAM desde 1971 en donde ha sido, entre otras cosas,
Jefe del laboratorio del Ing. Qumica y Coordinador de la misma carrera.
Ha dado, adems, clases de ingeniera qumica en la U. Ibero Americana, U.
La Salle, la Universidad Simn Bolvar, la U.A. de Yucatn, la U.A. del Carmen, la
U.A. de Baja California, la U.A. de Veracruz en Xalapa, la U.A. del Valle de Mxico
el Tecnolgico de Monterrey Campus Edo. De Mxico.
Es autor de 17 libros y ms de 30 artculos sobre la ingeniera qumica y ha
dirigido 87 tesis de licenciatura sobre la especialidad. Sus reas de inters son las
Operaciones Unitarias y la Enseanza de la Ingeniera Qumica.
Actualmente trabaja en la Facultad de Qumica de la UNAM, en donde es
profesor titular e investigador, tiempo completo nivel C y tiene una antigedad de
ms de 34 aos en la UNAM.
En 1998 La Sociedad Qumica de Mxico le otorg el premio nacional Andrs
Manuel del Ro en docencia.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
5
Introduccin
HISTORIA DE LA DESTILACIN
La operacin unitaria de destilacin es una de las ms empleadas en la industria
qumica, petroqumica, alimentaria, farmacutica y perfumera, para la separacin de
los componentes que forman mezclas lquidas miscibles. La destilacin es una
operacin unitaria de transferencia de masa, tal como la absorcin o la cristalizacin.
De acuerdo con el diccionario (Valiente, 1990) la destilacin es la operacin cuyo
fin es la separacin de dos o ms lquidos miscibles mediante la ebullicin. Los
vapores obtenidos se recuperan como producto deseable y se condensan. Los vapo-
res condensados son ms ricos en el lquido o lquidos ms voltiles, mientras que
los fondos, o lquidos remanentes, son ms ricos en las sustancias menos voltiles.
Esta operacin recibe tambin los nombres de alambicacin, refinacin,
agotamiento, fraccionamiento y rectificacin.
Origen
Hasta donde se sabe, el proceso de la destilacin fue inventado por los
alquimistas egipcios, quienes emplearon gran cantidad de aparatos diseados para
vaporizar sustancias voltiles y tratar los metales con ellas. Parece que,
ocasionalmente, se realizaba una especie de destilacin de lquidos. Por ejemplo, se
calentaba agua de mar en calderos cubiertos y se sacudan las gotas condensadas
en las tapaderas, con el fin de usadas como agua para beber. Asimismo, el aceite de
pez se elaboraba por el calentamiento del alquitrn y la subsecuente condensacin
de su vapor. El mercurio se obtena al calentar el cinabrio (mineral de sulfuro de
mercurio) sobre un plato de hierro, colocado dentro de una olla cubierta con un
puchero
Figura 1. Alambique.
o "ambix", en el que se condensaba el vapor de mercurio. Posteriormente, ese
trmino se us para denominar al aparato completo de la destilacin, en rabe al
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
6
anbiq,, de donde procede nuestro alambique.
Los alquimistas griegos, en el siglo prima nuestra era, inventaron el alambique
para destilar sustancias. Un alambique o destilador est compuesto de tres partes:
una vasija en la que se calienta el material que se va a destilar, una parte fria. Para
condensar el vapor producido y un recipiente para recogerlo (figura 1).
La destilacin se invent como un medio obtener un lquido capaz de atacar o
colorear los metales. Ciertamente, no se conoce el uso de alambiques para
propsitos no alqumicos hasta alrededor de 700 aos despus de su primer
empleo en la alquimia, cuando los encontramos en libros de recetas Debe
comprenderse que la falta de instrumentos. (termmetros, por ejemplo) y el hecho de
que no se conocieran disolventes ni cidos ms fuertes que el vinagre, representaba
una limitacin del campo de estudio. Los antiguos qumicos trabajaban
principalmente sobre alambiques primitivos, lo que les impeda recuperar los
compuestos de bajo punto de ebullicin. De aqu que no se descubrieran productos
qumicos como el alcohol hasta la poca de los rabes, aunque desde muchos
siglos atrs se conocan bebidas alcohlicas como el vino y la cerveza (Forbes,
1958).
En el mundo antiguo
Los conocimientos qumicos de los rabes eran considerables. Aunque no
profundizaron en la qumica terica, su qumica aplicada era positivamente superior
a la de los qumicos helnicos. Un grupo considerable de qumicos se inclin a las
teoras y discusiones abstrusas sobre la alquimia, en tanto que varios de los
notables, despreciaban a los" devotos de al-kimiya que conocen frecuentes maneras
de engaar a sus vctimaS'. Un genio, Abu Mussah-al-Sofi o Geber, quien vivi
alrededor de 760 dC describi mtodos mejorados de evaporacin, filtracin,
sublimacin, fusin, destilacin y cristalizacin. Otros como IbnSina, mejor conocido
como Avicena, clasificaron minerales y productos qumicos y describieron muy
detalladamente su elaboracin. Gracias a los esfuerzos de stos se estableci la
diferencia entre sosa y potasa. Dej de ser un misterio la purificacin de vitriolo,
alumbre, nitro y sal de amoniaco. La mayora de estos avances se debi a las
mejoras introducidas en los aparatos y en la calidad de los vidrios y esmaltes. Los
rabes fueron, por supuesto, famosos en el arte de la alfarera, 'especialmente por
los esmaltes lustrosos y coloridos aplicados a vasijas de barro. Estos vasos
esmaltados, muchos de los cuales eran refractarios, fueron bien diseados para
procesos tecnolgicos. Aunque la importacin de la alfarera y la porcelana de China
se remonta al siglo VIII, el secreto de la manufactura de esta ltima no se conoci en
Persia antes del siglo XII. La calidad de esta alfarera contribuy notablemente a
facilitar el trabajo de los alquimistas rabes, que intentaban algo parecido a la
produccin en gran escala de determinados productos. Inventaron hornos cilndricos
o cnicos, en los que disponan hileras de alambiques para producir agua de rosas o
"nafta" (gasolina) por medio del calor de los gases de combustin. Un incendio en la
ciudadela de El Cairo en 1085, destruy no menos de 300 toneladas de gasolina
almacenada all. El mtodo del horno de galera que acabamos de describir era la
nica forma en que podran producirse tales cantidades.
Los antiguos textos mencionan ciudades como Damasco entre los centros
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
7
manufactureros y destiladores. Debido a ellos en la qumica actual tenemos nombres
rabes para aparatos y productos qumicos: lcali, antimonio y alambique. El
procedimiento de destilar alcohol y producir cidos fuertes, como el sulfrico y el
ntrico, afectaron de manera importante a muchas tcnicas; la produccin de
perfumes, por ejemplo, cambi totalmente. Los qumicos antiguos
Figura 2. Alambique de la poca del Renacimiento.
obtenan sus esencias por enfleurage, esto es, mezclando flores y hierbas con
grasas o ceras fundidas, que despus se separaban por filtracin. Las esencias
responsables del aroma eran as absorbidas por el aceite o la grasa. Pero los rabes
empezaron entonces a mezclar las hierbas y las flores con alcohol o agua, y a
destilar las mezclas para producir un perfume lquido. Cuando se usaba agua, las
esencias formaban una capa fina en la parte superior de la mezcla y podan
separarse por decantacin. De este modo se produca el agua de rosas a partir de
los ptalos de las rosas. ste es el inicio de la destilacin por arrastre con vapor. Los
descubrimientos rabes produjeron un gran impacto en la Europa medieval, y sobre
todo la alquimia produjo furor en todos los reinos europeos. .
Gradualmente se introdujo en Europa la prctica de enfriar el tubo de salida del
alambique y, a partir del siglo XN, la salida se convirti en un serpentn condensador
del que deriva el refrigerante moderno.
Con esta mejora se consiguieron recuperar, por condensacin, los lquidos y
sustancias que tienen bajo punto de ebullicin. Las primeras descripciones europeas
del alcohol datan de los alrededores del ao 1100. Se encuentran en manuscritos
del gran centro mdico que fu Salermo. Cien aos despus, el alcohol, obtenido
por la destilacin del vino, era ya una sustancia bien conocida. Durante la Edad
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
8
Media, el alcohol concentrado sola prepararse en dos etapas; la primera destilacin
produca un alcohol de 60%, al que se le daba el nombre de agua ardens, o
aguardiente, una nueva destilacin suba la concentracin al 96%, el producto final
se conoca por el nombre de aqua vitae, o agua de la vida. En 1320, se produca
alcohol en gran escala en Mdena, Italia y su conocimiento se extendi a Francia y
Alemania (Forbes, 1958).
Monasterios y farmacias empleaban este alcohol para preparar cocciones de
hierbas, que al principio se vendan como medicinas. La peste negra, que devast la
poblacin de Europa, fue una de las causas de la difusin de la aficin al alcohol
fuerte. Despus de ese holocausto, la costumbre de beber "brandy", licores y
aguardiente o ginebra (de 33 a 45% de alcohol, o ms), qued firmemente arraigada
como costumbre social. Hasta entonces los licores que se beban contenan
pequeos porcentajes de alcohol,. tales como vinos y cervezas (7 a 15% en
volumen).
El monasterio de los benedictinos, dio su nombre a un famoso "brandy". La
tcnica mejorada de la destilacin hizo posible otro importante progreso en el campo
de la qumica: desde 1150, los qumicos italianos destilaron -cido ntrico de una
mezcla de nitro y alumbre. Venecia, y algunas ciudades de Francia y Alemania,
fueron los centros productores de este cido, que era el principal re activo empleado
para la refinacin del oro que contena plata. El cido sulfrico se produca en el
siglo XIII ya sea por destilacin de alumbre, o quemando azufre sobre agua bajo una
campana de cristal. En el siglo XV se destilaba cido clorhdrico de una mezcla de
nitro y sal comn. El conocimiento de estos cidos fuertes se difundi rpidamente,
en todas direcciones; se aplicaron a la disolucin de sales, en metalurgia y en el
trabajo de metales, as como en calidad de agentes mordientes, o de blanqueado.
El conocimiento de los cidos y los disolventes de bajo punto de ebullicin, como el
alcohol, result de extraordinaria importancia para el progreso de la qumica, tanto
terica como experimental. Los qumicos antiguos se haban limitado generalmente
al estudio de slidos o lquidos. Ahora podan estudiarse los cuerpos en disolucin
con otros compuestos. La industria qumica se integr al dominio del gremio de los
destiladores, que en el siglo XV comprenda no slo a los fabricantes de ginebra, Si
tambin a los boticarios y a los fabricantes de cidos La destilacin de cidos abri
la puerta a la produccin de diversos productos qumicos nuevos.
La medicina, en la primera parte de la Edad Media, no contaba en general ms
que con medicamentos en forma de polvos y jarabes. Estos ltimos fueron
reemplazados entonces por tinturas, es decir disoluciones o destilados de la droga o,
el especfico en alcohol.
Los perfumes que se haban preparado siempre en la forma clsica, macerando
hierbas y aceites o grasas, se empezaron a fabricar a la usanza rabe; es decir, por
destilacin y disolucin con el alcohol.
Hasta el siglo XIX los alambiques fueron del tipo de lotes con poco reflujo; eran
muy pequeos, de 30 a 80 centmetros de dimetro y 1.5 metros de alto, con todo y
accesorios.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
9
La modernidad
Los primeros libros sobre destilacin aparecieron en el siglo XVI (Brunschwig,
1500; Andrew, 1527); uno de ellos aparece ms tarde, escrito por Libanius (1606).
Boyle destil alcohol de madera y vinagre, y recibi las diferentes fracciones de
acuerdo con sus puntos de ebullicin, lo que constituy probablemente la primera
destilacin analtica. Tuvieron que pasar muchos siglos para que, al llegar la
revolucin Industrial, se encontraran nuevos usos para la destilacin. En esa poca
los experimentos realizados para obtener coque de buena calidad demostraron que
el carbn desprende un gas inflamable al ser calentado. Ese gas no tard en ser
aprovechado para producir gas de alumbrado. Con ello, 1os sub productos de la
industria del gas adquirieron una importancia creciente. Entre ellos estaba el
alquitrn, del que se obtena benceno, el cual, al descubrirse los colorantes
sintticos en 1856, condujo a 1as plantas destiladoras de alquitrn de hulla.
En 1800 Rumford us vapor de agua como agente trmico. En aquel tiempo los
investigadores franceses de vanguardia haban diseado y ensayado las llamadas
columnas de destilacin. Estas progresaron apreciablemente con el invento de la
columna de rectificacin de Cellier Blumenthal, en 1813. En 1822, Perrier invent
las campanas de burbujeo y desarroll un alambique continuo, con precalentamiento
de la alimentacin y uso de reflujo interno. Por otra parte, Adam y Brad disearon
pendientemente columnas para rectificar el alcohol extrado del vino. Blumenthal,
combin los principios utilizados por los dos inventores, para fabricar una columna
que proporcionaba una corriente de alcohol rectificado a partir de una alimentacin
continua de vino; logr as el primer proceso de destilacin a rgimen permanente.
Para 1850, las columnas rectificado ras de la industria del alcohol se empezaron a
utilizar en las industrias del petrleo y del alquitrn de hulla. Entre 1860 y 1880, se
descubrieron productos qumicos valiosos tales como el benceno, el tolueno y el
xileno, .mediante la destilacin del alquitrn.
A mediados del siglo pasado se descubri la forma de fabricar vidrio
transparente, dctil y capaz de soportar el calentamiento y enfriamiento continuos.
Este vidrio tuvo su aplicacin inmediata en la fabricacin de aparatos y material de
laboratorio. Ello signific una enorme ventaja sobre los equipos de metal y cermica
que se venan utilizando, especialmente por la resistencia qumica del vidrio, su
transparencia y su maleabilidad, lo que permiti la fabricacin de nuevos y
complicados instrumentos de laboratorio. En el campo de la destilacin, los
alambiques se modificaron y aparecieron los matraces, columnas y condensadores,
semejantes a los empleados hoy. Desde entonces, la destilacin ha sido una de las
tcnicas de separacin ms empleadas en los laboratorios y en la investigacin
qumica, al tiempo que se la utiliza tambin como una tcnica analtica.
Por otra parte, desde mediados del siglo pasado los equipos ms utilizados
industrialmente estaban hechos de acero o de otros tipos de metal y recibieron el
nombre de columnas de rectificacin o columnas de destilacin. Se trata de un
equipo que consta de un caldern o rehervidor (en el cual se genera vapor), una
columna con platos o con empaques (en la cual se lleva a cabo la rectificacin, al
ponerse los vapores en contracorriente con el lquido) y un condensador (en el cual
se condensan los vapores salientes del domo, se regresa parte de ese lquido como
"reflujo" y se extrae parte del mismo como un destilado o producto del domo), figura
3.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
10
En estas columnas, la alimentacin se efecta por lo general cerca del centro de
la columna. La parte por arriba de la alimentacin recibe el nombre de seccin de
rectificacin o de enriquecimiento y la parte de abajo seccin de agotamiento.
La industria de la reformacin del petrleo sufri tambin modificaciones
profundas bajo el impacto de la investigacin cientfica. En 1859 el coronel Drake
demostr por primera vez la posibilidad de extraer el petrleo crudo
I
Figura 3. Esquema de una columna moderna de rectificacin.
del subsuelo por medio de la perforacin, para no tener que depender
exclusivamente de las afloraciones. Hasta 1900, cuando la industria automotriz daba
apenas los primeros pasos, la industria del petrleo se haba restringido a la
produccin de queroseno. Los procesos de refinacin del petrleo y el
correspondiente aparato tcnico, eran en su mayora adaptaciones de otras
industrias, como la del alquitrn de hulla y la del alcohol. Gradualmente, las
industrias del petrleo pusieron en prctica mtodos ms cientficos en la destilacin
y refinacin del petrleo. Este cambio recibi el impulso de la creciente demanda de
productos distintos del queroseno: lubricantes, parafinas, asfalto, aceite combustible
y sobre todo gasolina, que entonces se necesitaban en cantidades mayores cada
vez para automviles y aviones.
Trumble, en Estados Unidos, ide en 1812 la combinacin de un destilador de
tubos con columnas desolladoras y evaporadores. Esto result ser un sistema
extraordinariamente flexible para adaptar las unidades destiladoras a la diversidad
de crudos existentes.
La refinacin qumica, originalmente un proceso por lotes, se hizo entonces
automtica, hasta convertirse en una
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
11
Figura 4. Campanas de burbujeo.
operacin continua en recipientes cerrados, lo cual evit la evaporacin peligrosa y
dispendiosa d fracciones ligeras.
El equipo predecesor de las campanas de burbujeo o "cachuchas" fue inventado
en 1822 por Perrier. Estas campanas se usaron como aparatos para mejorar el
contacto del vapor que se introduca por debajo del plato en el que estaban las
campanas. Arriba de las campanas se introduca vino, y por debajo vapor. El vapor
no se mezclaba con el vino. En 1830 Coffee desarroll una columna continua que
usaba tanto platos perforados como precalentamiento de la alimentacin y reflujo
interno.
Cuando el gas natural vino a suplir la falta de combustible, pudieron extraerse
compuestos valiosos con bajo punto de ebullicin, como el propano y el butano.
.
Esto era imposible sin una destilacin adecuada para eliminar los gases
disueltos. Como consecuencia, los tcnicos se vieron en la necesidad de idear
nuevos tipos de columnas destiladoras.
La destilacin fue un arte durante el periodo de su desarrollo inicial. La invencin
de las campanas de burbujeo, los platos perforados, los condensadores enfriados
con agua, el reflujo, el precalentamiento de la alimentacin y la adaptacin del
proceso a la operacin continua, se llevaron a cabo en el siglo XIX, aunque no se
hicieron intentos para sistematizar o aplicar principios cuantitativos a los procesos de
destilacin.
En los ltimos aos del siglo XIX, Hausbrand (1893) y Sorel (1899), presentaron
los primeros, dios matemticos aplicados al diseo de las columnas de
fraccionamiento. Sorel (1889) desarrollo y aplic relaciones matemticas para la
separa fraccionada de mezclas binarias, primero a las que tenan alcohol y agua, e
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
12
introdujo en sus clculos conceptos de entalpa molar, prdida de calor,
composiciones, reflujo y gastos.
Otros investigadores de esa poca fueron Barel Young, Rayleigh, Lewis,
Rosanoff y Dufton.
En 1925, WL. Mc.Cabe y E.W Thiele presentaron un trabajo (Mc.Cabe, 1925)
ante la American Chemical Society, que presentaba un nuevo mtodo sencillo,
rpido e ilustrativo para calcular graficamente el nmero de platos tericos
necesarios para la separacin de los componentes de una mezcla binaria en una
columna de rectificacin. La aportacin original de Mc.Cabe a este problema fue un
gran paso en el diseo cientfico de unidades destilacin y demostr ser un gran
progreso cuando pasaron a primer plano los nuevos sistemas de cracking hacia
1936.
Posteriormente, Ponchon y Savarit (1922) disearon un mtodo para el clculo de
columnas de destilacin para mezclas binarias, el cual no requera las
simplificaciones del mtodo de Mc.Cabe y que poda aplicarse a mezclas no ideales.
Entre 1930 y 1960, se hicieron numerosos estudios para predecir la eficiencia de
las columnas de destilacin. Sin embargo fue a partir de que el Instituto Americano
de Ingenieros Qumicos form una comisin para estudiar el problema (AIChE,
1958), cuando se pudo contar con un mtodo confiable para obtener las eficiencias
en columnas de destilacin que trabajan con mezclas binarias. Una vez resuelto este
problema, las bateras se orientaron hacia el diseo de columnas que trabajaran
mezclas multicomponentes (Holland, 1988). El diseo de stas recibi un impulso
muy importante con el desarrollo de las computadoras modernas, el cual hizo posible
la aplicacin de ecuaciones de estado para el clculo del equilibrio vapor-lquido.
El estudio de los sistemas azeotrpicos permiti tambin. que se pudieran
disear columnas que pudieran separar estas mezclas, para obtener productos
puros, tales como alcohol a partir de una mezcla alcohol-agua.
A pesar de que la operacin unitaria de destilacin es la que cuenta con ms
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
13
bibliografa y sobre la que se han efectuado y se efectan ms estudios e
investigaciones, todava no se ha agotado el campo, ni se ha dicho la ltima palabra
sobre el diseo de los aparatos de destilacin, que han probado ser tan tiles para la
humanidad. Hoy, la destilacin se reemplaza por otras operaciones que, o consumen
menos energa, o son ms eficientes, tales como la extraccin lquido-lquido, la
adsorcin, la cromatografa, etctera. Sin embargo, sigue presente en casi todos los
procesos qumicos, petroqumicos, farmacuticos o de la industria alimentaria y
vincola.
El aparato utilizado en la actualidad en la destilacin continua est constituido por
tres equipos integrados: un generador de vapor, rehervidor o caldern, un elemento
que pone en contacto vapor y lquido, columna de platos o empacada, y un
condensador, que es un cambiador de calor enfriado por agua o por un refrigerante
(figura 3).
La rectificacin o destilacin continua con etapas y con reflujo puede
considerarse, de forma simplificada, como un proceso en el cual se lleva a cabo una
serie de evaporaciones y condensaciones. Estos fenmenos se llevan a cabo en los
platos o charolas de la columna de destilacin. Para ello, el lquido de cada etapa
fluye por gravedad a la etapa inferior y el vapor de cada etapa lo hace hacia arriba, a
la etapa superior. Por consiguiente, en cada etapa entra una corriente de vapor G y
una corriente lquida L, las que se mezclan para transferir masa y tratar de alcanzar
el equilibrio. La forma de lograrlo es la creacin de una interfase lquido-vapor lo ms
extensa posible. La principal resistencia a la transferencia de masa est en la fase
vapor, por lo que se han diseado aparatos y dispositivos en los que el vapor
burbujee dentro del lquido, para obtener as una mayor superficie de transferencia.
Sin embargo, no es posible lograr que las corrientes que salen de una etapa estn
en equilibrio, de all que se hable de eficiencia, que es una medida del acercamiento
al equilibrio. Los platos reales de una columna tienen eficiencias menores que 100
por ciento.
Como ya se mencion, el principio de funcionamiento de la columna (figura 3) es
poner en contacto un vapor con un lquido ms rico en el componente ms voltil
que el correspondiente al equilibrio. Al mezclarse ntimamente, el vapor tender a
ponerse en equilibrio con el lquido, condensndose parte del componente menos
voltil y evaporndose el ms voltil. Mediante la repeticin de esos contactos a
contracorriente, el vapor se ir enriqueciendo y el lquido empobreciendo (en el
componente ms voltil) hasta alcanzar las composiciones del destilado y del
residuo respectivamente.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
14
Figura 5. Aparato alemn de destilacin del siglo XIX.
Figura 6. Platos con campanas de burbujeo con flujo cruzado para el contacto entre
dos fases. El gas fluye en el sentido que indican las flechas delgadas. El lquido fluye
como lo indican las flechas gruesas. las campanas de burbujeo dispersan el gas en
el lquido.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
15
Como el proceso consiste en poner en contacto vapor con lquido y a la columna
no le entra ms que la alimentacin, el vapor se genera evaporando parte del
residuo o fondos, y el lquido retornando a la columna parte del destilado, que son
las mezclas ms pobres y ms ricas, respectivamente, en el componente ms voltil.
La energa para que la torre funcione as es proporcionada por el calor que se
introduce en el rehervidor, el cual causa la evaporacin de parte del lquido que llega
a ste. La corriente de vapor, conforme asciende por la torre, se enriquece en el
componente ms voltil. Esta corriente se condensa en el condensador y una parte
de ese lquido se regresa -refluja- hacia la columna y otra parte se extrae del domo
como destilado o producto. La corriente del lquido que se refluja desciende por
gravedad y se va enriqueciendo con el componente ms pesado. Este proceso de
enriquecimiento y empobrecimiento en determinados componentes se lleva a cabo
en etapas sucesivas de la torre. Para entender ms fcilmente este mecanismo es
conveniente referirse a la figura 6, en la que se representa un plato y las
concentraciones del lquido voltil las corrientes lquidas y de vapor.
En cada plato se pone en contacto el lquido desciende del plato superior, L
n-1
con el vapor que sube del plato inferior, Gn+1 Cuando la etapa se comporta de
manera ideal se alcanza el equilibrio y las concentraciones son las correspondientes
a temperatura de equilibrio alcanzada, es decir, cuando la temperatura de ambas
corrientes es la misma (t
n
). En estas condiciones, la concentracin del componente
ligero en el lquido (X
n
,) y la concentracin
. en el vapor (Y
n
) son las concentraciones en el equilibrio. Aqu se puede apreciar
tambin el efecto, del empobrecimiento y el enriquecimiento mencionado. La
concentracin del lquido que desciende, X
n-1
es mayor que X
n
pero la concentracin
del vapor que sube aumenta, es decir, Y
n
es mayor que Y
n-1
.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
16
INTRODUCCIN
Los problemas de destilacin binaria pueden resolverse grficamente por
medio del uso de los diagramas de entalpa composicin, a este mtodo se le llama
tambin mtodo de Ponchon-Savarit. El uso de estos diagramas se adicionan a los
balances de masa, y de energa. Cuando existen calores de mezcla o cuando se
trabaja con mezclas no ideales que presentan puntos azeotrpicos, el mtodo de
Ponchon-Savarit presenta muchas ventajas sobre el de Mc.Cabe-Thiele. El
procedimiento grfico de Mc.Cabe-Thiele supone un flujo molar constante a travs
de una seccin de la torre, pero esto ser solamente cierto si los calores molares de
los compuestos puros son muy parecidos. Si eso no es as, los flujos molares
variarn de plato a plato y las ecuaciones simplificadas de Mc.Cabe-Thiele no
podrn aplicarse. Tales observaciones dieron origen al mtodo de Ponchon-Savarit,
que es tambin un mtodo grfico para emplearse en los casos en que no puede
aplicarse el mtodo de Mc.Cabe-Thiele.
Como ya se indic, el mtodo de Ponchon-Savarit utiliza los diagramas de
entalpa-composicin para la resolucin de los problemas de destilacin binaria.
Esos diagramas permiten representar tanto la composicin, como la temperatura y la
entalpa de las mezclas. Se puede construir indistintamente sobre una base de masa
o molar. No hay razn para utilizar unidades molares puesto que no es necesaria la
suposicin de igualdad de calores latentes, hecha por Mc.Cabe-Thiele, para los dos
componentes.
Las ecuaciones de las lneas de operacin se obtienen en el mtodo de
Ponchon-Savarit mediante los balances de materia y energa aplicados a cada
seccin de la torre.
En la figura 1 se tiene un diagrama de entalpa-concentracin, que es tpico
para la resolucin grfica por el mtodo de Ponchon-Savarit. En el diagrama se
presentan puntos y rectas bien definidas que son la base para el clculo del nmero
de platos tericos que se requieren, para lograr una determinada separacin de una
mezcla binaria. Durante el estudio de este fascculo, se ir introduciendo al alumno
en la manera de cmo se traza cada lnea y como se marca cada punto. De tal
manera que pueda ir comprendiendo paso a paso la construccin de estos
diagramas; y lo que a primera vista parece complicado de construir e interpretar,
despus de este estudio el alumno se dar cuenta de que es mucho ms sencillo de
lo que se imagina.
Se comprobar por ejemplo, que la relacin de las distancias M
D
a MN
es igual a la relacin de reflujo externa R
D
. Cualquiera de las lneas que parten del
punto focal
D
satisfacen los balances de materia y energa alrededor de cualquier
etapa de la seccin de enriquecimiento.
Alternando los balances de materia y energa con los clculos del equilibrio, es
posible obtener el nmero de platos ideales. El punto de alimentacin A se localiza
en la concentracin y entalpa apropiada. El punto
F
se localiza extendiendo la
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
17
lnea A
D
hasta que intercepte con la lnea vertical que recibe la composicin de
los fondos x
F
.
Se puede demostrar que cualquier lnea que parte del punto
F
satisface los
balances de materia y energa en la seccin de agotamiento, as que alternando los
clculos del equilibrio con los de los de balances de materia y energa se puede
obtener el nmero de platos ideales en las secciones de enriquecimiento y
agotamiento.
El mtodo grfico de Ponchon-Savarit para sistemas de destilacin binaria no
requiere las simplificaciones del mtodo de Mc.Cabe-Thiele ya que incorpora las
variaciones en la entalpa de los vapores y los lquidos en funcin de la composicin.
Figura 7 Diagrama de Ponchon-Savarit.
DIAGRAMAS DE EQUILIBRIO
Suele ser comn que las relaciones de equilibrio vapor-lquido de una mezcla
binaria de A y B se expresen en forma de un diagrama de puntos de ebullicin, tal
como se muestra en la figura 2, para el sistema benceno (A) tolueno (B), a presin
total de (760mm. de Hg).
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
18
Figura 8 Diagrama de puntos de ebullicin para el sistema Benceno (A) Tolueno
(B).
La lnea superior es la de vapor saturado (lnea de puntos de roco) y la
lnea inferior es la de lquido saturado (lnea de puntos de burbuja). La regin
de dos fases est localizada en la zona situada entre estas dos lneas.
En la figura 8, si se empieza calentando una muestra lquida fra de
x
A1
=0.318, la ebullicin se inicia a 98 C y la composicin del primer vapor en el
equilibrio es y
*
A1
= 0.532. A medida que contina la ebullicin, la composicin x
A
se
desplazar hacia la izquierda, puesto que y
*
A
es ms rico en A.
LAS SOLUCIONES IDEALES
En realidad no existen soluciones ideales y las mezclas reales slo tienden a
ser ideales como lmite. La condicin ideal requiere que las molculas de los
componentes sean similares en tamao, estructura y naturaleza qumica; tal vez la
aproximacin ms cercana a dicha condicin sea la ejemplificada por las soluciones
de ismeros pticos de compuestos orgnicos. Sin embargo, prcticamente muchas
soluciones se encuentran tan cerca de ser ideales que para fines de ingeniera se
pueden considerar como tales. El sistema Benceno Tolueno, es por lo tanto una
solucin ideal que obedece la ley de Raoult por lo que el diagrama de puntos de
ebullicin puede determinarse a partir de los datos de presin de vapor de la tabla 1,
junto con las siguientes ecuaciones:
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
19
Para una solucin ideal la presin parcial en el equilibrio P*
de un componente a
una temperatura fija es igual al producto de su fraccin mol en el lquido ( x ) por
su presin de vapor P cuando est pura a esta temperatura. Esta es la ley de
Raoult.
(1) P
*
A
= P
A
x
A
P
*
B
= P
B
( 1 x
A
)
Si la fase vapor tambin es ideal,
Pt = P
*
A
+ P
*
B
= P
A
x
A
+ P
B
( 1 x
A
) (2)
Y las presiones totales al igual que las parciales, son lneas en x a una
temperatura dada. Estas relaciones se muestran de modo grfico en la figura 3.
Entonces puede calcularse la composicin del vapor en el equilibrio a esta
temperatura. Por ejemplo el valor de y* en el punto D sobre la figura 3 es igual a
la relacin entre las distancias FG y EG,
y*
A
=
Pt
* P
A
=
Pt
x P
A A
(3)
1 y*
A
=
Pt
* P
B
=
( )
Pt
x 1 P
A B
(4)
En donde: Pt = presin total
P* = presin parcial
P = presin de vapor del componente puro
y* = fraccin mol del vapor en el equilibrio
x = fraccin mol del lquido en el equilibrio
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
20
Figura 9 Soluciones ideales
PROBLEMA 1
Calclense las composiciones del vapor y del lquido en equilibrio a 95 C
para benceno-tolueno, a 760 mm. de Hg. usando las presiones de vapor de la tabla
1.
Presin de vapor
Temp. C Benceno
(A)
mmHg
Tolueno
(B) mmHg
80.1 760
85 877 345
90 1016 405
95 1168 475
100 1344 557
105 1532 645
110.6 1800 760
Tabla 1
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
21
1. PLANTEAMIENTO
1.1 DISCUSIN
Utilizaremos la ley de Raoult para calcular las composiciones en el equilibrio
1.2 ECUACIONES DE EQUILIBRIO
Pt = P
A
x
A
+ P
B
( 1 x
A
)
y*
A
=
Pt
x P
A A
2. CALCULOS
2.1 FRACCIN MOL DEL COMPONENTE A EN EL LQUIDO x
A
De la tabla 1 a 95 C para el benceno P
A
=1168 mm Hg. y para el tolueno P
B
=
475 mm Hg. Sustituyendo estos valores en la ecuacin ( 2 ) y resolviendo
Pt = P
A
x
A
+ P
B
( 1 x
A
) = 760 mm Hg = 1168 (x
A
) + 475 (1-x
A
)
por consiguiente, x
A
= 0.411
2.2 FRACCIN MOL DEL COMPONENTE A EN EL VAPOR y*
A
y*
A
=
Pt
x P
A A
=
760
) 411 . 0 ( 1168
= 0.632
3. RESULTADO
x
A
= 0.411 y y*
A
= 0.632
De la misma forma se pueden encontrar las composiciones en el equilibrio
para el componente ms voltil (benceno), a diferentes temperaturas y cuyos
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
22
resultados se encuentran en la tabla 2. La grfica correspondiente para este
sistema es la mostrada en la figura 2.
Presin de vapor Fraccin mol de benceno a
760 mm Hg
Temp. C Benceno
mmHg
Tolueno
mmHg
x
A
y*
A
80.1 760 1.000 1.000
85 877 345 0.780 0.900
90 1016 405 0.580 0.777
95 1168 475 0.411 0.632
100 1344 557 0.258 0.456
105 1532 645 0.130 0.261
110.6 1800 760 0 0
Tabla 2
En la figura 10 se muestra un mtodo muy comn para graficar los datos de
equilibrio, donde se traza una curva de y*
A
en funcin de x
A
para el sistema
benceno-tolueno. Se incluye la lnea de 45 para mostrar que y*
A
es ms rico en
el componente A que x
A
.
Figura 10 Diagrama de equilibrio para el sistema benceno-tolueno a 760mm Hg.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
23
Figura 11 Diagramas de equilibrios de puntos de ebullicin:
(a) Azetropo de ebullicin mxima
(b) Azetropo de ebullicin mnima
LAS SOLUCIONES NO IDEALES
El diagrama de puntos de ebullicin de la figura 11 es tpico de un sistema
ideal que obedece la ley de Raoult. Los sistemas no ideales difieren
considerablemente. En la figura 5a se muestra el diagrama de puntos de ebullicin
para un azetropo de ebullicin mxima. La temperatura mxima T
mx
corresponde
a una composicin x
AZ
y en este punto, x
AZ
= y*
AZ
. La grfica de y*
A
en funcin de
x
A
mostrara que la curva cruza a la lnea de 45 en este punto; el sistema acetona-
cloroformo es un ejemplo tpico. En la figura 5b se muestra un azetropo de
ebullicin mnima con y*
AZ
= x
AZ
a T
mn
; un sistema tpico de este caso es el de
etanol-agua.
Se pueden construir diagramas similares a los de las figuras 5a y 5b a
temperatura constante, empleando la presin como variable. Sin embargo, el
diagrama de temperatura-composicin a presin constante, es con mucho, el ms
comn; probablemente la razn principal es que la mayor parte de las operaciones
de separacin se realizan en forma esencial a presin constante. Asimismo,
variando la presin sobre un sistema se puede, en algunos casos, evitar la formacin
de un azetropo.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
24
La presin de vapor P de un componente es una propiedad nica del
componente y es una funcin directa de su temperatura. Presin de vapor y
temperatura estn relacionadas por medio de la ecuacin de Antoine.
logP=A-
T + C
B
(5)
Donde A, B y C son las constantes de Antoine. Valores de estas constantes
para varios compuestos se encuentran en un sin nmero de referencias.
Para soluciones no ideales, tenemos:
P
A
x
A
A
+ P
B
x
B
B
= Pt (6)
En donde
A
y
B
son los coeficientes de actividad del lquido A y del lquido
B, los cuales dependen de las composiciones molares.
Por lo general, se acepta que no hay una tcnica efectiva para correlacionar
y/o predecir coeficientes de distribucin cuando la fase lquida no es ideal. Las
complejidades surgidas cuando 1, presentan un reto distinto y sin resolver
para la solucin termodinmica. Muchas aplicaciones industriales de operacin por
etapas se llevan a cabo a bajas presiones, en las que la fase vapor se considera que
es ideal en su comportamiento. No obstante, aun bajo esas condiciones el
comportamiento del lquido no ideal es comn. Por est razn, la mayor parte de la
atencin que se dirige al comportamiento no ideal, se dirige hacia el comportamiento
de la solucin y a la prediccin de los coeficientes de actividad.
Se dispone de tcnicas para extrapolar datos experimentales y/o datos de
prueba para la estabilidad termodinmica. Uno de los primeros procedimientos que
se realizaron fue el que propuso Van Laar (1929), l consider que la ecuacin de
estado de Van der Waals se aplica a componentes puros y mezclas, tanto en vapor
como en lquidos; Que el exceso de entropa parcial de mezclado de un
componente es cero y que el cambio de volumen molar parcial despus del
mezclado tambin es cero. Bajo estas restricciones, dedujo las siguientes
ecuaciones:
A= log
1
2
1
2
2
|
|
|
\
|
+
1
1
log x
log x
(7)
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
25
B = log
2
2
1
2
2
1
1
|
|
\
|
+
log x
log x
(8)
Log
1
=
2
1
2
1
|
|
\
|
+
B
A
A
x
x
(9)
Log
2
=
2
1
1
2
|
|
\
|
+
A
B
B
x
x
(10)
En donde:
A y B constantes de Van Laar
x
1
= fraccin mol del componente ms voltil en el lquido 1
x
2
= fraccin mol del componente menos voltil en el lquido 2
1
y
2
= coeficientes de actividad para los componentes 1 y 2.
DIAGRAMAS DE ENTALPA-COMPOSICIN
Un diagrama de entalpa-composicin para una mezcla binaria vapor-lquido
de A y B toma en consideracin calores de la mezcla. Se requieren los siguientes
datos para construir dicho diagrama a presin constante:
(1) capacidad calorfica del lquido en funcin temperatura, la composicin y la
presin.
(2) calor de disolucin en funcin de la temperatura y la composicin.
(3) calores latentes de vaporizacin en funcin de la composicin y la presin
o la temperatura.
(4) punto de ebullicin en funcin de la presin, composicin y temperatura.
El diagrama a una presin constante se basa en estados de referencia
del lquido y en la temperatura, tal como 0C (32 F). La lnea de entalpa de
lquido saturado H
L
Kcal/Kgmol se calcula por medio de la siguiente ecuacin:
H
L
= x
A
Cp
A
(T-T
O
) + (1-x
A
) Cp
B
(T-T
O
) + H
mez
(11)
En donde:
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
26
x
A
= fraccin mol o de peso de A
Cp
A
= capacidad calorfica molar o de peso del componente A
T
O
= Temperatura base para el clculo de entalpas
T = Temperatura de ebullicin de la mezcla
H
mez
= Entalpa de mezcla a T
O
en Kcal/Kg Kcal/Kgmol.
Si hay un desprendimiento de calor durante el mezclado, el valor de H
mez
de
la ecuacin (11) ser negativo.
La lnea de entalpa del vapor saturado H
G
se calcula aadiendo el calor
latente de vaporizacin
mez
a la entalpa del lquido saturado. Para propsitos
prcticos, esto equivale a
mez
= x
A
A
+ (1-x
A
)
B
(12)
H
G
= y*
A
[Cp
A
(T-T
O
) +
A
] + (1-y*
A
) [Cp
B
(T-T
O
) +
B
] + H
mez
(13)
En donde:
A
= calor latente molar o en peso a la temperatura de ebullicin
del componente A.
B
= es el calor latente de B.
Con frecuencia, no se dispone de los calores latentes de mezcla o disolucin, o
stos son bastante pequeos, como sucede en las mezclas de hidrocarburos;
entonces las lneas de entalpa de vapor saturado y la de entalpa de lquido
saturado se trazan como rectas entre las entalpas del lquido saturado de los
componentes puros y las entalpas del vapor saturado de los componentes
puros.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
27
Figura 12 Diagrama de entalpa-composicin en base a fracciones mol con diagrama
de equilibrio.
En la figura 6 se muestra una grfica tpica de entalpa-composicin. La lnea
superior representa la entalpa del vapor saturado, esto es, H
G
(Kcal/kgmol de
vapor) en funcin de y*
A
, y la lnea inferior es la entalpa del lquido saturado, H
L
(Kcal/kgmol de lquido) en funcin de la fraccin mol de lquido x
A
. La zona entre
ambas lneas es la regin de dos fases lquido-vapor. La lnea de unin ab
representa las entalpas y las composiciones de la fases lquida y vapor en el
equilibrio. La lnea de unin o de reparto ab se obtiene trazando las lneas dc, da y
cb.
Cada recta de reparto es una isoterma de la regin de dos fases. La recta de
reparto ab de la figura 6, corresponde a la recta horizontal cd de la misma figura.
El nmero de rectas de reparto es infinito, tambin se pueden construir el
diagrama como en la figura 7. Para cada recta de reparto se obtiene un punto como
el a, hallando la intercepcin de la vertical que pasa por x
e
con la horizontal que pasa
por y*. La lnea auxiliar que se representa en la figura 7 se ha trazado en esta forma,
y una lnea de reparto cualquiera se puede trazar simplemente efectuando la
construccin inversa.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
28
Figura 13 Mtodo para la construccin de rectas de reparto utilizando la lnea
auxiliar.
La grfica anterior es la construccin real de una lnea auxiliar, con los datos del
problema 2. la lnea de reparto constituye segn el problema 2, una isoterma de
100C. con las correspondientes composiciones x
e y* al equilibrio.
PROBLEMA 2
Construya los diagramas y* vs x, T vs x,y*, H vs x,y* para el sistema
benceno, etilbenceno a 586 mm. de Hg.
DATOS Constantes de Antoine
A B C
-Benceno 6.90656 1211.033 220.79
-Etilbenceno 6.95719 1424.255 213.206
Log P = A -
T + C
B
P = mm de Hg T = C
1. PLANTEAMIENTO
1.1 DISCUSIN
A partir del benceno y etilbenceno puros se obtendrn los datos de las
temperaturas lmite para el sistema. Despus dando valores a temperaturas
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
29
intermedias y obteniendo las presiones de vapor correspondientes se generarn los
datos de equilibrio. El sistema es ideal
1.2 ECUACIONES DE EQUILIBRIO
x
A
=
B A
B
P P
P Pt
(14)
La ecuacin (14) se obtiene de la (2), despejando
x
A
y*
A
=
Pt
x P
A A
1.3 ECUACIONES DE ANTOINE
Log P
A
= 6.90565 -
T 220.79
1211.03
+
Al sustituir P
A
= 586 mm de Hg. Se tiene
que T = 71.9 C.
Log P
B
= 6.95719 -
T 213.206
1424.255
+
Para el etilbenceno se obtiene T = 126.8 C.
1.4 ECUACIONES DE ENTALPAS
H
L
= x
A
Cp
A
(T-T
O
) + (1-x
A
) Cp
B
(T-T
O
)
H
G
= y*
A
[Cp
A
(T-T
O
) +
A
] + (1-y*
A
) [Cp
B
(T-T
O
) +
B
]
2. CLCULOS
2.1 EQUILIBRIO
Las temperaturas lmite son 71.9 C y 126.8 C. Para valores de temperatura
Intermedias, se calculan las presiones de vapor para los componentes cuyos
resultados se encuentran en la tabla 3 y utilizando las ecuaciones de equilibrio
anteriormente citadas, se hace el clculo, como por ejemplo, para 100 C.
Tenemos:
x
A
=
B A
B
P P
P Pt
=
256.9 - 1350.5
256.9 - 586
= 0.301
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
30
y*
A
=
Pt
x P
A A
=
586
0.301 * 1350.5
= 0.694
De la misma forma, se sigue calculando para las diferentes temperaturas
intermedias y se obtiene la tabla 3.
TABLA 3
2.2 CLCULO DE LA ENTALPA DEL LQUIDO H
L
Como por ejemplo, a 100 C.
x
A
= 0.301 x
B
= 0.699
Cp
A
= 0.465 Kcal/ Kg C Cp
B
= 0.52 Kcal/Kg C
PM
A
= 78 Kg/Kgmol PM
B
= 106 Kg/Kgmol
Por lo tanto:
Cp
A
= 0.465 * 78 = 36.27 Kcal/Kgmol C.
Cp
B
= 0.52 * 106 = 55.12 Kcal/Kgmol C.
H
L
= x
A
Cp
A
(T-T
O
) + (1-x
A
) Cp
B
(T-T
O
)
= 0.301 * 36.27 (100-0) + 0.699 * 55.12 (100-0) = 1091.72 + 3852.88
H
L
= 4944.6 Kcal/Kgmol.
T (C) P
A
P
B
x
A
y*
A
71.9 586 91.5 1 1
75 647.7 103.6 0.887 0.98
80 757.6 125.8 0.728 0.942
85 881.6 151.7 0.595 0.895
90 1021.0 181.9 0.482 0.839
95 1176.8 216.8 0.386 0.772
100 1350.5 256.9 0.301 0.694
105 1543.2 302.9 0.288 0.600
110 1756.3 355.2 0.165 0.494
115 1991.3 414.6 0.109 0.369
120 2249.3 481.7 0.059 0.226
126.8 2639.7 586 0 0
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
31
2.3 CLCULO DE LA ENTALPA DEL VAPOR H
G
y*
A
= 0.694
Cp
A
= 0.465 * 78 = 36.27 Kcal/Kgmol C
A
= 7176 Kcal/Kgmol
y*
B
= 0.306
Cp
B
= 0.52 * 106 = 55.12 2 Kcal/Kgmol C
B
= 9135 Kcal/Kgmol
H
G
= y*
A
[Cp
A
(T-T
O
) +
A,
] + (1-y*
A
) [Cp
B
(T-T
O
) +
B
]
= 0.694[ 36.2 (100-0) + 7176 ] + 0.306 [ 55.12 (100-0) + 9135 ]
= 7492.42 + 4481.98
H
G
= 11974.4 Kcal/kgmol.
De manera semejante se hacen los dems clculos, y los resultados son
desplegados en la tabla 4
2.4 DATOS DE ENTALPA VS. TEMPERATURA Y COMPOSICIN
H
L
H
G
T (C) x
A
y*
A
Kcal/Kgmol Kcal/Kgmol
71.9 1 1 2552 10040
75 0.887 0.98 2840 10236
80 0.728 0.942 3220 10629
85 0.595 0.895 3663 10805
90 0.482 0.839 4069 11262
95 0.385 0.772 4523 11645
100 0.301 0.694 4944.6 11974.4
105 0.228 0.6 5429 12666
110 0.165 0.494 5830 13272
115 0.109 0.369 6354 13956
120 0.059 0.226 6865 14751
126.8 0 0 7345.8 16197
Tabla 4
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
32
2.5 DIAGRAMAS
Figura 14 Diagrama y* vs. x del sistema benceno-etilbenceno a 586 mm de Hg.
Figura 15 Diagrama T vs. x, y* del sistema benceno-etilbenceno a 586 mm de Hg.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
33
Figura 16 Diagrama H vs. x, y* para el sistema benceno-etilbenceno a 586 mm
de Hg.
PROBLEMA 3
Construya el diagrama H vs. x, y* para el sistema etanol-agua a la presin
de 760 mm de Hg.
DATOS
Constantes de Antoine
A B C
Etanol 8.04494 1554.3 222.65
Agua 7.96681 1668.21 228
Punto azeotrpico
Temperatura 78.15 C y composicin del etanol x
E
= y*
E
= 0.8943
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
34
Propiedades criticas
Tc k Pc atm
Etanol 516 63
Agua 647.3 218.4
Capacidades calorficas
Cp
E
del etanol = 0.75 Kcal/ Kg C
Cp del agua = 1 Kcal/ Kg C
1. PLANTEAMIENTO
1.1 DISCUSIN
A partir del punto azeotrpico se obtendrn las actividades, con ellas se
obtendrn las constantes de Van Laar y de all se podr construir el diagrama.
1.2 ECUACIONES DE EQUILIBRIO
Pt =
O
2
H O
2
H O
2
H E E E
x P x P +
y*
E
=
Pt
x P
E E E
1.3 ECUACIONES DE ANTOINE
Log P
E
= 8.04494 -
T 222.65
1554.3
+
O
2
H
P Log = 7.96681 -
T 228
1668.21
+
1.4 COEFICIENTES DE ACTIVIDAD
En el punto azeotrpico como x
E
= y*
E
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
35
E
=
E
P
Pt
O
2
H
=
O
2
H
P
Pt
(15)
A = log
E
2
log x
log x
1
E E
O
2
H O
2
H
|
|
\
|
+
B =
O
2
H
log
2
log x
log x
1
O
2
H O
2
H
E E
|
|
\
|
+
log
E
=
2
x
x
1
O
2
H
E
|
|
\
|
+
B
A
A
O
2
H
log =
2
|
|
|
\
|
+
A
B
B
E
O
2
H
x
x
1
1.5 ECUACIONES DE ENTALPIAS
H
L
= x
E
[Cp
E
(T-T
O
)] + (1-x
E
) [Cp
O H
2
(T-T
O
)] + H
mez
H
G
= y*
E
[Cp
E
(T-T
O
) +
E
] + (1-y*
E
) [ Cp
O H
2
(T-T
O
) +
O H
2
] + H
mez
1.6 CALORES LATENTES
= R Pc ln
Te Tc
Te Tc
(
Ec. De Giacalone
En donde: Tc = temperatura crtica
Pc = presin crtica
Te = Temperatura de ebullicin
2. CLCULOS
2.1 CONSTANTES DE VAN LAAR
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
36
a T = 78.15 C x
E
= y*
E
= 0.8943 en el punto azeotrpico
log P
E
= A -
T + C
B
= 8.04494 -
C 78.15 222.65
1554.3
+
P
E
= 754.6mm de Hg.
E
=
E
P
Pt
=
Hg. de 754.6mm
Hg de mm. 760
= 1.007150
log
O
2
H
P = A -
T + C
B
= 7.96681 -
C 78.15 228
1668.21
+
O
2
H
P = 329.46 mm de Hg.
O H
2
=
O H
2
P
Pt
=
Hg. de mm 329.46
Hg. de 760mm
= 2.30674
A = log
E
2
log x
log x
1
E E
O
2
H O
2
H
|
|
\
|
+
= log 1.0071504
2
0071504 . 1 log 0.8943
2.30674 log 0.1057
1
|
|
\
|
+
A = 0.6837788
B =
O
2
H
log
2
log x
log x
1
O
2
H O
2
H
E E
|
|
\
|
+
= 30674 . 2 log
2
30674 . 2 log 1057 . 0
0071504 . 1 log 8943 . 0
1
|
|
\
|
+
B = 0.4172474
2.2 TEMPERATURAS DE EBULLICIN DE LOS COMPUESTOS PUROS A
760mm de Hg.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
37
log 760 = A -
E
T + C
B
= 8.04494 -
E
T 222.65
1554.3
+
Donde T
E
= 78.51908 C.
log 760 = A -
O
2
H
T + C
B
= 7.96681 -
O H
2
T 228
1668.21
+
Donde
O H
2
T = 100 C.
2.3 COMPOSICIONES
Para una composicin, como por ejemplo: x
E
= 0.2
O H
2
x = 0.8
log
E
=
2
x
x
O
2
H
E
|
|
\
|
+
B
A
A
1
=
2
) (0.4172474 0.8
) (0.683778 0.2
1
0.6837788
|
|
|
\
|
+
E
= 2.2084321
O
2
H
log =
2
|
|
|
\
|
+
A
B
B
E
O
2
H
x
x
1
=
2
|
|
|
\
|
+
) 0.6837788 ( 0.2
) 0.4172474 ( 0.8
1
0.4172474
O
2
H
= 1.0845323
Con los resultados anteriores, se debern cumplir las condiciones de la
ecuacin (6 ) de equilibrio:
Pt =
O
2
H O
2
H O
2
H E E E
x P x P +
760 = P
E
(0.2) (2.2084321) + P
O
2
H
(0.8) (1.0845323)
Se debern encontrar los valores de P que satisfagan la ecuacin anterior,
suponiendo valores de temperatura, ya que la P esta en funcin de la misma.
Suponiendo T = 80 C
log P
E
= A -
T + C
B
= 8.04494 -
80 222.65
1554.3
+
P
E
= 811.53 mm de Hg.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
38
log P
O
2
H
= A -
T + C
B
= 7.96681 -
80 228
1668.21
+
P
O
2
H
= 355.25 mm de Hg.
Sustituyendo estas P en la ecuacin (6) de equilibrio, tenemos:
Pt = (811.53)(0.2)(2.2084321) + (355.25)(0.8)(1.0845323)
= 666.67mm de Hg. 760 mm de Hg.
Suponiendo T = 83 C.
P
E
= 911.4 mm de Hg. P
O
2
H
= 400.67 mm de Hg.
Pt = 402.55 + 347.63 = 750.18 760mm de Hg.
Suponiendo T = 83.32 C.
P
E
= 921.93 mm de Hg. P
O
2
H
= 405.47 mm de Hg.
Pt = 407.2039 + 351.7926 = 758.9965 760mm de Hg.
Suponiendo T = 83.32 C.
P
E
= 922.63 mm de Hg. P
O
2
H
= 408.5 mm de Hg.
Pt = 407.51 + 352.09 = 758.9965 760mm de Hg.
Por lo tanto, s T
E
= 83.32 C. entonces P
E
= 922.63 mm de Hg.
y
y*
E
=
Pt
x
P
E
E
=
760
) 2.2084321 ( ) 0.2 ( 922.63
y*
E
= 0.5362
2.4 ENTALPIAS si T
O
= 0 C.
H
L
= x
E
[Cp
E
(T-T
O
)] + (1-x
E
) [Cp
O
2
H
(T-T
O
]
= 0.2[ 0.75(46
kgmol
kg
)(83.32-0)] + 0.8[ 1 (18
kgmol
kg
)(83.32-0)]
= 574.9 + 1199.8 =
H
L
= 1774.
kgmol
kcal
E
= R Pc ln
Te Tc
Te Tc
(
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
39
= 1.987
K kgmol
kcal
63 ln
) 273 32 . 83 ( 516
273) 83.32 ( 516
(
+
+
= 2287.9 (4.143)
= 9479
kgmol
kcal
O H
2
= 1.987
K kgmol
kcal
218.4 ln
) 273 32 . 83 ( 3 . 647
273) 83.32 ( 647.3
(
+
+
O H
2
= 8483
kgmol
kcal
H
G
= y*
E
[Cp
E
(T-T
O
) +
E
] + (1-y*
E
) [ Cp
O H
2
(T-T
O
) +
O H
2
]
= 0.5362[ 0.75 (46) (83.32) + 9479 ] +
0.4638 [ 1 (18) (83.32) + 8483 ] =
= 6623.96 + 4630.0
H
G
= 11253.96
kgmol
kcal
Procediendo de la misma forma se obtienen los siguientes datos:
Tabla 5
T C x
E
y*
E
H
L
kcal/kgmol
H
G
kcal/kgmol
100 0 0 1799.805 11219.78
87.054 0.1 0.431 1710.627 11355.16
83.32 0.2 0.5362 1774.7 11253.96
81.64 0.3 0.5878 1873.705 11210.02
80.614 0.4 0.6267 1983.121 11195.98
79.80 0.5 0.6642 2094.82 11197.56
79.15 0.6 0.7069 2208.38 11224.95
78.61 0.7 0.7573 2322.99 11277.7
78.28 0.8 0.8209 2442.57 11379.32
78.12 0.9 0.8984 2566.41 11526.3
78.34 1.0 1.0 2702.78 11767.81
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
40
3. DIAGRAMA
Figura 17 Diagrama H vs. Composicin para el sistema etanol-agua a 760mm de
Hg.
USO DE LOS DIAGRAMAS DE EQUILIBRIO
Los diagramas de entalpa concentracin, adems de representar
grficamente el equilibrio de mezclas binarias, permite tambin la resolucin en
forma grfica de ciertos problemas. En esos diagramas se puede obtener
rpidamente la composicin, la temperatura y la entalpa de las mezclas binarias all
representadas. Por ejemplo, En la figura 17 todo punto tal como l A, que est
sobre la lnea de burbuja, representa una mezcla lquida saturada o sea que est a
su punto de ebullicin. En la figura 18, el punto A indica una mezcla con 73% de
benceno en mol, la cual tiene una temperatura de ebullicin de 80 C. a 586 mm de
Hg. y una entalpa de 3200 kcal/kgmol.
En el mismo diagrama, el punto B representa una mezcla de vapores a su
punto de roco (saturada), que contiene 60% en mol de benceno y 40% de
etilbenceno y que est a la temperatura de 105 C, a la presin de 586 mm de Hg. y
cuya entalpa es de 12600 kcal/kgmol.
Todo punto tal como el C representa a lquidos subenfriados, mientras que el
D indica una mezcla de vapores sobrecalentados. El punto E que se
encuentra entre
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
41
Figura 18
las lneas de roco y de burbuja representan una mezcla de lquidos y vapores en
equilibrio tal y como se producira una destilacin flash. En el diagrama presentado
esto corresponde a una mezcla con una composicin global del 50 % de benceno
en mol, con una temperatura de 105 C. y una entalpa de 10700 kcal/kgmol. Si
permitimos la separacin de las fases gaseosa y lquida que forma la mezcla
obtendramos una fase lquida con 22.5% de benceno, una entalpa de 5400
kcal/kgmol y una temperatura de 105 C. La fase gaseosa en equilibrio con la
lquida tendra una composicin de 60% de benceno, una entalpa de 12600
kcal/kgmol y claro tambin una temperatura de 105 C.
Regla del brazo de la palanca
En el proceso que se muestra en la figura 19 un fluido constituido por una
mezcla de vapor-lquido que tiene una entalpa total H
A
y una composicin x
A
entra
a velocidad de A kgmol/h. Las corrientes de salida de D kgmol de vapor/h. y F
kgmol de lquido/h. cuyas composiciones son y
*
D
y x
F
, respectivamente estn en
equilibrio.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
42
Figura 19 Ilustracin del principio de brazo de palanca y de lneas de unin.
Escribiendo un balance general y otro con respecto al componente ms
voltil A,
A = D + F
(16)
A x
A
=
D y
*
D
+ F x
F
(17)
Despejando A de (16) y sustituyendo en (17) y reordenando,
F
D
=
A D
F A
x * y
x x
(18)
Escribiendo un balance de entalpa
H
A
A= H
D
D + H
F
F (19)
Sustituyendo (16) en (19) y reordenando,
F
D
=
A D
F A
H H
H H
(20)
Igualando (18) y ( 20),
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
43
F
D
=
A D
F A
x * y
x x
=
A D
F A
H H
H H
(21)
Reordenando,
A D
F A
x * y
x x
=
A D
F A
H H
H H
(22)
Esto muestra que en un diagrama de entalpa composicin, los puntos a, b y
f que representan las corrientes F, D y A, deben estar en una lnea recta. Adems,
puesto que las corrientes D y F estn en equilibrio, estarn situadas en una lnea
de unin. Esta lnea de unin se localiza por medio de un mtodo de
aproximaciones sucesivas cuando se conocen A, x
A
y H
A
( punto f de la figura
13).
Si se considera que la lnea a f es la hipotenusa de un tringulo rectngulo, usando
las propiedades de tringulos rectngulos, se establece que,
F
D
=
b f
f a
(23)
Esta es la regla del brazo de palanca invertido que establece que los kgmol
de A/kgmol de F es igual a la longitud de la lnea af / longitud de la lnea fb .
Regresando con la figura 20, si se aplica adems la regla de la palanca, se
puede saber la cantidad de vapor y lquido que se obtendra en el flash. En el
ejemplo presentado, la mezcla indicada por el punto E contiene 32.5% de lquido y
67.5% de vapor.
Figura 20 regla del brazo de la palanca inversa
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
44
En los diagramas de entalpa composicin, se pueden obtener adems
rpidamente los requerimientos energticos necesarios en los procesos de
enfriamiento y calefaccin. Por ejemplo para llevar la mezcla lquida F, desde el
punto F hasta el punto E (figura 12) se requerirn 8000 kcal/kgmol, ya que H
F
=
2700 kcal/kgmol y H
E
= 10700 kcal/kgmol.
Por ltimo, es tambin posible representar en esos diagramas la mezcla de
varias corrientes. Por ejemplo, si mezclamos adiabticamente partes iguales de G
con I (vase figuras 18 y 21; obtendremos que la mezcla resultante caera en J ( x
= 0.5, H = 9000).
Figura 21
PROBLEMA 4
Utilizando el diagrama de equilibrio siguiente, indique cual es la composicin,
temperatura, entalpa y estado fsico de los puntos A, B, D y E Cul sera la
composicin de las fases gaseosa y lquida resultantes de la mezcla representada
por el punto E ? Si se mezclan adiabticamente tres partes de la mezcla
representada por el punto P con un parte de la representada por el punto M.
Cul sera la composicin de la mezcla resultante?
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
45
Figura 22 Diagrama H, x-y* del sistema hexano-octano.
1. CLCULOS
1.1 PUNTO A
De acuerdo con el diagrama de equilibrio se obtiene que el punto A es un
lquido subenfriado.
x
A
HEXANO
= 0.3 T
A
= 71 C
x
A
OCTANO
= 0.7 H
A
= 4 000 cal/ g-mol
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
46
1.2 PUNTO B
El punto B representa una mezcla de vapores a su temperatura de roco
y*
B
HEXANO
= 0.7 T
B
= 100 C
y*
B
OCTANO
= 0.3 H
B
= 12 250 cal/ g-mol
1.3 PUNTO D
El punto D corresponde a un lquido saturado
x
D
HEXANO
= 0.09 T
D
= 118 C
x
D
OCTANO
= 0.91 H
D
= 7 000 cal/ g-mol
1.4 PUNTO E
El punto E representa una mezcla de vapor y lquido con una composicin
global
x
E
HEXANO
= 0.2 T
E
= 118 C y H
E
= 11 000 cal/ g-mol
El punto E dara un lquido con una composicin global
x
D
HEXANO
= 0.09 T
D
= 118 C y H
D
= 7 000 cal/ g-mol
La composicin de la fase gaseosa sera
x
F
HEXANO
= 0.3 T
F
= 118 C y H
F
= 14 800 cal/ g-mol
1.5 COMPOSICIN DE LA MEZCLA RESULTANTE DE UNIR P CON M
Mediante una lnea recta, se une el punto P con el M. Esta lnea representa
todas las mezclas posibles de P con M. De acuerdo con el enunciado del
problema:
P = 3 M = 1
P/M = 3 P + M = 4
Si dividimos la lnea PM en cuatro partes iguales, el punto de mezcla quedar
a un cuarto de la distancia que hay desde P. La mezcla final debe parecerse ms a
P que a M. La composicin final ser:
x
HEXANO
= 0.75 T = 92 C H = 10 600 cal/ g-mol
2. RESULTADOS
Punto A x
A
HEXANO
= 0.3 T
A
= 71 C H
A
= 4 000 cal/ g-mol
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
47
Punto B y*
B
HEXANO
= 0.7 T
B
= 100 C H
B
= 12 250 cal/ g-mol
Punto D x
D
HEXANO
= 0.09 T
D
= 118 C H
D
= 7 000 cal/ g-
mol
Punto E x
E
HEXANO
= 0.2 T
E
= 118 C H
E
= 11 000 cal/ g-mol
El punto E produce un lquido con 9% de hexano y un vapor con 30% de
hexano en mol.
La composicin de la mezcla resultante de P y M es de 75% en mol de
hexano.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
48
MTODO DE PONCHON-SAVARIT
En la industria, la separacin de dos componentes voltiles por lo general se
realiza sobre una base continua, mediante una columna de destilacin o de
fraccionamiento, como se muestra en la figura 17. La alimentacin A,se introduce
en forma continua en algn punto intermedio de la columna. El calor que se
introduce al rehervidor q
R
vaporiza una parte del lquido. Este vapor asciende por la
columna debido a que su densidad es menor que la del lquido que desciende. Se
proporcionan etapas en la columna para permitir contacto ntimo del vapor y del
lquido peridicamente. El vapor que abandona el plato de la parte superior G
1
de la
columna entra al condensador, donde el calor se remueve por enfriamiento con agua
o algn otro medio de enfriamiento q
C
. Una parte del lquido que se condensa se
regresa a la columna como reflujo lquido L
0
y el restante se convierte en el
producto destilado D.
La combinacin de la generacin de vapor en el rehervidor y la condensacin
del lquido en el condensador, con sus respectivas corrientes regresando a la torre,
diferenca la destilacin continua de las separaciones en equilibrio o flasheo
diferencial. El vapor del rehervidor y el lquido de reflujo permiten obtener productos
de elevada pureza y al mismo tiempo proporciona recuperacin mucho mayor de los
materiales tiles alimentados a la columna.
El condensador puede operar ya sea como un condensador total o como un
condensador parcial. En el primer tipo, todo el vapor que entra al condensador se
condensa y el reflujo que regresa a la columna, tiene la misma composicin que el
destilado o producto superior D. En el caso de un condensador parcial, solamente
una parte del vapor que entra al condensador se condensa a lquido. En la
mayor parte de este segundo tipo de condensadores, slo se condensar el lquido
suficiente con el fin de proporcionar el reflujo para la torre. No obstante, en algunos
casos, se condensar ms lquido del que se requiere para el reflujo, y en realidad
sern dos los productos destilados, uno que tenga la misma composicin que la del
reflujo, y el otro un producto en forma de vapor, En ambos tipos de condensadores
parciales, el vapor y el lquido que salen del condensador se encuentran muy
cerca del equilibrio uno con otro.
La seccin de la columna ubicada entre el plato de alimentacin y el
condensador por lo regular se conoce como la seccin de rectificacin o de
enriquecimiento de la columna. En la seccin de rectificacin, el plato de la parte
superior (domo) por lo general se denota como el plato 1 y el plato inmediatamente
arriba del de alimentacin es el plato Ensimo. La seccin de platos que se
encuentra entre el plato de alimentacin y el rehervidor por lo comn se denomina
seccin de aligeracin o agotamiento. El plato del fondo en la seccin de
agotamiento se numera etapa M y el plato de la parte superior es la etapa Emsima.
El diseo de una columna de destilacin para operacin continua requiere
informacin acerca de la interrelacin de tres variables: el nmero de platos que se
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
49
requiere, el rgimen de reflujo que se requiere y el calor de entrada que se requiere
en el rehervidor.
En la siguiente seccin comenzaremos el estudio del mtodo de Ponchon-
Savarit, el cual realiza anlisis en las diferentes secciones de la torre y por lo tanto
iniciaremos por la seccin de enriquecimiento.
Figura 23 Operacin unitaria de destilacin
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
50
SECCIN DE ENRIQUECIMIENTO
De acuerdo con la figura (24), los
balances de materia y energa en la
seccin de enriquecimiento de una torre de
destilacin seran:
n 1 n
L D G + =
+
(24)
n n
D 1 n 1 n
x L x D * y G +
+ +
= (25)
c n L, n
D L, 1 n G, 1 n
q H L H D H G + = +
+ +
(26)
Figura 24 seccin de enriquecimiento.
En donde:
D = moles de lquido destilado
1 n
G
+
= moles de vapor entrantes a la etapa n y que provienen de la etapa
n+1
1 n
* y
+
= composicin en fraccin mol de los vapores salientes de la etapa
n+1
H
1 n G, +
= entalpa de la corriente saliente de la etapa n+1. (vapor)
n L,
H = entalpa de la corriente saliente de la etapa n. (lquido)
c
q = calor quitado en el condensador
Por conveniencia el calor total perdido en el condensador
D
Q , se suele
expresar en trminos de calor perdido
c
q , por unidad de destilado D, por lo que:
D
q
Q
c
D
= (27)
Por lo que la ecuacin (26) se convierte en
) Q (H D H L H G
D D L, n L, n
1 n G, 1 n
+ + =
+ +
(28)
Arreglando la ecuacin (24) quedara:
D L G
n 1 n
=
+
(29)
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
51
Lo que nos indica que la diferencia entre cualquiera de las corrientes en la
seccin de enriquecimiento es constante e igual al destilado D.
Rearreglando (25) y (28)
D n n 1 n 1 n
x D x L - * y G =
+ +
(30)
) Q (H D H L - H G
D D L, n L, n
1 n G, 1 n
+ =
+ +
(31)
La ecuacin (30) nos indica que el flujo neto del componente ms voltil en la
seccin es constante e igual a la cantidad destilada de ese componente. La
ecuacin (31) indica que el flujo de calor neto
D
Q , es tambin una constante.
Las ecuaciones (29), (30) y (31) se deben resolver simultneamente para
obtener el nmero de platos requeridos. Esas ecuaciones indican que hay un punto
en comn (
D
) por donde pasan todas las lneas de operacin de la seccin de
enriquecimiento y que ese punto tiene las coordenadas (
D
x , ) Q H
D D L,
+ .
En el caso ms sencillo de destilacin, que es la de un condensador total,
tendremos que la composicin de G
1
y de L
0
es la misma y que
D L, o L,
H H = .
Aplicando las ecuaciones anteriores hasta el primer plato, tendramos
tambin, segn la figura 25:
D L G
o 1
+ = (32)
D o o 1 1
x D x L y G + = (33)
) Q H ( D H L H G
D D L, o L, o G,1 1
+ = 34)
Reordenando:
Figura 25
) Q H ( D H L H D) (L
D D L, o L, o G,1 o
+ = +
] H - ) Q H ( [ D ) H H ( L
G,1 D D L, o L, G,1 o
+ =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
52
D
o
R
D
L
=
o L, G,1
G,1
)
D
D L,
H - H
H - Q (H +
=
pero como
D L, o L,
H H =
D
o
R
D
L
=
D L, G,1
G,1
)
D
D L,
H - H
H - Q (H +
=
(35)
La relacin
D
Lo
es conocida como reflujo externo ( R
D
). Esta relacin
puede representarse en un diagrama de entalpa concentracin (figura 20).
Figura 26 Reflujo externo
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
53
Al punto
D
se le llama punto de
diferencia, y tiene una entalpa igual a
(H
L,D
+Q
D
) y composicin x
D
. El punto
D
es un punto de operacin comn para todos
los valores de G
n+1
y L
n
en la seccin de
enriquecimiento de la torre de destilacin.
Este punto
D
se incluye tambin
en la figura 27. En la figura se muestra
adems, la localizacin de G
1
, que tiene
una composicin y*
1
= x
D
para un
condensador total. El lquido L
1
est en
equilibrio con G
1
y se localiza trazando
una lnea de unin o de reparto que pase
por G
1
e intercepte a la lnea de lquido
saturado en L
1
. A continuacin se traza
una lnea en forma de L
1
D
que
intercepte a la lnea de vapor saturado en
G
2
.
Con respecto a la ecuacin (29),
D = G
2
- L
1
o
D + L
1
= G
2
Por consiguiente, G
2
debe estar en
una sola lnea con L
1
y
D
, tal como se
demostr en la deduccin de la regla del
brazo de la palanca.
A continuacin seguiremos con la elaboracin del siguiente plato terico, que
ser ejemplificada en la figura 28. Cmo se traza la lnea de unin o de reparto
G
2
L
2
? Esto se hace de la siguiente manera:
A partir del punto G
2
, trace una lnea completamente vertical hasta tocar la
lnea de 45 del diagrama de equilibrio y* vs. x . (punto c).
A partir del punto c, se traza una lnea completamente horizontal hasta la
curva de equilibrio del diagrama y* vs. x . (punto d ).
Del punto d se traza una lnea vertical hasta la lnea de lquido saturado o
punto de burbuja. Donde encontraremos L
2
. Y para encontrar G
3
, se traza la
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
54
lnea L
2
D
donde intercepte con la lnea de vapor saturado, ah se tendr el punto
G
3
.
Este proceso de la figura 28 se contina, escalonando los platos tericos en
la seccin de enriquecimiento de la torre. En la siguiente seccin se estudiar el
mtodo para localizar el punto de operacin en la seccin de agotamiento, lo cual
tambin indicar el momento en el que se pasa por el plato de alimentacin; en la
figura 28, la alimentacin es parte vapor y parte lquido.
Figura 28 Nmero de etapas en la seccin de enriquecimiento.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
55
SECCIN DE AGOTAMIENTO
Para analizar la seccin de
agotamiento de una torre fraccionadora, se
llevan a cabo un balance de materiales total
y un balance de materiales de componentes
en la figura 29.
1 m m
G F L
+
+ = (36)
1 m 1 m F 1 m m
y G x F x L
+ + +
+ = (37)
Reordenando (36) y escribindola
para los diversos platos,
1 m m
G - L F
+
=
m 1 - m
G - L =
F M
G - L = = . (38)
Nuevamente, esta diferencia entre las dos corrientes en contacto es un valor
constante F.
El mismo fundamento sucedera con la ecuacin (37), en la cual la
composicin de esta corriente de diferencia sera una constante x
F
.
Por conveniencia el calor total que entra en el rehervidor
F
Q , se suele
expresar en trminos de calor que entra
R
q , por unidad de fondo F, por lo que:
F
q
Q
R
F
=
(39)
Efectuando un balance de entalpa con una entrada de q
R
al rehervidor de la
figura 23.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
56
1 m G, m F L, R m L, m
H G H F q H L
1
+
+
+ = + (40)
Despejando q
R
de (39) y sustituyendo en 40, tenemos:
1 m G, m F L, F m L, m
H G H F Q F H L
1
+
+
+ = +
1 m G, m m L, m F F L,
H G - H L Q F - H F
1
+
+
=
1 m G, m m L, m F F L,
H G - H L ) Q - H ( F
1
+
+
= (41)
Nuevamente, la diferencia de entalpa entre las corrientes en contacto es
constante, siendo la entalpa ( H
L,F
- Q
F
).
A este nuevo punto de
diferencia en la seccin de
agotamiento le llamaremos
F
, y
tiene entalpa (H
L,F
- Q
F
). Y una
composicin x
F
. Este punto
F
es
un punto de operacin similar al
punto
D
de la seccin de
enriquecimiento. Este punto
F
se
incluye en la figura 24.
Para trazar el plato del fondo
empezamos en el punto
F
; de ah,
se traza una lnea vertical que tenga
de extremos, la interseccin con la
lnea de vapor saturado (punto a) y
la lnea de equilibrio del diagrama y*
vs. x (punto b). Despus se traza
una lnea a partir del (punto b)
unindolo horizontalmente con la
lnea de 45 del diagrama y* vs. x
(punto c). Se sigue a partir del
(punto c) verticalmente hasta la lnea
de vapor saturado (punto G
F
).
Ahora si, se une G
F
con F y
esta lnea es la de unin o reparto, o
tambin llamado plato terico.
A continuacin se traza la
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
57
lnea G
F
F
, ver figura 25. que intercepta a la lnea de lquido saturado en L
M
.
Reordenando (38)
G
F
+ F = L
M
(42)
Por consiguiente, L
M
debe estar en una misma lnea con G
F
y
F
. A
continuacin se traza la lnea de unin L
M
G
M
. Este proceso se contina
escalonando los platos tericos.
Figura 30 Nmero de etapas tericas en la seccin de agotamiento
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
58
COLUMNA COMPLETA
Existen dos puntos de operacin
D
y
F
, para la totalidad de la columna de
destilacin. Para obtener una relacin entre ambos puntos, se lleva a cabo un
balance general de entalpa en la totalidad de la columna.
C F L, D L, R A
q H F H D q H A + + = +
(43)
Reordenando,
( ) ( )
D D L, F F L, A
Q H D Q - H F H A + + =
(44)
Los dos trminos del lado derecho representan a los puntos de operacin
D
y
F
. La entalpa del punto F es H
F
= (H
L,F
- Q
F
)
, y la de D es H
D
= (H
L,D
+
Q
D
).
Por lo tanto, los tres puntos A,
D
y
F
, deben quedar en una lnea recta
con A situado entre
D
y
F
. Ver figura 31.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
59
Figura 31
DETERMINACIN DEL NMERO DE ETAPAS
La construccin grfica para el nmero de etapas tericas puede iniciarse,
tal como se muestra en la figura 32, tanto en la parte superior como en la inferior de
la torre. Cuando una lnea de unin o de equilibrio cruza la lnea
D
A
F
(que
pasa a travs de la condicin de alimentacin A), se usa el otro punto de diferencia
para el resto de la torre. Esto representa la localizacin ptima del plato de
alimentacin. En la figura 32, la alimentacin esta situada en el quinto plato,
enumerando desde arriba (domo). La torre tiene un total de ocho etapas tericas o
siete platos tericos y un rehervidor.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
60
Figura 32 Determinacin grfica del nmero de etapas tericas en una torre de
destilacin completa
REFLUJO TOTAL Y REFLUJO MNIMO
La relacin de reflujo R
D
= L /D puede determinarse de la siguiente manera.
Primero se reordena la ecuacin (28)
) Q (H D H L H G
D D L, n L, n
1 n G, 1 n
+ + =
+ +
Reemplazando
1 n
G
+
por
n
L + D , para despus factorizar y obtener
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
61
n L,
1 n G,
1 n G, D D L,
n
H H
H ) Q (H
D
L
=
+
+
+
(45)
Esta igualdad proporciona el valor de
D
L
n
interno. Par la relacin de
reflujo en la parte superior de la torre, la ecuacin (45) se transforma en la
siguiente expresin para dicha parte superior de la torre:
= R
D
D L,
G,1
1 , G D D , L
H H
H ) Q H (
D
L
=
+
=
D L,
G,1
1 , G D
H H
H ' H
(46)
donde, H
G,1
= H
G,D
= entalpa del vapor en el plano superior de la figura 19.
En la figura 22, la localizacin del punto de operacin
D
se sita de tal manera que
la distancia H - H
G,1
dividida entre la distancia H
G,1
- H
L,D
sea igual a R
D
.
Procediendo de otra forma, se grafica el punto
D
correspondiente a H = ( H
L,D
+
Q
D
) y x
D
.
Al aumentar el reflujo, L
O
/ D aumenta el punto
D
, el cual deber
colocarse ms arriba.
Cuando el reflujo tiende hacerse muy grande o se hace total, el punto
D
se
encuentra localizado en el infinito y las lneas de operacin se hacen verticales. En
este caso el nmero de etapas es el mnimo. Ver figura 33.
En reflujo total
D = 0
Q
D
=
D
q
C
=
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
62
Figura 33 Reflujo total
El reflujo mnimo se presenta junto con un nmero infinito de etapas y con un
mnimo de requerimientos de calor y de agua de enfriamiento. El reflujo mnimo en
el mtodo de Ponchon - Savarit se obtiene cuando las lneas de operacin y de
equilibrio coinciden. En el diagrama de equilibrio esto se logra haciendo pasar a
travs de la alimentacin una lnea paralela a la lnea de equilibrio, ms prxima.
Vase figura 34.
Figura 34 Trazo para conocer
D mn
y evaluar reflujo mnimo, realizado
paralelamente a la lnea de equilibrio ms cercana al punto A.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
63
PROCEDIMIENTO PASO A PASO PARA EL CLCULO DEL NMERO DE
ETAPAS IDEALES POR EL MTODO DE PONCHON-SAVARIT.
1.- Construya el diagrama de entalpa concentracin del sistema a la presin
de operacin requerida.
2.- Coloque sobre el diagrama los
puntos de alimentacin, destilado y fondos.
La posicin depender tanto de la
composicin como de la entalpa. En la
figura 35, A
1
es un lquido subenfriado. A
2
es un lquido a su punto de burbuja. A
3
es
una mezcla de vapor y de lquido. A
4
representa la alimentacin en forma de
vapor saturado. A
5
es un vapor
sobrecalentado.
Figura 35
3.- Localice el reflujo mnimo (si es que
no se conoce el reflujo que se va a utilizar).
Esto se logra haciendo pasar por la
alimentacin una lnea paralela a la lnea de
equilibrio ms cercana y prolongndola hasta
que choque con una lnea vertical que parte
del destilado. Vase figura 36. El reflujo
mnimo es, ecuacin (46):
D L,
D G,
D , G D D , L
Dmn
H H
H ) Q H (
R
=
+
Figura 36
4.- Localice el punto
D
de operacin. Este
punto es siempre mayor que el mnimo. El reflujo
de operacin puede ser de 1.5 a 2.5 veces el
mnimo o ser an mayor debido a requerimientos
del proceso.
R
D op
= R
D mn
()
= relacin de reflujo
Figura 37
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
64
5.- Localice el punto
F
. Con el reflujo de operacin se puede localizar
fcilmente el punto
F
, pues basta prolongar la lnea que une a la alimentacin con
el punto
D op.
hasta que cruce x
F
. Ver figura 37.
6.-Etapas en la seccin de enriquecimiento. El nmero de etapas se obtiene
con el uso alternado de las lneas de operacin y las de equilibrio. El procedimiento
se sigue hasta que una de las lneas de equilibrio atraviese la lnea de operacin
total.
Vase figura 38-A.
7.- Etapas en la seccin de agotamiento. Cuando la composicin saliente de
un plato es menor que la de alimentacin, las lneas de operacin se dibujan a partir
del punto
F
. El uso alternativo de estas lneas y la de equilibrio, darn las etapas
requeridas. El procedimiento contina hasta que la composicin del lquido saliente
de alguna etapa sea menos que la requerida para los fondos. Vase figura 38-B.
Figura 38
8.- Requerimiento de agua de enfriamiento y de vapor de calentamiento. Los
requerimientos energticos se obtienen a partir de los puntos
D
y
F
, ya que all
se leen los datos ( H
L,D
+ Q
D
) y de ( H
L,F
- Q
F
).
PROBLEMA 5
En una planta petroqumica se tiene una corriente de 5000 kg/h. La cual
contiene 50% de metanol en peso y el resto de agua. Para concentrar el metanol se
ha pensado en una columna de destilacin a una presin de 760 mm. de Hg.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
65
Cuntos platos ideales se requerirn si el destilado debe contener 95% en
peso de metanol y el residuo 5%?.
Se piensa utilizar un reflujo de 1.14285 y meter la alimentacin a su punto de
burbuja.
Cunto calor se debe quitar en el condensador y, cuanto se debe aadir en
el calderin?. A que porcentaje del reflujo mnimo se operar?.
Datos de equilibrio
x = fraccin mol de
metanol en el
lquido
y* = fraccin mol de
metanol en el vapor
H
G
kcal/kgmol H
L
kcal/kgmol
0 0 11421 1800
0.05 0.272 11322 1687
0.1 0.418 11231 1620
0.15 0.509 11113 1577
0.2 0.575 11009 1549
0.25 0.624 10910 1529
0.3 0.665 10823 1515
0.35 0.699 10746 1504
0.4 0.73 10676 1496
0.45 0.758 10612 1489
0.5 0.7825 10540 1483
0.55 0.808 10486 1479
0.6 0.83 10427 1475
0.65 0.8537 10372 1467
0.7 0.874 10314 1464
0.75 0.896 10262 1461
0.8 0.916 10208 1458
0.85 0.938 10160 1455
0.9 0.958 10110 1452
0.95 0.978 10058 1450
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
66
Tabla 6
1. TRADUCCI
Figura 39
2. PLANTEAMIENTO
2.1 DISCUSIN
Se usar el mtodo de Ponchon-Savarit para resolver el problema.
2.2 ECUACIONES DE BALANCE DE MATERIA
O H M
M
M
A
2
PM
A en agua de peso %
PM
A en metanol de peso %
PM
A en metanol de peso %
mol] fraccin [ x
+
=
( ) ( )
O H M
2
PM
agua de peso . fr A
PM
ol tan me de peso . fr A
kgmol/h] A[ + =
A = D + F
M
F
M
D
M
A
x F x D x A + =
2.3 REFLUJO
R
D
D L, G,1
G,1
D
D L,
H - H
H - ) Q (H +
=
3. CLCULOS
3.1 BALANCES
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
67
h
kgmol
217
18
) 0.5 ( 5000
32
) (0.5 5000
A = + =
mol fr. 0.36
18
50
32
50
32
50
mol] fr. [ x
M
A
=
+
=
mol fr. 0.915 x
M
D
= ; mol . fr 0287 . 0 x
M
F
=
A = D + F ; 217 = D + F ( I )
M
F
M
D
M
A
x F x D x A + = ; 217 ( 0.36 ) = D (0.915) + F (0.0287) ( II )
Resolviendo las ecuaciones ( I ) y ( II ) como un sistema de dos ecuaciones
con dos incgnitas:
D = 81.11 kgmol/h
F = 135.88 kgmol/h
3.2 REFLUJO MNIMO
Con los datos de equilibrio se construye el diagrama H vs. x,y*. En la figura
40 se colocan los puntos conocidos. Para hallar el reflujo mnimo se debe hacer
pasar una paralela a travs de A a la lnea de equilibrio ms cercana.
En la figura 36 se leen los valores de ( H
L,D
+ Q
D
)
mn
, H
G,1
y H
L,D
.
( H
L,D
+ Q
D
)
mn
= 16200 kcal / kgmol
H
G,1
= 10 280 kcal / kgmol
H
L,D
= 1450 kcal / kgmol
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
68
Figura 40
R
Dmn.
D L, G,1
G,1
)
D
D L,
H - H
H - Q (H +
= =
1450 - 10280
10280 - 16200
=
8830
5920
= 0.6704
R
D op
= 1.14285
R
D op
= R
D mn
()
= relacin de reflujo =
mn D
op D
R
R
=
0.6704
1.14285
= 1.7047 veces el reflujo mnimo.
Para encontrar el punto
D op
se despeja (H
L,D
+ Q
D
)
de la frmula
R
D op
D L, G,1
G,1
D
D L,
H - H
H - ) Q (H +
= 1.14285
1450 - 10280
10280 - ) Q (H
D
D L,
= =
+
(H
L,D
+ Q
D
)
= 20371.36 kcal /kgmol.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
69
Figura 41
3.3 NMERO DE ETAPAS
Con el reflujo de operacin y el punto
D
se construyen las etapas ideales
requeridas, figura 41.
3.4 AGUA REQUERIDA EN EL CONDENSADOR
(H
L,D
+ Q
D
)
= 20371 kcal /kgmol.
H
L,D
= 1450 kcal / kgmol
Q
D
= 20371 1450 = 18921 kcal / kgmol
De la ecuacin (27), tenemos:
D
q
Q
c
D
=
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
70
q
C
= Q
D
( D ) = 18921 kcal / kgmol ( 81.11 kgmol/h ) = 1 534 682.31 kcal / h
3.5 CALOR QUE SE NECESITA DAR EN EL REHERVIDOR
( H
L,F
- Q
F
) = - 9800 kcal / kgmol
Q
F
= 9800 + 1750 = 11 550 kcal / kgmol
De la ecuacin (39), tenemos:
F
q
Q
R
F
=
h / kcal 414 569 1 h) kgmol/ 135.88 ( kgmol kcal/ 11550 ) (F Q q
F
R
= = =
4. RESULTADOS
Se necesitan 7 platos ideales o 6 y el rehervidor. Enumerando desde el domo, la
alimentacin se har en el plato 4
q
C
= 1 534 682.31 kcal / h
q
R
= 1 569 414 kcal / h
Se operar a 1.7047 veces el reflujo mnimo.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
71
PROBLEMA 6
Se desean destilar 4540 kg/h de una solucin de acetona y agua la cual
contiene 65% en peso de acetona. Las especificaciones del proceso requieren de la
recuperacin del 90% de la acetona en el destilado, el cual debe tener una pureza
del 91% en mol de acetona.
La alimentacin proveniente de un sistema de recuperacin de acetona ha
sido precalentada de tal manera que est formada por 50% de vapor y 50% de
lquido. Los vapores destilados deben ser condensados en un condensador total
mediante agua de enfriamiento que entra a 27 C y sale a 40 C.
a) Determine el reflujo mnimo.
b) Obtenga el nmero de etapas en equilibrio requeridas para esta separacin
si se usa un reflujo de 1.8 veces el mnimo.
c) Determine la cantidad de agua requerida en el condensador.
d) Qu cantidad de vapor de calentamiento se requerir si se usa un vapor
saturado de 10 psig?
Datos de equilibrio
x = fraccin mol de
acetona en el
lquido
y* = fraccin mol de
acetona en el vapor
H
G
kcal/kgmol H
L
kcal/kgmol
0 0 9625 0
0.01 0.253 9550 0
0.02 0.425 9500 0
0.05 0.624 9400 0
0.1 0.755 9350 -550
0.15 0.798 9000 -550
0.2 0.815 8800 -440
0.3 0.83 8525 -385
0.4 0.839 8350 -275
0.5 0.849 8150 -165
0.6 0.859 7950 0
0.7 0.874 7810 0
0.8 0.898 7700 110
0.9 0.935 7535 110
0.95 0.963 7500 110
1.00 1.00 7425 110
Tabla 7
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
72
1. TRADUCCIN
Figura 42
2. PLANTEAMIENTO
2.1 BALANCES DE MATERIA
O H acetona
acetona
acetona
A
2
PM
A en agua de peso %
PM
A en acetona de peso %
PM
A en acetona de peso %
mol] [fr. x
+
=
( ) ( )
O
2
H M
PM
agua de peso fr. A
PM
metanol de peso fr. A
kgmol/h] A[ + =
( ) 0.9 x A x D
acetona
A
acetona
D
=
A = D + F
acetona
F
acetona
D
acetona
A
x F x D x A + =
2.2 REFLUJO
R
D op
= 1.8 R
D mn
R
D
D L, G,1
G,1 D
D L,
H - H
H - ) Q (H +
=
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
73
3. CLCULOS
3.1 BALANCES DE MATERIA
Fraccin mol de la acetona en la alimentacin.
mol fr. 0.3656
18
35
58
65
58
65
x
acetona
A
=
+
=
Moles en la alimentacin.
h
kgmol
139.15
18
) 0.35 ( 4540
58
) (0.65 4540
A = + =
Acetona en el destilado
acetona de
h
kgmol
45.78 (0.90) (0.3656) 139.15 (0.9) x A x D
acetona
A
acetona
D
= = =
moles de destilado
= =
acetona
D
x
acetona de
h
kgmol
45.78
D
0.91
acetona de
h
kgmol
45.78
=
D = 50.3
h
kgmol
Balance total
139.15 = 50.3 + F
F = 88.85
h
kgmol
Balance de acetona
acetona
F
acetona
D
acetona
A
x F x D x A + =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
74
acetona
F
x 88.85 (0.91) 50.3 (0.3656) 139.15 + =
0.057 x
F
acetona
=
Figura 43
3.2 CLCULO DEL REFLUJO MNIMO Y EL DE OPERACIN
A partir de la figura 39 se obtiene el reflujo mnimo.
En primer lugar se colocaron los puntos del destilado y el de alimentacin.
En este caso la concentracin de la alimentacin es de x
A
= 0.3656 fr. mol pero la
alimentacin est formada por 50% de vapores y 50% de lquido.
x
D
= 0.91 fr. mol x
F
= 0.057 fr. mol
Con los puntos de alimentacin y destilados es posible trazar la lnea de
reflujo mnimo.
kgmol
kcal
13500 ) Q (H
mn D D L,
= +
kgmol
kcal
110 H
D L,
=
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
75
kgmol
kcal
7700 H
G,1
=
0.7641
110 - 7700
7700 - 13500
R
mn
D
= =
1.3754 0.7641) ( 1.8 R
op
D
= =
110 - 7700
7700 - ) Q (H
1.3754
D D L,
+
=
kgmol
kcal
18140 ) Q (H
D D L,
= +
3.3 NMERO DE ETAPAS
En la figura 40 se obtienen fcilmente el nmero de platos. De la figura se
requieren 4 platos ideales. La alimentacin entra en el tercer plato enumerndolos
desde el domo de la torre.
3.4 AGUA NECESARIA
kgmol
kcal
18140 ) Q (H
D
D L,
= +
kgmol
kcal
110 H
D L,
=
kgmol
kcal
18030 Q
D
=
De la ecuacin (27), tenemos:
D
q
Q
c
D
=
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
76
Figura 44
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
77
h
kcal
269.6 907 )
h
kgmol
50.32 (
kgmol
kcal
18030 ) D ( Q q
D C
= = =
h
kg
789.96 69
C 27) - 40 (
C kg
kcal
1
h
kcal
269.6 907
da requeri Agua =
=
3.5 VAPOR REQUERIDO
kgmol
kcal
3000 - ) Q (H
F
F L,
= 0 H
F L,
=
kgmol
kcal
3000 0 3000 Q
F
= + =
De la ecuacin (39), tenemos:
F
q
Q
R
F
=
h
kcal
550 266 )
h
kgmol
88.85 (
kgmol
kcal
3000 ) (F Q q
F
R
= = =
kg
kcal
638.22 H
vapor
=
kg
kcal
120 H
s condensado
=
h
kg
514.35
120 - 638.22
550 266
Vapor = =
4. RESULTADOS
El reflujo mnimo es de 0.7641 y el reflujo de operacin es de 1.3754
El nmero de etapas ideales requeridas es de 4
Se requieren de 69 789.96 kg. de agua de enfriamiento por hora y 514.35
kg de vapor por hora.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
78
CASOS ESPECIALES DE APLICACIN DEL MTODO DE PONCHON-
SAVARIT
CONDENSADORES PARCIALES
Los condensadores parciales se usan en aquellos casos en que se de, a que
l destilado o parte de l, est en forma de vapor.
CASO I
Condensador parcial, destilado totalmente en forma de vapor. En este caso solo
se condensa el vapor requerido para proporcionar el reflujo a la torre.
Figura 45 Condensador parcial
BALANCES
D o 1
G L G + =
(47)
D D o o 1 1
* y G x L * y G + =
(48)
C D G, D o L, o G,1 1
q H G H L H G + + =
(49)
Reordenando los trminos en la forma acostumbrada
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
79
D o 1
G L G =
(50)
D D o o 1 1
* y G x L * y G =
(51)
) Q (H G H L H G
D D G, D o L, o G,1 1
+ =
(52)
Sustituyendo (47) en (52)
) Q (H G H L H ) G (L
D D G, D o L, o G,1 D
o + = +
] H - ) Q H ( [ G ) H - (H L
G,1 D D G, D o L, o
G,1
+ =
o L, G,1
G,1 D D G,
D
D
o
H - H
H - ] ) Q (H [
R
G
L
+
= =
(53)
En este caso el destilado que es vapor est en equilibrio con el reflujo lquido
por lo que en la figura 46 se tiene:
Figura 46
CASO II
El producto destilado sale en dos formas, una corriente en forma de vapor y la
otra en forma de lquido.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
80
Figura 47
BALANCES
D o o D D 1
M L L L G G + = + + =
(54)
x L x L * y G * y G
o o D D D D 1 1
+ + =
(55)
q H L H L H G H G
C o L, o D L, D G D G,1 1
D ,
+ + + =
(56)
Reordenando
D D
D o 1
M L G L - G = + =
(57)
Z M x L * y G x L * y G
D
D D D D D o o 1 1
= + =
(58)
H M q H L H G H L H G
DM
D C D L, D
D L, D o L, o G,1 1
= + + = (59)
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
81
) Q H ( M H L H G
D DM D
o L, o G,1 1
+ =
(60)
En donde
D D
D D D D
D
L G
x L * y G
Z
+
+
=
(61)
D D
D L, D D G, D
DM
L G
H L H G
H
+
+
=
(62)
Sustituyendo (54) en (60)
) Q (H M H L - H ) M (L
D
DM D o L, o G,1 D o
+ = +
] H - ) Q (H [ M ) H - (H L
G,1 D DM D o L, G,1 o
+ =
o L, G,1
G,1 D DM
D
o
D
H - H
] H - ) Q H ( [
M
L
R
+
= = (63)
En este caso el producto gaseoso est en equilibrio con el producto lquido.
Adems el producto lquido tiene la misma composicin que el reflujo, as como la
misma entalpa. En el diagrama de equilibrio esto queda como:
Figura 48
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
82
PROBLEMA 7
Una columna de destilacin debe procesar una mezcla de 10 000 kg/h que
contiene 36% de metanol en mol y el resto de agua. La mezcla se alimentar a la
columna en forma de lquido saturado. Por requerimientos del proceso se deber
usar un condensador parcial en el cual el destilado en forma de vapor deber salir
con 90% de metanol en mol. Adems se requiere que las moles de destilado
saliente en forma de vapor sean iguales a las salientes como lquido. El lquido
reflujado deber ser igual a la totalidad de los productos destilados. Cul ser el
nmero de platos ideales requeridos para esa separacin si los fondos deben
contener 2% en mol de metanol?
1. TRADUCCIN
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
83
Figura 49
2. PLANTEAMIENTO
2.1 BALANCES
F M F L G A
D D D
+ = + + =
F D D D D A
x F x L * y G x A + + =
D D
D D D D
D
L G
x L * y G
Z
+
+
=
D D D
L G M + =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
84
2.2 REFLUJO
o L, G,1
G,1 D DM
D
o
D
H - H
] H - ) Q H ( [
M
L
R
+
= =
D D
D L, D D G, D
DM
L G
H L H G
H
+
+
=
3. CALCULOS
3.1 BALANCES
h
kgmol
2 434.0
18
(0.50) 000 10
32
(0.50) 000 10
A = + =
F L G 434.02
D D
+ + =
F G 2 434.02
D
+ = [ I ]
(0.02) F ) (x G (0.9) G (0.36) 434.02
D D D
+ + =
El valor de x
D
de la ecuacin anteriorse obtiene a partir de los datos de
equilibrio para el metanol (tabla 6, pgina 48). Debe recordarse que x
D
est en
equilibrio con y*
D
. Con el valor de y* = 0.9 encontramos en la tabla 6 que al
equilibrio:
x
D
= 0.75 Ahora, continuando con la ecuacin anterior:
(0.02) F (1.65) G 156.25
D
+ = [ II ]
Resolviendo [ I ] y [ II ]
h
kgmol
91.658 G
D
=
Simultneamente
h
kgmol
250.703 F =
h
kgmol
91.658 L
D
=
3.2 REFLUJO Y LINEAS DE OPERACIN.
Para localizar el reflujo se deben obtener los siguientes puntos:
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
85
x
A
= 0.36 ; x
F
= 0.02 ; x
D
= 0.75 ; y*
D
= 0.9
mol fr. 0.825
(2) 91.658
(0.75) 91.658 ) (0.9 91.658
L G
x L * y G
Z
D D
D D D D
D
=
+
=
+
+
=
1461 - 10262
262 10 - ) Q H (
H - H
H - ) Q H (
1
M
L
R
D DM
o L, G,1
G,1 D DM
D
o
D
+
=
+
= = =
kgmol
kcal
063 19 ) Q (H
D DM
= +
Los valores de las entalpas son obtuvieron nuevamente de la (tabla 6,
pgina 48) o se pueden leer del diagrama de la figura 46
3.3 NMERO DE PLATOS
A partir de la figura 46, se obtiene 5 platos ideales
4. RESULTADOS
Se requieren 5 platos ideales.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
86
Figura 50
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
87
VAPOR VIVO
Cuando el compuesto menos voltil en una mezcla binaria es el agua, se
puede eliminar el caldern rehervidor y adicionar calor a la columna inyectando
vapor vivo por debajo de la ltima etapa. Este procedimiento puede resultar
econmicamente ventajoso. Como el vapor de agua que se inyecta es puro, su
concentracin se encontrar en x = 0, en donde x se refiere al compuesto ms
voltil. La entalpa del vapor se localizar en H
V
. Si se efecta un balance total
alrededor de la columna.
Figura 51
F D A V + = +
(64)
F D A
x F x D x A + =
(65)
F L, C D L, A V
H F q H D H A H V + + = +
(66)
La ecuacin (66) se puede poner como:
) Q (H D H F H A H V
D D L, F L, A V
+ + = +
La comparacin de esta ecuacin con la ecuacin normal del mtodo de
Ponchon-Savarit, nos indica que la lnea de operacin total pasar por el punto
D
,
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
88
x
A
y llegar a
F
. Las coordenadas
F
se fijan por la intercepcin de la lnea que
pasa por
D
y A; y la que pasa por H
V
, x
F
.
PROBLEMA 8
Si en el problema No. 5 se utiliza vapor vivo a 10 psig Cuntos platos
ideales se requeriran?
1. TRADUCCIN
Figura 52
2. PLANTEAMIENTO
2.1 BALANCES
F D A V + = +
F D A
x F x D x A + =
) Q (H D H F H A H V
D D L, F L, A V
+ + = +
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
89
3. CALCULOS
3.1 BALANCES
Del problema No. 5, tenemos:
A = 217 kgmol / h x
A
M
= 0.36 x
D
M
= 0.915 x
F
M
= 0.0287
217 + V = D + F
217 (0.36) = D (0.915) + F (0.0287)
Para resolver estas ecuaciones se requiere de una tercer ecuacin, ya que el
par anterior presenta tres variables; por lo tanto, utilizaremos como tercera ecuacin
el balance de entalpa para solucin. Los datos de entalpa se pueden obtener a
partir de los datos de equilibrio. (tabla 6, pgina 48) o tambin de la figura 37
pgina 52.
kgmol
kcal
1500 H
A
= ;
kgmol
kcal
1750 H
F L,
= ;
kgmol
kcal
1450 H
D L,
=
De tablas de vapor:
kgmol
kcal
11488
kg
kcal
638.22 H
V
= =
Balance de energa
) Q (H D H F H A H V
D D L, F L, A V
+ + = +
) 1750 ( F ) Q 1450 ( D ) (1500 217 ) 11488 ( V
D
+ + = +
Pero, del problema No. 5 (pgina 53) tenemos que:
kgmol
kcal
18921 Q
D
=
por lo tanto:
F D V 217 + = + ( I )
) 0.0287 ( F ) 0.915 ( D 78.12 + = ( II )
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
90
( D 325500 V 11488 = + 20371 ) + F ( 1750 ) ( III )
Resolviendo simultneamente
h
kgmol
151.3 V =
h
kgmol
76.21 D =
h
kgmol
292.09 F =
3.2 REFLUJO
Del problema No. 5 (pgina 51)
0.6704 R
mn D
= 1.14285 R
op.
=
kgmol
kcal
20371.36 Q H
D D L,
= +
kgmol
kcal
18921 Q
D
=
3.3 CONSTRUCCIN DEL DIAGRAMA
Del diagrama ( figura 53 ) tenemos 7 platos ideales
4. RESULTADOS
Se requieren 7 platos ideales
Se necesitan
h
kg
2723.4 vapor de
h
kgmol
151.3 =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
91
Figura 53
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
92
ALIMENTACIONES MLTIPLES
La adicin de material o de calor, requiere de un nuevo punto de diferencias
para la nueva seccin de la torre.
Figura 54
El balance total alrededor de la torre dara:
F D A A
2 1
+ = +
F D A2 2 A1 1
x F x D x A x A + = +
F C
D R A2 2 A1 1
H F q H D q H A H A + + = + +
Si definimos A
M
como:
2 1 M
A A A + = y a
2 1
A2 2 A1 1
AM
A A
x A x A
Z
+
+
=
2 1
A2 2 A1 1
AM
A A
H A H A
H
+
+
=
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
93
Las ecuaciones anteriores quedaran
D F A
M
+ =
D F AM M
x D x F Z A + =
) Q H ( F ) Q H ( D H A
F F L, D D L, AM M
+ + =
Esas ecuaciones nos indican que existe una lnea de operacin total que une
al punto
D
con el punto
AM
Z y el punto
F
.
Figura 55
Las corrientes que pasan por arriba de la alimentacin superior estn siempre
relacionadas por:
D L - G
n 1 n
=
+
D n n 1 n 1 n
x D x L - * y G =
+ +
) Q H D( H L - H G
D D L, n L, n 1 n G, 1 n
+ =
+ +
Figura 56
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
94
Por lo que el punto focal
D
sirve para trazar los platos que estn por
arriba de esa alimentacin.
Si se introduce una nueva alimentacin habr otra lnea de operacin, la cual
se encuentra haciendo un balance alrededor del condensador y de un plato general
en la seccin S.
Figura 57
S 1 S 1
L D G A + = +
+
constante A D L - G
1 S 1 S
=
+
S S 1 S
L - G =
+
tambin
S S D 1 S 1 S A1 1
x L x D * y G x A + = +
+ +
constante x A x D x L - * y G
A1 1 D S S 1 S 1 S
=
+ +
x x L - * y G
S S S S 1 S 1 S
=
+ +
De la misma manera el balance de entalpa quedara
C S S D 1 S G, 1 S A1 1
q H L H D H G H A + + = +
+ +
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
95
A1 1 D D L, S S 1 S G, 1 S
H A - ) Q (H D H L - H G + =
+ +
S
S S S 1 S G, 1 S
H H L - H G
+ +
=
Lo anterior indica que existe una lnea recta que pasa por
) x , H ( y ) x , H ( , ) x , Q H (
S S A1 A1 D D D
+
D
A
1
S
Haciendo ahora un balance alrededor del rehervidor y de un plato general en
la seccin S encontramos que:
F G L A
1 S S 2
+ = +
+
F L - G A
S 1 S 2
+ =
+
F A
S 2
+ =
De la misma forma tenemos
F 1 S 1 S S S A2 2
x F * y G x L x A + = +
+ +
F S S 1 S 1 S A2 2
x F x L - * y G x A + =
+ +
Figura58
F S S A2 2
x F x x A + =
El balance de energa dara
F L, 1 S G, 1 S S L, S A2 2 r
H F H G H L H A q + = +
+ +
F L, 1 S G, 1 S S L, S A2 2
H F H G H L H A + =
+ +
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
96
) Q - H ( F H H A
F F S S A2 2
+ =
Por lo tanto existe una lnea recta que pasa por los puntos
) Q - H , (x , ) x , H ( , ) x , H (
F F L, F S S A2 A2
F S 2
A
Como las dos lneas que pasan por la seccin S tiene un punto comn
S
,
este debe buscarse en la interseccin de ambas lneas, tal y como muestra el
diagrama siguiente:
Figura 59
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
97
Recapitulando, cuando se tienen dos alimentaciones se deben efectuar los
siguientes pasos.
1. Localizar en el diagrama los puntos A
1
, A
2
, x
D
, x
F
y A
M
.
2. Obtener el punto
D
.
3. Hacer pasar una lnea recta por los puntos A
M
,
D
, hasta x
F
.
4. Hacer pasar una lnea recta por los puntos
D
y A
1
.
5. Hacer pasar una lnea recta por los puntos
F
y A
2
.
6. La interseccin de las dos ltimas lneas dar el punto
S
.
7. A partir de
D
se comienza a trazar los platos de la seccin de
enriquecimiento.
8. Cuando una lnea de equilibrio cruce la lnea que va de A
1
al punto
S
el
nuevo punto focal utilizado para trazar los platos en la seccin de intermedia ser el
punto
S
.
9. Cuando el trazo de los platos cruce la lnea que une a
F
con
S
, el nuevo
punto focal ser
F
y con el se trazarn los platos de la regin de agotamiento.
La posicin del punto
S
depende de las alimentaciones, es decir si estas
son menores o mayores de 0.5 .
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
98
Figura 60
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
99
PROBLEMA 9
Que cantidad de producto de fondo se obtendra y cuantos platos se
requeriran, si se procesan en la misma columna 700 kgmol / h de una corriente con
45% en mol de benceno y 55% de etilbenceno, y otra corriente de 100 kgmol / h
con 85% de benceno y 15% de etilbenceno. La corriente destilada deber contener
95% de benceno y los fondos 10% de benceno en mol. Las alimentaciones se
introducirn por separado como lquidos saturados. El condensador es total. Se
usar un reflujo de 1.
1. TRADUCCIN
Figura 61
2. PLANTEAMIENTO
Se utilizarn los datos de equilibrio del problema 2; tabla 4, pgina 16. junto
con el mtodo de Ponchon-Savarit.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
100
2.1 BALANCES
2 1 M
A A A + = ,
2 1
A2 2 A1 1
AM
A A
x A x A
Z
+
+
= ,
2 1
A2 2 A1 1
AM
A A
H A H A
H
+
+
=
F D A A
2 1
+ = +
F D A2 2 A1 1
x F x D x A x A + = +
2.2 REFLUJO
H - H
H - ) Q H (
D
L
R
D L, G,1
G,1 D
D L,
o
D
+
= =
3. CLCULOS
h
kgmol
800 700 100 A A A
2 1 M
= + = + =
0.5
800
) 0.45 ( 700 ) 0.85 ( 100
A A
x A x A
Z
2 1
A2 2 A1 1
AM
=
+
=
+
+
=
kgmol
kcal
2700 H
A1
=
kgmol
kcal
4150 H
A2
=
kgmol
kcal
3968.75
800
) 4150 ( 700 ) 2700 ( 100
A A
H A H A
H
2 1
A2 2 A1 1
AM
=
+
=
+
+
=
800 = F + D
800 ( 0.5 ) = F ( 0.1 ) + D ( 0.95 )
Resolviendo el anterior sistema de ecuaciones lineales, tenemos que :
h
kgmol
423.52 F = y
h
kgmol
376.47 D =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
101
3.2 REFLUJO
Del diagrama de equilibrio figura 10, pgina 17; con x=y*= 0.95,
tenemos:
kgmol
kcal
400 10 H
G,1
=
kgmol
kcal
2500 H
D L,
=
2500 - 400 10
400 10 - ) Q H (
1
H - H
H - ) Q H (
D
L
R
D D L,
D L, G,1
G,1 D
D L,
o
D
+
= =
+
= =
Por lo tanto:
kgmol
kcal
300 18 ) Q (H
D D L,
= +
Con este valor y el de la vertical de x
D
= 0.95 se localiza el punto
D
.
3.3 LNEAS DE OPERACIN
A partir de los puntos A
1
, A
2
, Z
AM
, x
F
, x
D
y
D
se pueden efectuar los
trazos para encontrar los puntos
S
y
F
.
3.4 PLATOS TERICOS
De la figura 58 se observa que se requieren 5 platos tericos. La primera
alimentacin entrara en el plato 1 y la segunda en el plato 3. Comenzando a
enumerar los platos por el domo de la columna.
3.5 CALOR EN EL CONDENSADOR
kgmol
kcal
300 18 Q H
D D L,
= +
kgmol
kcal
800 15 500 2 - 300 18 H -
D
q
Q
D L, D
C
D
= = = =
h
kcal
226 948 5 ) (376.47 800 15 q
C
= =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
102
3.6 CALOR EN EL REHERVIDOR
8960 - Q - H
F
F L,
= 400 6 H
F L,
=
kgmol
kcal
360 15 400 6 8960
F
q
Q
R
F
= + = =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
103
h
kcal
267.2 505 6 ) (423.52 15360 q
R
= =
Figura 62
SALIDAS LATERALES
Si se extrae una corriente lateral de una etapa se produce una modificacin
en el mtodo, requirindose una lnea extra de operacin.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
104
BALANCES
1 - S S
L S D G + + =
S
1 - S S
S D L - G = + = Constante
1 - S 1 - S S D S S
x L x S x D * y G + + =
S S S D 1 - S 1 - S S S
x x S x D x L - * y G
= + =
C 1 - S L, 1 - S S L, D L, S G, S
q H L H S H D H G + + + =
Figura 63
S S S L, D D L,
1 - S L, 1 - S S G, S
H H S ) Q (H D H L - H G
= + + =
Esto indica que hay una lnea que pasa por los puntos
) H , (x , ) H , (x , ) Q H , (x
S L, S S S D D L, D
+
S
S D
Si se hace un balance desde el fondo de la torre
S 1 - S
G F L A + = +
F F L - G A
S 1 - S S
+ = + =
S S F 1 - S 1 - S A
* y G x F x L x A + = +
F S S F 1 - S 1 - S S S A
Fx x Fx x L - * y G Ax + = + =
S G, S F L, 1 - S L, 1 - S A R
H G H F H L H A q + = + +
H L - H G ) Q (H F H A
1 - S L, 1 - S S G, S F F L, A
+ =
Figura 64
S S F F L, A
H ) Q (H F H A
+ =
Como las dos lneas que pasan por la seccin S tienen un punto comn
S
,
este debe buscarse en la interseccin de ambas lneas.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
105
Figura 65
Las cantidades relativas de S y D determinan la localizacin de
S
.
S
D S = +
S S D S
x x D x S
= +
S
D S
S
x D x S
x
+
=
Hay dos casos posibles de extracciones laterales, la extraccin de un lquido
saturado y la de un vapor saturado. El desarrollo anterior se hizo para la extraccin
de un lquido saturado, pero por un tratamiento similar se puede demostrar que en el
caso de un vapor saturado la posicin relativa de las lneas de operacin quedara:
Figura 66
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
106
PROBLEMA 10
A una torre de destilacin entran 1000 kgmol / h de una mezcla de acetona y
agua con 40 % mol de acetona. El condensador es total.
La alimentacin es lquida y est a su punto de burbuja.
Se desea que los fondos salientes de la torre contengan 5% de acetona y
que los destilados salgan con 95% en mol de acetona. El reflujo es de 2 y se quiere
adems extraer una corriente lquida de 100 kgmol / h con 70 % de acetona.
Cuntas etapas ideales se requieren? En que etapa se deber extraer la
corriente lquida?
1. TRADUCCIN
Figura 67
2. PLANTEAMIENTO
2.1 BALANCES
S F D A + + = ,
S F D A
x S x F x D x A + + =
2.2 REFLLUJO
o 1
1 D D o
D
H - H
H - ) Q (H
D
L
R
+
= =
2.3 PUNTO
S
S
D S = + ,
S S D S
x x D x S
= + ,
S
D S
S
x D x S
x
+
=
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
107
3. CLCULOS
3.1 BALANCES
100 F D 1000 S F D A + + = = + + = (I)
) 0.7 ( 100 ) 0.05 ( F ) (0.95 D ) 0.4 ( 1000 x S x F x D x A
S F D A
+ + = = + + =
70 F 0.05 D 0.95 400 + + = (II)
Resolviendo simultneamente (I) y (II):
h
kgmol
316.67 D =
h
kgmol
583.33 F =
3.2 REFLUJO
Del problema No. 6 (Tabla 7, pgina 54)
kgmol / kcal 7500 H kgmol / kcal 110 H
G,1 o L,
= =
o L, G,1
G,1 D D L,
o
D
H - H
H - ) Q (H
D
L
R
+
= = =
110 - 7500
7500 - Q H
2
D D L,
+
=
kgmol / kcal 280 22 ) Q H (
D D L,
= +
3.3 PUNTO
S
416.67 316.67 100 D S
S
= + = = +
0.89
416.67
) 0.95 ( 316.67 ) 0.7 ( 100
x D x S
x
S
D S
S
=
+
=
+
=
4. RESULTADOS
A partir de la figura No. 68, se requieren seis platos ideales. La extraccin
es en el plato 4; la alimentacin llega al quinto plato. Enumerando por el domo.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
108
Figura 68
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
109
TORRES NO ADIABTICAS
Reciben el nombre de torres no adiabticas aquellas en las que se pierde
calor hacia los alrededores debido a que no estn debidamente aisladas.
Consideremos una de esas torres en las que se pierde calor q
1
, q
2
, q
3
etc.
A travs de las etapas 1, 2, 3 etc.
El balance alrededor del
condensador sera:
o 1
L D G + =
o o D 1 1
x L x D * y G + =
C o L, o D L, G,1 1
q H L H D H G + + =
H L ) Q (H D H G
o L, o D D L, G,1 1
+ + =
y por lo tanto el reflujo es:
Figura 69
H H
H ) Q (H
D
L
R
o L, G,1
G,1 D D L,
o
D
+
= =
Por lo que el punto
D
se obtiene de la misma manera que en el caso
general.
1 2
L D G + =
D L - G
1 2
=
x D x L - * y G
D 1 1 2 2
=
1 C D L, L,1 1 G,2 2
q q H D H L - H G + + =
1
D
D L, L,1 1 G,2 2
q ) Q (H D H L - H G + + =
Figura 70
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
110
O tambin: ) ' Q' ( D H L - H G
D L,1 1 G,2 2
=
De donde:
D
q
D
q
H ' Q'
1
C
D L,
D
+ + =
Pero como G
2
= D + L
1
; tendramos:
) ' Q' ( D H L - H ) L D (
D L,1 1 G,2 1
= +
) ' Q' ( D H L - H L H D
D L,1 1 G,2 1
G,2
= +
) H - ' Q' ( D ) H - H ( L
G,2 D L,1 G,2 1
=
) H - H (
) H - ' Q' (
D
L
L,1
G,2
G,2 D
1
=
Esto indica que existe una lnea recta que pasa a travs de:
) x , ' Q' ( , ) x , H ( , ) * y , H (
D D 1 L,1 2 G,2
En donde el punto ) x , ' Q' (
D D
es un nuevo punto
D1
.
Figura 71
El balance para la segunda etapa es similar al anterior, excepto que existe un nuevo
punto
D2
que tiene una entalpa adicional.
D
q
D
q
D
q
H ' Q'
2 1 C
D L, 2
+ + + =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
111
Figura 72
Esto contina hasta que se alcanza la alimentacin. El balance total en la
torre nos da:
F D A + =
F D A
x F x D x A + =
i
N i
1 i
C F L, D L, R A
q q H F H D q H A
=
=
+ + + = +
)
F
q
F
q
H ( F )
D
q
D
q
H ( D H A
N i
1 i
i R
F L,
N i
1 i
i C
D L, A
=
=
=
=
+ + + =
En donde
=
=
N i
1 i
i
D
q
es la sumatoria de los calores por unidad de destilado en la
seccin de enriquecimiento y
=
=
N i
1 i
i
F
q
es la sumatoria de los calores por unidad de
fondos en la seccin de agotamiento.
La ecuacin anterior permite el clculo de la seccin de agotamiento al
colocar el primer punto
F
.
Para los dems platos en la seccin de agotamiento se deber cambiar el
punto
F
en cada plato por la cantidad requerida
F
q
. Esto se contina hasta
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
112
alcanzar la composicin final
F
x . En ese punto se puede evaluar la entalpa que
es igual a
F
q
- H
R
F .
Figura 73
PROBLEMA 11
En una torre de destilacin se van a tratar 500 kgmol / h de una disolucin
que contiene 15% de etanol en mol y el resto agua. Se desea producir un destilado
con 70% de etanol en mol y unos fondos con 2% en mol de etanol. Se utilizar un
reflujo de 1.1 y un condensador total.
Debido a un insuficiente aislamiento se espera que la torre, pierda alrededor
de 100 000 kcal / h por cada etapa ideal. Cul seria el nmero de etapas
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
113
requeridas? La alimentacin se introducir a su punto de burbuja. Utilice los
siguientes datos de equilibrio para el sistema etanol-agua.
x
y*
]
kgmol
kcal
[ H
L
]
kgmol
kcal
[ H
G
0 0 1800 11490
0.0201 0.1868 1752 11411
0.0416 0.3019 1704 11525
0.0891 0.4319 1649 11607
0.1436 0.4954 1651 11607
0.2069 0.5334 1652 11610
0.2812 0.574 1796 11629
0.3698 0.595 1890 11630
0.4772 0.64 2002 11630
0.6101 0.7062 2050 11635
0.77886 0.8081 2098 11645
0.881 0.881 2131 11721
1.0 1.0 2131 11754
Tabla 8
1. TRADUCCIN
Figura 74
2. PLANTEAMIENTO
Utilizaremos el mtodo de Ponchon-Savarit
2.1 BALANCES
F D A + =
F D A
x F x D x A + =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
114
2.2 REFLUJO
) H - H (
H ) Q H (
D
L
R
o L,
G,1
G,1 D D L,
o
D
+
= =
3. CLCULOS
3.1 BALANCES
F D 500 F D A + = = + =
0.02) ( F ) (0.7 D ) 0.15 ( 500 x F x D x A
F D A
+ = = + =
por lo tanto:
h
kgmol
404.412 F ;
h
kgmol
95.588 D = =
3.2 REFLUJO
De la tabla 8 podremos encontrar los valores de H
G,1
y H
L,o
; con el dato de
x=y*= 0.7 , tendremos:
2075 - 11635
11635 - ) Q H (
1.1
) H - H (
H ) Q H (
D
L
R
D D L,
o L,
G,1
G,1 D D L,
o
D
+
= =
+
= =
kgmol
kcal
151 22 ) Q H (
D D L,
= +
3.3 PRDIDAS POR CADA ETAPA
destilados de
kgmol
kcal
046 1
95.588
000 100
D
q
= =
197 23 046 1 151 22
D1
= + =
243 24 046 1 197 23
D2
= + =
289 25 046 1 243 24
D3
= + =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
115
fondos de
kgmol
kcal
247.27
404.412
000 100
F
q
= =
3.5 NMERO DE ETAPAS
De acuerdo con el diagrama de la figura 71 se requerirn 5 etapas ideales
3.6 CALOR QUE DEBE RETIRARSE DEL CONDENSADOR
kgmol
kcal
150 22 ) Q H (
D D L,
= + ;
kgmol
kcal
2100 H
D L,
= 050 20 Q
D
=
h
kcal
539.4 916 1 )
h
kgmol
95.588 (
kgmol
kcal
050 20 ) D ( Q q
D C
= = =
3.7 CALOR QUE DEBE ADICIONARSE EN EL CALDERN
kgmol
kcal
920 3 Q - H
F F
= ;
kgmol
kcal
1800 H
F
=
kgmol
kcal
720 5 Q
F
=
h
kcal
236.6 313 2 )
h
kgmol
404.412 (
kgmol
kcal
720 5 ) F ( Q q
F R
= = =
4. RESULTADO
Se requieren de 5 etapas ideales, enumerando la columna por la parte del
domo.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
116
Figura 75
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
117
PLATOS NO IDEALES
Las torres de destilacin tienen una eficiencia menor del 100%, esto indica
que las etapas no se comportan como ideales y que las corrientes salientes de las
etapas no estn en equilibrio. Una de las formas ms utilizadas para medir la
eficiencia es la llamada eficiencia de Murphree.
1 - n n
1 - n n
MV
y - y
y - y
E
=
Figura 76
En donde:
n
y = composicin del vapor que estara (ideal) en equilibrio con el lquido de
composicin x
n
que sale del plato n.
n
y = composicin real promedio del vapor mezclado que sale del plato n.
1 n
y
= composicin real promedio del vapor mezclado que entra en el
plato n.
n
x = composicin del lquido saliente de la etapa n.
Cuando se conoce el valor de la eficiencia de Murphree, es posible calcular el
nmero de platos reales que debera tener una columna para lograr una separacin
dada.
Esto se logra trazando otra nueva lnea de roco, la que se construye
utilizando los datos de equilibrio ideales y multiplicando la longitud de las lneas de
equilibrio por la eficiencia.
Es de hacerse notar que la eficiencia puede variar de plato a plato o de
seccin en seccin en la torre de destilacin.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
118
Una vez que se cuenta con la nueva lnea de roco se puede lograr el clculo
de los platos ideales. En los trazos el punto
D
y
F
se conservan, es decir las
lneas de operacin no cambian, solo las lneas de equilibrio.
Figura 77
Figura 78
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
119
PROBLEMA 12
Una torre de destilacin con eficiencia de platos de Murphree es del 50% en todas
sus secciones, se utiliza para tratar 500 kgmol / h de una solucin que contiene 15 %
de etanol en mol y el resto de agua. Con la torre se desea producir un destilado con 70%
en mol de etanol y unos fondos de 2% en mol de etanol. Se utilizar un reflujo de 1.5
Cul es el nmero de etapas reales que se requieren? El condensador es total.
1. TRADUCCIN
Figura 79
2. PLANTEAMIENTO
2.1 BALANCES
F D A + =
F D A
x F x D x A + =
2.2 REFLUJO
) H - H (
H ) Q H (
D
L
R
o L,
G,1
G,1 D D
o
D
+
= =
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
120
2.3 EFICIENCIA
1 - n n
1 - n n
MV
y - * y
y - y
0.5 E = =
3. CLCULOS
Los clculos ya fueron realizados en el problema 11 y por lo tanto:
h
kgmol
404.412 F ;
h
kgmol
95.588 D = =
pero para un reflujo de l.5 tenemos:
kgmol
kcal
975 25 ) Q H (
D D L,
= +
3.1 NMERO DE ETAPAS
En la figura 76 tenemos el diagrama de H vs Composicin para el sistema
etanol-agua. La longitud total de cada isoterma del diagrama ser multiplicada por
E
MV
= 0.5, la cual nos da un punto por cada isoterma; esos puntos se unen por
medio de una lnea, la cual ser la nueva lnea de puntos de roco H
G
. Esto se
entiende as, para la isoterma de lnea gruesa tendramos una composicin de y*=
0.320 para una eficiencia del 50% (real); mientras que para esa misma isoterma
tendramos una composicin y* = 0.495 para una eficiencia del 100% (ideal). Por lo
tanto, se tienen que obtener de la figura 76 todos los nuevos valores de y* para la
lnea de 50% que junto con los valores de x que permanecen constantes, sern los
datos para construir el diagrama de equilibrio y* vs, x mostrado en la figura 80
De acuerdo con la figura 80 se requieren 13 platos reales o 12 platos y el
caldern.
Figura 80
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
121
Figura 81
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
122
NOMENCLATURA
Se puede utilizar cualquier conjunto consistente de unidades.
A Flujo de alimentacin, mol/tiempo
A,B Constantes de Van Laar, Adimensional
A AA A,B BB B,C CC C Constantes de Antoine, Adimensional
Cp Capacidad calorifica molar a presin constante, energa/mol T
D Flujo del destilado, mol/tiempo
E
MV
Eficiencia del plato de vapor de Murphree, fraccionaria
F Flujo de residuo o de fondos, mol/tiempo
G Corriente del vapor, mol/tiempo
H Entalpa molar, energa/mol
H Entalpia molar para un punto de diferencias , energa/mol
H
mez
Calor de mezclado por mol de solucin, energa/mol
L Corriente del lquido, mol/tiempo
N nmero de platos
Pc Presin crtica, Fuerza / rea
P* Presin parcial, Fuerza / rea
P Presin de vapor del componente puro, Fuerza / rea
Pt Presin total, Fuerza / rea
PM Peso molecular, Masa / mol
q
C
Energa total retirada por el condensador, Energa / tiempo
q
R
Energa total adicionada al rehervidor, Energa / tiempo
Q
D
q
C
/ D, Energa / mol
Q
F
q
R
/ F, Energa / mol
R constante del gas, Energa / mol T
R
D
Reflujo externo
S Corriente de salida lateral mol / tiempo o energa / tiempo
T Temperatura de ebullicin, T
Tc Temperatura crtica, T
T
O
Temperatura de referencia, T
V Corriente de vapor vivo, mol / tiempo
x composicin en el lquido, fraccin mol
y composicin en el vapor, fraccin mol
y* y* en equilibrio con x, fraccin mol
n
y composicin del vapor que estara (ideal) en equilibrio con el lquido de
composicin x
n
que sale del plato n, fraccin mol
Relacin de reflujo R
D op
/ R
D mn
, fraccin
coeficiente de actividad, adimensional
Punto de diferencias, representa una corriente ficticia
Calor latente molar de evaporacin, Energa / mol
Subndices
A alimentacin
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
123
A,B componentes A,B
AZ azetropo
D destilado
F fondos
G vapor
i cualquier componente
L lquido
m plato m
mx mximo
mez mezcla
mn mnimo
n plato n
op operacin
V vapor vivo
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
124
BIBLIOGRAFA
1. E.E. Ludwing - Applied process desing for chemical and petrochemical plants.
-Vol. 2 - Gulf -Houston- 1964.
Contiene un problema resuelto y nueve propuestos.
2. G.G. Brown - Operaciones bsicas de ingeniera qumica.
Ed. Marn - Barcelona 1965.
Libro clsico de operaciones unitarias, presenta teora, dos problemas resueltos
y
nueve propuestos.
3. A.S. Foust - Principles of unit operations.
- Wiley - New York - 1960.
Un problema resuelto y cuatro propuestos.
4. H. Sawistowski - Mtodos de clculo en los procesos de transferencia de
materia.
Ed. Alambra - Madrid - 1967.
Original libro en que se presentan las diversas formas en que puede calcularse
un
equipo. Presenta algo de teora y un problema resuelto.
5. A. Valiente y R.P.Stivalet - Problemas de balance de materia y energa.
Ed. Alambra - Mxico - 1986.
Presenta dos problemas resueltos y dos propuestos.
6. Ch. J. Geankoplis -Procesos de transporte y operaciones unitarias-
Ed. CECSA -Mxico- 1986. Libro orientado a la industria alimentara, contiene
teora, un problema resuelto y dos propuestos.
7. W. Mc Cabe y J. Smith -Unit operations of chemical engineering-
Ed. Mc. Graw Hill -New York- 1956. Presenta la teora en detalle, dos
problemas
resueltos y dos propuestos.
8. C. O. Bennet y J. E. Myers -Momentum heat and mass transfer-
Ed. Mc. Graw Hill- 1962. Libro dedicado al anlisis de los fenmenos de
transporte,
presenta teora, un problema resuelto y dos propuestos.
9. K. F. Pavlov, P. G. Romankov y A. A. Noskov -Problemas y ejemplos para el
curso
de operaciones bsicas y aparatos en tecnologa qumica-
Ed. MIR - Mosc- 1981. Libro de problemas, contiene dos problemas resueltos.
Destilacin binaria por el mtodo de Ponchon y Savarit
Antonio Valiente Barderas
125
10.M. Van Winkle -Distillation-
Ed. Mc. Graw Hill - New York- 1967. Libro clsico de destilacin,
Presenta teora, presenta un problema resuelto y seis propuestos.
11.Buford D. Smith -Design of equilibrium stage proceses-
Ed. Mc. Graw Hill -New York- 1963. Excelente libro, presenta un captulo
sobre
el mtodo de Ponchon-Savarit. Dos problemas resueltos y cuatro propuestos.
12.W. L. Bagder -Introduccin a la ingeniera qumica-
Ed. Mc. Graw Hill -Mxico- 1979. Libro de operaciones unitarias. Contiene
teora, tres problemas resueltos y dos propuestos.
13.R. E. Treybal -Mass transfer operations-
Ed. Mc. Graw Hill -Tokyo- 1968. Libro clsico de operaciones de
transferencia
de masa. Contiene teora, un problema resuelto y cuatro propuestos.
14.E. Kirschbaum -Distillation and rectification-
Ed. Chemical Publishing Co. New York- 1948.
Contiene teora y un problema resuelto.
15. P. T. Brian -Stage cascades in chemical processing-
Ed. Prentice Hall -Englewood Cliffs N. J.- 1972.
Contiene teora.
16 Ponchon, M. : -La technique moderne- , 20 24, (1921).
17. Savarit, R. : -Arts et mtiers- (1922). 65-69.
You might also like
- Metodo Grafico PonchonDocument17 pagesMetodo Grafico Ponchonkeyla Rut Seminario ZapataNo ratings yet
- Problemas Destilación Ponchon SavaritDocument2 pagesProblemas Destilación Ponchon SavaritJimmy Sierra CcorahuaNo ratings yet
- Tipos de Empaques. Operaciones de Transferencia de Calor y Momentum.Document7 pagesTipos de Empaques. Operaciones de Transferencia de Calor y Momentum.Leonel QuintalNo ratings yet
- Cuestionario 1-9Document6 pagesCuestionario 1-9Joel Machaca G100% (3)
- Tareas Absorcion IntentosDocument14 pagesTareas Absorcion IntentosmiguelNo ratings yet
- Destilación Flash: Separación de Mezclas por Cambio de Fase RápidoDocument10 pagesDestilación Flash: Separación de Mezclas por Cambio de Fase RápidoNallely Hernandez100% (2)
- Parcial PROCESOS DE SEPARACIÓN IDocument1 pageParcial PROCESOS DE SEPARACIÓN IClaüMartz0% (3)
- Problemas de Transferencia de Calor y Masa #03 - DocDocument6 pagesProblemas de Transferencia de Calor y Masa #03 - DocLuis Enrique Laurencio SabogalNo ratings yet
- TALLER Ingeniería de Las Reacciones Químicas 1 PDFDocument4 pagesTALLER Ingeniería de Las Reacciones Químicas 1 PDFAndres LlorenteNo ratings yet
- Destilacion AbiertaDocument8 pagesDestilacion AbiertaMario Parra CamargoNo ratings yet
- INFORMEEE Práctica #1. Determinación de Los Puntos de Carga e Inundación de Una Torre Empacada de Absorción Gaseosa para El Sistema Agua-AireDocument14 pagesINFORMEEE Práctica #1. Determinación de Los Puntos de Carga e Inundación de Una Torre Empacada de Absorción Gaseosa para El Sistema Agua-AireYubenny Petit Olivieri100% (1)
- Método de Ponchon y SavaritDocument31 pagesMétodo de Ponchon y SavaritSharon Fonseca50% (4)
- DR Tema2 3raedDocument33 pagesDR Tema2 3raedLucy Isabel Carpio Ramírez50% (2)
- LIXIVIACIÓNDocument42 pagesLIXIVIACIÓNNatalia ArteagaNo ratings yet
- Guía de Operaciones Unitarias 2Document7 pagesGuía de Operaciones Unitarias 2romina orellanaNo ratings yet
- Expo Operaciones 2Document10 pagesExpo Operaciones 2luisNo ratings yet
- Ejercicios Destilación DiferencialDocument14 pagesEjercicios Destilación DiferencialAngelo Varela67% (3)
- Sintesis de ReaccionDocument38 pagesSintesis de ReaccionDiego VillanuevaNo ratings yet
- DR - 4a Reactor de Flujo Pistón Con RecirculaciónDocument12 pagesDR - 4a Reactor de Flujo Pistón Con RecirculaciónBrenda Mares VieraNo ratings yet
- Ejercicio MC Cabe ThieleDocument13 pagesEjercicio MC Cabe ThieleLizbeth Rivera ValdovinosNo ratings yet
- Remoción de soluto A de un gas inerte B en torre de absorción contracorriente multietapaDocument3 pagesRemoción de soluto A de un gas inerte B en torre de absorción contracorriente multietapaAntonio AndradeNo ratings yet
- Simulación de procesos de absorción y desorción de amoniacoDocument6 pagesSimulación de procesos de absorción y desorción de amoniacoDavid GaytanNo ratings yet
- Planta de AcetonaDocument56 pagesPlanta de AcetonaJosé Arturo Tlapaltotoli PanecatlNo ratings yet
- Optimización de sistema de evaporación de agua de marDocument27 pagesOptimización de sistema de evaporación de agua de marBrandonEmmanuelSalasCalvarioNo ratings yet
- Unidad 4. Destilación. - 2018-2Document35 pagesUnidad 4. Destilación. - 2018-2LUIS FERNANDO VALENCIA CARDONANo ratings yet
- Tarea # 11Document6 pagesTarea # 11Carlos AlbanNo ratings yet
- Alquilación de OlefinasDocument13 pagesAlquilación de OlefinasJohann ChorenNo ratings yet
- Problemario AbsorciónDocument7 pagesProblemario AbsorciónAle Bernal33% (3)
- Metodo de Ponchon Savarit en Destilación BinariaDocument4 pagesMetodo de Ponchon Savarit en Destilación BinariaAndrés Jonathan Cepeda GuerronNo ratings yet
- DP-3.1 Construcción de Curvas CompuestasDocument83 pagesDP-3.1 Construcción de Curvas CompuestasElizabeth GarcíaNo ratings yet
- Practica 5 HumidificaciónDocument12 pagesPractica 5 HumidificaciónUlises Miranda50% (2)
- Ejercicios de Procesos de SeparacionDocument39 pagesEjercicios de Procesos de SeparacionEdmilio80% (5)
- Diseño de Planta de Producción de CiclohexanonaDocument7 pagesDiseño de Planta de Producción de CiclohexanonaUBALDO JUNIOR VILLEGAS NU‹EZ50% (2)
- Reporte de Practica Teoria Del PozoDocument20 pagesReporte de Practica Teoria Del Pozopacopapasoterico100% (2)
- Operaciones Unitarias IiiDocument9 pagesOperaciones Unitarias IiiIsabel RinconNo ratings yet
- La Importancia de Una Correcta HumidificaciónDocument18 pagesLa Importancia de Una Correcta HumidificaciónedgarNo ratings yet
- Practica 8 RetificacionDocument19 pagesPractica 8 RetificacionDavid M GaytanNo ratings yet
- Problemario Solido-FluidoDocument2 pagesProblemario Solido-FluidoAdahiNo ratings yet
- Metodologia de Los Modulos Basicos y Sus Etapas de DesarrolloDocument8 pagesMetodologia de Los Modulos Basicos y Sus Etapas de DesarrolloJackie VegaNo ratings yet
- Problemas Enf DeshDocument31 pagesProblemas Enf DeshFrancisco CanalesNo ratings yet
- Ejemplo 6.13Document4 pagesEjemplo 6.13Jackeline Condori sanchezNo ratings yet
- Pract-3-Intercambiador de Calor de Coraza-Y-TuboDocument12 pagesPract-3-Intercambiador de Calor de Coraza-Y-TuboJulio Barranco0% (1)
- Cuestionario BalanceDocument2 pagesCuestionario BalanceJuanLopezTrujilloNo ratings yet
- Bioprocesos y BiotecnologíaDocument4 pagesBioprocesos y BiotecnologíaAndrea Barreiro Cherrez67% (3)
- Cuestionario 5 PDFDocument3 pagesCuestionario 5 PDFRonald Capo0% (1)
- Diseño de torres de absorción de platosDocument58 pagesDiseño de torres de absorción de platosWendy DuarteNo ratings yet
- Tabla estequiometria y sensibilidad reacción etileno-bromuro de hidrógenoDocument2 pagesTabla estequiometria y sensibilidad reacción etileno-bromuro de hidrógenoEdgar Gabriel OrtizNo ratings yet
- Simulación de procesos químicos en reactoresDocument13 pagesSimulación de procesos químicos en reactoresVanne AmpaaranNo ratings yet
- Equilibrio de fases: Un enfoque basado en competenciasFrom EverandEquilibrio de fases: Un enfoque basado en competenciasNo ratings yet
- Elementos para el análisis y diseño de reactores químicosFrom EverandElementos para el análisis y diseño de reactores químicosNo ratings yet
- Vdocuments - MX Destilacion Binaria Por El Metodo Ponchon SavaritDocument139 pagesVdocuments - MX Destilacion Binaria Por El Metodo Ponchon SavaritVíctor Javier Cruz Martinez100% (1)
- Metodo Ponchon SavaritDocument155 pagesMetodo Ponchon SavaritBruno SantosNo ratings yet
- Ponchon SavaritDocument125 pagesPonchon SavaritJosiola MariledoNo ratings yet
- Historia Destilación PDFDocument7 pagesHistoria Destilación PDFDiegoRossoNo ratings yet
- Tema 2 Destilacion VinicaDocument42 pagesTema 2 Destilacion VinicaAitana Rubio NajeraNo ratings yet
- Historia de La Destilacion A Antonio ValienteDocument7 pagesHistoria de La Destilacion A Antonio ValientetbautistadiegoNo ratings yet
- Historia de La DestilaciónDocument7 pagesHistoria de La DestilaciónMariana GorositoNo ratings yet
- Historia de La Destilación. Antonio Valiente-Barderas PDFDocument7 pagesHistoria de La Destilación. Antonio Valiente-Barderas PDFMenelao Zubiri100% (3)
- Reseña HistóricaDocument3 pagesReseña HistóricaKatia UrearNo ratings yet
- Guia Naturales 2Document3 pagesGuia Naturales 2Alexander Alfonso Murgas ViloriaNo ratings yet
- Distribucion Audi A2Document5 pagesDistribucion Audi A2Irving Alexander RujanoNo ratings yet
- RENAULT CLIO II - MEGANE 1,6 Nafta - 16 Valv PDFDocument3 pagesRENAULT CLIO II - MEGANE 1,6 Nafta - 16 Valv PDFAlvaro RJ0% (1)
- Tema 2 Funcionamiento Motor DieselDocument200 pagesTema 2 Funcionamiento Motor DieselRoger MontecinosNo ratings yet
- Unidad de Alta Presión HT-400Document3 pagesUnidad de Alta Presión HT-400Muba rafaNo ratings yet
- ÁRbol de Levas Y Cojinetes Del ÁRbol de Levas PDFDocument12 pagesÁRbol de Levas Y Cojinetes Del ÁRbol de Levas PDFHamilton Miranda100% (1)
- IR XP 185 Catalogo Partes PDFDocument86 pagesIR XP 185 Catalogo Partes PDFAbdul Zapata Escobar100% (2)
- Sensores Por Jose Luis SapiaDocument19 pagesSensores Por Jose Luis Sapiaaleba1975No ratings yet
- Sistema de Diésel A Pilotos y Quemadores de Arranque - GEDocument4 pagesSistema de Diésel A Pilotos y Quemadores de Arranque - GEbtocarlNo ratings yet
- Curso de Winch Programa 1hDocument16 pagesCurso de Winch Programa 1hGlenn Araya VillalobosNo ratings yet
- Ejemplo Checklist Bitácora ContraincendiosDocument1 pageEjemplo Checklist Bitácora ContraincendiosCesar NZNo ratings yet
- Inventario Fisico - Estado de VehiculoDocument2 pagesInventario Fisico - Estado de VehiculoDeiby Celemin RinconNo ratings yet
- Capacitacion A OperadoresDocument2 pagesCapacitacion A OperadoresAxel GonzálezNo ratings yet
- Sesión Final de Liderazgo y Procesos OrganizacionalesDocument11 pagesSesión Final de Liderazgo y Procesos OrganizacionalesOctavio Azuara GuzmánNo ratings yet
- Clases N°07 Bomba Rotativa DesmontajeDocument63 pagesClases N°07 Bomba Rotativa DesmontajeNatali PeñaNo ratings yet
- Sistema EncendidoDocument10 pagesSistema EncendidoDario JaramilloNo ratings yet
- Unidad 1 Generalidades de La Maquinaria PesadaDocument49 pagesUnidad 1 Generalidades de La Maquinaria PesadaArmando Sixto100% (2)
- Diseño de Un Intercambiador de Calor Coraza - Albeiro Galvis - USBCTG - 2015 PDFDocument102 pagesDiseño de Un Intercambiador de Calor Coraza - Albeiro Galvis - USBCTG - 2015 PDFanyeloNo ratings yet
- Mantenimiento volqueta Internacional 2013Document8 pagesMantenimiento volqueta Internacional 2013Marcel Monroy100% (1)
- CM001 BalotarioDocument7 pagesCM001 BalotarioJosé LuisNo ratings yet
- 3-Presentacion Modulo 03 Modificado DEQF PDFDocument170 pages3-Presentacion Modulo 03 Modificado DEQF PDFJohnPortugalAlmeida100% (3)
- HAULOTTE ESP Manual de Uso e 06 07 PDFDocument196 pagesHAULOTTE ESP Manual de Uso e 06 07 PDFjulio_apaza_9100% (2)
- Bosch-Bombas de Inyeccion DiseselDocument105 pagesBosch-Bombas de Inyeccion DiseselMario Alberto Abarca Rodriguez100% (1)
- Trabajo de QuimicaDocument6 pagesTrabajo de Quimicaanon_227116522No ratings yet
- Ficha Técnica Del FMXDocument5 pagesFicha Técnica Del FMXFernandoCondoriQuispe100% (1)
- v01 Ka150 2c040h000 en Es WithcoverDocument116 pagesv01 Ka150 2c040h000 en Es WithcoverAlex Juarez83% (18)
- Andalucia Examen Rite 2018-IIDocument7 pagesAndalucia Examen Rite 2018-IIFrancisco Aparicio OrtegaNo ratings yet
- Que Es El Venteo de Gas NaturalDocument4 pagesQue Es El Venteo de Gas NaturalBryan Pérez Pérez67% (3)
- Sistema MPFI - TFSIDocument3 pagesSistema MPFI - TFSIElian Villarroel SocolaNo ratings yet
- Instrucciones manejo motosierraDocument40 pagesInstrucciones manejo motosierramaithepinoNo ratings yet
- Manual de Usuario TX 125 PDFDocument36 pagesManual de Usuario TX 125 PDFJesus0% (1)